新型超顺磁性氧化铁标记SD大鼠脂肪干细胞的有效性及安全性研究
2016-09-06马伟琼谢琦张鼎旋汤间仪雷正贤杨逸铭
马伟琼, 谢琦, 张鼎旋, 汤间仪, 雷正贤, 杨逸铭
·实验研究·
新型超顺磁性氧化铁标记SD大鼠脂肪干细胞的有效性及安全性研究
马伟琼, 谢琦, 张鼎旋, 汤间仪, 雷正贤, 杨逸铭
目的:采用新型超顺磁性氧化铁对SD大鼠来源的脂肪干细胞(ADSCs)进行标记,并与既往商用SPIO标记效果进行对比,探讨这种新型超顺磁性氧化铁标记的有效性及安全性。方法:分离、纯化、鉴定SD大鼠来源的ADSCs,然后分不同浓度组(0、6、12、25、50和100 μg/mL)和时间组(6、12、24和48 h)进行标记,通过普鲁士蓝染色测定铁标记率;在不影响细胞形态的前提下,对达到95%以上铁染色率的孵育浓度、时间进行标记安全性检测,包括活力、增殖力、细胞表面抗原表达;采用透射电子显微镜观察标记细胞的超微结构,采用ICP-AES对标记细胞内的铁含量进行测定,并与商用SPIO标记效果进行对比。结果:在无细胞毒性的前提下,新型SPIO达到95%以上铁染色率的孵育浓度是12和25 μg/mL,孵育时间是12 h;ICP-AES检测显示具有表面正电荷的聚乙二醇(PEG)/聚乙烯亚胺(PEI)修饰的SPIO标记后细胞内的铁含量达到35.4 pg/cell(25 μg/mL中孵育12h后)和20.16 pg/cell(12 μg/mL中孵育12h后),并随着孵育浓度的增加,细胞内的铁含量增加;而具有表面零电荷的PEG/聚乙烯吡咯烷酮(PVP)修饰的SPIO标记后的铁含量仅为6.96 pg/cell(25 μg/mL中孵育12h后);透射电子显微镜显示标记后细胞器结构完整,内吸收的SPIO主要位于细胞质内的囊泡和溶酶体中。结论:新型SPIO在适当孵育浓度和时间下可以安全、快速标记ADSCs; PEG/PEI修饰的SPIO标记效果要远远比既往商用的SPIO快速有效,可作为一种优势的新型磁性标记物用于干细胞标记;而PEG/PVP修饰的SPIO比起既往商用的SPIO并无明显优势,说明表面电荷在细胞标记中占有极其重要的角色。
新型超顺磁性氧化铁; 脂肪干细胞; 染色与标记; 铁含量; 表面电荷
由于磁性氧化铁纳米材料具有良好的磁导向性、生物相容性以及生物降解性等特点,因而被广泛用于干细胞标记领域[1-2]。目前干细胞示踪成像的磁性氧化铁纳米材料主要采用商用的Resovist、Feridex等,但它们都是由化学共沉淀方法制备的,普遍存在粒径不均匀、容易团聚的缺点,性能有提升的空间[3]。此外,由于细胞膜和商用的超顺磁性氧化铁纳米粒子(superparamagnetic iron oxide,SPIO)均为负电荷,必须与带有正电荷的商用转染剂(eg、脂质体、多聚赖氨酸、硫酸鱼精蛋白等)结合起来才能有效标记干细胞,这种结合存在复杂的相互反应[4,5],会导致表面性能的不精确和大小的不完全一致,这势必会引起标记效果的差异性。
本研究拟采用的聚乙二醇(polyethylene glycol,PEG)/聚乙烯亚胺(polyethylenimine,PEI)修饰SPIO是以高温多元醇法合成的,在合成过程中就通过表面涂层修饰对纳米粒子的表面性能进行了精细控制,具有结晶度高、尺寸分布均匀、磁性强、生物相容性好的特点,并且具有固定的表面正电荷[6]。笔者猜测这种具有固有表面正电荷的新型SPIO也许能更有效地应用于干细胞标记领域,本研究将其对SD大鼠来源的脂肪干细胞(adipose-derived stem cells,ADSCs)进行标记,并与既往商用SPIO标记效果进行对比,探讨这种新型超顺磁性氧化铁标记的有效性及安全性。本研究实验组还引入用相同方法合成的带表面固定零电荷的PEG/聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)修饰的SPIO进行对照标记,以探索表面电荷在标记有效性中的作用。
实验方法
1.SD大鼠ADSCs的提取、纯化、鉴定
取4周龄以内的SD大鼠(购自广东省医学实验动物中心),无菌条件下取腹股沟处的脂肪组织,反复冲洗,剪碎成大约1 mm3的细小组织块;加入I型胶原酶(Sigma公司)进行恒温振荡消化,中止消化后进行离心,种植在含10%胎牛血清(Gibco公司)的DMEM/F12(Hyclone公司)培养瓶中,标记为原代细胞(P0),以1:2的比例传代,纯化提取出ADSCs,传代到P3代备用。
取P3代的培养细胞,用FACScan 流式细胞仪(美国 BD FASCantoTM)进行表面抗原CD29、CD45、CD44 、CD106(Biolegend公司)的检测。
2.新型SPIO标记后ADSCs形态的观察和有效孵育时间、浓度的初步选定
SPIO由桂林理工大学张宝林教授团队以PEG作为溶剂,以乙酰丙酮合铁为铁源,加入PEI、PVP作为表面涂层修饰剂制成氧化铁纳米粒子水溶液[6]。
取6孔板,细胞铺板,设置不同浓度(0、6、12、25、50和100 μg/mL)和不同时间(6、12、24和48 h)组孵育,然后进行普鲁士蓝染色,倒置显微镜下观察标记细胞的形态,随机选择视野计数100个细胞,其中含蓝色颗粒的细胞为标记阳性细胞,计算标记阳性率,分别计数3次取平均值,初步选定达到95%以上的标记率且细胞形态无明显改变的孵育浓度和时间。
3.标记细胞的安全性检测
细胞活力:将未标记组和标记组的单细胞悬液与0.4%台盼蓝溶液以1:1比例混匀,3 min内用计数板计数后计算活细胞率(%)。
细胞增殖力:将未标记组和标记组的细胞分别在1、3、5 d进行MTT试验。实验时,每孔吸去20 μL培养液,加入MTT 20 μL,同上条件继续孵育4 h后弃上清,加入DMSO 150 μL/孔,室温下于圆周震荡器震荡10 min,酶标仪选用双波长(570、630 nm)测量各孔的光密度(optical density,OD)值,每孔重复测3次,减去空白孔后取均值,绘制出生长曲线。
细胞表面抗原表达:将未标记组和标记组的细胞加入荧光标记的大鼠来源CD29、CD45、CD44 、CD106抗体,进行细胞表面抗原表达的检测。
4.透射电子显微镜(transmission electron microscopy,TEM )观察
将标记后的细胞用2.5%戊二醛(预冷)4 ℃固定6 h,然后用1%锇酸固定2.5 h,梯度乙醇脱水,渗透、包埋、聚合,常规超薄切片(70 nm),用铅铀染色2 h,使用透射电子显微镜(日本 JEM1230)观察细胞超微结构,包括SPIO所在部位以及线粒体、内质网、高尔基体等细胞器的完整性。
5.电感耦合等离子体原子发射光谱法(inductively coupled plasma-atomic emission spectrometry,ICP-AES)检测标记细胞内的铁含量
将标记后一定数量(106)的细胞放置在15 mL玻璃管内,在每个样品中加入65%~68%的浓硝酸,保持121℃高温高压反应,使样本充分溶解呈溶液。设立标准样品分别为:空白、0.1、1、10、50、100(PPm),进行ICP-AES定量检测。根据其定量结果得出标准曲线,计算出单细胞铁含量。
6.统计学分析
采用SPSS 17.0软件进行统计学分析,标记组和未标记组的台盼蓝拒染率、MTT吸光度差异的比较采用单因素方差分析,数据符合正态分布的相关性分析采用Pearson相关检验,数据不符合正态分布的相关性分析采用Spearman相关检验,以P<0.05为差异有统计学意义。
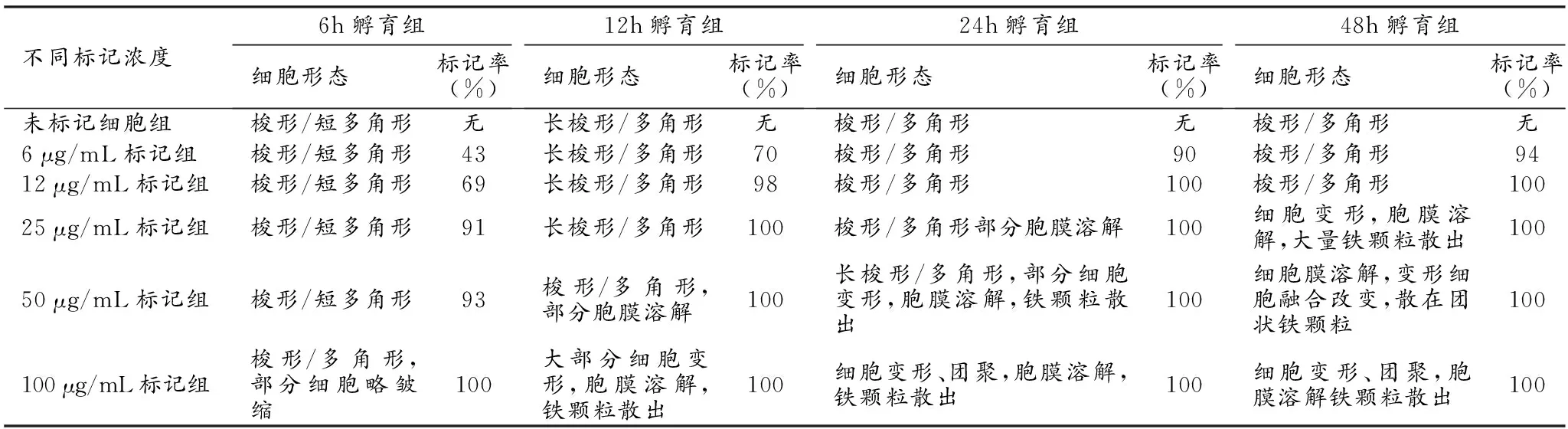
表1 不同浓度PEG/PEI修饰的SPIO孵育不同时间点ADSCs的形态变化和铁标记率测定
结 果
1.SD大鼠来源ADSCs的提取、纯化和鉴定
ADSCs呈多角形、纺锤形、梭形贴壁生长,HE染色显示细胞核位于细胞中间,细胞梭形突起相互连接,呈融合生长(图1)。
流式细胞仪检测显示P3代ADSCs对CD29的表达为强阳性,达到95%以上;对CD44的表达为阳性,为30%~40%;对CD106、CD45表达为阴性,表达小于5%(图2)。
2.ADSCs的有效孵育时间、浓度的观察和初步选定
细胞内铁标记率随着浓度和孵育时间的增加而增加,同时,细胞的形态学也随着孵育浓度与时间的增加而改变,细胞逐渐出现变形、皱缩、胞膜溶解的现象(表1、2、图3)。
PEG/PEI修饰SPIO标记组在12 μg/mL、25 μg/mL浓度下孵育12 h后即可得到95%以上的标记率,细胞形态无明显改变(表1、图3a、b)。而PEG/PVP修饰SPIO标记组在25 μg/mL、50 μg/mL浓度下孵育12 h后即可得到95%以上的标记率,细胞形态无明显改变(表2、图3),并且发现PEG/PVP修饰SPIO标记组随着标记浓度的增加,细胞内铁颗粒增加并不明显,只积聚在细胞质边缘靠近胞膜的区域。
3.标记安全性检测 (有效标记浓度和时间,细胞形态无改变的前提下)
台盼蓝染色:台盼蓝染色结果显示,25 μg/mL标记组2孵育48 h,50 μg/mL标记组2孵育12、24和48 h后,ADSCs的活力较未标记细胞组下降,差异有统计学意义(P<0.05),其余各组与未标记组比较差异均无统计学意义(P>0.05,表3)。
增殖力检测:增殖力曲线趋势图显示,12 μg/mL、25 μg/mL PEG/PEI修饰的SPIO标记组孵育12 h后,25 μg/mL PEG/PVP修饰的SPIO孵育12 h后,增殖力曲线与未标记组生长趋势无明显差异,其余标记组增殖力曲线下降(图4)。
经过标记率、细胞活力和增殖力的检测,选择PEG/PEI修饰的SPIO孵育浓度为12 μg/mL、25 μg/mL,PEG/PVP修饰的SPIO孵育浓度为25 μg/mL,孵育时间均为12 h;细胞表面抗原表达检测、电镜观察均选择该孵育浓度和时间。
细胞表面抗原表达鉴定:流式细胞仪检测显示标记后的ADSCs对CD29的表达为强阳性,达到95%以上;对CD44的表达为阳性,为30%~40%;对CD106、CD45表达为阴性,表达均<5%,与未标记组之间差异无统计学意义(图2b)。
注:标记组1是PEG/PEI修饰的SPIO标记组;标记组2是PEG/PVP标记组。P值为各标记组与未标记组的比较结果。
4.TEM观察
SPIO标记后,内吸收的氧化铁纳米颗粒均位于细胞质区域内,主要位于溶酶体内,呈囊泡样聚集改变,细胞核内未见纳米颗粒。PEG/PEI修饰的SPIO标记细胞组内沉积的囊泡数量要比PEG/PVP修饰的SPIO多,几乎蔓延了整个细胞质区域,而后者主要聚集于靠近细胞膜的区域(图5);从电镜图片来看,胞核不规则,染色质较均匀,细胞器结构基本完整,内吸收的纳米颗粒对细胞形态、结构无明显影响。
5.SPIO的性能特性
将既往商用SPIO的材料性能特性与本研究中的新型SPIO进行对比,结果见表4。
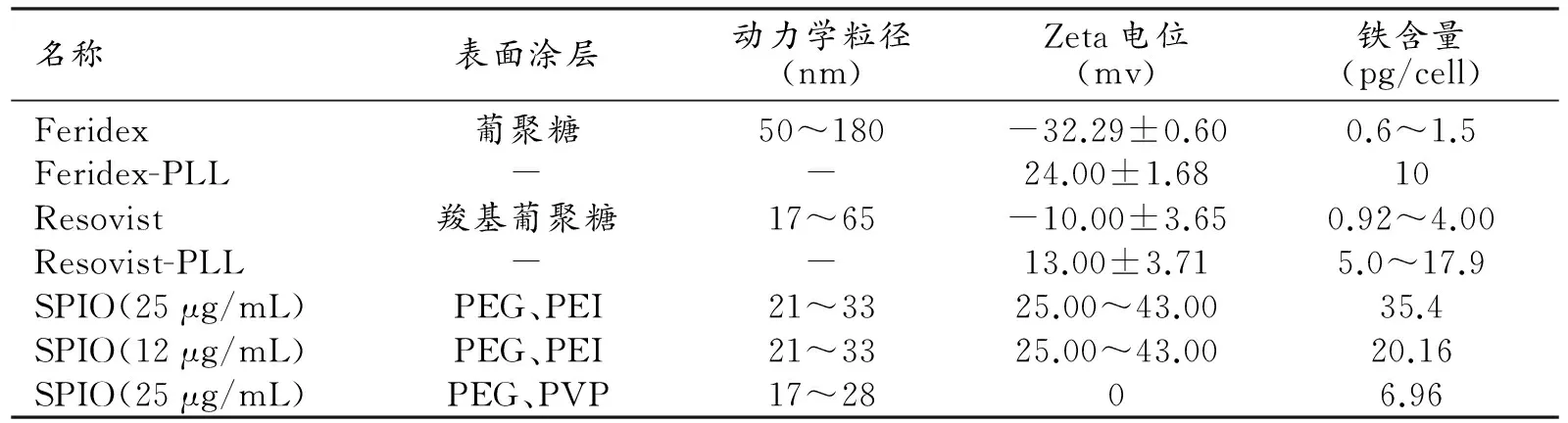
表4 多醇法合成的SPIO和既往商用的SPIO性能特性对比
讨 论
1.多醇法合成的SPIO的性能评价
PEG由于其较高的水溶性,并且无抗原性和免疫原性而可作为高温多元醇法中的溶剂使用,在合成的SPIO表面进行PEG涂层修饰,不仅能提高SPIO在水中的溶解性,而且能让纳米粒子在溶液中稳定分散[7]。PEI是一种含有大量氨基的阳离子聚合物,它一方面能够有效地中和胶体液中过量的负电荷,尤其是在酸性或者中性环境下;另一方面其包含的多量氨基能够与不同的物质相结合,从而使得合成的SPIO结构更加稳定,生物相容性和弛豫率亦有所提高[8]。PVP是一种两亲性聚合物,Lu等[9]的研究中发现这种以PVP为涂层的氧化铁纳米粒子溶解性和稳定性更高,在不同的有机溶剂和不同PH值的水溶液中(包括PBS液)中稳定分散。
而本研究中的新型SPIO是以PEG作为溶剂,以乙酰丙酮合铁(Fe(acac)3)为铁源,加入PEI、PVP作为表面涂层修饰剂制成[6],具有以下优点:①可以分散于水溶液中,一步合成水溶性的SPION;②结晶性好,磁性强;③粒径分布均匀,分散性好,基本没有出现团聚的现象。
2.高温多元醇法合成的SPIO与既往商用SPIO在标记有效性上的对比评价
本研究发现这种新型SPIO在12~25 μg/mL孵育浓度,12 h的孵育时间下即可达到95%以上铁标记率而无细胞毒性,而既往商用SPIO与转染剂结合后要达到有效标记率的孵育浓度为25~50 μg/mL,孵育时间为18~24 h[10],说明这种新型SPIO能更快速有效地标记干细胞;考虑是由于纳米粒子水动力学粒径小于100 nm,大小分布均一,有利于细胞对其吸收[4],并且表面修饰涂层的空间位阻以及粒子间的静电斥力阻止了粒子间的团聚,使得纳米粒子结构更加稳定,进一步促进了纳米粒子的吸收和内化[11]。
随后的ICP-AES检测对标记细胞内的铁含量进行测定进一步证实了这种新型SPIO在细胞标记领域的有效性。既往研究表明,Feridex在没有转染剂结合的情况下,25 μg/mL中孵育24 h后,细胞内的铁含量为0.6~1.5 pg/cell[12,13],加入了一定浓度的多聚赖氨酸(polylysine,PLL)结合后,细胞内的铁含量可达到10 pg/cell[10,12]。由于Resovist的水动力学粒径要小于Feridex,能更有效地促进粒子的吸收和内化[12],因此在相同的孵育浓度和时间条件下,细胞内的铁含量可达到0.92~4.00 pg/cell[12,14],与PLL结合后,细胞内的铁含量上升为17.9 pg/cell[5]。与此对比,PEG/PEI修饰的SPIO在25 μg/ml中孵育12 h后,测定细胞内的铁含量达到35.4 pg/cell;即使在12 μg/mL中孵育12 h,细胞内的铁含量也可达到20.16 pg/cell。因此,无论是从标记的浓度和时间,还是细胞内标记的铁含量来衡量,都提示本研究中的PEG/PEI修饰的SPIO比商用的SPIO能更加快速有效地标记细胞。
除此之外,本研究还发现PEG/PEI修饰的SPIO标记效果要比PEG/PVP修饰的SPIO明显,前者在不影响细胞生物活性的前提下,随着孵育浓度和时间增加,细胞标记率提高,细胞内铁染色量和铁含量亦增加;而PEG/PVP修饰的SPIO虽然在25 μg/ml的浓度下孵育12 h后达到95%以上的标记率,但随着标记浓度的增加,普鲁士蓝染色显示细胞内铁颗粒增加并不明显,只积聚在细胞质边缘靠近胞膜的区域,随后的ICP-AES测定细胞内铁含量仅达到6.96 pg/cell,标记效果与既往商用的SPIO对比并无优势;考虑是因为细胞标记不仅仅与纳米粒子的直径大小有关,还依赖粒子化学特性和表面电荷情况。有研究表明在外源性的纳米材料向细胞内输送过程中,增加表面电荷能够促使纳米粒子的吸收和内化[11]。本研究中PEG/PEI修饰的氧化铁纳米粒子表面为正电荷,而PEG/PVP修饰的纳米粒子表面却是零电荷[4],并不利于纳米粒子向细胞内的输送,说明表面电荷在细胞标记中占有极其重要的角色。
3.标记的安全性评价
纳米颗粒表面涂层结构修饰除了影响细胞的标记率,还会影响细胞毒性作用。Thorek等[11]的研究中发现,在10~50 μg/ml浓度下的SPIO孵育后,只有少量的可以忽略不计的细胞出现死亡,但在SPIO进行了胺化的涂层后,即使是在10 μg/ml的浓度下,都表现出了一定程度的细胞毒性,这种细胞毒性随着孵育浓度的增加而加剧。因此本研究将达到有效标记率的孵育浓度和时间进行了细胞毒性的测定,发现新型SPIO在适宜浓度和时间的条件下孵育后,不仅细胞活力、增殖力无明显改变,而且相应的ADSCs表面抗原表达能力与未标记组差异亦无统计学意义,因此考虑该孵育浓度和时间孵育后对干细胞的生物学活性无明显抑制作用。
一般来说,标记的安全性不仅需要评定标记对宿主细胞生物学活性的抑制作用,还得考虑内吸收的纳米铁颗粒进入细胞内如何代谢降解。目前普遍认为具有明显生物相容性的SPIO应该是可以通过物理铁代谢和利用的途径进行降解的[15]。现有的研究表明,进入细胞内的氧化铁纳米粒子是作为元素铁被代谢的,部分通过水解酶代谢,但主要还是在溶酶体的酸性条件下被代谢的[14]。因此纳米粒子通过内吞作用进入细胞质后,先位于细胞质中的溶酶体仓,然后再分发到细胞核周围的囊泡以及终极溶酶体中,通过生物体的组织中的分子蛋白,溶酶体中的元素铁可被储存或者进一步合成血红蛋白而降解,从而始终维持生物体内的铁平衡,本研究用透射电子显微镜对SPIO标记细胞的超微结构进行了观察,结果显示内吸收的SPIO主要位于细胞质区域的囊泡和溶酶体内,并且标记后的细胞结构基本完整,细胞器未见明显破坏,进一步说明了SPIO的标记是安全有效的。
本研究结果显示这种由高温多元醇法合成的新型SPIO在适当孵育浓度和时间下可以安全、快速地标记ADSCs。这种具有固定表面正电荷的PEG/PEI修饰的新型SPIO标记效果要远远比既往商用的SPIO快速有效,并随着孵育浓度的增加,细胞内的铁含量增加,可作为一种新型的磁性标记物用于干细胞标记;而具有固定表面零电荷的PEG/PVP修饰的SPIO比起既往商用的SPIO并无明显优势,说明表面电荷在细胞标记中占有极其重要的角色。
[1]Albukhaty S,Naderi-Manesh H,Tiraihi T.In vitro labeling of neural stem cells with poly-L-lysine coated super paramagnetic nanoparticles for green fluorescent protein transfection[J].Iranian Biomedical J,2013,17(2):71.
[2]Khurana A,Nejadnik H,Chapelin F,et al.Ferumoxytol:a new,clinically applicable label for stem-cell tracking in arthritic joints with MRI[J].Nanomedicine,2013,8(12):1969-1983.
[3]杨文胜,高明远,白玉白.纳米材料与生物技术[M].北京:化学工业出版社,2005:53-177.
[4]Jo J,Aoki I,Tabata Y.Design of iron oxide nanoparticles with different sizes and surface charges for simple and efficient labeling of mesenchymal stem cells[J].J Controlled Release,2010,142(3):465-473.
[5]Liu G,Yang H,Zhang XM,et al.MR imaging for the longevity of mesenchymal stem cells labeled with poly-L-lysine-Resovist complexes[J].Contrast Media Mol Imaging,2010,5(2):53-58.
[6]Zhao F,Zhang B,Wang J,et al.Synthesis and properties of magnetite nanoparticles coated with poly (ethylene glycol) and poly (ethylene imine)[J].J Nanosci Nanotechnol,2013,13(10):6793-6797.
[7]Ammar S,Helfen A,Jouini N,et al.Magnetic properties of ultrafine cobalt ferrite particles synthesized by hydrolysis in a polyol medium Basis of a presentation given at Materials Discussion No.3,26-29 September,2000,University of Cambridge,UK[J].J Materials Chemistry,2001,11(1):186-192.
[8]Brus C,Petersen H,Aigner A,et al.Physicochemical and biological characterization of polyethylenimine-graft-poly (ethylene glycol) block copolymers as a delivery system for oligonucleotides and ribozymes[J].Bioconjugate Chemistry,2004,15(4):677-684.
[9]Lu X,Niu M,Qiao R,et al.Superdispersible PVP-coated Fe3O4nanocrystals prepared by a "One-Pot" reaction?[J].J Physical Chemistry B,2008,112(46):14390-14394.
[10]Kim TH,Kim JK,Shim W,et al.Tracking of transplanted mesenchymal stem cells labeled with fluorescent magnetic nanoparticle in liver cirrhosis rat model with 3T MRI[J].Magn Reson Imaging,2010,28(7):1004-1013.
[11]Thorek DL,Tsourkas A.Size,charge and concentration dependent uptake of iron oxide particles by non-phagocytic cells[J].Biomaterials,2008,29(26):3583-3590.
[12]Mailänder V,Lorenz MR,Holzapfel V,et al.Carboxylated superparamagnetic iron oxide particles label cells intracellularly without transfection agents[J].Mol Imaging Biol,2008,10(3):138-146.
[13]Suh JS,Lee JY,Choi YS,et al.Efficient labeling of mesenchymal stem cells using cell permeable magnetic nanoparticles[J].Biochem Bioph Res Com,2009,379(3):669-675.
[14]Ittrich H,Lange C,Tögel F,et al.In vivo magnetic resonance imaging of iron oxide-labeled,arterially-injected mesenchymal stem cells in kidneys of rats with acute ischemic kidney injury:Detection and monitoring at 3T[J].J Magn Reson Imaging,2007,25(6):1179-1191.
[15]Barrow M,Taylor A,Murray P,et al.Design considerations for the synthesis of polymer coated iron oxide nanoparticles for stem cell labelling and tracking using MRI[J].Chem Soc Rev,2015,44(19):6733-6748.
The research of effectiveness and safety on SD rat adipose-derived stem cells labeled with a new type of superparamagnetic iron oxide nanoparticles
MA Wei-qiong,XIE Qi,ZHANG Ding-xuan,et al.
Department of Medical Imaging,Guangzhou First People′s Hospital/Nansha Central Hospital,Guangzhou Medical University,Guangzhou 510180,China
Objective:The aim of the present study was to explore the efficacy and safety of a new type of superparamagnetic nanoparticles (SPION) by labeling the SD rat adipose-derived stem cells (ADSCs) with SPION and comparing with our previous research results on commercial superparamagnetic iron oxide (SPIO).Methods:First,the SD rat ADSCs were incubated and labeled by different concentration groups (0,6,12,25,50,100μg/mL,respectively) and by different time groups (6,12,24,48h,respectively) after isolation,purification and identification.The labeling rate of iron oxide nanoparticles were detected by prussian blue staining.Second,the safety of high labeling efficacy (>95%) in ADSCs were evaluated,under the condition of not affecting the cell morphology,with viability,proliferation,surface makers identification and neuronal induction.Third,the ultrastructure of labeled ADSCs were oberved by transmission electron microscopy (TEM).Fourth,the iron content of labeled ADSCs were measured with ICP-AES and compared with our previous research results on commercial SPIO.Results:Under the premise of with no cytotoxicity,the incubation concentration for high labeling efficiency (>95%) of the new SPIO were 12 and 25μg/mL at the incubation time of 12h.The ICP-AES measurements showed that the iron content in ADSCs was 35.4pg/cell or 20.16pg/cell at the incubation of PEG/PEI SPIO which carried permanent positive surface charge, whereas only 6.96pg/cell at the incubation of PEG/PVP SPIO (25μg/mL,12h).TEM imaging showed that the cellular ultrastructure was intact,and the nanoparticles uptake was dominantly located in the vesicles and lysosomes.Conclusion:At the incubation of appropriate concentration and time,ADSCs can be safely and quickly labeled with new type of paramagnetic nanoparticles.Compared with the commercial SPIO,the new type of PEG/PEI SPIO trends to be a more advantaged magnetic tracer to label stem cells.In contrast,the advantage of PEG/PVP SPIO is not apparent,which indicates that surface charge have played an extremely important role in stem cell magnetic labeling.
New type of superparamagnetic nanoparticles; Adipose derived stem cells; Staining and labeling; Iron content; Surface charge
510180广州,广州医科大学附属广州市第一人民医院/广州市南沙中心医院医学影像部(马伟琼、谢琦、张鼎旋、汤间仪、雷正贤、杨逸铭);516001广东,惠州市中心人民医院放射科(马伟琼)
马伟琼(1986-),女,广东梅州人,硕士研究生,医师,主要从事神经影像诊断与分子影像学研究工作。
2014广州市南沙区经贸科技与信息化局民生科技项目基金(2014MS01);2014广州市医药卫生科技一般引导项目(20141A010015);2015广州市科技计划项目科学专项(一般项目)基金(1563000424)及2015广东省科技计划项目技术开发类基金(2014A020212034)
R814.3
A
1000-0313(2016)05-0386-07
10.13609/j.cnki.1000-0313.2016.05.001
2015-10-29
2016-01-11)
