硫酸-高氯酸消解植物样品的氮损失研究
2016-09-05张仁懿史小明卢月娅袁建立
张仁懿, 史小明, 卢月娅, 袁建立
(兰州大学 生命科学学院,草地与农业生态系统国家重点实验室, 甘肃 兰州 730000)
硫酸-高氯酸消解植物样品的氮损失研究
张仁懿, 史小明, 卢月娅, 袁建立
(兰州大学 生命科学学院,草地与农业生态系统国家重点实验室, 甘肃 兰州730000)
通过控制高氯酸加入浓度及消解温度, 探讨硫酸-高氯酸消解法的氮损失过程,探索其最佳的消解条件。结果表明:消解温度是决定植物样品氮损失的关键因素,而铵离子形态的氮损失受高氯酸加入浓度、消解温度的影响显著;高氯酸加入浓度与高温消解温度共同影响植物样品消解的完成时间;0.30 mL的蒸馏水加入量、低温120 ℃、高温260 ℃的消解条件,能够在获得较快消解速率的同时,有效地控制氮的损失。
植物; 氮损失; 硫酸-高氯酸消解
近年来,消解设备不断升级,对消解条件的控制日益精确。然而,当前植物样品的电热消解仍旧采用上个世纪的方法[1-2],消解条件粗放和实验人员的频繁介入,极大影响了实验的可靠性及工作效率。微波消解方法的发展,虽然能够缩短消解时间,提高工作效率[3-5],但微波消解主要使用低沸点的硝酸,带入的氮源使其不能用于含氮的植物样品消解。因此,含氮的植物样品消解成为当前样品分析过程的瓶颈,为了满足自动化设备大批量上样的需求,亟需发展快速、可靠的多元素联合消解方法。
用于植物多元素联合消解常用的方法为硫酸-氧化剂消解法,其中氧化剂一般选择过氧化氢或高氯酸[1,6]。相比传统的凯氏消煮法(Kjedahl),硫酸-氧化剂消解法具有以下优点:消解过程中不带入金属离子,在浓硫酸脱水的环境中,过量的氧化剂高温加热后分解,不影响多元素(如氮、磷、钾等)的联合测定。然而,过氧化氢受热不稳定,消解过程中需多次中断消解、补加过氧化氢,耗时耗力[7-8]。小于72%的低浓度高氯酸在常温下主要表现为酸性,其氧化能力较弱,而高于150 ℃时表现出强氧化性[9]。样品消解过程中,高氯酸将易消解成分先氧化,留下较难消解的成分;而随着体系中水分的蒸发,高氯酸浓度及氧化性也表现出上升趋势。高氯酸溶液的共沸点为203 ℃,可在高于此温度下将剩余的高氯酸赶除[10]。
本研究通过精确控制高氯酸的加入浓度及消解温度,控制高氯酸的氧化能力和反应的激烈程度,以期在实现快速多元素联合消解的同时,有效控制消解过程中的氮损失。
1 实验
1.1设备与试剂
设备:程序式全自动消解炉(型号DK20,功率2.3 kW,意大利VELP);全自动化学分析仪(Smartchem 200,法国,AMS);全自动凯氏定氮仪(VAPODEST 50,德国Gerhardt)。
试剂:硫酸铵溶液(含1% 氮);浓硫酸(98%);高氯酸(60%);混合催化剂的硫酸钾含量∶五水硫酸铜含量∶硒粉含量=100∶10∶1。
1.2实验设计
实验材料为青藏高原亚高寒草甸施氮处理的地上混合样品,烘干粉碎后过80目筛。称取0.200 0 g±0.000 5 g植物样品至消解管,以0.30 mL蒸馏水润湿,加入5.00 mL浓硫酸脱水碳化30 min,先后加入适量的蒸馏水及0.50 mL高氯酸(60%),充分摇匀后低温t1下消解30 min,不取出消解管升至高温t2下消解至清亮后继续消解10 min,记录总耗时。消解液定容至500 mL,用全自动化学分析仪测定其氮含量。
实验设置蒸馏水加入量(含最先加入的0.30 mL蒸馏水)、低温消解温度t1、高温消解温度t23个因素,各取3水平,按正交表L9(34)设计,以凯氏法为对照[8]。以硫酸铵溶液为标准物质(相当于植物样品含氮量1.5%),计算加标回收率。每组实验重复10次。
1.3分析方法
不同实验组间的氮含量及加标回收率比较以用LSD多重比较进行检验;各因子对氮含量、加标回收率及消解时间的影响以一般线性模型(GLM)分析。分析过程均在SPSS 18.0中(IBM公司)完成。氮率损失计算如下:
氮损失率=[(凯氏法氮含量-高氯酸法氮含量)/凯氏法氮含量]×100%
2 结果与讨论
实验设置及消解结果见表1。表1结果显示,硫酸-高氯酸法消解测得样品氮含量均低于凯氏法,各实验组消解条件下均存在不同程度的氮损失,氮损失范围为1.29%~28.66%。植物样品氮含量多重比较结果显示,实验组1、2、4、6、7、8与凯氏法的测量结果差异不显著,然而加标回收率的分析结果显示,仅有实验组1与凯氏法差异不显著,达到了95.16%。已有研究表明,消解0.20 g植物样品大约需要消耗高氯酸0.3 g[11]。本研究的植物样品消解过程,0.30 g的高氯酸基本被消耗;而加入标准物质硫酸铵时,高氯酸在整个消解体系中保持较高水平,高氯酸表现出较强的氧化性,将部分铵态氮氧化成氮气而逸出[12]。因此,高氯酸消解植物样品的氮损失包括氧化有机物时有机态氮的损失及消解完成后体系中无机态氮(铵离子)的损失。加入高氯酸浓度或残留高氯酸浓度较高的情况下,以上两方面的氮损失都易发生,因此使用高氯酸法消解需严格控制高氯酸的加入量。
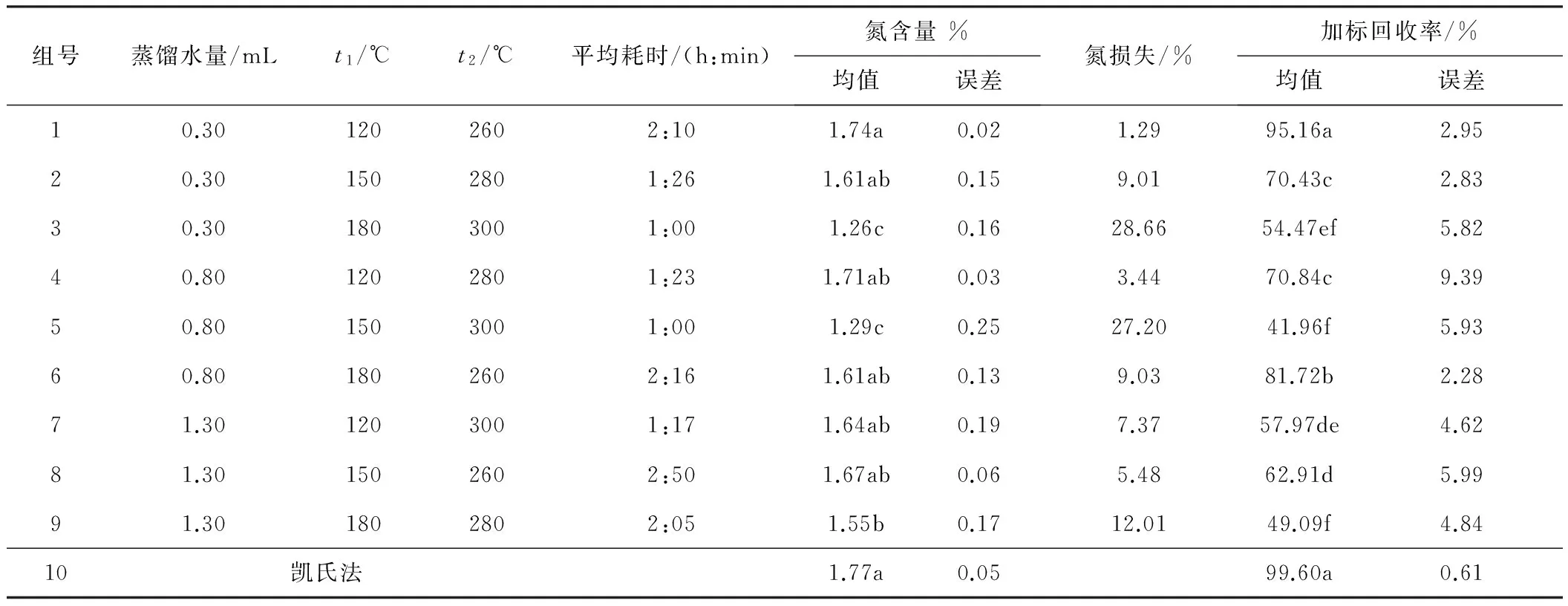
表1 实验设置及消解结果
注:同一列不同小写字母代表差异显著(P< 0.05)。
GLM分析结果表明,t1和t2均对植物样品的氮含量有极显著的影响(P<0.001),而加入的蒸馏水量对样品氮含量的影响不显著(见表2,表2中df为自由度),意味着不管是消解前期还是后期,温度都是硫酸-高氯酸法消解植物样品控制氮损失的最关键因素[11]。除了消解温度,加标回收率还受加入蒸馏水量(高氯酸
加入浓度)的显著影响。相对于植物样品,在加标样品的消解体系中,高氯酸消耗小而使高氯酸的加入浓度的影响较强。有研究表明,高氯酸法的氮损失主要发生在消解过程的前期[11],而本实验结果显示氮损失在消解前期和后期均存在,且根据F值判断,氮损失主要发生在后期的高温消解过程。
蒸馏水加入量、消解温度对消解时间的GLM分析显示,植物样品消解的完成时间受蒸馏水加入量(P< 0.05)、t2(P< 0.001)的影响显著,其中t2的影响最大(见表2),而t1对消解时间的影响不显著(P>0.05),这说明消解速率主要由t2决定。加入的蒸馏水稀释了高氯酸和硫酸的浓度,减弱了体系的氧化能力,使反应变慢而增加了消解时间。本研究消解时间最短为1 h,均为t2=300 ℃的实验组,然而该条件下不管是植物样品还是加标样品,氮损失率也最高。因此在包含氮的多元素消解过程中,使用高氯酸法需充分考虑快速消解带来的氮损失。
植物样品和加标样品消解的分析结果显示,实验组1与凯氏法的结果均无显著差异(见表1)。在蒸馏水加入量为0.3 mL、t1=120 ℃和t2=260 ℃时,其测试结果达到了凯氏法的水平。该实验组下,整个消解过程耗时为130 min,相对于常用的硫酸-过氧化氢法(耗时一般为3~4 h)达到了省事省力的目的[7],且有效地控制了消解过程中的氮损失。
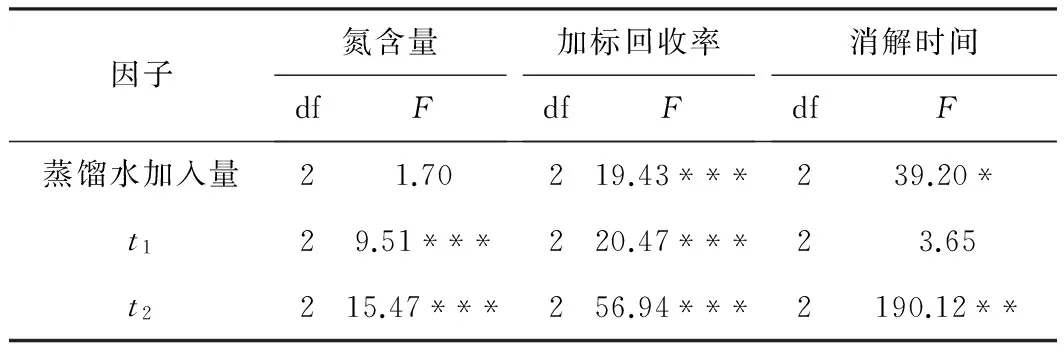
表2 蒸馏水加入量、t1及t2对分析结果和
注:*:P< 0.05;**:P< 0.01;***:P< 0.001。
3 结论
(1) 硫酸-高氯酸法消解植物样品的氮损失包括有机质氧化时的氮损失,以及消解成铵盐后的氮损失。
(2) 该法的氮损失在消解初期的低温及后期的高温过程中均可能发生,但以高温消解过程的氮损失为主。
(3) 在蒸馏水加入量为0.3 mL、t1=120 ℃和t2=260 ℃时,与凯氏法相比,不存在显著的氮损失。此条件下植物样品的消解耗时为130 min,在实现快速消解的同时有效地控制了氮的损失。
References)
[1] 劳家柽. 土壤农化分析手册[M]. 北京: 农业出版社, 1988.
[2] 鲍士旦. 土壤农化分析 [M]. 北京: 中国农业出版社, 2000.
[3] 杨锐明, 李彦. 微波消解及ICP-AES同时测定土壤中多种元素含量[J]. 实验技术与管理, 2011, 28(8): 26-28.
[4] 周勇义, 谷学新, 范国强,等. 微波消解技术及其在分析化学中的应用[J]. 冶金分析, 2004, 24(2): 30-36.
[5] 顾培, 巩万合, 陈荣府,等. 普通消解与微波消解分析植物样品中A l等元素的方法比较 [J]. 土壤通报, 2007, 38(3): 616-618.
[6] 赵金兰, 张树莲, 祁建峰. 硫酸-高氯酸-钼锑抗比色法测定土壤全磷的注意事项[J]. 现代农业科技, 2009(21): 234.
[7] 李朝英, 郑路, 卢立华,等. 测定植物全氮的H2SO4-H2O2消煮法改进[J]. 中国农学通报, 2014,30(6):159-162.
[8] 陈淑萍, 王雪征, 茜晓哲,等. 几种凯氏加速剂对植物全氮消煮时间和结果的比较分析[J]. 华北农学报, 2006,21(增刊):19-22.
[9] 方艳玲, 方艳敏, 张波. 高氯酸在样品消解中的应用[J]. 中国热带医学, 2005,5(9):1913,2018.
[10] 潘乃寿, 潘明混. 高氯酸在环境有机样品分解中的应用 [J]. 中国坏境监刚, 1988,2(1):47-49.
[11] 贺立源, 梁华东. 高氯酸-硫酸消化植物样品防止氮素损失的研究 [J]. 分析化学, 1992,20(11):1277-1280.
[12] 谈玲华, 李凤生. 纳米铜粉的制备及其对高氯酸铵热分解催化性能的研究 [J]. 南京工程学院学报:自然科学版,2005,3(1):6-10.
Study on nitrogen loss for sulfuric acid-perchioric acid digesting plant sample
Zhang Renyi, Shi Xiaoming, Lu Yueya, Yuan Jianli
(State Key Laboratory of Grassland and Agro-Ecosystems, School of Life Sciences, Lanzhou University, Lanzhou 730000, China)
In order to explore the nitrogen loss and find the optimum condition for the method, a series of perchloric acid concentration and digest temperature are set. The nitrogen loss of plant sample is determined by the digest temperature, and the nitrogen loss of ammonium in the solution is affected by the perchloric acid concentration and digest temperature. The elapsed time of sample digestion is also dependent on the perchloric acid concentration and digest temperature. The digest condition with 0.30 mL distilled water, 120 ℃ initial temperature and 260 ℃ subsequent temperature, can prevent the nitrogen loss effectively and simultaneously achieve the rapid digestion.
plant; nitrogen loss; sulfuric acid-perchloric acid digestion
10.16791/j.cnki.sjg.2016.02.014
2015- 06- 17修改日期:2015- 07- 15
国家自然科学基金项目(41201285)
张仁懿(1983—),男,福建三明,博士,中级实验师,主要研究方向为生态化学计量学.
E-mail:zrenyi@lzu.edu.cn
Q946
A
1002-4956(2016)2- 0048- 03
