实用化改良Feulgen染色法的研究
2016-09-05黄荣祥余岚岚何文波厦门麦克奥迪医学检验所福建厦门361006
黄荣祥,余岚岚,聂 琨,唐 剑,何文波,马 亮(厦门麦克奥迪医学检验所,福建厦门361006)
实用化改良Feulgen染色法的研究
黄荣祥,余岚岚,聂琨,唐剑,何文波,马亮(厦门麦克奥迪医学检验所,福建厦门361006)
目的探讨一套具有重复性强、染色稳定、耗时短、可大规模推广的改良Feulgen染色法(TEM35),为临床科研的应用提供方法学指导。方法选取该所2014年3~4月收集的符合实验条件的21例液基宫颈标本,每例宫颈标本混匀后制成2张片子,将42张片子分为两组,每组各21张,采用TEM35、经典Feulgen染色法(TEM25)分别对两组涂片染色,采用Motic DNA图像分析系统测量二倍体细胞核的积分光密度(IOD)及其变异系数(CV),并对测量结果进行统计学分析。结果TEM25所得的整体IOD平均值为114.554,而TEM35所得平均值为112.933,IOD一致性较好(Kendall′s τ=0.692,P<0.01)。TEM25所得CV值为8.166,而TEM35所得CV值为7.732,CV一致性略好(Kendall′s τ=0.568,P<0.01)。结论实用化的TEM35所获结果与TEM25所获结果高度一致,且TEM35耗时短、染色特异性好。
染色与标记;病理学;图像处理,计算机辅助;DNA;肿瘤
近年来,随着恶性肿瘤发病率和死亡率的不断提高,恶性肿瘤已经成为疾病致死的首要原因。基于全球肿瘤流行病统计数据(GLOBOCAN)估计,2012年全球癌症新发病例1 410万,死亡病例820万[1]。国家癌症中心分析数据估计,2015年中国癌症总发病例数为429.16万,总死亡病例281.42万[2],大约每分钟有6人被诊断为癌症[3],中国因癌症死亡的病例总数占全球的近1/4[4]。癌症将对中国乃至全球的公共卫生服务造成越来越大的负担,因此肿瘤的早期诊断显得尤为重要。恶性肿瘤的诊断和预后评价所公认的方法为细胞病理学,然而该方法受限于病理医生的诊疗水平,具有随意及主观性强的缺点。细胞DNA图像分析则是一种客观、可控、独立的病理诊断新技术,能更早地定量反映肿瘤细胞生长情况。大量研究表明,单独采用细胞DNA图像分析或联合细胞学、分子诊断学、免疫学等方法对恶性肿瘤的早期诊断、治疗、预后均具有重要的指导意义[5-9]。自从1924年Feulgen等建立了DNA-Feulgen染色方法以来,Feulgen染色法即成为了DNA图像定量分析的“金标准”[10]。然而,现有的经典Feulgen染色法(TEM25)操作时间较长,难以满足临床快速病理诊断的要求。针对TEM25耗时长的缺点,多位该领域的研究人员曾试图通过各种方法来缩短染色时间[11-15]。然而,这些快速染色法往往片面地追求速度而忽略了临床的实用性,其所需条件苛刻难以控制,染色效果不稳定,仅适用于科研,难以在医院推广应用。医院或医学检验机构迫切需要一种既省时又实用、可靠的Feulgen染色法。本研究通过对欧洲细胞病理学会推荐的TEM25[16-17]进行长期摸索,反复改进,利用Motic DNA图像分析系统测量和分析宫颈细胞涂片上细胞核的DNA含量,并多次与TEM25的DNA测定结果对比,以期研究出一套具有重复性强、染色稳定、耗时短、可大规模推广的改良Feulgen染色法(TEM35)。
1 材料与方法
1.1材料随机抽取本所2014年3~4月所收集的符合实验条件的液基宫颈细胞标本21例,每例宫颈标本混匀后制成2张片子,将42张片子分为两组,每组各21张,自然晾干备用。
1.2仪器与试剂Bohm-Sprenger固定液配置:甲醇、甲醛、冰醋酸按16∶3∶1分别量取,搅拌混匀,装入储存瓶中封存备用,以上试剂及无水乙醇、盐酸、二甲苯等均为分析纯,由西陇化工股份有限公司提供。Motic DNA图像分析系统(麦克奥迪实业集团有限公司)、SHP-250FE智能生化培养箱(上海三发科学仪器有限公司)。
1.3方法
1.3.1细胞DNA染色液配置量取196 mL蒸馏水于搅拌瓶中,加入乙酸硫堇酯和偏重亚硫酸盐各0.2 g,加入4 mL 5 mol/L盐酸,搅拌染色液混合物,过滤或真空抽滤染色液,染色液应呈蓝紫色,过滤后无可见沉淀物。
1.3.2Feulgen染色
1.3.2.1TEM25Bohm-Sprenger固定液固定50 min (25℃),流水冲洗;5 mol/L盐酸水解60 min(25℃),流水冲洗;硫堇染色液染色75 min(25℃),流水冲洗;蒸馏水漂洗15 min(25℃),梯度乙醇脱水,过二甲苯,封片。以上均在室温下操作。
1.3.2.2TEM35Bohm-Sprenger固定液固定 30 min (35℃),流水冲洗;5 mol/L盐酸水解25 min(35℃),流水冲洗;硫堇染色液染色40 min(35℃),流水冲洗;蒸馏水漂洗5 min(35℃),梯度乙醇脱水,过二甲苯,封片。固定液、5mol/L盐酸、染色液、蒸馏水均提前预热至35℃。
1.3.3宫颈细胞核参数的测量按Motic DNA图像分析系统测量光密度的操作要求,测量宫颈标本细胞核的积分光密度(IOD),分别计算二倍体细胞核的IOD平均值及其变异系数(CV)值,以IOD平均值作为二倍体细胞核DNA含量的代表值。DNA含量测定时的差异以CV表示,CV=标准差/平均值×100%,均为系统自动生成。
1.4统计学处理应用SPSS20.0统计软件对2种染色方法结果的一致性进行分析。采用Kendall′s系统进行评价,将2种染色方法测量值分别排序并转换成秩次,检查两组数值排序的一致性。计算2种方法所测IOD、CV的95%置信区间。
2 结 果
2.1镜下效果TEM35染色稳定、细胞核染色深,且着色鲜艳、核轮廓清晰,细胞质及玻片背景干净,获得了较为满意的效果。TEM25及TEM35染色效果分别见图1。

图1 宫颈脱落细胞染色效果图(Fulgen染色,200×)
2.2宫颈标本二倍体细胞核IOD平均值、CV值分布情况
2.2.12种染色法所得21例宫颈标本二倍体细胞核IOD平均值、CV值线性分布情况TEM25与TEM35所测得每张宫颈片二倍体细胞核IOD平均值、CV值分布情况见图2、3。21例标本的2种染色方法之间有较明显的直线回归,IOD的回归系数为1.137,CV的回归系数为0.864。
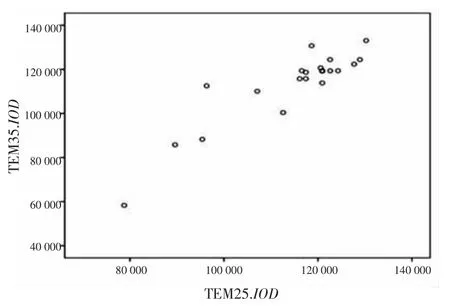
图2 21例宫颈标本二倍体细胞核IOD平均值线性分布
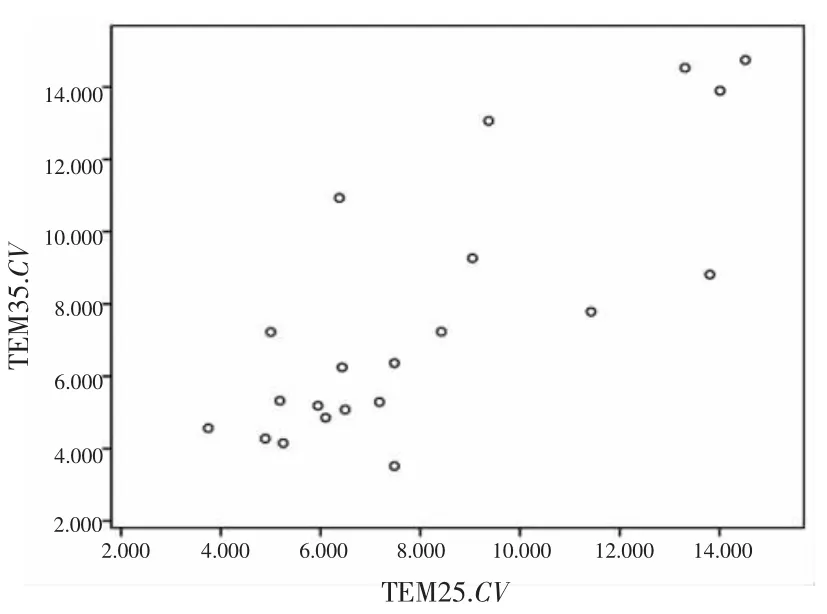
图3 21例宫颈标本二倍体细胞核CV值线性分布
2.2.22种染色法所得21例宫颈标本二倍体细胞核IOD、CV值一致性评价采用TEM25所得的21例宫颈标本二倍体细胞核的 IOD平均值为 114.554,而TEM35为112.933,二者较为相近。一致性检验结果表明,2种染色法的IOD一致性较好(Kendall′s τ=0.692,P<0.01)。TEM25所得CV值为8.166,而TEM35为7.732。一致性检验结果表明,2种染色法的CV一致性略好(Kendall′s τ=0.568,P<0.01),见表1。

表1 2种染色法所得21例宫颈标本二倍体细胞核IOD、CV值情况
3 讨 论
随着科学技术的不断发展,从分子水平研究细胞病理已成为热点。在众多技术中,细胞DNA图像分析正被越来越广泛地应用。目前,Feulgen染色仍然是DNA图像分析系统的标准染色方法。其作用机制主要是细胞DNA经盐酸水解,脱氧核糖与嘌呤之间的糖苷键断开,嘌呤碱基被解离,脱氧核糖(五碳糖)一端形成游离醛基,染色液中硫堇和亚硫酸根形成的中间产物与暴露出的游离醛基相互作用,生成蓝紫色化合物,从而使细胞核中的DNA呈蓝紫色。根据上述原理,Feulgen染色既是一种特异的染色方法,也是一种特殊的化学反应,提高反应温度是加快反应、缩短染色时间的一条重要途径。温度是影响盐酸水解的关键因素,酸解不充分或过度酸解都将影响DNA染色效果。仅当酸解暴露的游离醛基总量处于最大值时,才能与饱和的染色液充分结合,显示出所有的DNA。本实验表明,于5 mol/L盐酸(35℃)中水解25 min即可完成DNA游离醛基的最大化。
在细胞DNA染色液中,温度适当提高,使醛基与染料更快、更充分地接触,既缩短染色液反应时间,又保证染色效果。本实验表明,DNA在此环境中染色40 min即达反应平衡最高点,较TEM25时间缩短近半。整个配制、染色过程均在35℃环境中进行,无须煮沸、降温等,增强了染色液反应的稳定性。2种方法的染色液有效时长及使用次数基本一致,为了达到最佳染色效果,染色液不重复使用,仅限当天现配现用。此外,该染色液与其他Schiff试剂同样存在如下问题:配制时应避光,搅拌、过滤、染色要尽量在同一温度下操作,否则搅拌时已溶解的染料会由于温度变化而析出,造成结晶,影响染色与定量。
从本实验结果来看,TEM35缩短了着色时间,色彩清晰。与TEM25相比,2种方法所测得各标本的二倍体细胞核IOD平均值一致性高,呈明显的线性关系,且CV值相近,CV反映了各细胞之间的着色效果,CV越小,细胞之间的着色差异越小,DNA染色越一致,着色特异性越强。以上分析说明,TEM35能够使细胞核DNA充分地水解,并与染色试剂更充分地结合,满足了细胞DNA图像分析系统对准确度与精确度的标准要求。Kendall′s τ等级相关分析是反映分类变量相关性的指标,适用于2个变量均为有序分类的情况。运用统计学的Kendall′s τ一致性检验来评价2种染色方法的一致性,既可定量又可定性,使评价更客观,为后续研究提供一种可供参考的评价方法。
固定液可改变DNA分子结构,影响DNA对盐酸的敏感性,不恰当的固定液甚至可能破坏DNA结构,使之无法酸解或解离成DNA小片段。Bohm-Sprenger混合固定液含甲醛、甲醇、冰醋酸,甲醛是现阶段病理学评价较为常用的固定液,其能迅速穿透细胞,是一种相当好的快速固定剂。此外,甲醛具有致癌性,已有实验室开始探讨使用环保型固定剂作为醛类固定剂的替代品[18]。醇能将核蛋白固定成水溶性状态,使DNA暴露在水性液体中,有利于染料的结合。冰醋酸可以抵消组织因醛、醇导致的高度收缩和硬化作用,冰醋酸的渗透性很强,可快速固定细胞核内的染色质核蛋白,是固定染色质的极佳选择,有效避免因核固缩影响细胞DNA图像分析的精准性[19]。
近几十年来,科研工作者试图通过多种途径提高反应温度,追求快速,结果导致染色不稳定、可靠性低,不利于临床实际应用。TEM35在解决上述问题的基础上,同时避免了以下问题:作者通过大量的实践发现,仅当反应温度不高于35℃时,挥发性气体能被工作人员接受,且未有切片脱落现象,减少了重制片、重染色情况的发生。该温度下对细胞微观结构的破坏最小,符合人体生理温度,最大限度地保证细胞原始形态功能,为联合免疫组织化学、原位杂交等提供可能。
综上所述,TEM35大大地缩短了染色时间,为细胞DNA图像分析技术作为肿瘤诊断中的重要手段提供了保障。与免疫组织化学、荧光原位杂交技术、细胞学的联合辅助诊断将是未来发展的一个趋势,如何在一张切片上体现多种诊断,对于TEM35既是机遇又是挑战。实用化的TEM35最大限度地综合各方面的优势,使其在提升染色速度的同时又能保持稳定性、可靠性,非常适合在各大医疗机构推广应用。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[3]潘钢火,鲁晓明.中国癌症分布以及影响因素的研究进展[J].首都师范大学学报:自然科学版,2016,37(1):56-60.
[4]Guo P,Huang ZL,Yu P,et al.Trends in cancer mortality in China:an update[J].Ann Oncol,2012,23(10):2755-2762.
[5]李德昌,岳颖,郑吉春,等.组织印片DNA倍体分析在胃癌诊断和预后评估中的应用[J].空军医学杂志,2014,30(1):48-50.
[6]Xiao X,Shi L,Li H,et al.DNA content status using brush biopsy with image cytometry correlated with staging of oral leukoplakia:a preliminary study[J].Oral Oncol,2015,51(1):59-63.
[7]Meng Z,Shi J,Zhu C,et al.Automated quantificationof DNA aneuploidy by image cytometry as an adjunct for the cytologic diagnosis of malignant effusion[J].Analytical Cellular Pathology,2013,36(3/4):107-115.
[8]Schramm M,Wrobel C,Born I,et al.Equivocal cytology in lung cancer diagnosis[J].Cancer Cytopathol,2011,119(3):177-192.
[9]张立冬,张慧敏,刘美玲.细胞图像DNA倍体分析结合高危型HPV、支原体和衣原体检查与宫颈上皮内瘤变相关性研究[J].中华实验和临床病毒学杂志,2014,28(6):433-436.
[10]Biesterfeld S,Beckers S,Del Carmen Villa Cadenas M,et al.Feulgen staining remains the gold standard for precise DNA image cytometry[J].Anticancer Res,2011,31(1):53-58.
[11]刘育艳.Feulgen染色改良法[J].山西医科大学学报,2000,31(4):379.
[12]焦红丽,冶亚平,夏潮涌.两种染色方法在细胞核DNA含量检测中的应用及比较[J].中国体视学与图像分析,2007,12(3):180-184.
[13]金日男,夏潮涌.三种Feulgen染色方法的比较[J].中国体视学与图像分析,2006,11(1):39-43.
[14]楚广民,程爱明,张云汉.细胞DNA-Feulgen染色方法的改良[J].中国误诊学杂志,2003,3(3):402-403.
[15]凌玉琴,顾映红,赵为之,等.显示DNA含量的快速Feulgen染色技术及应用[J].中华病理学杂志,2003,32(2):175-176.
[16]Haroske G,Giroud F,Reith A,et al.1997 ESACP consensus report on diagnostic DNA image cytometry.PartⅠ:basic considerations and recommendations for preparation,measurement and interpretation[J].Anal Cell Pathol,1998,17(4):189-200.
[17]Giroud F,Haroske G,Reith A,et al.1997 ESACP consensus report on diagnostic DNA image cytometry.PartⅡ:Specific recommendations for quality assurance[J].Anal Cell Pathol,1998,17(4):201-208.
[18]Moelans CB,Oostenrijk D,Moons MJ,et al.Formaldehyde substitute fixatives:effects on nucleic acid preservation[J].J Clin Pathol,2011,64(11):960-967.
[19]魏清柱,夏潮涌,刘江欢.染色质浓缩对细胞核DNA含量检测的影响[J].中国体视学与图像分析,2007,12(2):123-125.
Study on practical improved Feulgen staining method
Huang Rongxiang,Yu Lanlan,Nie Kun,Tang Jian,He Wenbo,Ma Liang(Xiamen Motic Medical Laboratory Institute,Xiamen,Fujian 361006,China)
ObjectiveTo explore a set of strongly repetitive,dyeing stable,short time-consuming and large-scale popularization improved Feulgen staining method(TEM35)to provide the methodological guidance for clinical scientific research applications.MethodsTwenty-one specimens of liquid-based cervical smear from March 2014 to May 2014 in our institute were selected.Each cervical specimen was made for 2 sections after mixing and all the sections were divided into two groups,21 sections in each group.The two groups were respectively stained by using the TEM35 and classical Feulgen staining method (TEM25).The Motic DNA image analysis system was used to measure the diploid cell nuclear(IOD)and its coefficient of variation (CV)value,and the measurement results were analyzed statistically.ResultsThe overall IOD average value measured by TEM25 was 114.554 and which measured by TEM35 was 112.933,IOD had better consistency(Kendall′s τ=0.692,P<0.01).The CV value by TEM25 was 8.166,while which by TEM35 was 7.732,CV had slightly better consistency(Kendall′s τ=0.568,P<0.01). ConclusionThe results obtained by using the practical improved Feulgen staining method are highly consistent with those by using the classical Feulgen staining,moreover which has short time-consuming and good staining specificity.
Staining and labeling;Pathology;Image processing,computer-assisted;DNA;Neoplasms
10.3969/j.issn.1009-5519.2016.15.008
A
1009-5519(2016)15-2298-03
黄荣祥(1986-),主要从事细胞病理学及细胞图像分析方向的研究。
(2016-03-14)
