应用蛋白质组学方法分析新疆地方性砷中毒血浆中蛋白质的表达差异
2016-09-05谢惠芳吴顺华郑玉建
谢惠芳, 吴顺华, 张 杰, 马 艳, 郑玉建
(新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室, 乌鲁木齐 830011)
应用蛋白质组学方法分析新疆地方性砷中毒血浆中蛋白质的表达差异
谢惠芳, 吴顺华, 张杰, 马艳, 郑玉建
(新疆医科大学公共卫生学院劳动卫生与环境卫生学教研室, 乌鲁木齐830011)
目的应用蛋白质组学方法分析比较新疆地方性砷中毒患者与正常对照血浆蛋白质的表达差异。方法将25例地方性砷中毒患者1∶1配比正常对照,采集分离血浆,经二维凝胶电泳分离和凝胶考马斯亮兰染色,质谱(MALD I-TOF-MS)分析,再经数据库(NCBInr)检索鉴定差异蛋白质斑点。结果正常对照组表达图谱可检测到113个蛋白点,地方性砷中毒病例组表达图谱可检测到165个蛋白点,与正常对照组相比,匹配率>65%。并且地方性砷中毒病例组鉴定出12个差异表达蛋白质,其中有5个表达上调,7个表达下调。这12个蛋白质均和免疫应答有关。与正常对照组相比,地方性砷中毒病例组的蛋白质表达存在着较大差异。结论地方性砷中毒的发生与免疫反应异常有关,12个蛋白质的表达可以作为地方性砷中毒诊断的潜在生物标志物。本研究为阐明地方性砷中毒的机制以及地方性砷中毒生物标志研究提供了一条新途径。
砷中毒; 蛋白质组学; 质谱
由于新疆奎屯地区长期饮用含高砷的水,故出现饮水型地方性慢性砷中毒,该病不仅可以引起皮肤损伤,而且对机体多个重要脏器均有影响,并最终导致癌症的发生[1]。国内外众多学者对砷中毒的发病原因及其致病机制进行了大量研究,并且期望从中发现砷中毒的特异生物标志。Komissarova等[2]研究发现抗砷细胞中的γ-谷氨酰1(GGT1)高表达。由于砷环境暴露因素的复杂性、种族(属)的代谢差异等,砷中毒的发病机制及其生物标志的研究仍在不断的探索中。作为发挥基因功能的载体——蛋白质,在疾病的发生、发展中有更直接而重要的意义。由于蛋白质组学可大规模、高通量地研究正常和病理情况下组织或细胞中蛋白质表达及翻译后修饰的变化,筛选用于疾病诊断、治疗及预后的蛋白质生物标志,从而成为医学研究中的热点。某一种细胞、组织或生物体的基因组所表达的全部蛋白质及其存在方式就是蛋白质组(proteome)[3-4]。通常同一基因组在不同的组织及不同的细胞中的表达情况各不相同;即使是同一种细胞在不同的发育阶段、不同的生理条件下,该细胞的蛋白质表达水平与修饰状态也不尽相同。Hegedus等[5]研究发现砷暴露时,β-防御素-1(HBD-1)蛋白多肽的分泌水平会降低,而通常认为HBD-1蛋白多肽降低与泌尿系统的肿瘤发生有关,因而HBD-1多肽可以作为砷暴露的生物标志。Chowdhury等[6]发现,砷暴露后,仓鼠肝脏以及膀胱组织的3个蛋白质中有1个高表达,2个低表达。因而双向凝胶电泳与质谱技术结合可以用于研究无机砷导致的肿瘤发病机制。
本研究通过利用2-DE分辨,并用电泳后的酶切及基质辅助的激光解吸附质谱以定位和分析地方性砷中毒患者与正常人血浆中蛋白质质谱变化,寻找地方性砷中毒患者血浆中的特异差异蛋白质,采用生物信息学方法建立可作为地方性砷中毒诊断标志的蛋白质质谱模型或生物标记,从分子水平研究地方性砷中毒蛋白质的组成及动态变化规律,从而深入认识个体的各种生理、病理过程,为地方性砷中毒的诊断、治疗和预防寻求高效的生物标志物和新的方法。
1 材料与方法
1.1试剂与仪器固相pH梯度干胶条(IPG gel strip)、PH3-10两性电解质购自Bio-Rad公司,CHAPS、DTT、Iodoacetamide购自Sigma公司,尿素购自BBI公司,硫脲购自天津市化学试剂一厂,Proteo Extract Albumin Removal购自Calbiochem公司,乙腈(CAN)购自Fisher公司,三氟乙酸(TFA)购自DIMA公司,Trypsin Gold购自Promega公司,基质CHCA、碳酸氢铵购自Fluka公司,其他试剂为国产分析纯。
1.2样品收集及处理调查新疆奎屯慢性地方性砷中毒病区,当地水砷浓度为(177.78±215.20) μg/L,按照《地方性砷中毒诊断标准》(WS/T 211-2001)进行诊断。随机抽取25例患者为地方性砷中毒病例组(Arsenism Patients,AP)。男性16例,女性9例,平均年龄(64.84±8.735)岁。在非慢性地方性砷中毒病区,当地水砷浓度为(29.61±52.48) μg/L,1∶1配比25例正常人为正常对照组(Control,C)。正常对照组选择生活背景与上述慢性地方性砷中毒患者相同,正常对照组男性13例,女性12例,平均年龄(63.92±7.041)岁。两组性别、年龄均衡,均为汉族。采集研究对象外周静脉血5 mL,肝素抗凝,离心收集血浆(不能溶血)。将血浆按100 μL/管分装置于-20℃冰箱保存。AP组(D)和正常对照组(C)各分为3个混合样本。样品用去高丰度蛋白柱去除高丰度蛋白,经过晾干沉淀,裂解回溶,bradford法测量浓度,-80℃ 保存。
1.3双向凝胶电泳将pH3~10的17 cm IPG预制胶条,使用溶胀缓冲液泡胀胶条12 h。溶胀缓冲液成分为8M尿素,2M硫脲,0.5%CHAPS,0.52%两性电解质,0.02%溴酚蓝,1%DTT。充分泡胀后,将胶条取出放入聚焦槽内,加入矿物油至没过上样杯,上样量为1 mg,并用溶胀buffer稀释至170 μL。等电聚焦设置程序见表1。聚焦结束的胶条放入平衡缓冲液Ⅰ中,在摇床上水平振荡15 min,再将胶条转入平衡缓冲液Ⅱ中水平振荡15 min(平衡缓冲液I:50 mM Tris-HCl 6.8,6M尿素,30%甘油,2% SDS,2%DTT,0.02%溴酚蓝;平衡缓冲液Ⅱ: 50 mM Tris-HCl 6.8,2% SDS,2.5%IAA,6M尿素,30%甘油,0.02% 溴酚蓝)。平衡结束后,将IPG胶条从样品水化盘中移出,放到已配好的12%SDS-PAGE凝胶上端,在凝胶的一端放置marker,0.5%的琼脂糖封严胶条和marker,胶板固定于电泳槽内。往电泳槽加入电泳缓冲液后,接通电源,于溴酚蓝指示剂达到底部边缘时停止电泳。轻撬两层玻璃,取出凝胶,进行染色。该过程按Bio-Rad公司双向电泳实验流程进行操作,见表1。

表1 等电聚焦的参数和步骤
1.4考马斯亮蓝染色法凝胶放入装有染色液的水平盘内,将水平盘置水平摇床上水平振荡过夜。染色液含10%硫酸铵、10% 磷酸、0.12% G250、20% 甲醇。然后将凝胶浸于脱色液中,水平摇床振荡。最后换成MQ再洗涤30 min。 脱色液为3%冰醋酸溶液。
1.5蛋白质胶内酶切将选取的差异蛋白质点在图像上做好标记。将考马斯亮蓝染色的蛋白点胶条切成小块,约1 mm3,在离心管中,水洗3次。用50%(v/v)ACN/25 mM碳酸氢铵(100 μL,pH 8.0)15 min脱色重复3次,至颜色脱尽。蒸馏水洗涤1次。将胶块浸入30 μL 100%ACN中脱水5 min,胶块变白后室温抽干。用8 μL Trypsin酶液覆盖胶块, 30 min吸胀后,补充酶液适量,37℃过夜16~20 h。基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)进行分析,获得肽质量指纹图谱。
1.6基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)分析用美国ABI公司4700型MALDI-TOF-TOF串联二级质谱仪分析。0.3 μL的基质加0.3 μL 酶解后的样品,点到样品板上,室温晾干。应用4000 Series software,将样品板放入质谱仪。新建一个spotset,打开校正仪器的采集方法和处理模式,校正仪器。打开测试未知样品的采集方法和处理模式,开始样品分析。一级激光强度2100,二级激光强度2300,检测分子量范围700~4 000 u,线性反射模式进行质谱分析。
1.7肽质量指纹图谱的分析和数据库检索利用MASCOT网站提供的检索工具查询,选择MS或MS/MS,选择NCBI nr(非冗余)数据库。设定参数:肽片段分子质量容许误差(Precursor tol.)为±0.1,二级质谱肽片段分子质量容许误差(MS/MS Fragment tol.)为±0.3,酶解片段不完全位点1,固定修饰为脲甲基半胱氨酸(Carbamidomethyl,C),可变修饰为氧化(Oxidation,M)。MASCOT给出的>95%置信水平的蛋白质有统计学意义。
1.8凝胶扫描应用PDQuest软件,选择相对含量差异2倍以上的点作为差异点。
2 结果
2.1Bradford法检测样本蛋白定量结果浓度地方性砷中毒病例组和正常对照组样本蛋白质浓度见表2。
2.2地方性砷中毒病例组与正常对照组蛋白质组的2-DE差异分析对血浆样品进行双向电泳分析,正常对照组和地方性砷中毒病例组的血浆样品分别混合,消除个体差异性后,血浆样品进行双向电泳,双向电泳重复3次。在各组中选取蛋白图谱较好的几张图谱用GPS Explorer v3.5软件分析。正常对照组血浆样本检出113个蛋白点,地方性砷中毒病例组血浆样本检出165个蛋白点。与正常对照组比较,地方性砷中毒病例组表达量上调,差异有统计学意义的蛋白点有5个,表达量下调的有7个。正常对照组与地方性砷中毒病例组的典型2-DE图谱见图1。
表2地方性砷中毒病例组和正常对照组样本蛋白质浓度(μg/μL)

组别123地方性砷中毒病例组(D)7.107.687.07正常对照组(C)6.887.317.63


750 μg血浆样本蛋白质提取物,在17 cm pH 3~10的IPG胶条上进行等电聚焦,反应条件为71 000 Vh,然后用12%聚丙烯酰胺凝胶电泳进行分离。考马斯亮蓝染色显影。图上数字和箭头显示了差异蛋白点。蛋白质的表达水平通过分析每个点的强度进行定量,基于凝胶有效点的总量进行标准化。
2.3差异蛋白质的MALDI-TOF-MSMS鉴定结果使用Pdquest7.3软件对地方性砷中毒病例组与正常对照组血浆蛋白质双向凝胶电泳图谱进行分析并匹配,选定两组血浆差异2倍以上的蛋白点,差异表达蛋白点通过胶内胰蛋白酶消化后,提取的胰蛋白酶多肽再用MALDI-TOF-MSMS质谱分析鉴定,得到蛋白质的肽质量指纹图谱(PMF)后,与Mascot Peptide Mass Fingerprint数据库匹配,成功鉴定出12个差异蛋白质(表3)。典型的地方性砷中毒病例的肽质量指纹质谱图、Mascot得分及其在NCBI蛋白质数据库中各个蛋白质的序列见图2。
进行完数据库检索分析和鉴定:和正常对照组比较,地方性砷中毒病例组λ-本周蛋白(Bence-Jones)、IgA、α2-巨球蛋白亚型7高表达,锌-a2-糖蛋白(Zinc-alpha-2-glyeoprotein)、盐溶蛋白(sulfated glycoprotein-2)等低表达。
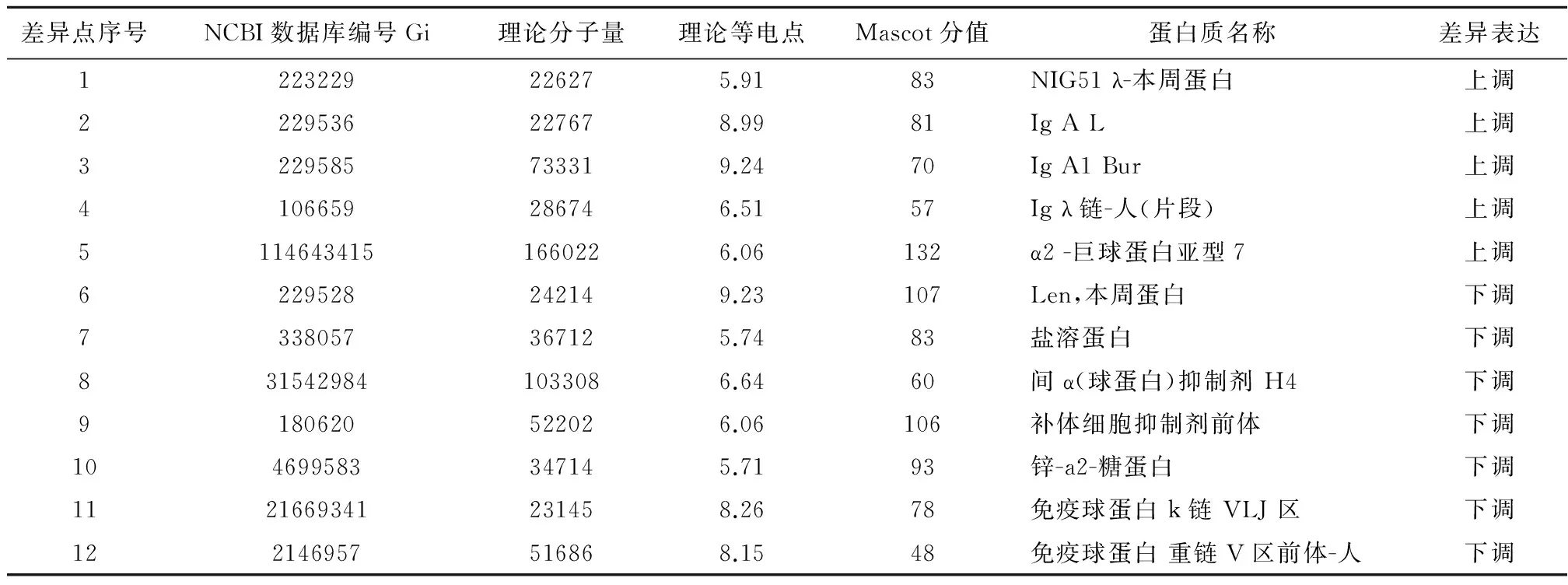
表3 地方性砷中毒病例组与正常对照组血浆差异表达的蛋白质鉴定结果
注: 上调:表达增加; 下调:表达降低。

(差异表达蛋白点通过胶内胰蛋白酶消化,其后提取的胰蛋白酶多肽由基质辅助激光解吸电离时间飞行质谱分析,产生肽质量指纹图谱。如上图中所示为地方性砷中毒病例的肽质量指纹图谱蛋白点。)
图2NIG51 λ-本周蛋白的MALDI-TOF 肽质量指纹图谱(PMF)
3 讨论
目前对地方性砷中毒发病机制的研究已经开展了很多,但其发生的确切机制仍然未知。已经完成的研究提示,砷中毒的发生机制似乎与多种作用途径以及多种因素有关,如抑制DNA修复[7]、影响DNA结合和表达、氧化应激[8]等。由于蛋白质作为发挥基因功能的载体,在疾病的发生、发展中有更直接而重要的意义。故近年来,蛋白组学技术在疾病的发生、发展研究中日益重要,广泛用于筛选疾病标志物。本研究首次将蛋白质谱技术将用于饮水型地方性砷中毒的研究中,结果显示正常对照组和地方性砷中毒病例组中筛选、鉴定出12个差异表达蛋白质。这些表达有差异的蛋白是从地方性砷中毒人群和正常对照人群血浆中比较分析而来,故可认为是地方性砷中毒的相关蛋白。
3.1地方性砷中毒与本周蛋白正常单克隆免疫球蛋白是由B细胞和浆细胞合成的,在每一个单克隆免疫球蛋白中,包含2条重链(γ,α, μ, δ, ε)以及2条轻链(κ or λ)[9-10]。而大量产生的游离轻链(FLC)往往被肾脏迅速清除。同时κ和λ蛋白的的结合状态会影响其自身的清除,单体κ的过滤是二聚体λ的3倍。由此导致,即使κ的合成产量高于λ的2倍,但在正常血浆中λ仍然多于κ。血浆FLC的浓度往往随着合成的增加而增加,但是也会因为肾功能衰竭造成的排出减少而增加[11]。传统上,其被称为本斯琼斯蛋白质[12]。Len本周蛋白从属于κ轻链的IV亚群[13]。本周蛋白作为癌症检测的第一个生物标志,比其他癌症检测的生物标志物提前了100多年[14]。1970年Glenner等[15]研究证实免疫球蛋白的轻链成分可以演变为淀粉样蛋白。目前的共识是:λ轻链蛋白与肾脏AL-淀粉样变性病有关。特别是由于血浆FLC受肾功能影响较小,与尿液本周蛋白相比,能够更准确地反映疾病变化。本研究发现本周蛋白λ轻链在砷中毒人群中表达,而在正常对照人群中不表达;Len本周蛋白在正常对照组中表达,地方性砷中毒病例组不表达。在两组血浆样品的采样时间、保存条件、处理方法、实验方法及条件完全相同情况下,显示出来的这种结果差异可能和κ轻链在体内的清除速率是λ轻链清除速率的3倍有关,在采样时地方性砷中毒人群体内血浆中的κ轻链经过肾脏代谢,含量很低,尤其在进行2-DE分析时,经过自然的半衰减,已经无法检测到κ轻链,只能检测出体内含量高于κ轻链的λ轻链。另外有研究指出,当体内κ轻链检测不出来时,可能与κ轻链发生聚合反应有关[16]。本研究结果可能符合该现象。另外在本研究中的地方性砷中毒人群体内血浆组织中λ轻链表达阳性,提示砷中毒会刺激机体产生相应的免疫应答,对肾脏产生毒性作用,λ本周蛋白是砷中毒的相关蛋白。
3.2地方性砷中毒与α2-巨球蛋白亚型7(alpha-2-macroglobulin isoform 7)α2-巨球蛋白(α2M)主要分布在血浆中,是一类大分子蛋白酶抑制剂,该四聚体蛋白是由成对的二硫桥将4个相同的180 ku的亚单位连接形成。在每个亚单位中都含有诱捕区域,可被多种蛋白酶识别和切割。此外,它还包含1个活化的内在的β半胱胺酰-γ-谷氨酰硫酯位点。目前认为多种疾病的发生、进展与α2M有关,上海地区汉族人群α2M基因多态性与阿尔茨海默病明确相关[17]。α2M也可以作为脑中炎性反应的一种急性蛋白。血脑屏障损伤且通透性增高时,α2M随之大量增加出现在CSF中。故此CSF中α2M的多少可以反映中枢神经系统感染受损的程度[18]。本研究发现α2M蛋白在砷中毒人群中高表达,而在正常对照人群中α2M蛋白低表达。α2M蛋白表达异常增加,提示砷中毒时存在免疫反应的异常,α2M蛋白可能作为地方性砷中毒时的相关蛋白,但是α2M增加的具体机制及效应有待进一步研究。
3.3地方性砷中毒与ZAGZAG作为一种可溶性糖蛋白,最早从人的质膜中分离,锌存在的情况下ZAG会发生沉淀,因而认为该蛋白与人体免疫有关。而糖基化是蛋白质常见的翻译后修饰方式,在细胞相互作用、细胞黏附、配体与受体的相互识别过程中发挥作用[19]。糖基化异常往往与疾病发生有关,以此作为诊断的标志物[20]。研究显示ZAG蛋白在人体中有多项功能,例如脂质移动以及受精,通过研究确定了该蛋白的结构和功能[21-23]。虽然它的一些功能仍然未被确定,但是已明确糖皮质激素类可以调节ZAG的表达。ZAG在结构上有一个大凹槽,和I型组织相容性抗原(MHC)肽段结合凹槽相似,在结构上进一步证实ZAG的表达可能关联免疫应答。本研究显示ZAG蛋白在地方性砷中毒人群中的表达低于正常对照人群,提示砷会抑制ZAG蛋白表达,从而对ZAG蛋白产生的生物功能产生抑制效应,如抑制免疫应答反应、机体产生炎症等。还有研究认为ZAG是一种衰老表型的修饰剂,对黑色素生成起到调节作用,对肿瘤增生起到阻碍作用,参与肾脏产物的转运[24]。本研究发现ZAG蛋白在砷中毒人群中低表达,可能与地方性砷中毒的典型皮肤色素异常(色素沉着、色素脱失)表现有关,低表达的ZAG蛋白可能对黑色素生成的调节功能下降。
3.4地方性砷中毒与盐溶蛋白(sulfated glycoprotein-2)盐溶蛋白又称丛生蛋白(clusterin),是一种糖蛋白,是异源性二聚体由二硫键连接形成,分子量70 ku。盐溶蛋白来自哺乳动物组织。盐溶蛋白在组织重建、生殖、DNA修复、补体调节、脂质转运、凋亡以及细胞内的信号转导等过程中发挥作用。目前已经确认盐溶蛋白属于分泌蛋白质,并证实该蛋白具有多种活性。该蛋白质的功能包括参与炎症和免疫过程的作用和机制,尤其是自身免疫。神经变性疾病及脑膜疾病患者体内盐溶蛋白表达不增加,而在脱髓鞘疾病患者体内盐溶蛋白表达增加,该蛋白的表达上调可能与多发性硬化存在可能的神经保护机制有关[25]。Jenne等[26]研究提示,对于雄性生殖系统盐溶蛋白具有保护精子细胞以及上皮组织的作用,使其免受补体攻击。本研究发现相比正常对照人群,盐溶蛋白在砷中毒人群中低表达,提示地方性砷中毒患者发生了神经系统的病变,可以认为是神经系统发生病变的直接反应;也提示砷中毒对男性生殖功能会产生不良影响。因此盐溶蛋白也可以作为地方性砷中毒的一类相关蛋白。本研究中鉴定出的另外一个表达下调差异蛋白Gi52202 Complement cytolysis inhibitor precursor为盐溶蛋白前体物质,进一步说明了盐溶蛋白可以作为地方性砷中毒的生物标志物。
3.5地方性砷中毒与其他蛋白(sulfated glycoprotein-2)在本研究中获得的其他几种蛋白质Gi22767 Ig A L、73331 Ig A1 Bur、28674 Ig lambda chain、23145 immunoglobulin kappa light chai VLJ region、Gi103308 inter-alpha (globulin) inhibitor H4间-α(球蛋白)抑制剂H4以及Gi2146957 Ig heavy chain V region precursor都属于免疫球蛋白家族,它们的异常表达,显示地方性砷中毒存在免疫应答的异常反应,地方性砷中毒患者体内存在炎症反应。
本实验运用2-DE电泳结合MALDI-TOF-MS/MS质谱技术成功鉴定出12个有意义的差异蛋白,这些蛋白可能成为诊断鉴别地方性砷中毒的生物标记,为进一步研究地方性砷中毒的发病机理提供了有意义的线索。然而,地方性砷中毒从生理生化水平、细胞水平、分子水平上来看,涉及诸多因素。弄清这12个有意义的差异蛋白的功能和在地方性砷中毒发展过程中的作用,则需要进一步分离相关基因和进行功能鉴定,研究确证有关这些蛋白的基因在地方性砷中毒中的作用,以此来揭示地方性砷中毒分子机制。
[1]Soriano C, Creus A, Marcos R. Arsenic trioxide mutational spectrum analysis in the mouse lymphoma assay[J]. Mutat Res,2008,646(1-2): 1-7.
[2]Komissarova EV, Li P, Uddin AN, et al. Gene expression levels in normal human lymphoblasts with variable sensitivities to arsenite: identification of GGT1 and NFKBIE expression levels as possible biomarkers of susceptibility[J]. Toxicol Appl Pharmacol,2008, 226(2): 199-205.
[3]Wasinger VC, Cordwell SJ, Cerpa-Poljak A, et al. Progress with gene-product mapping of the Mollicutes: Mycoplasma genitalium[J]. Electrophoresis,1995,16(7):1090-1094.
[4]Wilkins MR, Sanchez JC, Williams KL, et al. Progress with proteome projects: why all proteins expressed by a genome should be identified and how to do it[J]. Biotechnol Genet Eng Rev,1996,13:19-50.
[5]Hegedus CM, Skibola CF, Warner M, et al. Decreased urinary beta-defensin-1 expression as a biomarker of response to arsenic[J]. Toxicol Sci,2008,106(1): 74-82.
[6]Chowdhury UK, Aposhian HV. Protein expression in the livers and urinary bladders of hamsters exposed to sodium arsenite[J]. Ann N Y Acad Sci,2008,1140: 325-334.
[7]Tran HP, Prakash AS, Barnard R, et al. arsenic inhibits the repair of DNA damage induced by benzo(a)pyrene[J]. Toxicol Lett, 2002 ,133(1): 59-67.
[8]Hu Y, Jin X, Snow ET. Effect of arsenic on transcription factor AP-1 and NF-kappaB DNA binding activity and related gene expression[J]. Toxicol Lett,2002,133(1): 33-45.
[9]Mollee P. Current trends in the diagnosis, therapy and monitoring of the monoclonal gammopathies[J]. Clin Biochem Rev ,2009,30:93-103.
[10]Poshustal TL, Sikkinkl LA, Leung N, et al. Mutations in specific structural regions of immunoglobulin light chains are associated with free light chain levels in patients with AL amyloidosis[J]. PloS One,2009, 4(4):e5169-5179.
[11]Merlini G. Serum-free light chain analysis: works in progress[J]. Clin Chem Lab Med,2009;47(9):1021-1022.
[12]Bradwell AR, Carr-Smith HD, Mead GP, et al. Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine[J]. Clin Chem,2001,47(4):673-680.
[13]Schneider M, Hilschmann N. The primary structure of a monoclonic immunoglobulin-L-chain of subgroup IV of the kappa type (Bence-Jones protein Len.) [J]. Hoppe Seyler′s Zphysiol Chem, 1975,356(5):507-557.
[14]Jones HB. Papers on chemical pathology, lecture III[J]. Lancet,1847,2:88-92.
[15]Glenner GG, Terry W, Harada M, et al. Amyloid fibril proteins: proof of homology with immunoglobulin light chains by sequence analysis[J].Science,1971,172:1150-1151.
[16]Palladini G, Russo P, Bosoni T, et al. Identification of amyloidogenic light chains requires the combination of serum-free light chain assay with immunofixation of serum and urine[J]. Clin Chem,2009,55:499-504.
[17]Tang GM,Zhang MY,Xie HJ, et a1.Alpha-2 macroglobulin 11000V polymorphism in Chinese sporadic Alzheimer’s disease and Parkinson′s disease[J]. Neuroscience Letters, 2002,328(2):195-197.
[18]Merzeniuk ZA,Churliaev lA,Nikiforova NV, et al. The possible role of alpha-2 macroglobulin in regulating the immune components of the brain in tick-borne encephalitis[J].Mikrobiol Epidemiol Immunobiol,2000,(3):76-78.
[19]Ajit V. Biological roles of oligosaceharides: all of the theories are correct[J].Glycobiology,1993,3:97-130.
[20]Crystal K, Bensheng L, Hyun J, et al. Serum glycomics approach to breast cancer biomarkers[J]. Mol Cell Proteomics,2007,6:43-55.
[21]Laura P, David T, Luis M, et al. Zinc a-2-glycoprotein is expressed by malignant prostatic epithelium and may serve as a potential serum marker for prostate cancer[J]. Clin Cancer Res, 2001,7:846-853.
[22]ST Russell1, MJ Tisdale. The role of glucocorticoids in the induction of zinc-a2-glycoprotein expression in adipose tissue in cancer cachexia[J]. British J Cancer, 2005,92:876-881.
[23]Qu F, Ying XQ, Guo W, et al. The role of Zn-a2 glycoprotein in sperm motility is mediated by changes in cyclic AMP[J]. Reproduction,2007,134:569-576.
[24]Roland S, Arnaud M, Cantley LG. Zag Expression during aging suppresses proliferation after kidney injury[J]. J Am Soc Nephrol, 2008 ,19(12):2375-2383.
[25]Hansson SF, Puchades M,Blennow K, et al.Validation of a prefractionation method followed by two dimensional electrophpresis Applied to cerebrospinal fluid protein from frontotemporal dementia patients[J].Proteome Sci,2004, 2(1):7.
[26]Jenne DE, Tschopp J. Molecular structure and functional characterization of a human complement cytolysis inhibitor found in blood and seminal plasma: Identity to sulfated glycoprotein 2, a constituent of rat testis fluid[J]. Proc Nati Acad Sci,1989,86:7123-7127.
(本文编辑张巧莲)
Proteomics analysis of differentially expressed proteins of plasma in Xinjiang endemic arsenism
XIE Huifang, WU Shunhua, ZHANG Jie, MA Yan, ZHENG Yujian
(CollegeofPublicHealth,XinjiangMedicalUniversity,Urumqi830011,China)
ObjectiveApplied proteomics to analysis the differential expression proteins of plasma in Xinjiang endemic Arsenism and normal control. Methods25 cases Xinjiang endemic arsenism 1∶1 matched with normal control. Collected and separated plasma, Performed two-dimensional gel electrophoresis and Coomassie blue stained, MALDI-TOF-MS proteomic analyses of plasma, using the database (NCBI nr) to identify differential protein spots. ResultsBy the analyses of match differentially displayed map, 113 protein spots were detected in proteome map of Normal control, 165 protein spots were detected in proteome map of endemic arsenism, compared with normal control, the matching rate >65%. 12 prominent (5 up-regulated and 7 down-regulated) proteins were identified in endemic arsenism, These identified proteins were all related with Immunity. Compared with normal control, the protein expression of endemic arsenism was Significant different. ConclusionOccurrence of Endemic Arsenism may be related to abnormalities immune response, those 12 proteins could be biomaker of endemic arsenism and might be applied to diagnosis, treatment and prevention of endemic arsenism in the future.
arsenism; proteomics; mass spectrum
国家自然科学基金(81260410)
谢惠芳(1974-),女,博士,副教授,研究方向:环境与健康研究。
郑玉建,男,博士,教授,博士生导师,研究方向:环境与健康,E-mail:zhyujian6@hotmail.com。
R21; Q7
A
1009-5551(2016)06-0672-06
10.3969/j.issn.1009-5551.2016.06.003
2016-03-12]
