榅桲总黄酮对过氧化氢诱导人脐静脉血管内皮细胞氧化损伤的保护作用研究
2016-09-05古再努尔买买提阿尔孜古丽吐尔逊阿迪力阿不都热合曼周文婷邬利娅伊明艾尼瓦尔吾买尔
古再努尔·买买提, 阿尔孜古丽·吐尔逊, 阿迪力·阿不都热合曼, 周文婷,邬利娅·伊明, 艾尼瓦尔·吾买尔
(新疆医科大学1基础医学院药理教研室, 乌鲁木齐 830011; 2第一附属医院科研中心, 乌鲁木齐 830054)
·基础医学研究·
榅桲总黄酮对过氧化氢诱导人脐静脉血管内皮细胞氧化损伤的保护作用研究
古再努尔·买买提1, 阿尔孜古丽·吐尔逊2, 阿迪力·阿不都热合曼1, 周文婷1,邬利娅·伊明1, 艾尼瓦尔·吾买尔1
(新疆医科大学1基础医学院药理教研室, 乌鲁木齐830011;2第一附属医院科研中心, 乌鲁木齐830054)
目的研究榅桲总黄酮 (TFCOM) 对过氧化氢(H2O2) 诱导人脐静脉内皮细胞(HUVEC) 氧化损伤和凋亡的保护作用及机制。方法体外培养HUVEC,分为正常对照组、H2O2模型组(10 μmol/L)和TFCOM低浓度 (10 μg/mL)、中浓度 (20 μg/mL)、高浓度 (40 μg/mL)干预组。在建立H2O2氧化损伤模型的基础上,采用MTT法检测HUVEC活力,流式细胞仪和Hochest33258荧光染色法检测细胞凋亡率,观察HUVEC的周期变化。结果榅桲总黄酮干预组细胞形态介于正常对照组与H2O2模型组,并随着药物浓度的增高,细胞形态改善更加明显,与H2O2模型组比较,细胞间隙缩小,细胞间连接增加,边界较清楚。TFCOM能对抗H2O2诱导引起的细胞凋亡,能促进HUVEC增殖分化,TFCOM低浓度组变化与H2O2模型组比较差异无统计学意义,但中、高浓度组细胞存活率逐渐增高,差异有统计学意义(P<0.01)。榅桲总黄酮低、中、高浓度能够促进细胞DNA合成,与H2O2模型组比较差异有统计学意义(P<0.01)。正常对照组细胞的早期凋亡率为3.4%,H2O2模型组细胞的早期凋亡率为19.2%,与正常对照组比较差异有统计学意义(P<0.05);TFCOM低、中、高浓度组的早期凋亡率为16.7%、12.6%、6.1%, 与H2O2模型组比较差异均有统计学意义(P<0.05)。结论TFCOM可抑制H2O2诱导的内皮细胞凋亡,减轻H2O2对内皮细胞的损伤作用,可明显降低H2O2对血管内皮细胞的氧化损伤。
榅桲总黄酮; 人脐静脉内皮细胞; 过氧化氢; 氧化损伤
维药比叶(Biye),在新疆又名别木梨,英文名Quince,统称为“榅桲”[1]。榅桲(Cydonia Oblanga Mill,COM)是蔷薇科(Rsaceae)楹椁属(Cydonia)的果树,榅桲是新疆维吾尔医药领域中具有独特疗效、浓郁的地方民族传统药材。榅桲总黄酮 (TFCOM) 为榅桲果实的提取物,榅桲果实中含有丰富的黄酮类化合物和人体必需的微量元素,总黄酮含量>60%[2]。以往研究结果证实,榅桲提取物具有补脑益心、降压、降脂、降糖、抗炎、抗氧化、调节免疫、止泻、利尿等药理作用,但对其防止心血管系统疾病的机制研究尚未阐明[3-8]。处于功能障碍状态下的内皮细胞能直接或间接地反映某种程度上的氧化,同时内皮细胞损伤和功能障碍加快了动脉硬化的发生和发展,成为动脉粥样硬化(As)形成的开始[9]。本实验采用体外培养细胞的方法,人脐静脉内皮细胞 (HUVEC) 直接被H2O2损伤并建立模型,初步探究TFCOM对HUVEC氧化损伤的保护作用及抗凋亡功能的机制,为榅桲的进一步开发利用提供新的理论依据。
1 试剂与仪器
1.1主要试剂HUVEC 由新疆医科大学第一附属医院科研中心细胞室提供,过氧化氢(H2O2,批号:BCBN6035V)、二甲基亚砜 (DMSO,批号:Q2259)、四甲基偶氮唑盐 (MTT,批号:M5178)、胰蛋白酶(批号:J150031)均购于美国Sigma公司,M199培养基(批号:NAC1355)、胎牛血清(批号:41G5741K)均为美国Gibco公司产品,PBS(批号:NAH1444)、双抗(批号:J150023)均为美国HyClone公司产品,Annexin V-FITC/-AAD试剂盒(批号:4293719,为美国BD公司产品),检测周期的试剂盒(批号:4220918,南京凯基生物科技有限公司),Hoechst33258荧光染色试剂盒(批号:20151218),4%多聚甲醛(批号:20151103,为博世德生物科技有限公司产品)。
1.2仪器酶标仪Benchmark PLUS(美国BIO-RAD公司),CO2培养箱371型(美国Thermo公司),超净台SW-CJ-2F(上海智域分析仪器公司),倒置显微镜IX71-12FL/PH (日本Olympus公司),离心机 BR4i型(美国Beckman公司),微量进样器(德国Eppendorf公司),超纯水仪MILLI-Q BIOCEL(美国Millipore公司),电子天平TP114(北京Scotsman公司),恒温水浴锅DK8D(北京永光明医疗仪器厂),流式细胞仪FACSAriaII(美国Beckman公司),全自动细胞计数仪及计数板2C08351P (Korea)。
2 方法与结果
2.1榅桲总黄酮的制备榅桲叶采摘自新疆喀什地区叶城县,榅桲总黄酮由新疆医科大学基础医学院药理教研室制备。制备方法:榅桲叶用水洗净,55℃鼓风干燥48 h,冷却后粉碎过筛,采用索式提取器石油醚脱脂2 h,药渣挥干溶剂,真空干燥。干燥药渣以30倍量60%乙醇超声提取3次,每次40 min,合并滤液,减压浓缩至浸膏状,真空干燥得榅桲叶总黄酮粗品。总黄酮粗粉加水溶解,过滤,滤液先经AB-8型大孔吸附树脂分离、乙醇洗脱、收集洗脱液、减压蒸馏得浓缩液。浓缩液再经聚酰胺树脂分离、乙醇洗脱、收集洗脱液、减压蒸馏得浓缩液、冷冻干燥后得到榅桲叶总黄酮的精制品,备用。采用分光光度法测定其含量,榅桲总黄酮纯度>60%。
2.2H2O2浓度的测定采用30%H2O2细胞培养时,先用超纯水配成1 mmol/L的H2O2,用M199培养液稀释使用。
2.3HUVEC的培养从-80℃冰箱中取出HUVEC,放进37℃水浴锅里快速振摇,在1~2 min内解冻并离心。离心后将细胞悬液移到25 mL培养瓶中并加入5 mL含10%FBS的M199培养液,轻轻摇匀后放入37℃、 95%空气、5%CO2培养箱中进行培养24 h。在显微镜下观察细胞的生长情况,过夜后换1次培养液。细胞生长至可传代培养细胞时,经酶消化法加入1 mL 0.25%胰蛋白酶消化,并按1∶2或1∶3传代。
2.4生长曲线取对数生长期细胞以5×104/mL细胞/孔接种于96孔板中,隔日换液,连续10 d观察细胞的生长情况。
2.5实验方法和计量分组待细胞生长至80%~90%融合成单层时进行实验,实验设5组:正常对照组、H2O2模型组(10 μmol/L)及TFCOM低浓度(10 μg/mL)、中浓度(20 μg/mL)、高浓度(40 μg/mL)干预组,先加TFCOM干预24 h后再加入终浓度为10 μmol/L 的H2O2,继续培养4 h后进行有关指标的测定。
2.6MTT法检测细胞按1×105/mL密度接种于96孔板中,每孔加入含10%FBS的M199培养液100 μL,每组设 6个复孔,37℃、5% CO2培养箱中培养24 h。正常对照组和H2O2模型组仅加M199培养液,药物干预组分别加入不同浓度的榅桲总黄酮干预24 h后,药物干预组和H2O2模型组同时每孔加入现配制的终浓度为10 μmol/L的H2O2培养液100 μL,轻轻摇荡,同样条件下继续培养4 h;镜下观察后每孔细胞加入终浓度为0.5 mg/mL的MTT溶液 20 μL,继续培养4 h后弃去各孔内的培养液,每孔加入150 μL的 DMSO溶液,充分振荡10 min,使MTT溶液反应的蓝紫色结晶甲瓒完全溶解,用全自动酶标仪在490 nm波长处检测各孔吸光度(OD值)。实验结果以OD值或抑制率表示。 抑制率(%)=(对照组OD-实验组OD)/对照组OD×100%。
2.7细胞周期检测将细胞按5×105/mL密度接种于小皿(分组与处理同上)。用0.25%胰蛋白酶消化并收集细胞,1 000 r/min离心5 min,弃上清,加PBS洗涤细胞2次,加预冷的70%乙醇并均匀吹打,制备细胞悬液,在4℃冰箱避光过夜,固定后再次离心并PBS清洗2次,彻底除尽乙醇。加1 mL碘化丙啶染液(propidine iodide,PI)使细胞悬浮于染液中,室温避光30 min,染色后用300目筛网过滤,检测细胞周期的变化。
2.8凋亡率检测将细胞按1×106/mL密度接种于小皿(分组与处理同上)。药物处理后的细胞弃去培养基,加PBS洗1次,收集细胞,加0.25%胰蛋白酶1 mL消化,制成细胞悬液后以1 000 r/min离心5 min,弃上清,加PBS洗涤细胞2次,再次以同样的条件离心。加入5 μL Annexin V-FITC试剂和5 μL 7-AAD,轻轻震摇混匀,每管加入500 μL的1×binding buffer,室温(25℃)避光15 min,染色后用300目筛网过滤,1 h内用流式细胞仪检测。
2.9Hochest 33258荧光染色将细胞按5×105/mL密度接种于6孔板中(每孔2 mL,每组设3个复孔),细胞分组与处理同前。药物处理后的细胞弃去培养基,加PBS洗2次,用4%多聚甲醛 (4℃,15~20 min) 固定,弃除固定液,加PBS洗2次,每孔加入1 mL Hochest 33258(浓度为20 μg/mL)染色液,室温避光染色10 min后,荧光显微镜200倍下随机取3个视野(激发波长350 nm左右,发射波长460 nm左右),观察各组呈蓝色细胞核的细胞、荧光情况并进行拍照。
2.10生长曲线细胞接种后的前2 d生长较慢,但从第3天开始生长加快,细胞数量显著增多,第3~4天细胞进入对数生长期,第6~7天进入平台期。故选用第3天为最佳加药时间,见图1。

2.11TFCOM对H2O2氧化损伤HUVEC形态学改变的影响(1)正常对照组:细胞生长快,大小相等,细胞质饱满透亮,呈多角形紧密连接状;贴壁坚固,胞核完好,边界清楚,呈单层 “铺路石” 状排列,没有重叠生长现象。(2)H2O2模型组:经10 μmol/L H2O2作用细胞后,数量明显减少,多数损伤的细胞出现核收缩,胞体变圆变小,间隙增宽,边界不清,胞膜不完整,甚至损伤破裂,贴壁能力降低,导致成片状细胞脱落区,培养板底部可以见到细胞碎片。(3)TFCOM干预组:细胞形态介于对照组与H2O2模型组,并随着药物浓度的增高,细胞形态改善更加明显,与H2O2模型组比较细胞间隙缩小,细胞间连接增加,边界较清楚,TFCOM低、中、高浓度均可减轻H2O2氧化损伤后的细胞形态和排列及增殖能力,见图2。

正常对照组(×10倍)

正H2O2模型组(×10倍)

TFCOM高浓度组(×10倍)
图2TFCOM对H2O2氧化损伤HUVEC细胞形态学的影响
2.12MTT法对HUVEC细胞的影响用不同浓度的H2O2刺激HUVEC,随着H2O2浓度的升高细胞存活率急剧下降,当H2O2浓度达到10 μmol/L时,H2O2对HUVEC细胞造成适宜的损伤且细胞存活率为50% 左右,与正常对照组相比,差异有统计学意义(P<0.01)。因此选用浓度为10 μmol/L的H2O2进行后续实验。用TFCOM低、中、高3个不同浓度给药时,TFCOM能对抗H2O2诱导引起的细胞凋亡,能促进HUVEC增殖分化,TFCOM低浓度组变化与H2O2模型组相比差异无统计学意义,但TFCOM中、高浓度组细胞存活率逐渐增高,差异有统计学意义(P<0.01),结果见表1。


组别剂量/(μmol/L)ODIR/%正常对照组-0.184±0.009-H2O2模型组100.121±0.005##38.8TFCOM低浓度组100.128±0.00830.5TFCOM中浓度组200.134±0.001*24.1TFCOM高浓度组400.140±0.003**19.1
注:与H2O2模型组比较,*P<0.05,**P<0.01; 与正常对照组比较,##P<0.01
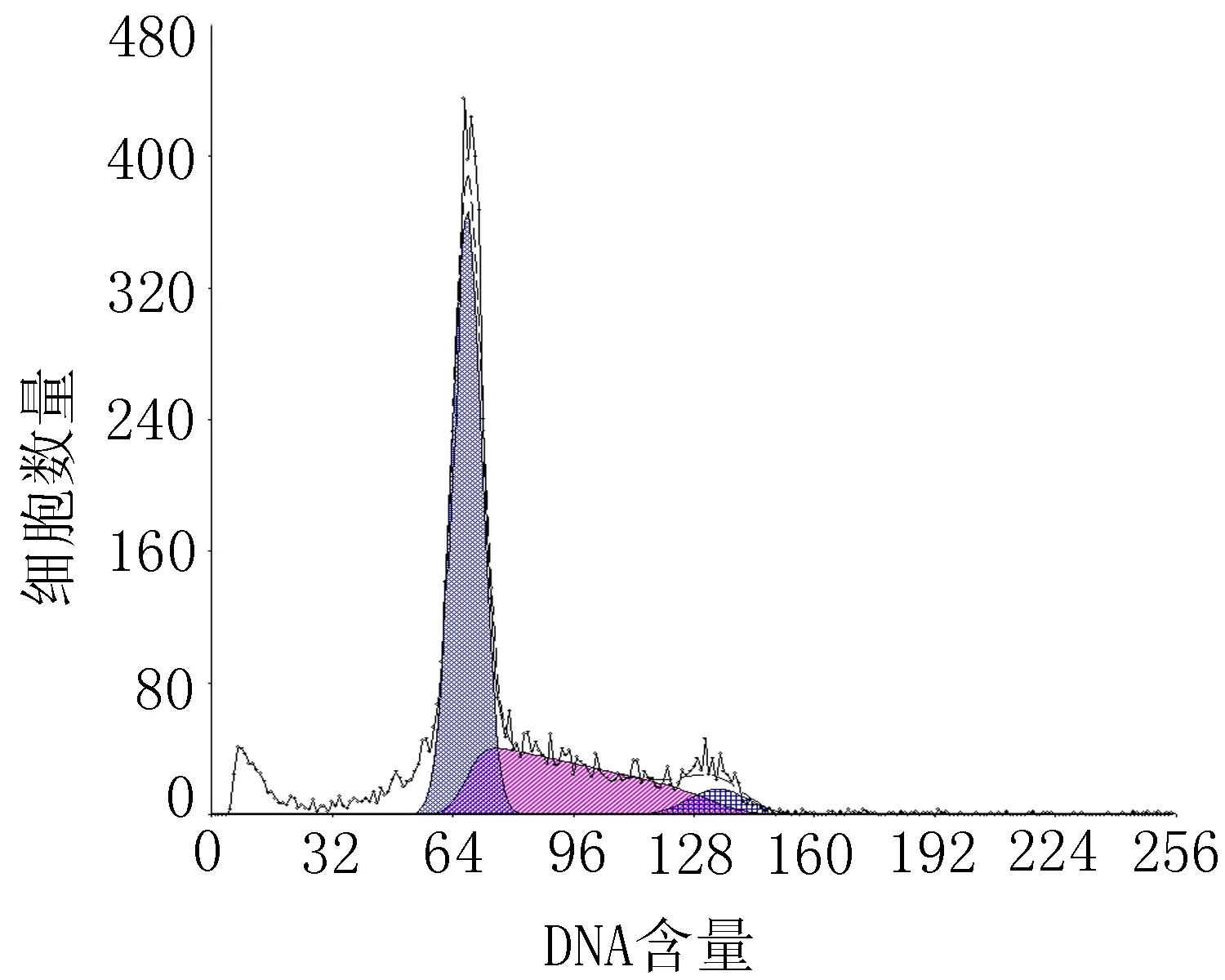
2.13细胞周期比较结果从细胞周期分析看,10 μmol/L的H2O2可引起G0/G1期细胞比值增高,S期细胞比值下降,即细胞DNA合成的量减少。加入低、中、高3个不同浓度的TFCOM干预后G0/G1期细胞比值有所下降,S期细胞和G2/M期细胞比值有不同程度的增加,TFCOM低、中、高浓度组与H2O2模型组相比,差异有统计学意义(P<0.05或P<0.01),结果见表2、图3。
2.14凋亡率检测正常对照组细胞的早期凋亡率为3.4%,经10 μmol/L H2O2作用后模型组细胞的早期凋亡率为19.2%,与正常对照组相比内皮细胞的早期凋亡率明显增加,差异有统计学意义(P<0.05);TFCOM作用后HUVEC均能逆转H2O2引起的细胞凋亡,TFCOM低、中、高浓度组HUVEC的早期凋亡率分别为16.7%、12.6%、6.1%,与H2O2模型组比较差异具有统计学意义(P<0.05),随着药物的浓度增高,凋亡率降低,且呈一定的浓度依赖性,见图4。

表2 各组HUVEC细胞周期比较(%, ±s, n=6)
注:与H2O2损伤组比较,*P<0.05,**P<0.01; 与正常对照组比较,#P<0.05,##P<0.01。
2.15Hochest33258荧光染色Hoechst33258是一种与DNA特异结合并能穿透细胞膜的蓝色荧光染料,对凋亡细胞发生染色,而对正常细胞的染色较慢。荧光染色显示,正常细胞核呈弥散均匀荧光,凋亡细胞因发生染色质凝聚而被浓染,可见浓染致密的颗粒状荧光强度很高的蓝色亮点。细胞荧光染色结果:(1)正常对照组:细胞核完整而呈椭圆形, 出现的荧光强度很弱,几乎无凋亡的细胞;(2)H2O2模型组:加入10 μmol/L H2O2处理后,HUVEC细胞变圆,细胞核发生变化,呈核体积变小、大小不等、染色不均匀等明显的凋亡特征,呈浓缩致密的颗粒状或块状强度高的蓝色荧光,大部分细胞发生凋亡;(3)TFCOM干预组:经低、中、高3个不同浓度的TFCOM干预后荧光强度发生改变,随着药物浓度的增高,高浓度组荧光强度明显减弱,出现的蓝色亮点数目变少,药物干预组凋亡细胞明显少于H2O2模型组。榅桲总黄酮对H2O2导致的凋亡具有一定的拮抗作用,见图5。

正常对照组

H2O2模型组
TFCOM低浓度组


TFCOM中浓度组TFCOM高浓度组
图3TFCOM对氧化损伤HUVEC细胞周期变化的影响

正常对照组

H2O2模型组

TFCOM低浓度组


TFCOM中浓度组TFCOM高浓度组
图4TFCOM对氧化损伤HUVEC细胞凋亡率的影响
3 讨论
内皮细胞是血管壁的主要组成部分,是细胞和血液物质交换的第一屏障。内皮细胞通过合成、分泌血管活性物质而调节血管内环境的稳态,如保持血液循环通畅、血管收缩和舒张平衡、防止血小板聚集而形成血栓。血管内皮是心血管疾病危险因子的关键靶点,血管内皮细胞受损是导致动脉粥样硬化的起始点,血管内皮细胞损伤的影响因素很多,其中氧化应激引起的血管内皮细胞氧化损伤是血管内皮功能障碍的重要因素之一,其导致的内皮细胞结构破坏和功能障碍是造成许多心血管疾病的病理基础[14]。前期研究表明,TFCOM对缺血再灌注造成的血管内皮细胞的损伤具有保护和对抗作用,且此作用与抗炎作用和抗氧化作用有关[15],但对于TFCOM能否防止血管内皮细胞受损的机制尚无报道。

正常对照组(×200)

H2O2模型组(×200)

TFCOM低浓度组(×200)
图5Hochest33258荧光染色
MTT法可用于研究血管内皮细胞活性与活细胞的数目,且两者呈正比关系,而血管内皮细胞活性的高低可以反映细胞的能量代谢与增殖情况[16]。本研究显示,10 μmol/L H2O2作用4 h诱导损伤,使细胞存活率降低,生长缓慢,出现凋亡,凋亡率随着过氧化氢的浓度增高而增加,而用TFCOM干预后可以减少H2O2诱导的细胞氧化损伤,提高了细胞活力,说明榅桲总黄酮对H2O2引起的氧化损伤具有抑制作用,能使细胞凋亡率明显下降;血管内皮细胞损伤的原因有很多,其中氧化应激是导致血管内皮细胞损伤的主要原因,H2O2是一种常见的活性氧,如果生物体内没有及时清除过氧化氢,H2O2会轻易透过细胞膜作用于血管内皮细胞,使细胞膜破裂、DNA断裂、细胞器受损、并直接或间接地激活细胞内的多条信号传导通路来调节基因的表达,造成细胞结构和功能受损,最终引起细胞凋亡,同时使羟自由基的产生增加,导致细胞膜脂质过氧化,使细胞损伤而死亡[17]。在细胞周期中,10 μmol/L的H2O2可引起G0/G1期细胞比值增加,S期细胞比值下降,得知细胞DNA合成减少,进入程序性死亡期或静息期的细胞数量增多。加入不同剂量的TFCOM干预后可抑制H2O2引起的变化。与此相反,G0/G1期的细胞比例有所下降,S期细胞比例有不同程度的增加,凋亡率显著降低,由此可见TFCOM可以促进受损的内皮细胞DNA合成,对改善细胞分裂增殖有益。Hochest 33258荧光染色结果显示:H2O2诱导的细胞凋亡经TFCOM处理后核固缩和核碎片细胞数量显著减少,多数细胞核形态接近正常,从形态学方面证实了TFCOM对H2O2诱导的HUVEC细胞凋亡具有保护作用。
已有研究证实,氧化应激成为内皮细胞损伤和凋亡的直接原因,是促发动脉粥样硬化、血管顺应性改变、对缩血管性因素和扩血管性因素反应改变的最重要因素[18-19]。超氧化物因阴离子和过氧化物对动脉粥样硬化进展起了很大的促进作用,而细胞的氧化还原状态取决于ROS的氧化和抗氧化保护作用,寻找具有抗氧化应激作用的药物可以达到保护血管内皮细胞的完整性而防止动脉粥样硬化的目的,对于动脉粥样硬化的预防和治疗有很重要的临床意义,也是医药工作者目前必须解决的问题的之一。具有抗氧化作用的药物可以降低或消除内皮细胞氧化损伤,保护血管内皮细胞,并防治或预防心血管疾病。本实验以血管内皮细胞为基础,过氧化氢作为氧化应激诱导剂建立体外损伤模型,用榅桲总黄酮预处理并对内皮细胞的保护作用及其机制进行了初步探究,为榅桲总黄酮的抗氧化提供了进一步的实验依据和理论基础,也可以为临床的开发应用提供更可靠的科学依据。
[1]艾尼瓦尔·吾买尔, 孙晓伟, 周文婷. 榅桲叶提取物对高脂血症模型大鼠血脂和肝功能的影响[J].中成药,2013,35(10):2249-2252.
[2]俞德俊. 中国植物志(36卷)[M]. 北京:科技出版社, 1986:344-345.
[3]热木·伊力, 袁琳.可在北方干旱地区开发利用的稀有果树-榅桲[J].北方果树,2003, (1):38.
[4]马木提·库尔班,长马力别克·吾买尔. 榅桲中总黄酮的测定[J].新疆师范大学学报:自然科学版,2004,23(4):68-69.
[5]乌兰巴依尔,杨永新,王雪飞,等.榅桲提取物对抗血栓作用的实验观察[J].中成药,2011,33(8):135-137.
[6]Wojdylo A, Teleszko M, Oszmian′ski J. Antioxidant property and storage stability of quince juice phenolic compounds [J]. Food Chem,2014,(152):261-270.
[7]Wojdylo A, Oszmian′ski J, Beilicki P. Polyphenolic composition,antioxidant activity, and polyphenol oxidase (PPO) activity of quince (Cydonia oblonga Mill.) varieties[J]. J Agric Food Chem,2013,61(11):2762-2772.
[8]Essafi-Benkhadir K, Refai I, et al. Quince (Cydonia oblonga Mill.) peel polyphenols modulate LPS-induced inflummation in human THP-1-derived macrophages through NF-kB, p38MAPK and Akt inhibition[J]. Biochem Biophys Res Commun,2012,418(1):180-185.
[9]Kawahara T, Iinzuka T. Inhibitory effect of hot-water extract of quince (Cydonia oblonga) on immunoglobulin E-dependent late-phase immuse reactions of mast cells[J]. Cytotechnology,2011,3(2):143-152.
[10]Carvalho M,Silva BM, Silva R,et al. First report on Cydonia oblonga Miller anticaner potential:differential antiproliferative effect against human kidney and colon cancer cells[J]. J Agric Food Chem,2010,58(6):3366-3370.
[11]美合日阿依·伊萨克, 艾尼瓦尔·吾买尔.榅桲叶多糖含量测定和纯化工艺研究[J].新疆医科大学学报,2015,38(6):715-717.
[12]张义军,张永军,李连疆,等.白刺总黄酮对血管内皮细胞损伤的保护作用的研究[J].时珍国医国药,2009,20(3):562-564.
[13]Duygu O, David B, Paolo C, et al. Human vascular endothelial cells:a model system for studying vascular inflammation in diabetes and atherosclerosis [J].Curr Diab Rep,2011,11(3):193-202.
[14]齐曼古丽·阿吉,周文婷,艾尼瓦尔·吾买尔,等.榅桲总黄酮对血栓形成和血小板聚集作用的影响[J].中成药,2015,37(7):1589-1592.
[15]刘永刚,王晓东,张小兵.白藜芦醇对脑缺血/再灌注损伤炎症反应的影响[J].中国中药杂志,2007,32(17):1792-1795.
[16]刘永刚,李芳君,谢少玲.白藜芦醇对脑缺血再灌注损伤的抗氧化活性及线粒体保护作用的研究[J].中成药,2007,29(9):1274-1277.
[17]刘永刚,罗景慧.白藜芦醇对过氧化氢诱导的人脐静脉血管内皮细胞损伤的保护作用[J].中成药,2011,33(7):1126-1130.
[18]邱雅慧. 血管内皮细胞的功能以及损伤修复与动脉粥样硬化[J].中国组织功能研究与临床康复,2007,10(3):1927-1933.
[19]Harrington L, Sainson R, Williams C, et al. Regulation of multiple angiogenic pathways by Dll4 and notch in human umbilical vein endothelial cells [J].Microvascul Res,2008,75(2):144-154.
(本文编辑周芳)
Protective effect of Total Flavonoids in Cydonia oblanga Mill. on human umbilical vein endothelial cell oxidative damage induced by hydrogen peroxide
Guzainuer Maimaiti1, Aerziguli Tuerxun2, Adili Abudureheman1, ZHOU Wenting1, Wuliya Yiming1, Anwar Umar1
(1DepartmentofPharmacology,CollegeofBasicMedical,XinjiangMedicalUniversity,Urumqi830011,China;2TheScienceResearchCenter,theFirstHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
ObjectiveTo investigate the protective effects and mechanisms of Total Flavonoids in Cydonia oblanga Mill. (TFCOM) on the oxidative injury and apoptosis of human umbilical vein endothelial cell (HUVEC) induced by hydrogen peroxide (H2O2). MethodsHUVEC were cultured in vitro and divided into five groups, including normal control group, H2O2injured group (10 μmol/L), low-dosage of TFCOM group (10 μg/mL), mid-dosage of TFCOM group (20 μg/mL) and high-dosage of TFCOM group (40 μg/mL). On the basis of establishing the oxidative damage model of H2O2, observe the periodic change of HUVEC, by detecting HUVEC vigor using by MTT method ,flow cytometry instrument and Hochest33258 fluorescent staining method were used to detect apoptosis rate. ResultsCell morphology of TFCOM group was between normal control group and H2O2model group, and cell morphology improvement was more obvious with the increasing of drug concentration. Compared with H2O2model group, the cell gap was narrowed and the intercellular junctions were increased and the border was clear in TFCOM group. TFCOM can against cell apoptosis induced by H2O2and promote the proliferation and differentiation of HUVEC. The difference between the low-dose TFCOM group and H2O2model group had no significant difference, while cell survival rate of medium and high concentration group was gradually increased, and had significant difference (P<0.01). Low, medium, high concentration of TFCOM can promote the synthesis of cell DNA, and compared with H2O2model group, had significant difference (P<0.01). The early stage apoptosis rate of the normal control group was 3.4%, the early stage apoptosis rate of H2O2model group was 19.2%, compared with normal control group, and the difference was statistical (P<0.05). The early apoptosis rate of TFCOM in low, medium and high concentration groups were 16.7%, 12.6%, 6.1%, compared with H2O2model group, the differences were statistically significant (P<0.05). ConclusionTFCOM can inhibit endothelial cell apoptosis, and reduce the effect of H2O2on endothelial cells, can significantly reduce the oxidative damage of H2O2on vascular endothelial cells.
TFCOM; endothelial cell; H2O2; oxidative stress injury
国家自然科学基金 (81260490); 新疆维吾尔自治区自然科学基金 (2015211C033); 新疆维吾尔自治区高校科研计划项目(XJEDU2014S028)
古再努尔·买买提(1989-),女(维吾尔族),在读硕士,研究方向:动脉粥样硬化。
艾尼瓦尔·吾买尔,男(维吾尔族),教授,博士生导师,研究方向:心血管药理学,E-mail: anwar.umar@126.com。
R29
A
1009-5551(2016)06-0696-07
10.3969/j.issn.1009-5551.2016.06.008
2016-03-08]
