原代小鼠肝细胞培养方法的比较
2016-09-02王方萍李慧瑶何志妮陈丽萍
王 珊,柏 青,王方萍,李慧瑶,陈 燊,何志妮,王 庆,陈 雯,陈丽萍
原代小鼠肝细胞培养方法的比较
王珊,柏青,王方萍,李慧瑶,陈燊,何志妮,王庆,陈雯,陈丽萍*
(中山大学公共卫生学院预防医学系,广东广州510080)
目的: 比较3种不同培养条件下原代小鼠肝细胞的形态以及肝细胞功能,寻找适合于原代小鼠肝细胞体外培养的培养基配方。方法:采用改良Seglen两步胶原酶灌注法分离原代小鼠肝细胞,糖原染色观察细胞纯度,在贴壁4 h后用基础培养基、基础培养基加DMSO(DMSO组)、基础培养基加DMSO和EGF(DMSO+EGF组)等3种不同的条件培养肝细胞。镜下观察肝细胞形态,用MTT法检测细胞活力,生化分析仪检测细胞培养上清液中乳酸脱氢酶(LDH)水平以及用ELISA法检测细胞培养上清液中白蛋白水平。结果:成功分离小鼠原代肝细胞,肝细胞纯度达95%以上;原代肝细胞培养至96 h时,DMSO组仍能较好地维持细胞形态,基础培养基组的细胞活力比DMSO组和DMSO+EGF组分别降低了66.87%和67.16%(P<0.05),且基础培养基组的LDH水平均高于DMSO组和DMSO+EGF组(P<0.05)。此外DMSO组在96 h时仍能维持较高水平的白蛋白分泌,比基础培养基组和DMSO+EGF组分别增加了185%和24.2%(P<0.05)。结论:小鼠原代肝细胞培养基中加入DMSO对于维持肝细胞的形态和功能有促进作用,本研究为体外原代肝细胞培养模型的建立和优化提供了实用的方法。
小鼠;原代肝细胞培养;二甲基亚砜;表皮生长因子
【ABSTRACT】OBJECTIVE: To identify a better maintenance medium for primary hepatocyte culture in vitro,wecompare the cellular morphology and function of mouse primary hepatocytes under three different culture conditions.METHODS:Primary hepatocytes were isolated by using a modified two-step collagenase perfusion procedure asdescribed by Seglen. The purity of hepatocytes were determined by PAS staining. After plating for 4 h,the medium wasreplaced with three different maintenance medium (base medium,base medium supplemented with DMSO,base mediumsupplemented with DMSO and EGF). The cellular morphology was observed under an inverted microscope. The cellviability was measured using the MTT assay,the concentrations of lactate dehydrogenase (LDH) was detected by automaticbiochemical analyzer and the albumin level was examined using ELISA. RESULTS:Mouse primary hepatocytes weresuccessfully isolated with purity more than 95%. When primary hepatocytes were cultured for 96 h ,only the DMSO grouphad better cell morphology. Viability of cells in the base medium group was reduced by 66.87% and 67.16% compared withthe DMSO and the DMSO+EGF groups (P<0.05),respectively. The LDH level of the base medium group was higher thanthe DMSO and the DMSO+EGF groups (P<0.05). In addition,cells in the DMSO group had high level of albumin secretionat 96h which was 185% and 24.2% higher than the base medium and the DMSO+EGF group (P<0.05),respectively.CONCLUSION:DMSO addition to maintenance medium supported primary hepatocytes to maintain its morphology andfunction. Our study provides an applicable method for optimization of primary hepatocytes in culture.
【KEY WORDS】mouse;primary hepatocyte culture;dimethyl sulfoxide;epidermal g rowth f actor
原代肝细胞作为一种肝毒性评价体外模型,既能较好地保留肝脏的代谢功能,还可反映外源化学物的刺激,并能排除其他细胞、组织的影响,具有良好的可重复性,被认为是目前体外毒理学和药物试验的重要研究模型而得到广泛应用[1]。然而,原代肝细胞分离后在体外培养过程中很快丧失其正常表型及功能,并迅速进入失分化和衰老状态。因此,体外原代肝细胞存活时间短、失去正常肝细胞功能,以及不同实验室由于技术上掌握的熟练程度不同带来的毒性评价偏倚,大大降低了肝细胞模型在化学物毒性测试中的应用价值。一直以来,研究者们探索不同方法来改善原代肝细胞的微环境,进而维持肝细胞的功能,其主要通过添加促分化因子、细胞外基质或与其他细胞共培养。二甲基亚砜(dimethyl sulfoxide,DMSO)和表皮生长因子(epidermal growth factor,EGF)是两种能促进肝细胞分化的因子[2-4],本研究通过在细胞培养基中添加DMSO或EGF,以不同培养条件培养小鼠原代肝细胞,通过检测细胞形态、细胞损伤和白蛋白分泌功能等指标来评估在不同培养条件下肝细胞的形态和功能,寻找最佳的培养条件,延长原代肝细胞的体外分离后的正常功能维持时间,促进其在毒理学或药理学中的应用。
1 材料与方法
1.1实验动物
SPF级C57BL/6雄性小鼠,6~8周龄,25~30 g,购于中山大学实验动物中心,动物合格证号SCXK (粤)2011-0029。
1.2主要试剂和仪器
William’s E培养基、IV型胶原酶、4-羟乙基哌嗪乙磺酸[4-(2-hydroxyerhyl)piperazine-1-erhaesulfonic acid,HEPES]、青霉素/链霉素、L-谷氨酰胺均购自美国Gibco公司;胎牛血清购自法国Biowest公司;地塞米松、牛胰岛素、表皮生长因子均购自美国Sigma公司;Percol密度分离液购自美国BD公司;DMSO 购自美国Amresco公司;白蛋白检测试剂盒购自美国Abcam公司;Cell Titer 96®AQueous One Solution 细胞增殖试剂盒购自美国Promega公司。
主要仪器包括:倒置显微镜(Nikon,Japan)、酶标仪(Biorad,USA)、全自动生化分析仪(7600-020 HITACH,Japan)。
1.3实验方法
1.3.1分离小鼠原代肝细胞在Seglen两步胶原酶灌注法[5]基础上改进分离小鼠原代肝细胞方法。C57BL/6小鼠经腹腔注射水合氯醛(0.5 mg/g)麻醉,常规消毒皮肤,开腹,肝门静脉插管固定,用含EGTA的D-Hanks灌流液灌流。然后灌流含1.6 mmol/L CaCl2和0.5 mg/mL IV型胶原酶的D-Hanks液约40 mL至肝脏变软,剪下肝脏,划破肝包膜,收集细胞悬液,并用200目筛网过滤,4 ℃、50 g离心,然后用含有2 mmol/L CaCl2的DHanks清洗液清洗3次,再用清洗液重悬并加入预先配置好的Percol密度分离液中,100 g离心20 min。最后用含FBS的William’s E培养基重悬,0.4%台盼蓝检测细胞存活率需大于90%。
1.3.2小鼠原代肝细胞的培养方法小鼠原代肝细胞以1.0×105/cm2的细胞密度接种于包被有鼠尾胶原的培养板内。使用贴壁培养基(William’s E培养基、体积分数为10%的胎牛血清、1 μmol/L地塞米松、4 μg/mL牛胰岛素、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 μg/mL链霉素、15 mmol/L HEPES)在37 ℃、体积分数为5%的CO2培养箱中培养4 h后,将培养基吸出,铺上层胶原,形成三明治结构。2 h后分为3组分别加入不同的无血清培养基来维持肝细胞生长。第1种维持培养基综合了文献中常用的培养基成分(William’s E培养基、0.1 μmol/L地塞米松、4 μg/mL牛胰岛素、2 mmol/L L-谷氨酰胺、100 U/mL青霉素、100 μg/mL链霉素、15 mmol/L HEPES)(下称基础培养基组);第2种培养基在第1种培养基的基础上添加了2% DMSO(下称DMSO组);第3种培养基在第1种培养基的基础上同时添加了2% DMSO和12.5 ng/mL EGF(下称DMSO+EGF组)。每天更换新鲜培养液。
1.3.3糖原染色法鉴定肝实质细胞小鼠原代肝细胞培养4 h后弃培养液,PBS清洗2~3次,多聚甲醛固定10 min,蒸馏水洗2~3次,加入高碘酸溶液反应10 min,蒸馏水洗2~3次,每次1 min,接着用Shiff液染色30 min,蒸馏水洗2~3次,继以苏木素染色液染细胞核1~2 min,酸性乙醇分化液分化2~5 s,用自来水冲洗2~3次,在400倍光学显微镜下观察。
1.3.4MTT法检测小鼠原代肝细胞的细胞活力小鼠原代肝细胞以每孔3×104个细胞的密度接种在96孔板,每孔设置3个平行样,分别培养24、48、72、96 h。利用Cell Titer 96®AQueous One Solution 细胞增殖试剂盒检测肝细胞的细胞活力。每孔加入Cell Titer 96®AQueous One Solution 试剂20 μL,37 ℃孵育4 h,选择490 nm波长,用空白孔调零,酶标仪读取各孔吸光度D(490)值。
1.3.5培养细胞上清中乳酸脱氢酶(lactate dehydrogenase, LDH)水平检测小鼠原代肝细胞培养24、48、72、96 h 时分别收集细胞培养基上清,12 0 00 r/min离心10 m in,全自动生化分析仪检测LDH的水平。1.3.6 培养细胞上清中白蛋白水平的检测在小鼠原代肝细胞培养24、48、72、96 h时分别收集培养基上清。采用ELISA法白蛋白检测试剂盒检测培养细胞上清中的白蛋白水平。450和570 nm双波长下检测吸光度值,调零后用四参数逻辑回归分析(4-parameter logistic regression)计算白蛋白水平。
1.4统计分析
各组所得计量数据采用x±s表示,用SPSS 20.0软件处理数据,多组间均数的比较用方差分析,检验水准α=0.05。
2 结果
2.1不同培养条件对小鼠原代肝细胞形态的影响
小鼠原代肝细胞分离成功并培养4 h后,用PAS染色法在倒置显微镜下观察贴壁小鼠原代肝细胞。镜下发现,小鼠原代肝细胞的胞浆内均可见紫红色糖原颗粒,大部分肝细胞均已贴壁并伸展成圆形或多边形,纯度超过95%(图1)。原代肝细胞分别培养24、48和96 h后镜下观察肝细胞形态。如图2所示,培养24 h时,3种培养条件下的肝细胞均表现为多边形,少数呈圆形。大多数肝细胞中可见双核,细胞间相互接触,界限清晰,排列成肝索样结构,呈典型的肝细胞形态。培养48 h后,肝细胞由立体逐渐变成扁平的多边形结构。培养至96 h,基础培养组的细胞间的边界模糊,细胞核增大,细胞形态不能辨认,DMSO+EGF组的细胞间的边界变模糊,逐渐丧失多边形结构,只有添加了2% DMSO组的肝细胞还能维持较好的肝细胞的多边形结构,细胞间的边界仍较清晰。上述实验表明在原代肝细胞维持培养基中添加2% DMSO可以更好维持肝细胞的形态。
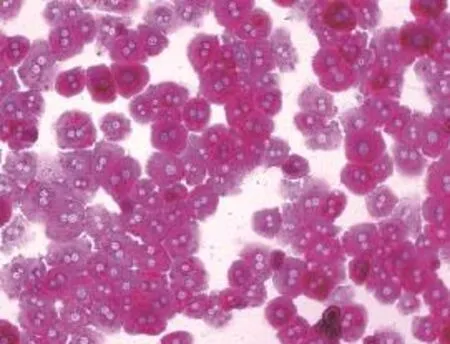
图1 PAS染色观察小鼠原代肝细胞贴壁4 h后的形态(×400)
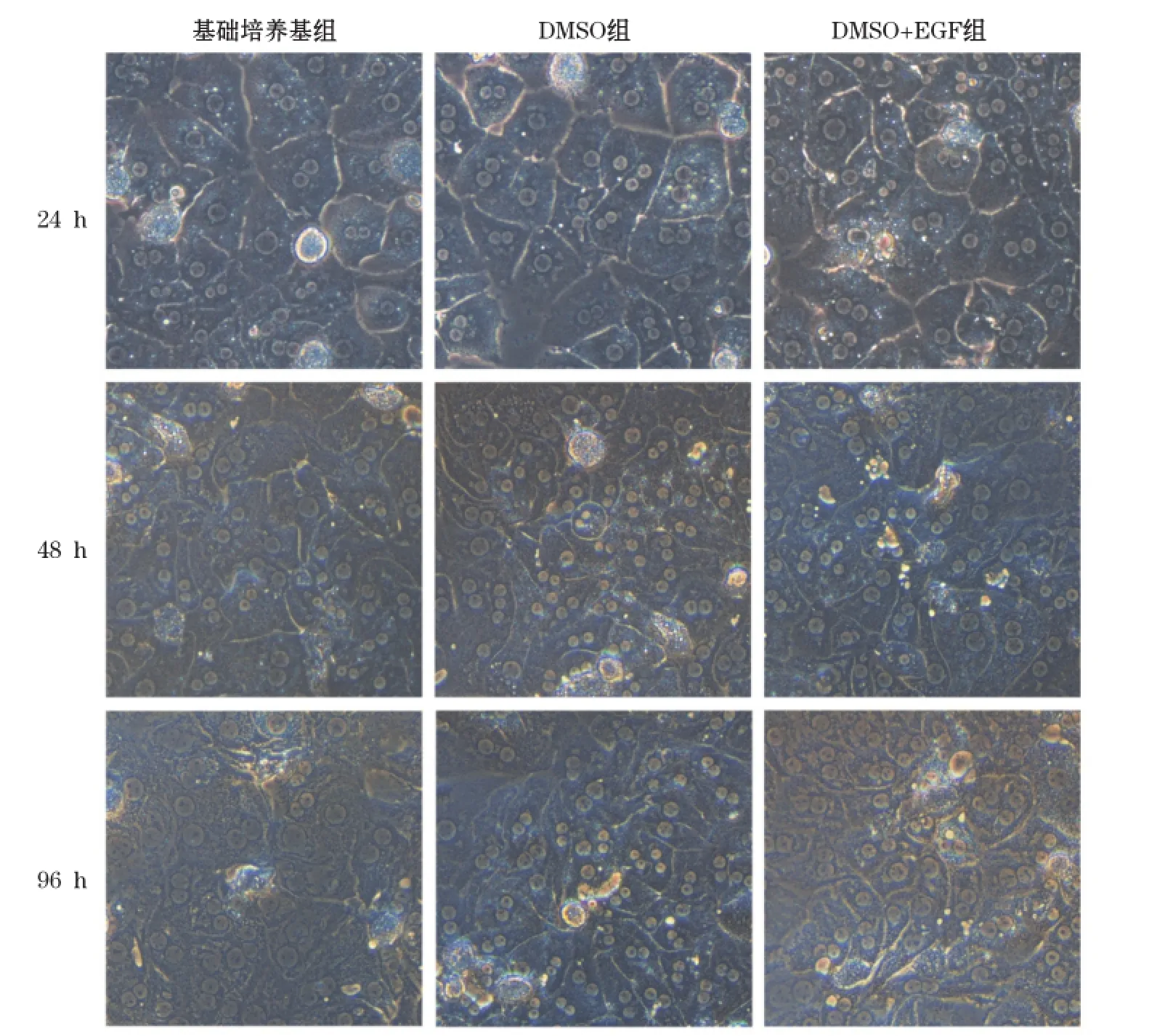
图2 不同培养条件下各时间点原代小鼠肝细胞形态(×400)
2.2不同培养条件对小鼠原代肝细胞活力的影响
我们进一步采用MTT法检测细胞活力。如图3所示,3种不同培养条件下小鼠原代肝细胞的细胞活力的D(490)值在48 h达到峰值,提示细胞活力处于最佳状态。随着培养时间延长,3种条件下肝细胞的细胞活力开始逐渐下降,其中基础培养基组下降最为显著。在96 h时,基础培养基组的D(490)值比DMSO组和DMSO +EGF组降低了66.87%和67.16%,而DMSO组和DMSO+EGF组无明显区别,提示在培养基中添加了DMSO或EGF可以提高原代肝细胞的细胞活力。
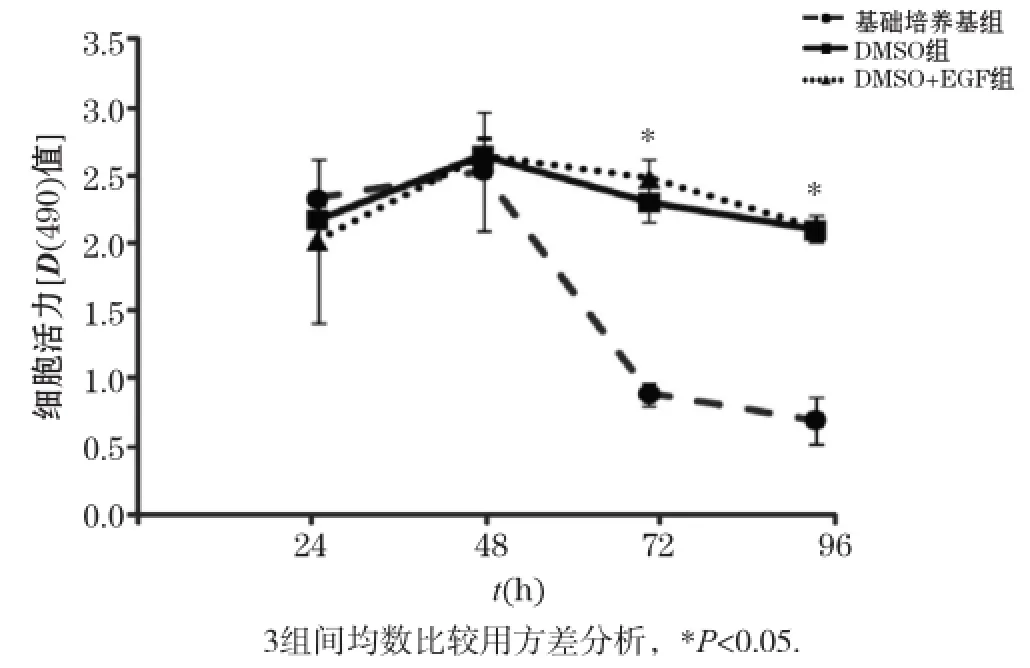
图3 不同培养条件下小鼠原代肝细胞的细胞活力
2.3不同培养条件对肝细胞培养上清LDH的影响
细胞培养上清中的LDH水平可以作为肝细胞损伤的标志。如图4所示,3种培养方式肝细胞培养上清的LDH水平随着培养时间的增加而逐渐下降。但在培养的不同时间点,基础培养基组的LDH水平均高于DMSO组和DMSO+EGF组。表明培养基中添加DMSO或EGF可以减少肝细胞的损伤。
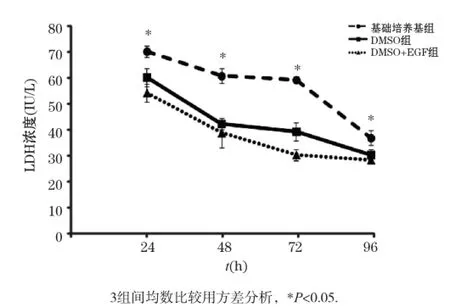
图4 不同培养条件下肝细胞培养上清中LDH水平
2.4不同培养条件对小鼠原代肝细胞白蛋白分泌的影响
白蛋白分泌能力是评价肝细胞功能的重要指标,因此我们检测3种培养条件下小鼠原代肝细胞培养基中的白蛋白水平。如图5所示,基础培养基组的白蛋白分泌在48 h达到峰值,随后逐渐下降,而DMSO+ EGF组的白蛋白水平在72 h时达到峰值,之后开始下降。DMSO组的白蛋白分泌在肝细胞分离后逐渐升高,在72 h时达到峰值,并在96 h时仍能维持白蛋白的高水平,且比基础培养基组和DMSO+EGF组分别增加了185%倍和24.2%,提示培养基中单独添加DMSO可以更好地维持白蛋白的分泌。综合上述结果显示培养基中添加DMSO可更好地维持肝细胞的形态、活力和功能。虽然同时添加DMSO和EGF能促进细胞存活,但在细胞形态和功能维持上与单独添加DMSO相比没有优势。综合细胞形态、活力、LDH和白蛋白分泌4个指标,我们发现单独添加DMSO的效果最佳。
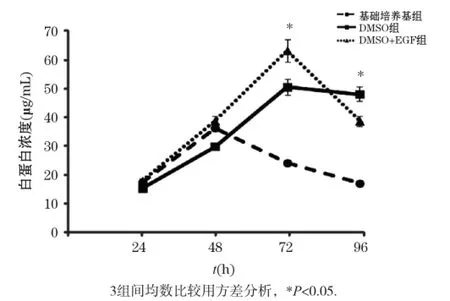
图5 不同培养条件下小鼠原代肝细胞培养上清中的白蛋白水平
3 讨论
肝脏是外源化学物代谢的重要器官,通过肝脏的代谢作用,许多外源化学物质转化为无毒、低毒或毒性更大的代谢产物,因此肝脏是毒理学和药理学研究的重要靶器官。目前已有很多体外肝脏模型用于毒物的代谢、代谢机制及毒物间相互作用的研究,如肝组织切片、肝脏灌流、原代肝细胞、肝微粒体和永生化肝细胞系等[1]。其中,原代肝细胞被认为是体外试验的一个简单而有效的模型,它能够维持肝细胞的功能达24~72 h,可用于酶的诱导和抑制试验,中等通量的外源化学物毒性筛查以及比较物种内和物种间的代谢差异[6-7]。然而,原代肝细胞在体外分离后迅速启动失分化机制,主要原因是在分离的过程中失去了正常肝细胞的微环境、细胞间相互作用以及细胞膜结构[8-10],限制了其在化学物毒性评价中的应用价值。因此,探索长时间有效维持肝细胞功能的培养条件是目前亟需解决的问题。本研究使用不同的维持培养基培养小鼠原代肝细胞,并通过细胞形态、细胞活力、细胞损伤和白蛋白分泌这4个方面综合评价其培养效果。我们发现添加2% DMSO的维持培养基能使肝细胞维持良好的形态和细胞活力,减轻肝细胞损伤,且维持白蛋白分泌的时间更长、分泌能力更强。我们的研究结果为完善体外原代肝细胞在药理学和毒理学中的应用提供了较实用的方法。
本研究发现在基础培养基中添加了DMSO可以更好维持原代肝细胞的形态和功能。以往Isom等[11]研究也发现大鼠原代肝细胞培养基中添加DMSO可促进肝细胞分化。然而,我们基于其研究的基础上优化原代肝细胞培养的方法。相比之下,本研究获得纯化的原代肝细胞,且使用三明治结构的培养方法以更好地维持细胞形态[12],并尝试在DMSO的基础上添加EGF,以筛查更好的原代肝细胞培养条件。此外,本研究旨在优化原代肝细胞模型以用于毒理学或药理学评价,毒理学和药理学评价主要依赖肝细胞的代谢作用,而原代肝细胞的代谢酶在分离出体外后24~72 h则会迅速下降,因此本研究选用96 h为最长观察时间。DMSO是一种氧自由基清除剂,既往研究发现它能较好地维持肝细胞的形态,CYP酶系和肝特异转录因子(如HNF-3,HNF-4和C/EBP)的表达,改进白蛋白分泌的功能[13-14]。然而其作用机制尚不明确,有研究认为这些功能可能与其抑制肝细胞增殖,使细胞停留在细胞G1期相关[15],具体机制仍需进一步研究探讨。此外,我们也发现添加表皮生长因子(EGF)能促进培养细胞的存活,但并不能长时间维持肝细胞形态和白蛋白分泌功能,即使添加DMSO也不能恢复,相关机制不清楚。EGF是能促进有丝分裂的激素,在促进原代细胞增殖和存活中起作用,然而研究发现EGF能激活磷脂酶A2,引起原代肝细胞扁平化,导致CYP酶表达降低[16-17]。因此EGF作为原代肝细胞培养的添加因子还需结合具体实验目的及调整添加剂量,而DMSO作为原代细胞培养基的一个添加成分,价格经济,且容易获得,是一个较好的培养基的添加成分。
目前国外关于原代肝细胞的培养更多地关注于将多种抗失分化的手段结合在一起模拟肝细胞在体内的微环境[18-20],以更好地维持肝细胞的形态和功能。例如将微流体系统、3D培养、与其他非实质细胞(纤维细胞、星形胶质细胞、库否细胞)共培养,以及添加促分化的细胞培养基共同结合在一起,可以使肝细胞的白蛋白和尿素分泌在14 d保持较高水平,用CYP450代谢酶的诱导剂能诱导出较高的代谢酶活性[21]。而本研究主要关注于对促分化培养基成分的改进,旨在为原代肝细胞模型的构建和优化提供基础数据。
综上所述,本研究发现在维持培养基中添加DMSO有利于保留其与小鼠体内肝细胞相近的形态与功能,为体外肝细胞模型局限性提供了新的方法。未来体外代谢模型构建的发展方向主要是模拟人源细胞的代谢模式,虽然人源原代肝细胞模型能最大程度的模拟人体细胞对外源化学物刺激的反应,在体外毒性检测中最具应用价值,但是由于可及性差以及个体差异性而无法全面推广。基于生物工程的仿真代谢模型的构建将是重要的发展趋势。
[1] Soldatow VY,LeCluyse EL,Griffith LG,et al. In vitro modelsfor liver toxicity testing[J]. Toxicol Res,2013,2(1):2 3-39.
[2] Eguchi S,Kawazoe Y,Sugiyawa N,et al. Effects ofrecombinant human hepatocyte growth factor on the proliferationand function of porcine hepatocytes[J]. ASAIO J,2000,46(1):5 6-59.
[3] Michalopoulos GK,Bowen WC,Mule K,et al. Histologicalorganization in hepatocyte organoid cultures[J]. Am J Pathol,2001,159(5):1877-1887.
[4] Fraczek J,Bolleyn J,Vanhaecke T,et al. Primary hepatocytecultures for pharmaco-toxicological studies:at the busycrossroad of various anti-dedifferentiation strategies[J]. ArchToxicol,2013,87(4):577-610.
[5] Seglen PO. Preparation of isolated rat liver cells[J]. Methods CellBiol,1976,13:29-83.
[6] LeCluyse EL. Human hepatocyte culture systems for the in vitroevaluation of cytochrome P450 expression and regulation[J]. EurJ Pharm Sci,2001,13(4):343-368.
[7] Sivaraman A,Leach JK,Townsend S,et al. A microscale invitro physiological model of the liver:Predictive screens fordrug metabolism and enzyme induction[J]. Curr Drug Metab,2005,6(6):569-591.
[8] Fraslin JM,Kneip B,Vaulont S,et al. Dependence ofhepatocyte-specific gene expression on cell-cell interactions inprimary culture[J]. EMBO J,1985,4(10):2487-2491.
[9] Ben-Ze'ev A,Robinson GS,Bucher NL,et al. Cell-cell andcell-matrix interactions differentially regulate the expression ofhepatic and cytoskeletal genes in primary cultures of rathepatocytes[J]. Proc Natl Acad Sci USA,1988,85(7):2161-2165.
[10] Oda H,Yoshida Y,Kawamura A,et al. Cell shape,cell-cellcontact,cell-extracellular matrix contact and cell polarity areall required for the maximum induction of CYP2B1 and CYP2B2gene expression by phenobarbital in adult rat culturedhepatocytes[J]. Biochem Pharmacol,2008,75(5):1 209-1217.
[11] Isom HC,Secott T,Georgoff I,et al. Maintenance of differentiated rat hepatocytes in primary culture[J]. Proc Natl Acad Sci U SA,1985,82(10):3252-3256.
[12] Noel G,Le Vee M,Moreau A,et al. Functional expression and regulation of drug transporters in monolayer- and sandwichcultured mouse hepatocytes[J]. Eur J Pharm Sci,2013,49(1):39-50.
[13] Su T,Waxman DJ. Impact of dimethyl sulfoxide on expression of nuclear receptors and drug-inducible cytochromes P450 in primary rat hepatocytes[J]. Arch Biochem Biophys,2004,424(2):226-234.
[14] Vinken M,Papeleu P,Snykers S,et al. Involvement of cell junctions in hepatocyte culture functionality[J]. Crit Rev Toxicol,2006,36(4):299-318.
[15] Elaut G,Henkens T,Papeleu P,et al. Molecular mechanisms underlying the dedifferentiation process of isolated hepatocytes and their cultures[J]. Curr Drug metab,2006,7(6):6 29-660.
[16] Papeleu P,Loyer P,Vanhaecke T,et al. Trichostatin A induces differential cell cycle arrests but does not induce apoptosis in primary cultures of mitogen-stimulated rat hepatocytes[J]. J Hepatol,2003,39(3):374-382.
[17] Papeleu P,Loyer P,Vanhaecke T,et al. Proliferation of epidermal growth factor-stimulated hepatocytes in a hormonally defined serum-free medium[J]. Altern Lab Anim,2004,32 Suppl 1A:57-64.
[18] Ananthanarayanan A,Narmada BC,Mo XJ,et al. Purposedriven biomaterials research in liver-tissue engineering[J]. Trends Biotechnol,2011,29(3):110-118.
[19] Evenou F,Hamon M,Fujii T,et al. Gas-permeable membranes and co-culture with fibroblasts enable high-density hepatocyte culture as multilayered liver tissues[J]. Biotechnol Prog,2011,27(4):1146-1153.
[20] Leite SB,Teixeira AP,Miranda JP,et al. Merging bioreactor technology with 3D hepatocyte-fibroblast culturing approaches:Improved in vitro models for toxicological applications[J]. Toxicol In Vitro,2011,25(4):825-832.
[21] Esch MB,Prot JM,Wang YI,et al. Multi-cellular 3D human primary liver cell culture elevates metabolic activity under fluidic flow[J]. Lab Chip,2015,15(10):2269-2277.
Comparison of different culture methods for mouse primary hepatocyte
WANG Shan,BAI Qing,WANG Fangping,LI Huiyao,CHEN Shen,HE Zhini,WANG Qing,CHEN Wen,CHEN Liping*
(Faculty of Preventive Medicine, School of Public Health, Sun Yat-sen University, Guangzhou 510080, China)
R114
A
1004-616X(2016)02-0125-06
1 0.3969/j.issn.1004-616x.2016.02.009
2016-02-12;
2016-02-27
广东省自然科学基金重点项目(S2013020012725);国家自然科学基金青年项目(31401213)
作者信息: 王珊,E-mail:274639734@qq.com。*
,陈丽萍,E-mail:chenliping_happy06@163.com
