叔丁基过氧化氢诱导人正常肝细胞系L02自噬模型的建立及其线粒体应激机制
2016-09-02师腾瑞海春旭秦绪军1
师腾瑞,李 鸽,海春旭,秦绪军1,,
叔丁基过氧化氢诱导人正常肝细胞系L02自噬模型的建立及其线粒体应激机制
师腾瑞1,3,李鸽2,3,海春旭1,3,秦绪军1,2,3,*
(1. 第 四军医大学预防医学院毒理学教研室,陕西西安710032;2. 第 四军医大学预防医学院营养与食品卫生学教研室,陕西西安710032;3. 陕西省自由基生物学与医学重点实验室,陕西西安710032)
目的: 建立叔丁基过氧化氢(t-BHP)诱导的人正常肝细胞系L02自噬模型并探讨其中的线粒体应激机制。方法:体外培养L02细胞,用不同浓度(100、200、400、800、1 000 μmol/L)t-BHP及线粒体靶向抗氧化剂MitoQ或p38/MAPK特异性抑制剂SB203580进行处理,采用免疫荧光和Western blot检测自噬标志蛋白LC3-II和p62蛋白水平,以及p38/MAPK信号通路的激活情况;Mito-SOX Red染色流式法检测细胞线粒体活性氧(ROS)水平。结果:免疫荧光结果显示t-BHP剂量≥800 μmol/L时可明显诱导L02细胞内LC3-II发生聚集。Western blot结果显示,与对照组比较,800和1 000 μmol/L t-BHP处理可显著增加LC3-II蛋白水平,并降低p62蛋白水平(P均<0.05)。同时线粒体ROS水平在≥400 μmol/L t-BHP处理后明显升高,在1 000 μmol/L t-BHP处理后p38蛋白磷酸化水平显著增加(P均<0.05)。给予线粒体靶向抗氧化剂MitoQ或p38/MAPK特异性抑制剂SB203580预处理后可有效拮抗t-BHP(1 000 μmol/L) 处理引起的LC3-II和p62蛋白水平改变。结论:我们成功建立了t-BHP诱导体外培养人正常肝细胞系L02的自噬模型,证明线粒体ROS介导了此过程的发生,同时p38/MAPK通路在此过程中发挥了重要作用。
叔丁基过氧化氢;自噬;线粒体;活性氧;p38/MAPK
【ABSTRACT】OBJECTIVE: To understand autophagy induction by tert-butyl hydroperoxide (t-BHP) in human hepatic cell line L02 and to explore the involvement of mitochondria. METHODS:L02 cells were treated with different concentrations of t-BHP (100,200,400,800,1 000 μmol/L) with or without specific inhibitors (mitochondria targeted antioxidant MitoQ or p38/MAPK inhibitor SB203580). Autophagy markers LC3-II and p62 as well as the p38/MAPK pathway proteins were detected by immunofluorescence and/or Western blot. Mitochondrial reactive oxygen species (ROS) were measured by flow cytometry with Mito-SOX Red kit. RESULTS:The high concentrations of t-BHP (≥800 μmol/L) induced the accumulation of LC3 fluorescence puncta,with LC3-II protein level increased and p62 protein level decreased significantly. These changes accompanied the elevated mitochondrial ROS and the activated p38/MAPK pathway. Pretreatment with mitochondria targeted antioxidant MitoQ or specific p38/MAPK inhibitor SB203580 attenuated these changes which were induced by t-BHP (1 000 μmol/L). CONCLUSIONS:We established the autophagy model induced by t-BHP in human hepatic cell line L02. Mitochondrial ROS and p38/MAPK pathway played critical roles in this process.
自噬(autophagy)是一种高度保守的自我消化过程,将各种细胞器或大分子蛋白进行消化降解成为能够被重新利用的营养成分,从而达到在清除受损细胞器或大分子的同时最大限度地有效利用自身营养成分的目的[1]。自噬是一种普遍存在的生命现象。正常细胞中自噬维持在一个相对较低的水平,营养缺乏、氧化应激以及代谢应激等多种应激条件下可诱导自噬水平的增加[2]。其中氧化应激是多种应激损伤因素共有的机制之一。氧化应激是指机体或细胞活性氧(reactive oxygen species,ROS)产生超过抗氧化防御体系所能清除的能力而引起的应激损伤作用[3]。ROS与自噬的相关性已有很多文献报道[4],但具体机制仍然知之甚少。虽然在很多自噬研究中观察到了ROS的变化,也通过抗氧化剂干预证明了ROS在自噬中的作用,而直接采用ROS诱导自噬的模型较少。本研究采用氧化剂叔丁基过氧化氢(tert-butyl hydroperoxide,t-BHP)建立了体外人正常肝细胞系L02自噬模型,进一步观察了线粒体氧化应激及ROS相关信号通路p38/MAPK在其中的作用,为ROS与自噬的研究提供新的实验模型和数据。
1 材料与方法
1.1细胞、主要试剂及仪器
人正常肝细胞系L02,由本实验室保存。MitoQ和t-BHP购自Sigma公司;Mito-SOX R ed购自Life T echnologies公司;RIPA裂解液购自碧云天生物科技有限公司;兔抗鼠tubulin单克隆抗体购自北京博奥森生物技术有限公司;兔抗鼠P-p38、p38、p62和LC3-I/II单克隆抗体购自Cell Signaling公司;BCA蛋白定量分析试剂盒购自Thermo Fisher公司;p38/MAPK通路抑制剂SB203580购于Selleck公司;Universal Hood II凝胶成像系统为Bio-Rad公司产品;fluo FV10i激光共聚焦显微镜为Olympus公司产品;Infinite M200 PRO全波段酶标仪为Tecan产品。
1.2实验方法
1.2.1细胞培养及处理人正常肝细胞系L02细胞,于MEM完全培养基(含青霉素G 100 U/L,链霉素100 mg/L,10%胎牛血清),37 ℃,CO2体积分数为5%条件下常规培养。以2×105/mL接种于培养板或培养皿上,传代24 h后,分别以100、200、400、800、1 000 μmol/L t-BHP处理L02细胞6 h后检测自噬及ROS相关指标。在干预实验中,线粒体靶向抗氧化剂MitoQ(1和10 μmol/L)和针对p38/MAPK通路的特异性抑制剂SB203580(10 μmol/L)均在t-BHP处理前30 min加入。
1.2.2细胞免疫荧光染色细胞按1.2.1处理后,用4%多聚甲醛固定20 min,0.5% Triton X-100破膜5 min,充分洗涤,5% BSA室温封闭1 h,滴加LC3-I/II抗体(1∶200),4 ℃孵育过夜,充分洗涤,羊抗兔FITC二抗(1∶100)室温孵育1 h,充分洗涤,用激光共聚焦显微镜观察拍照。
1.2.3细胞线粒体ROS水平检测细胞接种于6孔板上,分组处理同1.2.1。以1∶1 000 Mito-SOX Red染色30 min,消化、收集细胞,充分洗涤后用流式细胞仪于510和580 nm波长处检测荧光强度。
1.2.4蛋白免疫印迹实验消化、收集处理的细胞,以每1×106个细胞加入100 μL RIPA细胞裂解液,裂解充分后以14 000 g、4 ℃离心20 min,取上清为细胞总蛋白,采用BCA试剂盒进行蛋白浓度定量后,加入等体积2×SDS上样缓冲液(含0.1 mol/L DTT),100 ℃煮沸5 min。根据BCA蛋白定量结果计算样品的上样量,每孔总蛋白25 μg,选用12% SDS-PAGE凝胶和Tris-甘氨酸电泳缓冲液电泳,室温稳压150 V电泳60 min。采用半干转装置将蛋白转于PVDF膜上,室温下5%脱脂奶粉封闭摇床2 h,TBST洗膜,加入按要求稀释的兔抗鼠tubulin、P-p38、p38、p62、LC3-I/II单克隆抗体,4℃摇床孵育过夜。TBST洗膜,加入二抗室温孵育2 h,TBST洗膜后,发光、凝胶成像系统拍照,结果采用Quantity One软件进行量化分析。
1.3统计学分析
应用SPSS 1 3.0软件,结果用x±s表示,采用ANOVA单因素方差分析和t检验进行各组间数据的比较。
2 结果
2.1t-BHP处理对L02细胞自噬水平的影响
免疫荧光结果显示,在不同浓度t-BHP处理条件下,绿色荧光点代表的自噬小体明显随剂量的加大而增多,如图1所示。随t-BHP浓度增加,蛋白免疫印迹结果显示,细胞自噬标志蛋白LC3-II表达水平明也依次升高,与对照组相比,在800和1 000 μmol/L时差异具有统计学意义(P<0.05);且细胞内p62蛋白水平降低,与对照组相比,在800和1 000 μmol/L时差异具有统计学意义(P<0.05),如图2所示。这些结果均显示,一定浓度t-BHP可诱导L02细胞发生自噬。
2.2t-BHP处理对L02细胞线粒体ROS的影响以及线粒体靶向抗氧化剂MitoQ的保护作用
采用线粒体ROS探针Mito-SOX Red染色方法测定L02细胞内线粒体ROS水平,结果显示,细胞内线粒体ROS水平随t-BHP浓度的增加而增加,与对照组相比,在t-BHP≥400 μmol/L时差异均有统计学意义(P<0.05),如图3所示。针对升高的线粒体ROS,我们采用经典的线粒体靶向抗氧化剂MitoQ(1和10 μmol/L)进行干预,结果发现,与1 000 μmol/L t-BHP单独处理组相比,MitoQ处理组自噬标志蛋白LC3-II水平随着MitoQ剂量增加而降低(P<0.05),同时p62蛋白表达显著增加(P<0.05),如图4所示。以上结果显示,t-BHP 可通过诱导细胞线粒体ROS水平升高,诱导自噬发生。
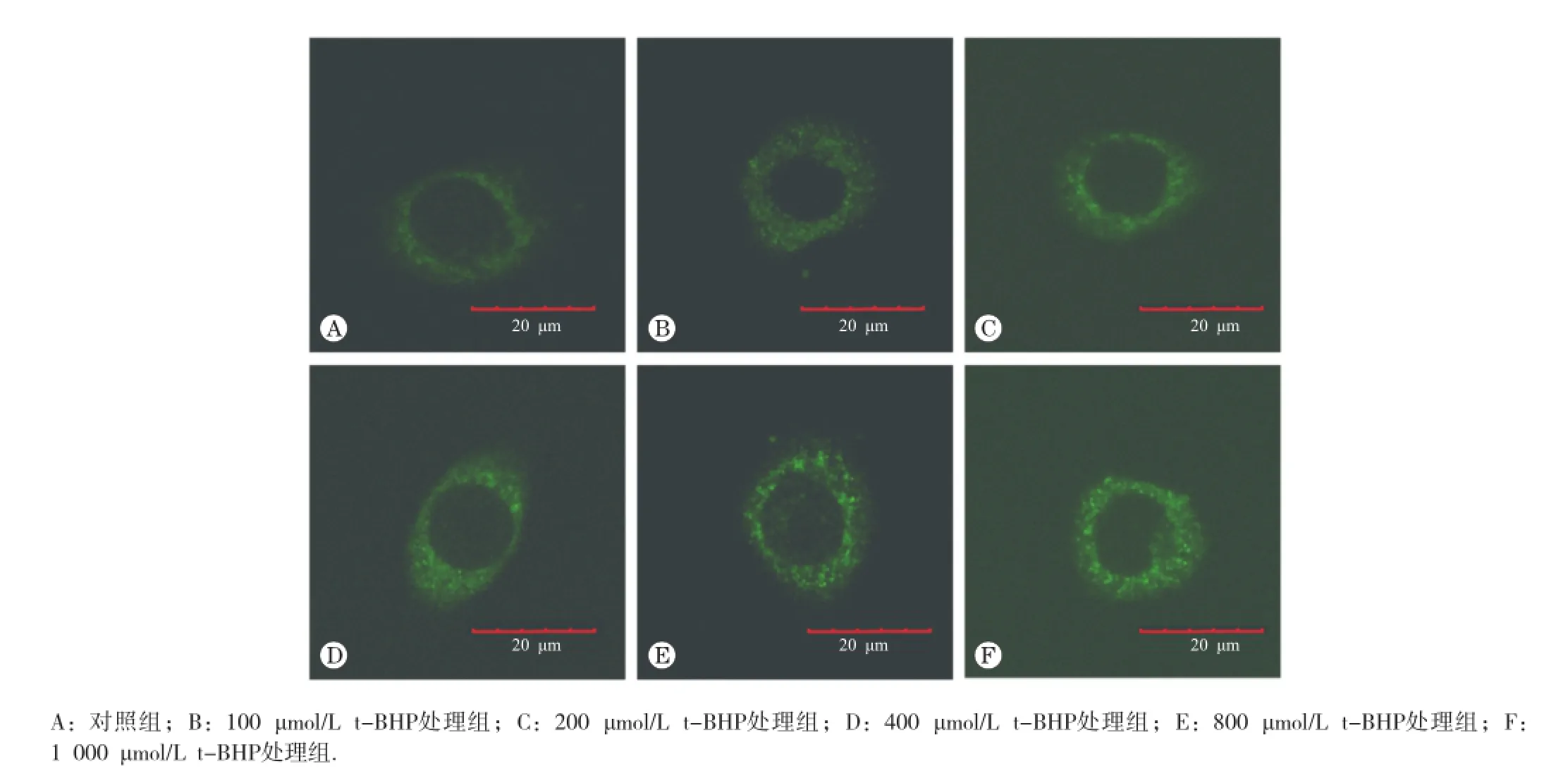
图1 不同浓度t-BHP处理L02细胞6 h后LC3免疫荧光检测结果
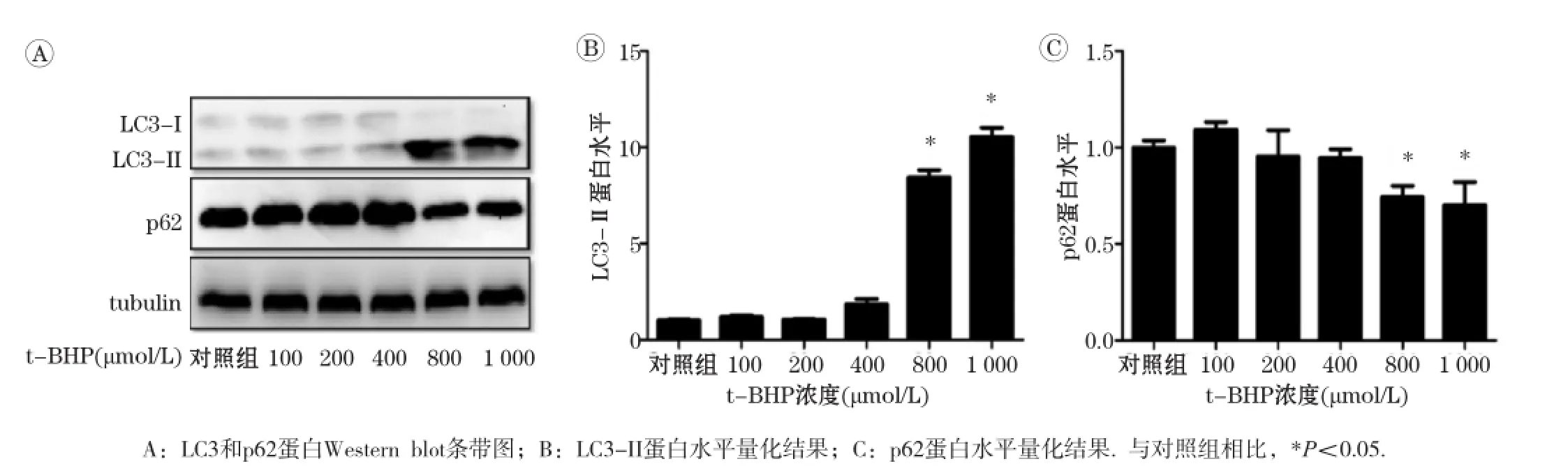
图2 不同浓度t-BHP处理L02细胞6 h后LC3-II及p62蛋白免疫印迹检测结果
2.3p38/MAPK通路在t-BHP诱导自噬中的作用
以1 000 μmol/L t-BHP处理L02细胞6 h后,蛋白免疫印迹结果显示,与对照组相比P-p38蛋白水平显著升高(P<0.05),如图5所示。针对p38/MAPK通路,给予特异性抑制剂SB203580(10 μmol/L)预处理30 min后,再给予1 000 μmol/L t-BHP处理6 h,蛋白免疫印迹结果显示,与t-BHP单独处理组相比,P-p38蛋白水平明显减少(P<0.05),同时LC3-II蛋白水平也随之下降(P<0.05),p62蛋白明显升高(P<0.05),见图6。以上结果表明,p38/MAPK通路参与了t-BHP诱导的自噬发生。
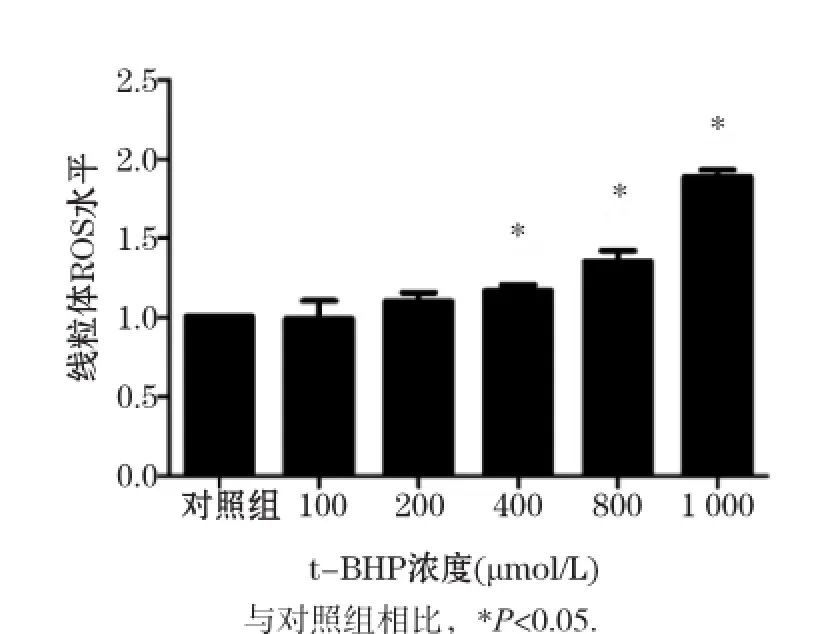
图3 不同浓度t-BHP对L02细胞线粒体ROS水平的影响
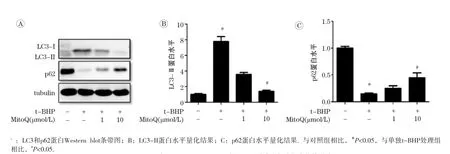
图4 MitoQ对1 000 μmol/L t-BHP诱导L02细胞自噬标志物变化的影响
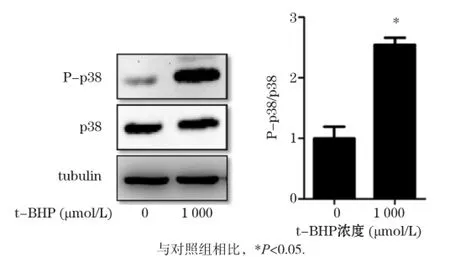
图5 t-BHP对L02细胞p38磷酸化水平的影响
3 讨论
研究发现多种应激因素诱导自噬均与诱导ROS的产生密切相关[4],但多数研究中ROS氧化应激同时复合了多种其他应激损伤机制,单一ROS直接诱导自噬的研究报道并不多。建立ROS直接诱导的自噬模型,将进一步确证ROS诱导自噬的独立作用,同时也将为ROS诱导自噬的分子机制研究,以及针对ROS及相关靶点调控自噬的抗氧化剂筛选提供了合适的研究平台和手段。
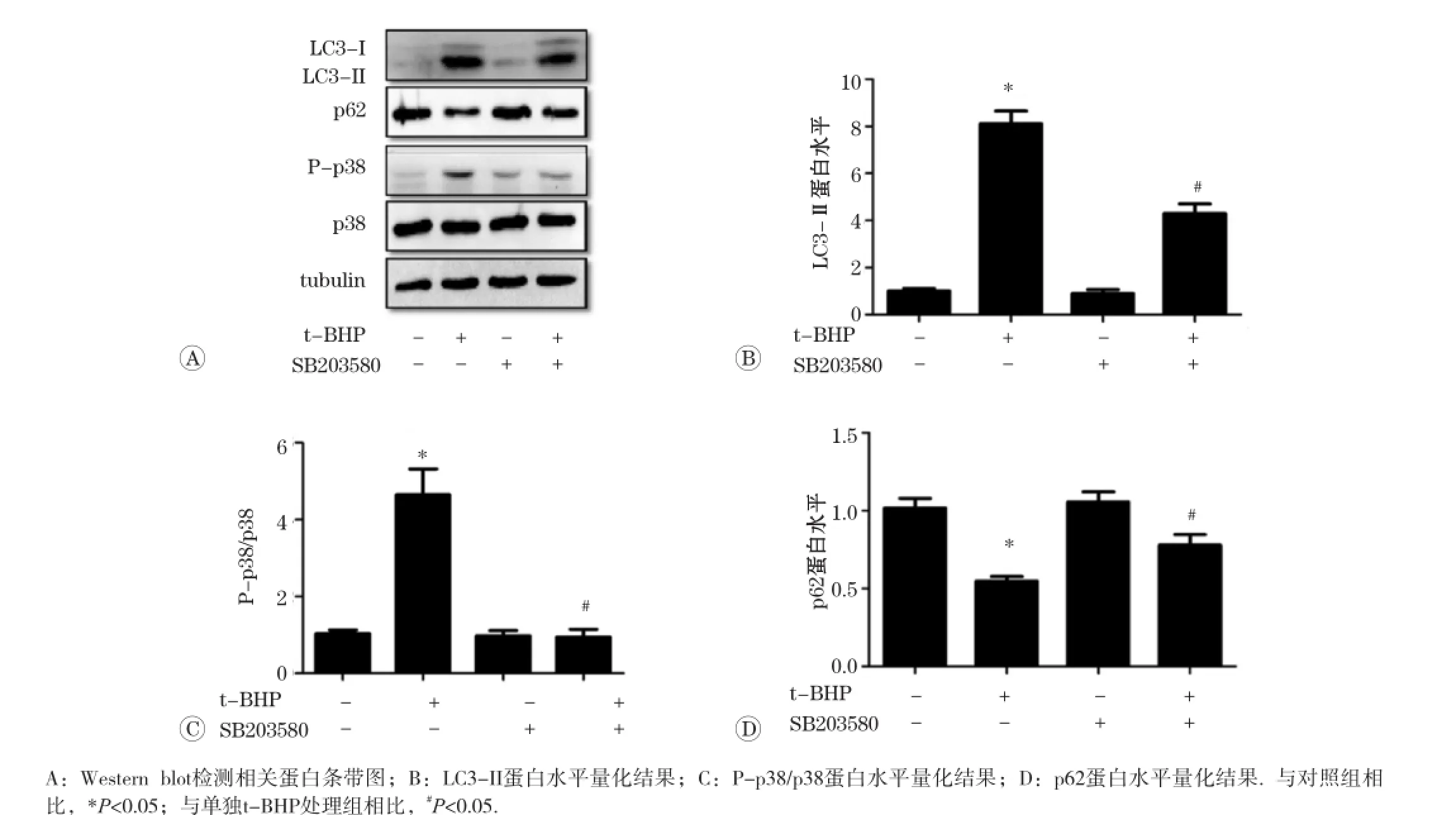
图6 抑制剂SB203580对t-BHP诱导细胞自噬及p38磷酸化水平的影响
ROS是一类性质活泼的含氧自由基及衍生物的统称,代表性的有超氧阴离子()、羟自由基(·OH)、单线态氧)和过氧化氢(H2O2)等,其中H2O2由于半衰
22期较长而常被用于氧化应激的诱导剂。但在实际实验中,H2O2仍然很容易分解而不容易实现较稳定的氧化应激[5]。t-BHP分子结构中一个-(CH3),置换了H2O2中的-OH,其稳定性加强,而体内代谢后则可重新置换释放H2O2,从而实现较长时间的氧化应激,因此,t-BHP在许多研究中被作为高效、缓释的氧化剂使用[6]。如我们实验室应用t-BHP建立氧化应激复合高脂高糖诱导大鼠胰岛素抵抗模型[7]。但尚未有报道将t-BHP作为自噬诱导剂的研究。本研究预实验中,分别检测了1h、3h、6h、12h和24h不同处理时间条件下自噬各指标变化,发现6h处理条件下各指标变化明显且细胞状态良好,故在整个研究中均选择6h作为统一的处理观察时间。
自噬过程由一系列自噬相关蛋白协作共同完成,这些蛋白质在自噬体形成的不同阶段发挥作用。当自噬体形成后,LC3-I和磷脂酰乙醇胺(phosphatidy lethano lamine,PE)偶联形成LC3-II并定位于自噬体内膜和外膜,并且LC3-II能始终稳定地保留在自噬体膜上直至与溶酶体融合,因此被用来作为自噬体的标记,LC3-II的水平在某种程度上反映了自噬体的数量[8]。在本研究中随着t-BHP浓度的增加,LC3-II的免疫荧光聚集明显增加,蛋白印迹杂交结果也证明了LC3-II的水平增加,这提示适量的t-BHP可以明显诱导自噬的发生。为了确证自噬的发生,我们进一步检测另一个重要自噬标志物p62。p62是SQSTM1编码的泛素结合蛋白,参与自噬蛋白降解过程。p62蛋白本身也是自噬的选择性底物之一,当自噬发生时,细胞内p62被降解,p62蛋白含量降低[9]。在本研究中p62蛋白水平显著降低,与升高的LC3-II的水平变化相对应,进一步证明t-BHP诱导了自噬的发生。
线粒体是细胞内的重要细胞器,线粒体氧化呼吸链也是正常情况下细胞内源性ROS的最主要来源。大量研究表明,线粒体也是众多内外损伤因素的作用靶点,诱导线粒体大量产生ROS是其中重要的共有机制[10-11]。而最近有研究表明,外源性的氧化应激也往往是通过多种信号通路刺激线粒体产生ROS而发挥作用,出现一种被称之为“ROS诱导ROS释放”的现象[12],本研究中,我们采用线粒体ROS标记探针Mito-SOX Red检测线粒体内的ROS水平,结果发现,线粒体ROS水平随着t-BHP的剂量增加而显著升高,提示了线粒体ROS可能参与了t-BHP诱导的自噬。为了进一步确证线粒体ROS在此过程中的作用,我们采用线粒体靶向抗氧化剂MitoQ进行干预研究。MitoQ是目前研究最多和应用最广泛的线粒体靶向抗氧化剂,可以不断地清除过氧化氢、过氧亚硝酸盐、超氧化物,保护线粒体对抗脂质过氧化[13]。本研究结果发现,MitoQ可以显著拮抗t-BHP处理引起的LC3-II水平的增加以及p62蛋白的减少,表明线粒体ROS确实参与了t-BHP诱导的自噬的发生。
调控自噬的信号通路很多,主要包括两类,即依赖mTOR(雷帕霉素靶点)途径的自噬,具体又包括PI3K/ AKT/mTOR和信号通路[14-15],以及非依赖mTOR的信号通路。p38/MAPK通路是受氧化应激调控的重要下游信号通路,已有许多报道认为p38/MAPK通路可以调节依赖mTOR信号通路的自噬[16]。为了明确p38/MAPK通路在t-BHP诱导自噬过程中的作用,首先我们观察了p38蛋白及其磷酸化激活情况,结果发现t-BHP处理可以显著提高p38的磷酸化水平,提示p38/MAPK通路可能参与了t-BHP诱导的自噬的发生。为了进一步确证,我们采用p38/MAPK特异性抑制剂SB203580进行干预处理,结果发现,抑制p38/MAPK通路后可以有效拮抗t-BHP处理引起的LC3-II蛋白水平的增加以及p62蛋白水平的减少,表明p38/MAPK通路参与了t-BHP诱导自噬的发生。
综上所述,本研究成功建立了t-BHP诱导的体外人正常肝细胞系L02的自噬模型,并且初步证明了线粒体ROS介导了该自噬过程的发生,在此过程中p38/MAPK通路发挥了重要作用。该模型将为ROS直接诱导自噬的研究提供了实验手段,同时也为将来进一步针对线粒体为靶点的抗氧化调控自噬的研究提供了可靠的平台。
[1] Mei Y,Thompson MD,Cohen RA,et al. Autophagy and oxidative stress in cardiovascular diseases[J]. Biochim Biophys Acta,2015,1852(2):243-251.
[2] Bernard A,Jin M,Xu Z,et al. A large-scale analysis of autophagy-related gene expression identifies new regulators of autophagy[J]. Autophagy,2015,11(11):2114-2122.
[3] Gavia-Garcia G,Gonzalez-Martinez H,Miliar-Garcia A,et al. Oxidative damage and antioxidant defense in thymus of malnourished lactating rats[J]. Nutrition,2015,31(11/12):1408-1415.
[4] Li L,Tan J,Miao Y,et al. ROS and autophagy:interactions and molecular regulatory mechanisms[J]. Cell Mol Neurobiol,2015,35(5):615-621.
[5] Lushchak VI. Free radicals,reactive oxygen species,oxidative stress and its classification[J]. Chem Biol Interact,2014,224:164-175.
[6] Slamenova D,Kozics K,Hunakova L,et al. Comparison of biological processes induced in HepG2 cells by tert-butyl hydroperoxide(t-BHP) and hydroperoxide (H2O2):The influence of carvacrol[J]. Mut Res,2013,757(1):15-22.
[7] 张伟,海春旭,梁欣,等. 高脂高糖加氧化剂tBHP诱导胰岛素抵抗大鼠模型的建立[J]. 毒理学杂志,2009,21(1):44-47.
[8] Gottlieb RA,Andres AM,Sin J,et al. Untangling autophagy measurements:all fluxed up[J]. Circ Res,2015,116(3):504-514.
[9] Lippai M,Low P. The role of the selective adaptor p62 and ubiquitin-like proteins in autophagy[J]. Biomed Res Int,2014,2 014:832704.
[10] Chattopadhyay M,Khemka VK,Chatterjee G,et al. Enhanced ROS production and oxidative damage in subcutaneous white adipose tissue mitochondria in obese and type 2 diabetes subjects[J]. Mol Cell Biochem,2015,399(1/2):95-103.
[11] Benkhalifa M,Ferreira YJ,Chahine H,et al. Mitochondria: participation to infertility as source of energy and cause of senescence[J]. Int J Biochem Cell B,2014,55:60-64.
[12] Izyumov DS,Domnina LV,Nepryakhina OK,et al. Mitochondria as source of reactive oxygen.species under oxidative stress. Study with novel mitochondria-targeted antioxidants--the “Skulachevion” derivatives[J]. Biochemistry:Mosc,2010,75(2):123-129.
[13] Miriyala S,Spasojevic I,Tovmasyan A,et al. Manganese superoxide dismutase,MnSOD and its mimics[J]. Biochim Biophys Acta,2012,1822(5):794-814.
[14] Heras-Sandoval D,Perez-Rojas JM,Hernandez-Damian J,et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[ J]. Cell Signal,2014,26(12):2694-2701. [15] Meijer AJ,Lorin S,Blommaart EF,et al. Regulation of autophagy by amino acids and mTOR-dependent signal transduction[J]. Amino acids,2015,47(10):2037-2063.
[16] Hernandez G,Lal H,Fidalgo M,et al. A novel cardioprotective p38-MAPK/mTOR pathway[J]. Exp Cell Res,2011,317(20):2938-2949.
Involvement of mitochondria for induction of autophagy by tert-butyl hydroperoxide in human hepatic cell line L02
SHI Tengrui1,3,LI Ge2,3,HAI Chunxu1,3,QIN Xujun1,2,3,*
(1. Department of Toxicology, Fourth Military Medical University, Xi’an 710032; 2. Department of Nutrition and Food Hygiene, Fourth Military Medical University, Xi’an 710032; 3. The Key Laboratory of Free Radical Biology and Medicine of Shaanxi Province, School of Preventive Medicine, Fourth Military Medical University, Xi’an 710032, Shaanxi, China)
tert-butyl hydroperoxide;autophagy;mitochondria;reactive oxygen species;p38/MAPK
R114;R992
A
1004-616X(2016)02-0091-06
1 0.3969/j.issn.1004-616x.2016.02.002
2015-12-15;
2016-01-19
国家自然科学基金(81270417,31070766,30300074);陕西省青年科技新星人才基金(2010KJXX-06)
作者信息: 师腾瑞,E-mail:526611412@qq.com。*
,秦绪军,E-mail:qinxujun@hotmail.com
