单质铜颗粒的制备及其光催化性能研究
2016-09-02刘花蓉
刘花蓉
(四川建筑职业技术学院,四川 德阳 618000)
单质铜颗粒的制备及其光催化性能研究
刘花蓉
(四川建筑职业技术学院,四川德阳618000)
采用化学还原法,在十六烷基三甲基溴化铵(CTAB)的辅助下,以氯化铜(CuCl2·2H2O)为铜源制备单质铜颗粒。利用XRD和SEM对样品成分、形貌和结构进行了表征分析,并以甲基橙溶液的降解率来评估纳米铜颗粒的光催化性能。结果表明,在未通入保护气体的情况下,该法成功制得单质铜。所制备的单质铜粉末都具有光催化活性,且光催化能力随CTAB加入量的增加而提高。
单质铜;CTAB;氯化铜;光催化
随着绿色环保概念的提出,光催化材料逐渐成为研究热点之一[1-3]。由于纳米金属粉体具有尺寸小、高催化活性等优异特性[4-7],使其在化工催化方面应用广泛。比如在纳米金属粉体的催化作用下,高分子聚合物氧化和还原反应反应速率得到明显的提高。越来越多的实验工作者制备出了Ag[8]、Cu[9]、Pt[10]和Pd[11]等金属纳米粉体。其中,金属铜纳米颗粒因具有催化性强、反应速度快而作为催化剂得到越来越多的重视。例如,在铜纳米颗粒的催化作用下,氧化烃类化合物、还原氮氧化合物[12]等反应速率得到极大的提高。
近年来,多种关于铜纳米的制备技术被开发出来。如真空蒸气沉淀法[13]、化学还原法[9]等。为防止金属纳米颗粒被氧化,在这些方法的实验过程中会通入保护气体。在本研究中,所有实验过程的温度都控制在25 ℃,不需要通入保护气体。选用十六烷基三甲基溴化铵作阳离子表面活性剂,氯化铜为铜源,水合肼为还原剂,成功制备出了单质铜颗粒。单质铜颗粒的形貌随CTAB的改变而改变,同时也使得单质铜颗粒的光催化性能发生变化。
1 实 验
1.1试剂与仪器
CuCl2·2H2O,十六烷基三甲基溴化铵(CTAB),N2H4·H2O,NH3·H2O,甲基橙,所有化学试剂均为分析纯,成都市苌钲化玻有限公司。
医用40 W的紫外灯,Philips公司;UV-Vis2550分光光度计,Shimadzu 2550,Japan;DX-2500型X射线衍射仪,丹东浩圆仪器有限公司;Fei Quanta200环境扫描电子显微镜,USA;Biofuge Primo离心机,美国SORVALL。
1.2纳米铜颗粒的制备
当固定铜源CuCl2·2H2O时,在25 ℃的条件下,分别配制溶液A和B。溶液A配制如下:分别将 向100 mL蒸馏水中加入0.5 g,1.5 g,2.5 g和3.5 g CTAB搅拌至CTAB完全溶解。再分别加入相同质量的CuCl2·2H2O(均为0.01 mol),待CuCl2·2H2O完全溶解后,加入氨水调节溶液pH至10。溶液B配制如下:分别将 向100 mL蒸馏水中加入0.5 g,1.5 g,2.5 g和3.5 g CTAB搅拌至CTAB完全溶解。再分别加入相同质量的N2H4·H2O(均为15 g),搅拌均匀。然后将溶液B加入到对应的溶液A中,磁力搅拌3 h左右。最后抽滤烘干收集样品。
1.3光催化实验
分别取50 mg的单质铜粉末分散于50 mL浓度为10 mg/L的甲基橙溶液中。照射前,先在黑暗条件下磁力搅拌20 min,使其充分接触溶液并吸附。以40 W的紫外灯为光源,采用分光光度计检测上层液体在紫外吸收光谱466 nm处的浓度。每隔20 min检测一次,共检测5次。
通过公式η=(1-At/A0)×100%计算甲基橙的降解率,从而评估单质铜颗粒的光催化活性。其中,A0为甲基橙的初始浓度,At为降解t min后的浓度。
2 结果与讨论
2.1实验原理
该法主要基于化学还原的原理,主要反应式如下[9]:
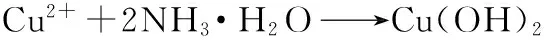
(1)
(2)
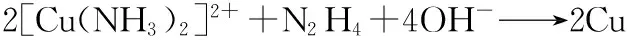
(3)
从以上反应式可以看出,反应过程中有N2产生,可防止Cu与氧气反应生成铜的氧化物(CuO或Cu2O)。因此在制备单质铜的实验过程中,不需要另外通入氮气(N2)或其它惰性气体作为保护气体。
2.2样品的结构分析
图1是所得样品的XRD图谱。从图1可知,2θ为43.4°,50.6°和74.3°分别对应于单质铜的(111),(200)和(220)的三个晶面。制备出的4个样品都存在这样的三个晶面且没有其它杂质衍射峰出现,尤其没有出现CuO或Cu2O的特征衍射峰。说明通过化学还原法,在十六烷基三甲基溴化铵(CTAB)的辅助下,以氯化铜(CuCl2·2H2O)为铜源成功制备出单质铜颗粒。
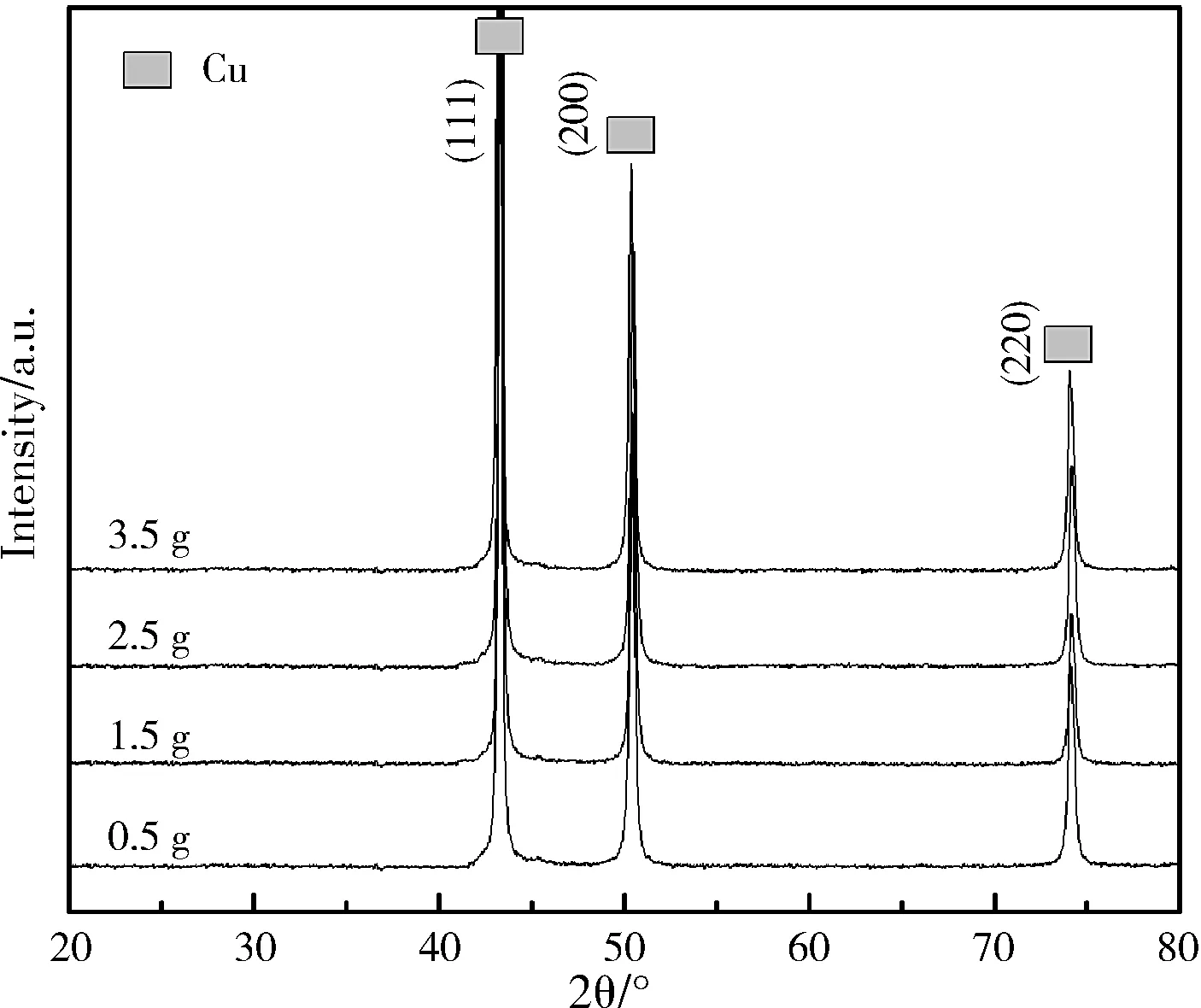
图1 单质铜颗粒样品的XRD图谱Fig.1 XRD patterns of the copper, respectively
2.3样品的微观形貌分析

图2 100 mL蒸馏水中不同CTAB加入量所制备样品的SEM图Fig.2 SEM images of Cu with different content of CTAB in 100 mL distilled water
为了进一步研究该法制备的单质铜的结构,对样品进行了SEM表征以观察其微观形貌。图2分别表示100 mL蒸馏水中,CTAB的加入量依次为0.5 g,1.5 g,2.5 g和3.5 g制备的单质铜样品放大10000倍的形貌。图2(a)为CTAB加入量为0.5 g时制得样品的SEM扫描结果,单质铜呈现米粒状,长度约为0.1~0.2 μm,团聚体之间间隙较大。当CTAB加入量为1.5 g时,SEM扫描结果见图2(b)。单质铜呈片状连接且团聚严重。当CTAB加入量增加到2.5 g时,单质铜呈细条状,分散较为均匀,如图2(c)所示。图2(d)显示出CTAB加入量为3.5 g时,单质铜呈月牙状且分散均匀,基本无团聚现象。因此,从图2可以看出,单质铜的形貌以及团聚现象随CTAB加入量的改变而改变。
2.4样品的光催化性能分析
通过催化降解甲基橙溶液(MO)的实验来研究单质铜颗粒的光催化性能。图3是不同CTAB加入量制备样品的降解率-时间曲线图,其中空白实验是仅有紫外光对甲基橙溶液的降解效率(未加入任何光催化剂)。检测结果显示空白实验中,甲基橙溶液经紫外光源辐照100 min后降解率极小,约为4.96%。当CTAB的加入量依次为0.5 g,1.5 g,2.5 g和3.5 g 制备的单质铜粉末样品对甲基橙的降解能力均有不同程度的提高,且降解率随CTAB的加入量增加而增加。经紫外光源辐照100 min后,其中CTAB的加入量为2.5 g和3.5 g制备的样品对甲基橙的降解率约为58.13%和66.35%。从图2(c,d)可以看出,该两组样品分散性较好,因为相同质量的单质铜粉末比表面积大,吸光能力强,故甲基橙降解率较高。甲基橙降解率较小的是CTAB的加入量为0.5 g和1.5 g制备的样品,从图2(a,b)可以看出,样品团聚严重,因而样品吸附能力和吸光能力都比较差。故CTAB的加入量为0.5 g和1.5 g制备样品的光催化性能较低。
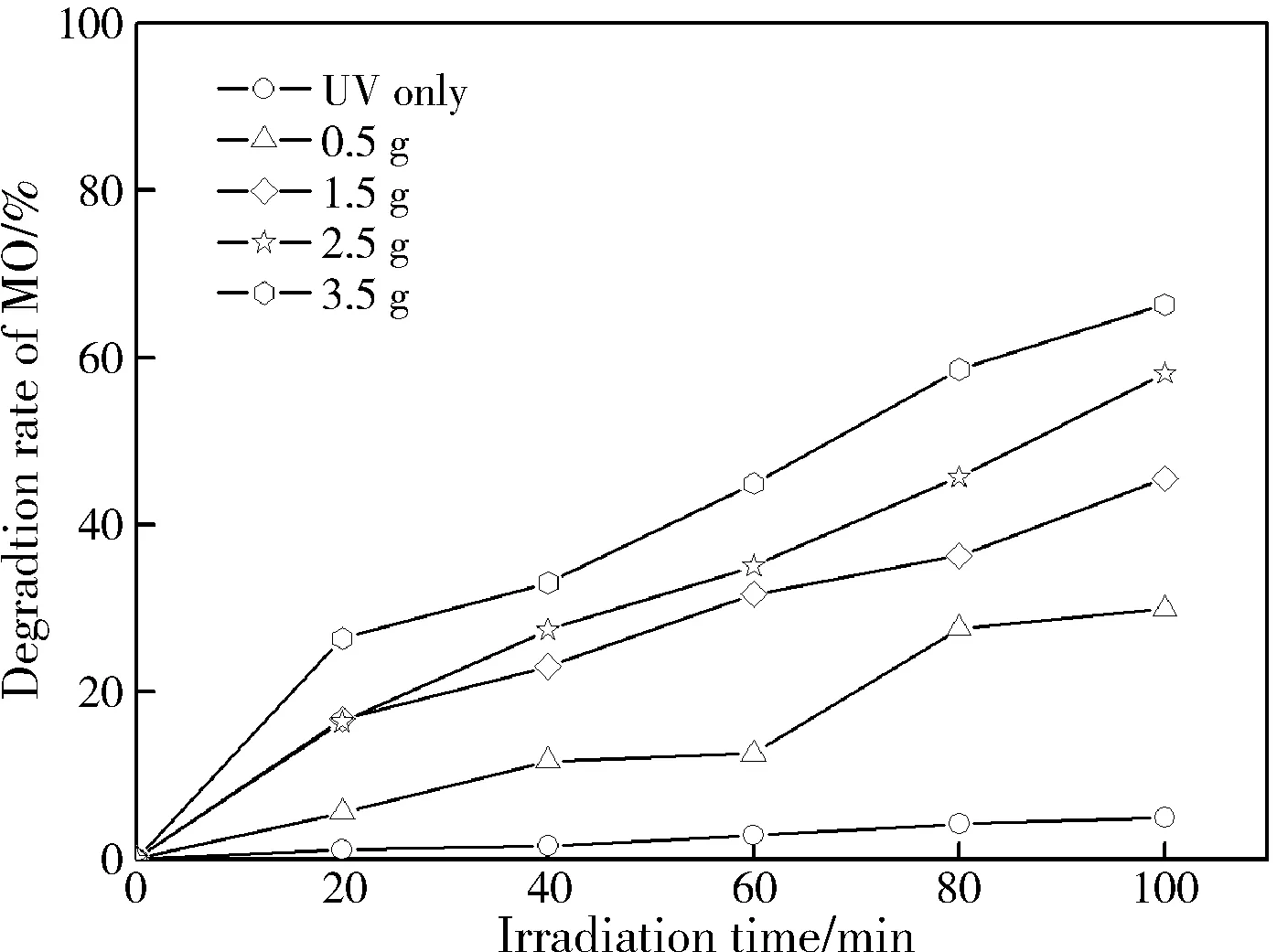
图3 不同CTAB加入量制备样品的降解率曲线图Fig.3 Degradation rate curves of Cu with different content of CTAB
3 结 论
(1) 通过化学还原法,在CTAB辅助下,以CuCl2·2H2O为铜源成功制备出单质铜颗粒。
(2) 光催化降解实验结果显示所制备的单质铜粉末都具有光催化活性,且光催化能力随CTAB加入量的增加而提高。其中,当100 mL蒸馏水中CTAB加入量为3.5 g时,单质铜粉末对甲基橙溶液的降解率可达到66.35%。
[1]韩承辉,李智渝,沈俭一.纳米 TiO2-Cu2O 可见光下光催化降解活性艳红及其机理研究[J].材料导报:研究篇,2014,28(7):4-8.
[2]C Gu, C Cheng, H Huang, et al. Growth and Photocatalytic Activity of Dendrite-like ZnO@Ag Heterostructure Nanocrystals[J].Crystal Growth & Design,2009,9(7): 3278-3285.
[3]王双,刘凯婷,汪宇青,等. 碳载 Au/TiO2光催化材料的制备与拉曼增强特性[J].材料导报B:研究篇,2015,29(12):11-15.
[4]P H Matter, D J Braden, U S Ozkan. Steam reforming of methanol to H2 over nonreduced Zr-containing CuO/ZnO catalysts[J]. U.S.J.Catal., 2004,223:340-351.
[5]B L Kniep, F Girgsdies, T Ressler. Effect of precipitate aging on the microstructural characteristics of Cu/ZnO catalysts for methanol steam reforming[J]. J.Catal.,2005,236(1): 34-44.
[6]K V R Chary, G V Sagar, D Naresh. Characterization and reactivity of copper oxide catalysts supported on TiO2-ZrO2[J]. J.Phys.Chem.B., 2005,109:9437-9444.
[7]W J Shen, Y Ichihashi, Y Matsumura. Low temperature methanol synthesis from carbon monoxide and hydrogen over ceria supported copper catalyst[J]. Appl.Catal.A., 2005,282:221-226.
[8]J Tanori, N Duxin, C Petit, et al. Synthesis of nanosize metallic and
alloyed particles in ordered phases[J]. J.Tanori.Colloid Polym.Sci.,1995,273:886-892.
[9]S H Wu, D H Chen. Synthesis of high-concentration Cu nanoparticles in aqueous CTAB soIutions[J]. J.Colloid and Interface Science.,2004,273:165-169.
[10]A Duteil, R Queau, B Chaudret, et al. Preparation of organic solutions or solid films of small particles of ruthenium, palladium,and platinum from organometallic precursors in the presence of cellulose[J]. Chem.Mater.,1993,5(3):341-347.
[11]N Toshima, T Takahashi. Colloidal Dispersions of Platinum and Palladium Clusters Embedded in the Micelles Preparation and Application to the Catalysis for Hydrogenation of Olefins[J]. Bull. Chem.Soc.Jpn.,1992,65: 400-409.
[12]S Bennici, A Auroux, C Guimon. Supported binary oxide catalysts containing CuO coupled with Ga2O3and SnO2[J]. Appl.Catal.B., 2006,62:336-344.
[13]G Vitulli, M Bernini, S Bertozzi, et al. Nanoscale copper particles derived from solvated Cu atoms in the activation of molecular oxygen[J]. Chem.Mater.,2002,14 (3):1183-1186.
Preparation of Cu and Its Photocatalytic Property
LIUHua-rong
(Sichuan College of Architectural Technology, Sichuan Deyang 618000, China)
Simple substance copper were prepared via chemical reduction method employing the cupricchloride (CuCl2·2H2O) as source of copper with the assistant of Hexadecyl trimethyl ammonium Bromide (CTAB). The chemical composite structure and morphology of Cu were characterized and studied in detail by XRD and SEM. The photocatalytic activities of Cu were evaluated through degradation rate of methyl orange(MO). The results showed that the simple substance copper were obtained successfully without protective gas. All the samples exhibited evident photocatalytic property which increased with increasing amount of CTAB.
copper; CTAB; cupricchloride; photocatalytic activities
O69
A
1001-9677(2016)015-0107-03
