六味补血颗粒中芍药苷和阿魏酸含量的测定
2016-09-02鲁赤姣王文渊
鲁赤姣,王文渊
(1 湖南永州市产商品检验所,湖南 永州 425100;2 湖南永州职业技术学院,湖南 永州 425100)
六味补血颗粒中芍药苷和阿魏酸含量的测定
鲁赤姣1,王文渊2
(1 湖南永州市产商品检验所,湖南永州425100;2 湖南永州职业技术学院,湖南永州425100)
建立了HPLC梯度洗脱法测定六味补血颗粒中芍药苷和阿魏酸的含量。方法 采用Platisil ODS色谱柱(150 mm×4.6 mm,5 μm);甲醇-0.1%磷酸溶液为流动相;流速1.0 mL/min;检测波长284 nm;柱温:25 ℃。结果表明:芍药苷在8.512~212.8 μg·mL-1的范围内峰面积积分值与浓度呈良好的线性关系(r=0.9998),平均回收率为99.71%,RSD=1.08%(n=6);阿魏酸在0.908~22.7 μg·mL-1的范围内峰面积积分值与浓度呈良好的线性关系(r=0.9999),平均回收率为99.02%,RSD=1.57% (n=6)。该法准确、简便,重现性好,可作为六味补血颗粒制剂质量控制的有效方法。
六味补血颗粒;芍药苷;阿魏酸;含量测定
具有养气补血功效的六味补血颗粒,临床用于治疗气血两虚、神疲乏力、头昏眼花等症状。六味补血颗粒是以当归、白芍、川芎、黄芪、熟地黄、紫草六味中药为原料提取制成的复方制剂,其中白芍、当归、川芎为方中主药。白芍中的主要活性成分芍药苷具补血助气、调经、平肝止痛之功效[1-2],当归、川芎中的主要活性成份阿魏酸具有活血行气、祛风止痛、改善血液微循环、抑制血小板聚集、抗氧化和清除自由基作用[3-4]。现行使用的质量标准仅以测定芍药苷的含量来控制制剂的质量[5-6],本试验采用反相高效液相色谱梯度洗脱法同时测定芍药苷和阿魏酸两种主要活性成分的含量,以便控制产品中白芍、当归、川芎3味主药材的质量,进一步提高与完善该制剂的质量控制方法。
1 实 验
1.1仪器
Waters 2489高效液相色谱仪(广州逸海科技有限公司);Empower Waters工作站;Waters 2489 UV检测器;Platisil ODS色谱柱(150 mm×4.6 mm,5 μm);FA-2004电子天平,常州科源电子有限公司;PL-J40D超声波清洗器,东莞康士洁超声波科技有限公司。
1.2试药
芍药苷对照品(批号110736-201427),中国食品药品检定研究院;阿魏酸对照品(批号07773-201415),中国食品药品检定研究院;六味补血颗粒样品(批号20150706,20150707,20150709,20150710)与阴性样品均由湖南敬和堂药业有限公司提供;甲醇为色谱纯,水为超纯水,其余试剂为分析纯。
2 结果与讨论
2.1色谱条件
Platisil ODS色谱柱(150 mm×4.6 mm,5 μm);流速1.0 mL·min-1;检测波长284 nm;柱温25 ℃;进样量20 μL;流动相为甲醇-0.1%磷酸溶液,洗脱方式:梯度洗脱,程序见表1。

表1 梯度洗脱程序表
2.2溶液的制备
2.2.1对照品溶液的制备
用电子天平准确称量21.28 mg干燥的芍药苷对照品,以60%甲醇为溶剂溶解并定容于50 mL容量瓶中,得浓度为425.6 μg·mL-1的芍药苷对照品溶液。准确称量9.08 mg阿魏酸对照品,加入1 mL盐酸,以60%甲醇为溶剂溶解并定容于200 mL棕色容量瓶中,得浓度为45.4 μg·mL-1的阿魏酸对照品溶液。
2.2.2供试品溶液的制备
避光操作,取本品研细(过四号筛),取约1.0 g,精密称定,置具塞锥形瓶中,精密量取50 mL60%甲醇加入,密塞,称定重量,超声40 min,放冷,再称定重量,补足溶剂挥发减失的重量,滤过,弃去初滤液,准确移取续滤液25 mL,水浴蒸干,用甲醇-0.1%磷酸溶液(40:60)溶解并定容于10 mL棕色容量瓶中,用0.45 μm滤膜滤过,制得供试品溶液。
2.2.3阴性对照溶液的制备
取阴性供试制剂(缺白芍、当归、川芎药材的阴性制剂),照供试品溶液项下的方法制备阴性对照溶液。
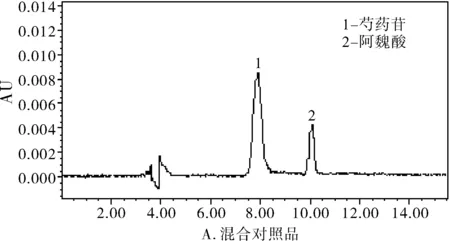
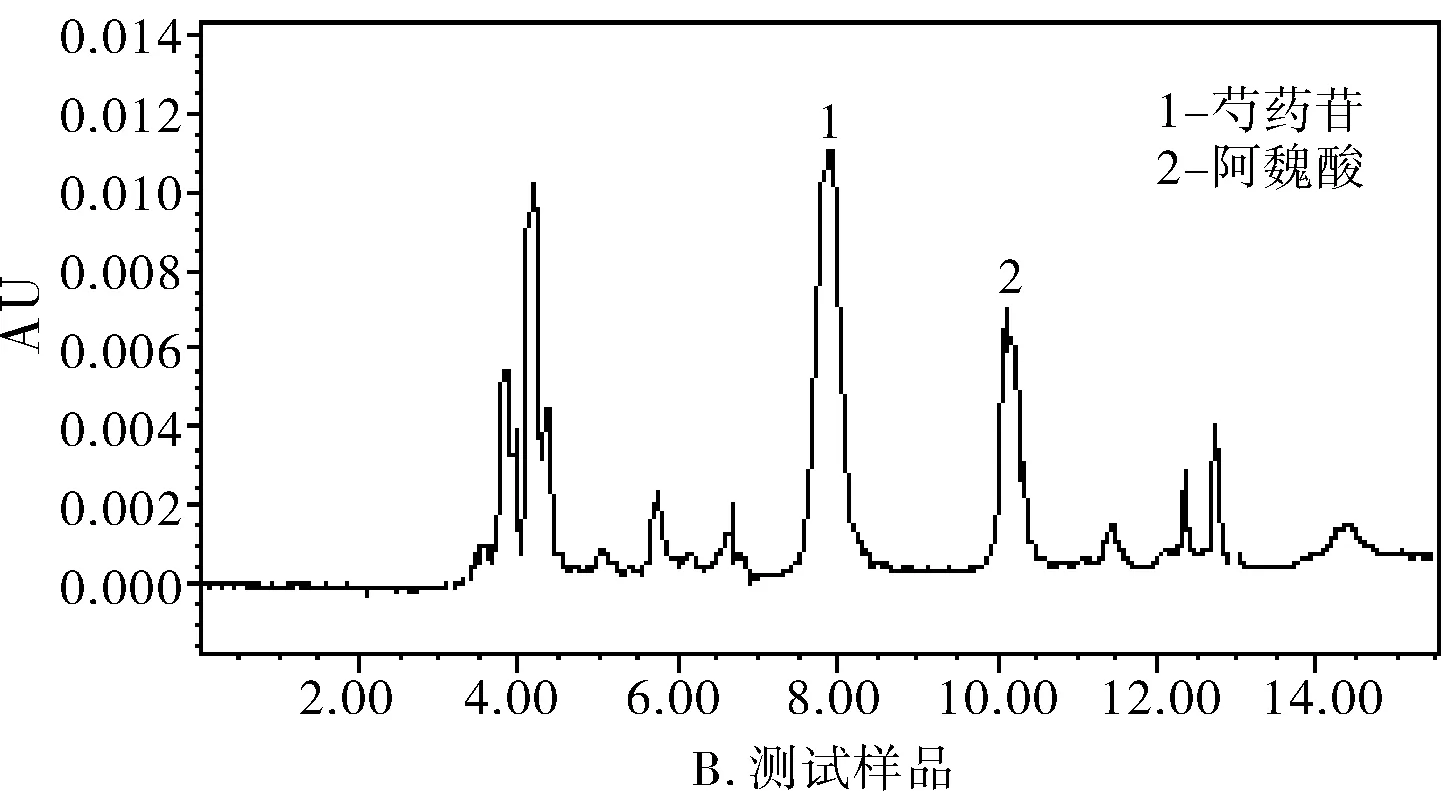
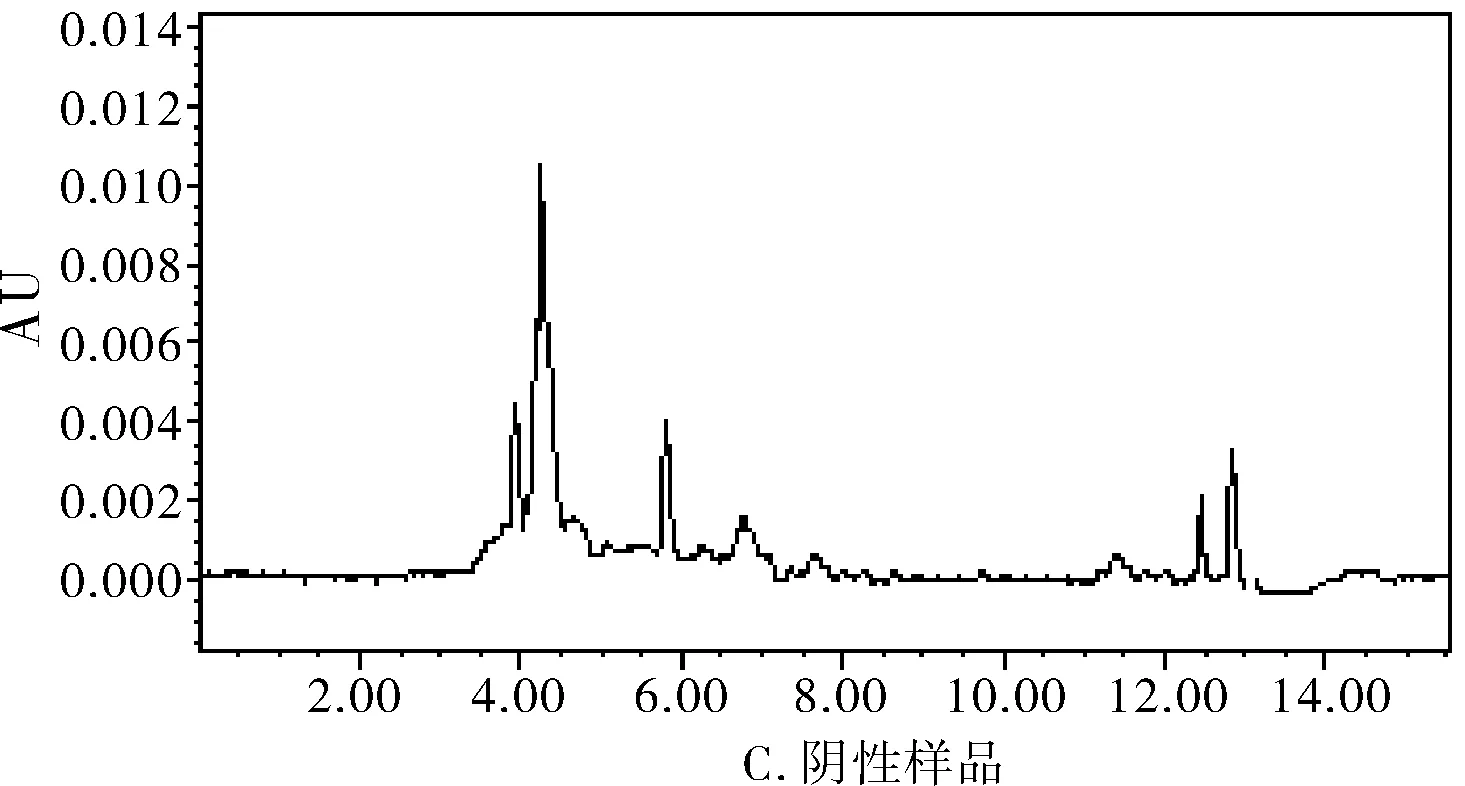
图1 高效液相色谱图
分别精密吸取对照品溶液、供试品溶液和阴性对照溶液各20 μL注入液相色谱仪,记录色谱图。结果表明,供试品色谱图中,在与对照品色谱峰相应的位置上有相同的色谱峰,主峰与其它色谱峰达到基线分离,阴性对照无此峰且无干扰,见图1。
2.3方法学考察
2.3.1线性关系考察
避光操作,精密吸取芍药苷对照品溶液(425.6 μg·mL-1)和阿魏酸对照品溶液(45.4 μg·mL-1)各0.2、0.5、1.0、2.0、3.0、5.0 mL分别置于10 mL棕色容量瓶中,用甲醇-0.1%磷酸溶液(40:60)稀释至刻度,混匀。分别吸取20 μL,依次注入液相色谱仪中,按上述色谱条件测定。以芍药苷、阿魏酸浓度(μg·mL-1)为横坐标,相对应的峰面积值为纵坐标,绘制标准曲线,线性回归方程分别为:
芍药苷: Y=2584.047X+184.283,r=0.9998
阿魏酸: Y=5937.543X-381.574,r=0.9999
结果表明,芍药苷在8.512~212.8 μg·mL-1、阿魏酸在0.908~22.7 μg·mL-1范围内具有良好的线性关系。
2.3.2精密度试验
分别吸取同一对照品溶液20 μL,重复进样6次,测定芍药苷、阿魏酸峰面积积分值,并计算各自的RSD,见表2,结果表明该方法精密度良好。
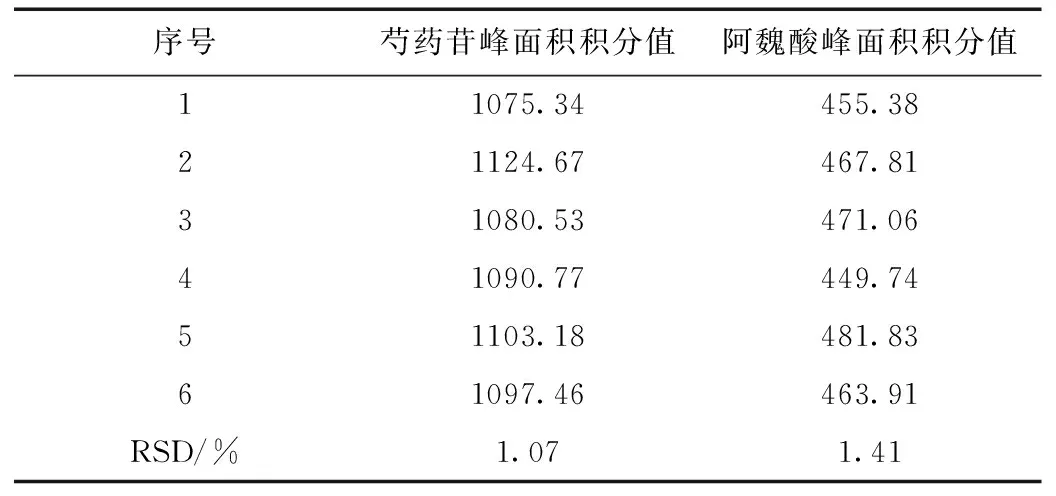
表2 精密度试验
2.3.3稳定性试验
避光操作,分别精密吸取供试品(批号20150709)溶液20 μL,于0、3、6、9、12、15 h按上述色谱条件进样测定,计算芍药苷与阿魏酸峰面积的RSD,见表3,结果表明在15 h内稳定性较好。
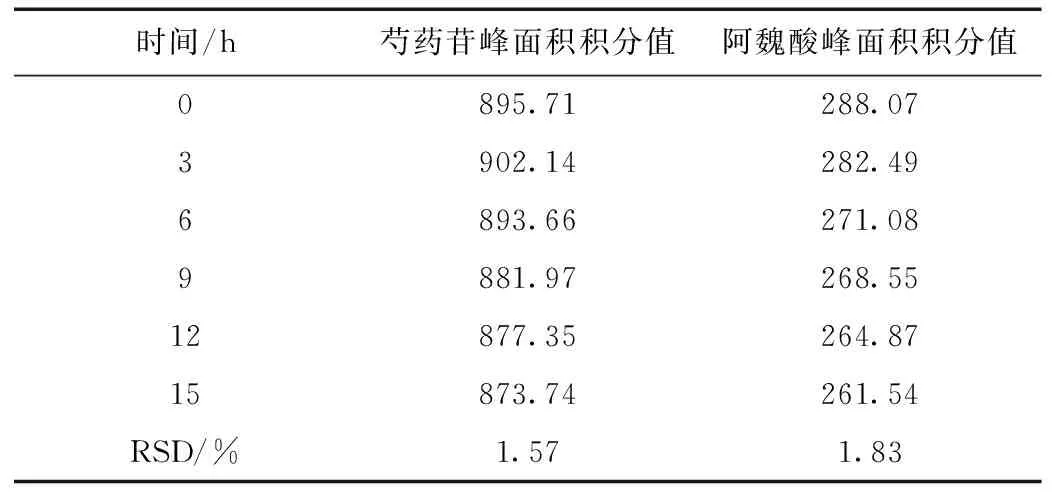
表3 稳定性试验(n=7)
2.3.4重复性试验
取同一样品(批号20150709)粉末6份,每份约1.0 g,精密称定,按供试品溶液制备项下操作,各精密吸取20 μL进样,测定芍药苷和阿魏酸的含量,并计算芍药苷和阿魏酸含量测定值的RSD,见表4,结果表明重复性良好。

表4 重复性试验(n=6)
续表4

61.490.040平均值1.470.035RSD/%0.921.13
2.3.5回收率实验
取已知含量(每克含芍药苷1.47 mg、阿魏酸0.035 mg)的本品(批号20150709)细粉6份,每份约1.0 g,精密称定,置具塞锥形瓶中,分成三组,每组分别精密加入芍药苷对照品溶液1.5、2.0、2.5 mL,阿魏酸对照品溶液0.5、1.0、1.5 mL,按供试品溶液制备项下操作,各精密吸取20 μL进样,测定芍药苷和阿魏酸的含量,计算回收率,结果见表5。
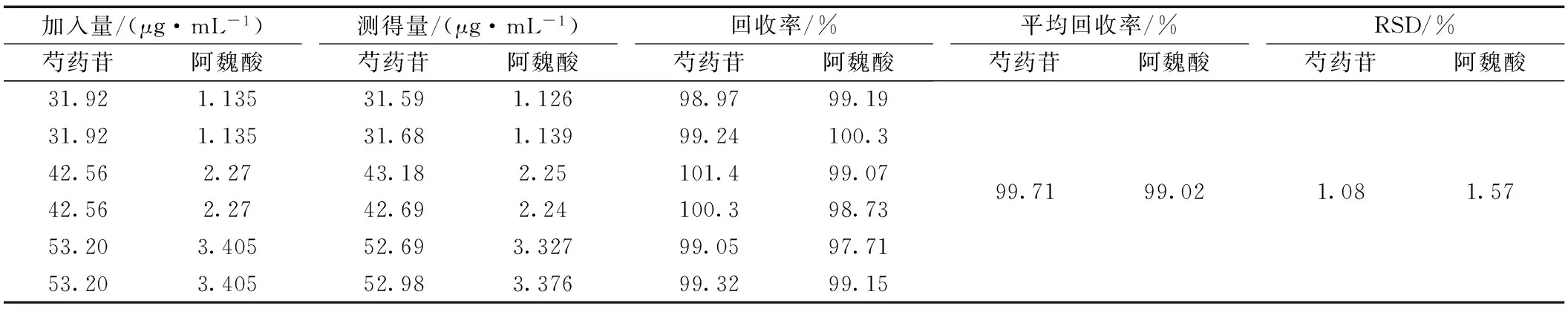
表5 加样回收试验结果(n=6)
2.3.6样品测定
取5批六味补血颗粒,按供试品溶液制备法依法制备样品溶液。分别精密量取样品溶液和芍药苷与阿魏酸的混合对照品标准溶液各20 μL进样,按上述色谱条件测定,外标法计算含量,测定结果见表6。

表6 样品含量测定结果(n=3)
3 讨 论
(1) 超声时间的考察 用该法对六味补血颗粒中芍药苷和阿魏酸的含量进行测定的过程中,比较了超声提取时间对芍药苷和阿魏酸含量测定的影响,试验中发现,超声提取40 min后,芍药苷和阿魏酸的含量基本不变,可认为提取完全。故将超声提取时间确定为40 min。
(2)保护措施的确定 阿魏酸是丙烯酸衍生物,性质不稳定,见光极易分解,但在酸性溶液中稳定性增强,故在对照品和样品溶液的制备过程中,采用酸化及避光操作等保护性措施。
(3) 检测波长的选择 采用紫外分光光度计对芍药苷与阿魏酸对照品溶液进行吸收扫描,发现芍药苷与阿魏酸的最大吸收分别在232 nm、320 nm,但二者在284 nm波长处均有较大吸收,因此,选择284 nm作为检测波长。
使用梯度洗脱法同时测量六味补血颗粒中芍药苷和阿魏酸的含量,可监控产品中3味主药材的质量。同时,该方法的准确度高,重现性好,操作简单,适用于六味补血颗粒的质量控制。
[1]利创华,林艳菲,丘思兰,等. 归芍调经口服液质量标准研究[J].湖北中医药大学学报,2013,15(3):43-46.
[2]张传平,吕紫璇,李洪斌. 反相高效液相色谱法测定冠心生脉丸中芍药苷含量[J].中国药业,2015,24(2):50-51.
[3]赵东平,杨文钰,陈兴福. 阿魏酸的研究进展[J]. 时珍国医国药, 2008,19(8):1839-1841.
[4]胡益勇,徐晓玉. 阿魏酸的化学和药理研究进展[J].中成药,2006,28(2):253-255.
[5]周祖坤,孙代华,凌飒. 高效液相色谱法测定当归芍药颗粒剂中芍药苷的含量[J].药物分析杂志,2006,26(7):1001-1003.
[6]王文渊,龙红萍,卜生高. HPLC同时测定六昧补血颗粒中芍药苷和阿魏酸的含量[J].湖南师范大学学报(医学版),2008,5(1):58-60.
Determination of Paeoniflorin and Ferulic Acid in Liuweibuxue Granules
LUChi-jiao1,WANGWen-yuan2
(1 Hunan Yongzhou Products Inspection Institute,Hunan Yongzhou 425100;2 Hunan Yongzhou Vocational Technical college,Hunan Yongzhou 425100, China)
An HPLC method for determination of Paeoniflorin and ferulic acid in Liuweibuxue granules was established. The analytical column was Platisil ODS (150 mm×4.6 mm) filled with at 5 μm stationary phase, using methanol-0.1%phosphoric acid gradient elution as mobile phase. The flow rate was 1.0 mL·min-1, the detection wavelength was 284 nm,and the column temperature was 25 ℃. Results showed that the linear range for Paeoniflorin and ferulic acid were 8.512~212.8 μg·mL-1(r=0.9998) and 0.908~22.7 μg·mL-1(r=0.9999), the average recovery was 99.71% (RSD=1.08%) for Paeoniflorin and 99.02% (RSD=1.57%) for ferulic acid. The method is simple, accurate and reproducible, and suitable to be used in quality control of liuweibuxue granules.
Lliuweibuxue granules; ferulic acid; Paeoniflorin; determination
鲁赤姣(1972-),女,工程师,从事产品质量分析检测。
R917
A
1001-9677(2016)010-0156-03
