喹啉季铵盐中氯和溴对其缓蚀性能的影响
2016-09-02李琛琛唐鋆磊李勇怀朱元强
王 虎,李琛琛,唐鋆磊,李勇怀,朱元强,景 亚
(1. 西南石油大学 油气藏与地质开发国家重点实验室,成都 610500; 2. 西南石油大学 材料科学与工程学院,成都 610500;3. 西南石油大学 化学与化工学院,成都 610500; 4. 中海油能源发展股份有限公司 上海环境工程技术分公司, 上海 200000)
喹啉季铵盐中氯和溴对其缓蚀性能的影响
王 虎1,2,李琛琛2,唐鋆磊3,李勇怀4,朱元强3,景 亚3
(1. 西南石油大学 油气藏与地质开发国家重点实验室,成都 610500; 2. 西南石油大学 材料科学与工程学院,成都 610500;3. 西南石油大学 化学与化工学院,成都 610500; 4. 中海油能源发展股份有限公司 上海环境工程技术分公司, 上海 200000)
以喹啉为母体,以氯化苄、溴化苄为季铵化试剂,制得两种喹啉季铵盐缓蚀剂。采用失重法、电化学方法、扫描电镜(SEM)及能谱分析(EDS)法考察两种缓蚀剂单独使用以及不同复配条件下的缓蚀性能。结果表明:溴化苄基喹啉(BQB)与增效剂复配后,其缓蚀率可以达到98.73%;在相同条件下BQB的缓蚀性能优于氯化苄基喹啉(BQC)的;两种喹啉季铵盐在碳钢表面的吸附符合Langmuir吸附等温式,是一个自发、放热的混合吸附过程;BQC的吉布斯吸附自由能和活化能均大于BQB的。
缓蚀剂;喹啉季铵盐;吸附机理
在酸性条件下,喹啉类衍生物的缓蚀效果好,是最常用的缓蚀剂之一。由于喹啉在水溶液中的溶解度很低,通常需要将其季铵化[1],从油溶性转变为水溶性的季铵盐。而季铵化试剂会对喹啉季铵盐的缓蚀性能产生一定影响。季铵化试剂中的卤素元素对喹啉季铵盐产生的影响可通过改变季铵化程度、水溶性大小[2]、电离度,以及卤素元素的配位能力来实现。虽然前人大量研究了卤族离子与缓蚀剂之间的复配合协同作用[3],但各种缓蚀剂的使用条件差别巨大,所以结论并不完全一致。例如,吡啶可以与卤素离子(Cl-,Br-,I-)在酸介质中产生协同作用[4],并且通常的协同效果的顺序是Cl- 为了探究不同卤族季铵化试剂对喹啉季铵盐缓蚀剂的作用,本工作合成了两种喹啉季铵盐,用静态失重法、电化学方法、扫描电镜(SEM)及能谱方法(EDS)系统地研究了氯化苄基喹啉(BQC)及溴化苄基喹啉(BQB)对碳钢在1 mol/L硫酸溶液中的缓蚀性能差异;并计算两种缓蚀剂在1 mol/L硫酸溶液中的动力学及热力学参数,对两种缓蚀剂的吸附方式和缓蚀机理进行了研究,分析了其缓蚀效果产生差异的原因,为此类缓蚀剂的设计、开发和优化提供参考。 1.1喹啉季铵盐的合成 在250 mL三口烧瓶中,加入1 mol喹啉,搅拌,缓慢升温至50 ℃,慢慢滴加0.8 mol季胺化试剂(氯化苄或溴化苄),滴加完成后在90 ℃下保温8 h;达到设定的反应时间后,将温度降至78 ℃,逐滴滴加无水乙醇至反应产物恰好完全溶解,冷却至室温,减压重结晶得到两种喹啉季铵盐。 1.2喹啉季铵盐的缓蚀性能评价 1.2.1 静态挂片失重 参考JB /T7901-1999《金属材料实验室均匀腐蚀全浸试验方法》,以1 mol/L硫酸为腐蚀介质,对碳钢进行静态挂片失重试验,温度设定为20,40,60,80 ℃,时间4 h。 1.2.2 电化学测量 电化学测试在IVIUM电化学工作站上进行。采用标准三电极电解池,工作电极为碳钢电极,辅助电极为铂电极,参比电极为套有卢金毛细管的饱和甘汞电极(SCE),试验温度为20 ℃。将工作电极在1 mol/L硫酸溶液中浸泡0.5 h,待开路电位稳定后进行测试。极化曲线测试中扫描范围为自腐蚀电位附近±250 mV,扫描速率0.3 mV/s。电化学阻抗谱测试扰动电位振幅为±10 mV,测试在自腐蚀电位(OCP)下进行,频率范围为10-2~105Hz。以下电位若无特指均相对于参比电极而言。 1.2.3 扫描电镜及能谱测试 将经打磨抛光、去油、干燥后A3钢片分别放入空白和加了缓蚀剂的1 mol/L硫酸溶液中,在60 ℃中试验4 h后取出,用大量去离子水冲洗、干燥后采用扫描电子显微镜观察腐蚀后试样表面形貌,用X射线能谱仪(EDS)进行分析。 2.1静态挂片失重试验结果 2.1.1 不同温度下的缓蚀性能 图1为四种温度条件下添加不同量BQC及BQB的1 mol/L硫酸中静态失重试验结果。从图中可以看出,缓蚀率随着缓蚀剂添加量的增加明显升高并逐渐趋于平稳,且相同条件下的BQC的缓蚀率明显高于BQB的。 2.1.2 缓蚀剂的复配 将500 mg/L BQC及BQB分别与乌洛托品(50 mg/L)、丙炔醇(50 mg/L)、烯丙硫醇(50 mg/L)在80 ℃下进行复配,利用缓蚀剂之间的协同效应提高缓蚀剂的缓蚀率和经济效益,同时考察氯溴在不同协同作用下的差异。从表1中可以看出,复配后BQC和BQB的缓蚀率显著提高,分别由原来的68.77%和80.71%提高到95%以上。在乌洛托品-丙炔醇的体系中,BQB的协同作用明显强于BQC的,而在乌洛托品-烯丙硫醇的体系中,BQB的协同作用虽然也强于BQC的,但两者之间的差异很小。 表1 BQC及BQB加入复配剂后的缓蚀性能 2.2电化学测试结果 2.2.1 极化曲线 在添加不同量BQC及BQB的硫酸溶液中,碳钢的极化曲线如图2。相关的电化学参数采用电化学工作站中Model模型法进行分析,数据列于表2。从图2以及表2中可以看出,碳钢表面极化曲线的自腐蚀电位都有不同程度的正移,阳极区腐蚀电流密度逐渐减小,腐蚀溶解作用减弱,阴极区阴极极化电流密度也显著降低,阴极还原作用也被抑制。当添加的缓蚀剂量相同时,可以明显看出加入BQB后的腐蚀电流小于加入BQC后的,其缓蚀效率更高。复配乌洛托品、烯丙硫醇后的腐蚀电流明显小于复配乌洛托品、丙炔醇后的。 2.2.2 电化学阻抗谱 图3显示了在20 ℃下碳钢在含有不同量缓蚀剂的1 mol/L硫酸溶液中的Nyquist图。在图谱中的高频区可以看到一些不规则的容抗弧,容抗弧反映了电极表面BQC和BQB所形成膜的电化学性质,阻抗谱中半圆直径反映了电极反应的电化学阻抗大小。由图可见,容抗弧随着硫酸溶液中缓蚀剂添加量的增加而逐渐变大,说明随着更多的BQC及BQB分子在碳钢上的吸附,腐蚀反应中电子传递的阻力不断增大,腐蚀反应越难进行;缓蚀剂的质量浓度在100~2 000 mg/L时,相同质量浓度下BQB的容抗弧都大于BQC的,说明BQB的缓蚀性能要优于BQC的。BQC和BQB复配之后,任何条件下容抗弧均显著增大。乌洛托品-丙炔醇复配体系的容抗弧大于单独添加1 000 mg/L BQC或BQB的;乌洛托品-烯丙硫醇复配体系的容抗弧大于单独添加2 000 mg/L BQC或BQB的。 2.3扫描电镜及能谱分析 由图4可以看出,空白溶液中金属表面发生了严重的腐蚀,添加500 mg/L BQC及BQB后,金属表面的腐蚀得到了很大程度的抑制;在复配乌洛托品、烯丙硫醇以后,腐蚀进一步减弱。 由表3可知,在空白溶液中浸泡后A3钢含有氧(9.71%)以及少量的硫元素,说明试片表面存在铁的氧化物及硫酸亚铁盐腐蚀产物。加入500 mg/LBQC及BQB后,氧含量显著下降(2.56%和1.97%),表明腐蚀产物减少,说明加入的缓蚀剂起到了明显的保护作用。在复配乌洛托品、烯丙硫醇以后,氧的含量进一步下降,此时A3钢仅发生很轻微的腐蚀。 表3 A3钢在不同溶液中浸泡后的EDS结果(质量分数) 2.4缓蚀剂的吸附动力学及热力学计算 对缓蚀剂加量在500 mg/L时腐蚀速率的对数和1/T进行直线拟合,拟合的相关系数(r)十分接近1,说明在此条件下两种缓蚀剂吸附动力学符合阿伦尼乌斯动力学模型。碳钢在此条件下的活化能可以根据以下推导公式[6]求出: (1) 式中:Wcorr为腐蚀速率;K为腐蚀速率常数;Ea为活化能;R为气体常数;T为热力学温度。 通过计算,在不加缓蚀剂的1 mol/L硫酸中碳钢的活化能为53.71 kJ/mol,加入500 mg/L BQC后活化能为72.28 kJ/mol,加入500 mg/L BQB后活化能为73.49 kJ/mol。未加缓蚀剂时Ea最小,添加缓蚀剂后Ea增大,加入等量BQB比BQC活化能更高,缓蚀率也更高。因为Ea越大,腐蚀反应越难进行,反应物必须获得大于Ea的能量变成活化状态,才能越过能垒生成腐蚀产物[7]。 (2) 式中:R为气体常数;T为热力学温度;Kads为吸附平衡常数;55.5为水的浓度(单位为mol/L)。 (3) (4) 式中:C为常数。 表4 不同温度下BQC及BQB的吸附热力学参数 试验结果也表明溴化季铵盐的缓蚀效果更好,说明Br-对缓蚀剂的性能起到了促进作用。对于氯化苄基季铵盐,BQC分子在酸中电离出分子量较大的季氮阳离子和分子量较小的无机Cl-,由于Cl-具有电负性,在碳钢表面产生吸附,使季氮阳离子能够通过静电引力吸附在钢片表面;季氮阳离子中含有两个苯环结构,具有较高的电子云密度,且和铁原子的d空轨道形成配位键,产生强烈的化学吸附[10]。与BQC相比,BQB在酸性溶液中含有电子云半径相对较大的Br-,Br-和Cl-在界面处起到相似的作用,但Br-电负性较低,其配位能力比Cl-更好,因此有助于其在钢表面的吸附[11]。从离子半径或者是电子云的角度来观察,Br-的电子云更容易变形从而与铁发生成键作用[12],进而促进BQB整体在钢片表面的吸附,提高缓蚀剂的覆盖度,缓蚀率也就更高。 在复配体系中的电化学测试与腐蚀挂片结果均显示BQB的性能优于BQC,说明在复杂协同体系中,卤族元素对喹啉季铵盐的影响作用仍然存在。所以实际应用中使用BQB代替BQC可以有效地提高缓蚀性能,而BQB-乌洛托品-烯丙硫醇复配体系在BQB加入量仅500 mg/L的条件下即可在80 ℃的1 mol/L硫酸溶液中使缓蚀率达到98.73%,与传统复配缓蚀剂配方相比性能更为优异。乌托洛品是有机胺,其极性基——胺基与水中的氢离子结合[13],生成带有正电荷的离子(RNH3)+在铁表面吸附。烯丙硫醇分子中的巯基容易与金属离子络合形成稳定的化合物,覆盖在金属表面形成保护膜[14];丙炔醇中-C≡CH同样容易吸附在金属表面,形成一层致密的保护层[15]。因此除卤族元素协同作用差别之外,喹啉季铵盐-乌托洛品-烯丙硫醇体系的综合协同作用使得保护膜更加稳定,耐蚀效果优异。 (1) BQC及BQB对碳钢在1 mol/L硫酸溶液中腐蚀具有较好的抑制作用,缓蚀率随着缓蚀剂质量浓度的升高而提高,在相同质量浓度下BQB的缓蚀率高于BQC的,而且在不同的复配体系中,BQB的性能也是优于BQC的。 (2) BQC及BQB分子在碳钢表面的吸附满足Langmuir吸附等温式,标准自由能和标准吸附焓数据表明吸附过程为一自发、放热的混合吸附过程。在相同条件下BQB的活化能高于BQC的。 (3) 溴元素相比氯元素对喹啉季铵盐缓蚀剂性能有更大的促进作用,并且BQB-乌洛托品-烯丙硫醇复配体系可在加量较少的情况下即达到98.73%的缓蚀率,缓蚀性能突出,有较好的应用前景。 [1]藤厚开. 新型缓蚀剂的合成及在海上采油系统防腐中的应用研究[D]. 天津:天津大学,2001. [2]王红. 咪唑啉缓蚀剂的合成及性能评价[D]. 四川:西南石油大学,2008. [3]王静,汤兵,陈欣义. 酸洗缓蚀协同机理研究与进展[J]. 腐蚀与防护,2007,28(5):217-220. [4]李向红. 缓蚀剂研究现状及展望[J]. 清洗世界,2006,22(12):18-23. [5]罗胜联,陈金华,陈凡,等. 卤素离子与苯并三氮唑协同成膜动力学的体声波传感技术研究[J]. 湖南大学学报(自然科学版),2002,29(1):52-57. [6]MISTRY B M,SAHOO S K,JAUHARI S. Experimental and theoretical investigation of 2-mercaptoquinoline-3-carbaldehyde and its schiff base as an inhibitor of mild steel in 1M HCl[J]. Journal of Electroanalytical Chemistry,2013,7:118-129. [7]MARTINE S,STERNT I. Thermodynamic characterization of metal dissolution and inhibitor adsorption processes in the low carbon steel-mimosa tannin/sulfuric acid system[J]. Applied Surface Science,2002,199(1/4):83-89. [8]HOHENBERG P,KOHN W. Inhomogeneous electron gas[J]. Physical Review,1964,136:864-871. [9]陈怀兵,李养池,张新发,等. 油酸基咪唑啉缓蚀剂缓蚀性能和量子化学计算[J]. 腐蚀与防护,2014,35(12):1234-1238. [10]蒋平,赵力云,万朝晖,等. 喹啉季铵盐缓蚀性能评价[J]. 油田化学,2011,28(2):219-223. [11]RAWAT N S,UDAYABHANU G. Synergistic effects of halide ions and benzyl amine on electrochemical behaviour of mild steel in dilute sulfuric acid[J]. Key Engineering Materials,1991(20/28):2963-2970. [12]GOMMA G K. Corrosion of low-carbon steel in sulphuric acid solution in presence of pyrazole-halides mixture[J]. Materials Chemistry and Physics,1998,55(3):241-246. [13]王成,江峰,王福会. 有机胺对铝合金在3.5%氯化钠溶液中的缓蚀作用[J]. 腐蚀与防护,2003,24(4):139-142. [14]冉润欣,范晓丽,杨永亮,等. 不同覆盖度下丙硫醇在Au(111)面吸附的理论研究[J]. 物理学报,2013,62(22):101-104. [15]王新刚,王晶,张波,等. 油酸基咪唑啉类缓蚀剂的复配及其缓蚀性能研究[J]. 材料保护,2008,41(1):20-23. Effects of Chlorine and Bromine in Quinoline Quaternary Ammonium Salts on Its Corrosion Inhibition Performance WANG Hu1,2, LI Chen-chen2, TANG Jun-lei3, LI Yong-huai4, ZHU Yuan-qiang3, JING Ya3 (1. State Key Laboratory of Oil and Gas Reservoir Geology and Exploitation, Southwest Petroleum University,Chengdu 610500, China; 2. College of Materials Science and Engineering, Southwest Petroleum University,Chengdu 610500, China; 3. College of Chemistry and Chemical Engineering, Southwest Petroleum University,Chengdu 610500, China; 4. Shanghai Environmental Engineering Technology Company, CNOOC Energy Technology Co., Ltd., Shanghai 200000, China) Two different quinoline quaternary ammonium salts were successfully synthesized using quinolone as matrix, benzyl chloride and benzyl bromide as link agents respectively. Weight loss measurement, electrochemical testing, electron scanning microscopy (SEM) and energy dispersive spectroscopy (EDS) were used to evaluate the corrosion inhibition performance in individual use and compound use of the two inhibitors. The experiment results show that benzyl quinolinium bromide (BQB) compound with synergistic agent had an inhibition efficiency of 98.73% and the corrosion inhibition performance of BQB is better than that of benzyl quinolinium chloride (BQC). The adsorption of BQC and BQB molecules on carbon steel surface is a spontaneous and exothermic process which obeys the Langmuir isothermal adsorption model. However, the Gibbs free energy and the activation energy of BQB are higher than those of BQC. inhibitor; quaternary ammonium salt; adsorption mechanism 10.11973/fsyfh-201604011 2015-02-04 唐鋆磊(1983-),副教授,博士,从事腐蚀与防护技术研究,028-83037361,tangjunlei@126.com TG174.42 A 1005-748X(2016)04-0321-061 试验
2 结果与讨论


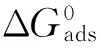
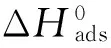
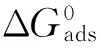
3 结论
