响应面法优化徽州大黄菊总黄酮提取工艺
2016-09-01韩成云赵志刚邹磊江西省天然药物活性成分研究重点实验室江西宜春336000宜春学院化学与生物工程学院江西宜春336000宜春学院生命科学与资源环境学院江西宜春336000
韩成云,赵志刚,邹磊(1.江西省天然药物活性成分研究重点实验室,江西宜春336000;.宜春学院化学与生物工程学院,江西宜春336000;3.宜春学院生命科学与资源环境学院,江西宜春336000)
响应面法优化徽州大黄菊总黄酮提取工艺
韩成云1,2,赵志刚3,*,邹磊2
(1.江西省天然药物活性成分研究重点实验室,江西宜春336000;2.宜春学院化学与生物工程学院,江西宜春336000;3.宜春学院生命科学与资源环境学院,江西宜春336000)
利用响应面法优化徽州大黄菊总黄酮的提取条件,以纯水为溶剂,选取料液比、浸提时间和浸提温度进行三因素多水平分析,用紫外分光光度计法测量样品中总黄酮的含量。结果显示,在料液比为1∶68(g/mL),浸提时间在38min,浸提温度为87℃时菊花中总黄酮含量最高,其含量是28.609 mg/g,为徽州大黄菊功能活性成分的提取及综合利用提供理论参考。
菊花;水提取法;总黄酮;响应面分析
菊花是属于菊科多年生草本植物菊(Chrysanthemum morifolium ramat)的干燥头状花序[1],我国主要栽培的品种有滁菊、杭菊、怀菊、济菊、贡菊、黄菊、祁菊、亳菊等八大种类,主产于河南、安徽和浙江等省份[2-3]。本文所研究的徽州大黄菊(黄菊),原产安徽省黄山市歙县深山,花朵大,颜色黄,既具有观赏价值,又具有一定的药用功能。该品种集色、香、味、型于一体,味道清香甘爽,具有养肝明目、生津止渴、宁心安神、清凉解毒之功能。
利用菊花冲泡中溶解的黄酮类物质是一类主要的有效成分,它是包括木犀草素(Luteohn)、刺槐苷(A-caciaglucoside)、矢车薄苷(Chrysan themin glucoside)等的混合物质,这些物质具有抗氧化、防治心血管疾病以及抗肿瘤等多种药理功效[4-6]。
一般提取物质最佳条件找寻中,常会用到响应面分析(response surface method,RSM)法[7-8],该方法是在多因素数量处理试验的分析中,通过分析试验指标(因变量)与多个试验因素(自变量)间的回归关系,并采用多元二次回归方程来拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法[9]。
目前关于菊花总黄酮提取方法的文献报导,研究多采用乙醇做溶剂浸提[10-13],依据阮俊等[14]的研究报道,采用乙醇提取法的总黄酮含量(3.37%)略优于水提法(3.29%)。综合成本与生产实践,及菊花主要作为饮品原料等特质因素,采用水提法可以更好地进行工艺操作。因此本研究选取徽州大黄菊作为研究对象,以纯水为溶剂,选取料液比、浸提时间和浸提温度等因素,利用响应面法对菊花总黄酮含量进行分析,分析结果可为徽州大黄菊功能活性成分的提取及综合利用提供理论参考。
1 试验材料、试剂及仪器
1.1材料与试剂
徽州大黄菊:由江西隆平有机农业有限公司提供。
70%C2H5OH:量取无水C2H5OH 70 mL,加30 mL去离子水,摇匀,室温保存;30%C2H5OH:量取无水C2H5OH 30mL,加70mL去离子水,摇匀,室温保存;5% NaNO2对照液:称取NaNO25.00 g,加95 mL去离子水,溶解,室温保存;4%NaOH:称取NaOH 4.00 g,加96 mL去离子水,溶解,室温保存;10%Al(NO3)3:称取Al(NO3)310.00 g,加90 mL去离子水,溶解,室温保存;芦丁对照品:用60%C2H5OH配制0.1 mg/mL的对照液。试剂均为分析纯。
1.2主要仪器

表1 主要实验仪器设备Table 1 The main experimental apparatus and equipment
1.3方法
1.3.1响应面试验设计
在菊花产品的浸提过程中,料液比、浸提时间、以及浸提温度都会影响浸提溶液中菊花有效物质总黄酮含量的提取率。因此,本试验首先选取菊花冲泡过程常见的浸提温度(70℃~100℃)、浸提时间(10 min~40 min)和料液比[1∶30(g/mL)~1∶70(g/mL)]3个因素分别进行单因素试验,研究其对总黄酮提取率的影响。再根据单因素试验结果,以料液比(A)、浸提时间(B)、浸提温度(C)3个因素做响应面分析试验(表2),找出浸提工艺最佳条件。

表2 响应面设计方案Table 2 Response surface experimental design
1.3.2菊花总黄酮含量检测方法
1.3.2.1标准曲线的绘制[3]
用60%C2H5OH配制0.1 mg/mL的芦丁对照液。分别精确吸取芦丁对照液0.00、0.50、1.00、2.00、3.00、4.00、5.00 mL于试管中:
1)加入5%NaNO2溶液0.30mL,摇匀,静置6.0min;
2)加10%Al(NO3)3溶液0.30 mL,摇匀,静置6.0 min;
3)加入4%NaOH溶液4.00 mL;
4)依次分别加入5.40、4.90、4.40、3.40、2.40、1.40、0.40 mL 60%C2H5OH使反应液体积达到10 mL,摇匀,静置12.0 min;
5)测定510 nm处吸光值。
选取对照样液浓度做X轴,样液在510 nm处的吸光度(OD510nm)做Y轴,如图1所示。

图1 芦丁标准曲线Fig.1 The standard curve of rutin
由此算出回归方程,y=10.153x+0.016 6(R2=0.9985)结果显示芦丁在0~0.05 mg/mL范围内与吸光值有比较理想的线性关系。
1.3.2.2总黄酮含量的测定[15]
1)准确称取菊花样品1.0 g,加入超纯水30 mL,在一定温度水浴锅中分别浸提一定时间后抽滤,用70% C2H5OH溶液洗涤到100 mL的容量瓶中,定容,摇匀震荡后备用;
2)精确吸取供试样品溶液3 mL于10 mL容量瓶中,用30%的C2H5OH溶液定容至刻度;
3)分别精确吸取2mL于10mL试管中,加5%NaNO2溶液0.3 mL,震荡摇匀放置6 min,加10%Al(NO3)30.3 mL,震荡摇匀,放置6 min;
4)加4%NaOH溶液4 mL,震荡摇匀,用30%C2H5OH溶液定容至刻度,震荡摇匀;
5)放置15 min后置于比色皿中在510 nm处测定吸光值,以30%C2H5OH溶液做空白对照,再由标准曲线计算出总黄酮含量。
6)重复两次上述试验,控制单因素料液比,改加50、70 mL超纯水。
2 结果与分析
2.1单因素分析
2.1.1浸提时间对总黄酮含量的影响
在浸提温度80℃,料液比1∶30(g/mL)的条件下,将浸提时间分别设定为5、10、15、20、25、30、40 min进行试验,结果见图2。

图2 浸提时间对总黄酮含量的影响Fig.2 Effect of extraction time on total flavonoids content
通过图2可以看出,总黄酮含量随着时间的延长呈不断上升趋势,这主要是随着时间的增加,浸提液中菊花的总黄酮等物质不断析出,时间在30 min~40 min时,趋势基本稳定,表明在30 min左右总黄酮含量析出达到最大水平,因此,响应面设计的浸提时间初步定在10 min~40 min较为合适。
2.1.2浸提温度对总黄酮含量的影响
在浸提时间25 min,料液比1∶30(g/mL)的条件下,将浸提温度分别设定为70、75、80、85、90、100℃进行试验,结果见图3。

图3 浸提温度对总黄酮含量的影响Fig.3 Effect of extraction temperature on total flavonoids content
通过图3可以看出,总黄酮含量随着温度的升高先表现不断升高,在90℃后呈快速下降的趋势,这表明在一定温度下,总黄酮类物质随温度升高分子运动加剧,析出的量因此不断增加,超过一定温度后,随温度升高总黄酮含量降低,可能是由于高温造成了总黄酮类物质某些成分降解,因此,响应面设计的浸提时间初步定在70℃~100℃较为合适。
2.1.3料液比对总黄酮含量的影响
在浸提温度80℃,浸提时间25 min的条件下,将料液比分别设定为1∶30、1∶40、1∶50、1∶60、1∶70(g/ mL)进行试验,结果见图4。

图4 料液比对总黄酮含量的影响Fig.4 Effect of solid-liquid ratio on total flavonoids content
通过图4可以看出,总黄酮含量随着料液比的增加呈现先升高后下降的趋势,数据显示,在料液比为1∶60(g/mL)处达到最高值,这表明在设定浸提温度和时间下,随着料液比的增加,菊花总黄酮溶出速率增加,溶出的量相应增加,在料液比1∶60(g/mL)左右条件下有效成分浸出比较充分,而继续增加溶液会相应稀释总黄酮量,出现下降趋势。因此,响应面设计的料液比初步定在1∶30(g/mL)~1∶70(g/mL)较为合适。
2.2响应面分析
在以上单因素试验的基础上选取料液比(A)、浸提时间(B)和浸提温度(C)作为自变量,黄菊花总黄酮含量(Y)作为响应值,利用Design-Expert 8.0.5软件,按照Box-Behnken进行响应面分析试验,试验设计方案及结果见表3所示。
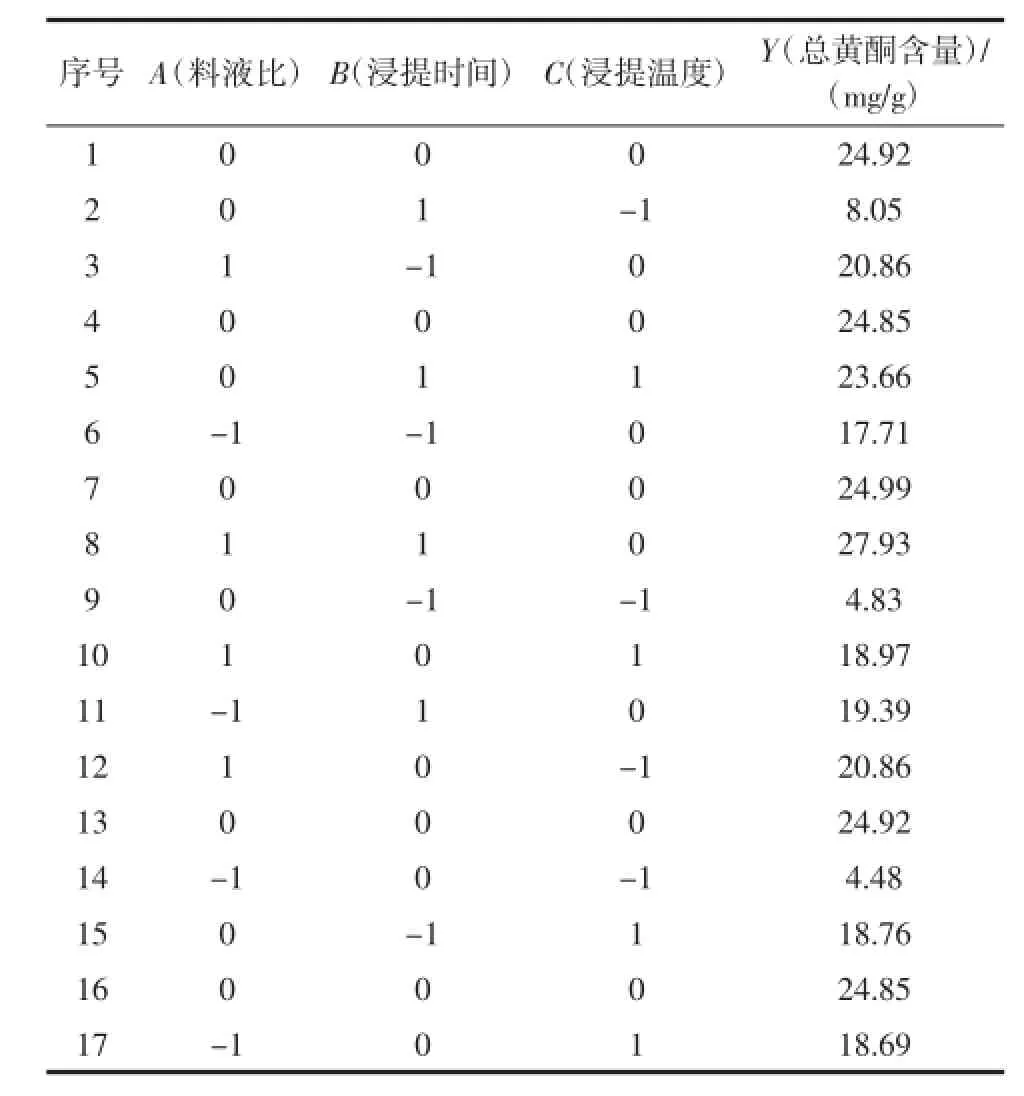
表3 响应面试验设计方案及结果Table 3 Response surface experimental design and results
对表3的试验结果进行响应面分析,经回归拟合,各因素对响应值的影响可用以下公式表示:
Y=24.91+3.54A+2.11B+5.23C+1.35AB-4.03AC+ 0.4BC-0.75A2-2.68B2-8.40C2
并对回归模型进行方差分析,结果见表4。

表4 回归分析结果Table 4 Results of regression analysis
根据回归分析结果可以看出,模型回归R2=0.950 7,表明该模型与实际拟合较好,自变量(液料比、浸提时间和浸提温度)与响应值(总黄酮含量)之间线性关系显著。同时结果还表明,浸提温度的一次项、二次项和液料比的一次项均达到极显著水平(P<0.01);浸提时间的一次项和料液比与浸提温度的交互作用影响也较为显著(P<0.05);此外,各因素对总黄酮含量提取的影响次序分别为:浸提温度二次项>浸提温度一次项>液料比一次项>料液比与浸提温度的交互作用>浸提时间一次项。
保持试验条件的3个变量中的1个变量在0水平不变,另外2个变量在相应范围内变化,作响应面图进行分析。

图5 料液比和浸提时间交互作用响应面Fig.5 Response surface plots of interaction between solid-liquid ratio and extraction time
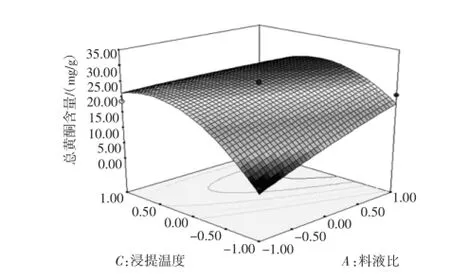
图6 料液比和浸提温度交互作用响应面Fig.6 Response surface plots of interaction between solid-liquid ratio and extraction temperature
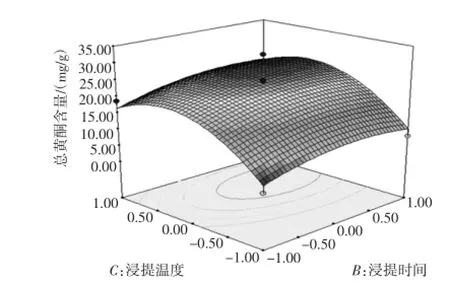
图7 浸提时间和浸提温度交互作用响应面Fig.7 Response surface plots of interaction between extraction time and temperature
由图5~图7可以看出,当浸提温度一定时,总黄酮含量随料液比和浸提时间的增大出现先升高后下降的趋势;当浸提时间一定时,总黄酮含量随料液比和浸提温度的增大出现快速上升后略有下降的趋势;当料液比一定时,总黄酮含量随浸提时间和浸提温度的增大先升高后缓慢下降。为进一步确定最佳点,再对回归模型求一阶偏导,解得最优参数为:A=0.92、B= 0.89、C=0.14;带入之前的变换公式得出:料液比1∶68.4(g/mL)、时间38.35 min、温度87.10℃,此时总黄酮含量为28.609 mg/g。表明该条件下总黄酮含量提取效果最佳。考虑到实际操作,将工艺参数修正为料液比1∶68(g/mL)、时间38 min、温度87℃,在此条件下总黄酮含量为28.595 mg/g,与理论值很接近,表明该数学模型对优化徽州大黄菊总黄酮含量的提取工艺是可行的。
3 结论
本研究以徽州大黄菊为原料,以纯水作为浸提溶剂提取,采用单因素试验为基础,并借助响应面分析法,选取料液比、浸提时间和浸提温度进行三因素多水平分析,优化总黄酮的提取工艺,确定最优提取参数为:料液比1∶68(g/mL)、时间38 min、温度87℃,在此条件下总黄酮含量为28.609 mg/g,为大黄菊功能活性成分的提取及综合利用提供理论参考。
[1]韩波.菊花干燥工艺研究[D].保定:河北大学,2011
[2]田耀平.神农香菊生药学与化学成分的研究[D].武汉:湖北中医药大学,2007
[3]张建勇,江和源,袁新跃,等.菊花总黄酮、多酚及水浸出物含量分析[J].中国农学通报,2010,26(9):102-105
[4]Chang X Q,Ding L X.Manual of analysis of active component in Chinese Nateria Medica[M].Beijing:Xueyuan press,2002
[5]王芳.菊花化学成分的研究进展[J].中国新医学论坛,2008,8(3): 23-24
[6]国家药典委员会.中华人民共和国药典:一部[S].北京:化学工业出版社,2000
[7]Douglas C,Montgomery.Design and Analysis of Experiments[S].汪仁官,陈荣昭,译.北京:中国统计出版社,1998
[8]王振忠,武文洁.野菊花总黄酮提取工艺的响应面设计优化[J].时珍国医国药,2007,18(3):648-650
[9]李稳宏.款冬花多糖提取纯化工艺研究及结构鉴定[D].西安:西北大学,2010
[10]罗显华,郁建生.野菊花总黄酮的提取与纯化[J].食品科技,2008,33(7):179-183
[11]陈维佳.野菊花化学成分及总黄酮提取工艺研究[D].济南:山东中医药大学,2009
[12]陈菡.野菊花总黄酮的提取及萃取精制研究[D].杭州:浙江大学,2012
[13]崔援军,蔡中琴,臧文华,等.正交设计优选怀菊花总黄酮提取工艺[J].河南中医学院学报,2006(3):33-34
[14]阮俊,黄永林.野菊花总黄酮提取方法研究[J].中成药,2004,26(2):69-70
[15]徐文斌,郭巧生,李彦农,等.药用菊花不同栽培类型内在质量的比较研究[J].中国中药杂志,2005,30(21):5-8
Optimization of Extraction for Flavonoids from Huizhou Chrysanthemum by Response Surface Method
HAN Cheng-yun1,2,ZHAO Zhi-gang3,*,ZOU Lei2
(1.Key Laboratory of Natural Active Pharmaceutical Constituents of Jiangxi Province,Yichun 336000,Jiangxi,China;2.College of Chenmistry and Biology Engineering,Yichun University,Yichun 336000,Jiangxi,China;3.Life Science and Resources and Environment,Yichun University,Yichun 336000,Jiangxi,China)
Response Surface Method(RSM)was applied to optimize the extraction condition of flavonoids from Chrysanthemum.With pure water as a solvent,the influence factors of ratio of liquid to solid,extraction time,extraction temperature were evaluated.Total flavonoid content of the sample was measured by UV spectrophotometer.The optimum extraction conditions were confirmed as follows:1∶68(g/mL)in solid-liquid ratio,extraction time 38 min,extraction temperature was 87℃.The extraction rate of flavonoids under this condition was the highest.Its content was 28.609 mg/g.The results provide a theoretical basis for the extraction and utilization of the active ingredient of Huizhou Chrysanthemum.
Chrysanthemum;water extracts;flavonoids;response surface analysis
10.3969/j.issn.1005-6521.2016.13.009
江西省高校十二五重点学科基础研究资助项目(作物遗传育种学);2013国家园艺综合改革项目(ZG0273)
韩成云(1981—),女(汉),副教授,博士,主要从事植物活性成分提取及开发等研究工作。
2015-07-04
