家酿葡萄汁饮品中优势酵母菌的分离鉴定
2016-09-01姚璐晔张琪沈博文李欣怡董骏王开方田嘉龙常熟理工学院生物与食品工程学院江苏常熟215500
姚璐晔,张琪,沈博文,李欣怡,董骏,王开方,田嘉龙(常熟理工学院生物与食品工程学院,江苏常熟215500)
家酿葡萄汁饮品中优势酵母菌的分离鉴定
姚璐晔,张琪,沈博文,李欣怡,董骏,王开方,田嘉龙
(常熟理工学院生物与食品工程学院,江苏常熟215500)
分离研究家酿葡萄汁饮品中的优势酵母菌,为本地葡萄酿酒酵母资源的筛选及其利用奠定基础。从家酿葡萄汁饮品中分离得到一株优势酵母菌(命名为CSLG02),结合显微结构和生理生化试验结果,以及对其26S rDNA D1/D2序列的分析确定该菌株的系统发育地位;通过人为地在葡萄汁中添加试验菌株CSLG02,发酵酿制葡萄汁饮品,考察饮品的各个理化指标。研究结果表明,菌株CSLG02鉴定为酿酒酵母属(Saccharomyces cerevisiae)。添加该菌后的试验组较对照组,饮品中各个理化指标均有不同程度的改变。S.cerevisiae CSLG02的添加,能改善家酿葡萄汁饮品的口感和品质,对形成地域性葡萄汁饮品的研究具有实际帮助意义。
家酿葡萄汁饮品;优势酵母菌;酿酒酵母;特性
葡萄酒自然发酵是借助于葡萄果皮或空气中的天然野生酵母完成的酒精发酵过程。葡萄酒发酵是一个复杂生态和生化过程,多种酵母在发酵过程中的相互协作可有效地增加葡萄酒风味的多样性和复杂性[1]。在酿造过程中,通过酵母菌的作用将葡萄原料中的各种潜在品质于酒中充分凸显出来[2]。酵母作为主要的发酵微生物不仅对葡萄酒质量和发酵过程影响很大,而且对葡萄酒色泽、香气、感官质量及风格的形成有重要贡献[3]。同时,酿酒葡萄的自然发酵液一直是野生优良酵母的重要来源[4]。用不同菌株发酵生产的葡萄酒,其酒质和风味差别很大。所以寻找能够适应当地葡萄原料特性、有利于形成地域葡萄酒风格的新土著酵母菌株及新酵母种已成为研究的焦点[5-10]。
由于天然酿制葡萄酒价格的昂贵,大多数人引用自己酿制的葡萄汁饮品,其与葡萄酒相比,口感较甜,略有涩感,符合广大人们的感官需求;同时,由于其制作简单、成本较低且富有保健功效,深受人们的喜爱。本研究从家庭酿造的葡萄汁饮品(口感、颜色较突出)中分离出优势酵母菌,进行鉴定,并在实验室中,添加进葡萄汁进行发酵,对生成的酒体进行理化指标检测,证实分离得到的菌株对酿造的葡萄汁饮品品质有显著提高。
1 材料与方法
1.1材料与培养基
样品:家酿葡萄汁饮品。
麦芽汁培养基:称取500 g麦芽,2 000 mL水,于60℃、搅拌煮沸4 h,4层纱布过滤,取滤液;用蛋清澄清滤液,即得麦芽汁(12°Bx)。添加2%的琼脂于液体培养基,即为麦芽汁固体培养基。
葡萄品种:采用中晚熟葡萄,品种为本地区常见的金手指和巨峰。
1.2仪器与设备
M124A电子天平:伯拉莫贝林(上海)精密仪器有限公司;FE20便携式(数显)pH计:梅特勒-托利多仪器(上海)有限公司;CJ-2S超净工作台:天津泰斯特仪器有限公司;ZQWY-200G振荡培养箱:上海知楚仪器有限公司。
1.3方法
1.3.1酵母菌的分离纯化
将样品液梯度稀释,取0.2 mL稀释液涂布于麦芽汁固体培养基上,36℃培养36 h,挑取单菌落。将得到的优势单菌落再次进行划线分离,获得纯菌落,保存于麦芽汁固体培养基上备用。
1.3.2酵母菌的显微结构
制作酵母水片,用显微镜高倍镜(40×10倍)观察其单细胞形态特征及生殖方式。
1.3.3酵母菌生理生化鉴定
按照《酵母菌的特征与鉴定手册》[11]的方法,将酵母菌接种到不同培养基中,考察其生长情况。
1.3.4酵母菌的分子生物学鉴定
提取酵母菌株的26S rDNA D1/D2序列,使用TaKaRa Fungi Identification PCR Kit(Code No.RR178),进行PCR扩增目的片段。反应条件具体为:94℃、5 min;94℃0.5 min、55℃0.5 min、72℃1 min,30次循环;72℃、5 min。反应结束,取5 μL进行3%琼脂糖凝胶电泳,切胶回收目的片段。送于上海宝生物公司进行测序,测序结果在GenBank中进行BLAST比对。选取同源性比较高的典型菌株的26S rDNA基因序列作为参比对象,用CLUSTAL 1.83软件进行多序列比对并计算目标菌株与参比菌株之间的序列相似性[12-13],采用邻位相接法(Neighbor-Joining)[14-15],应用MEGA6.0软件构建目标菌株与参比菌株之间的系统进化树[15]。
1.3.5酵母菌的活化
将4℃保藏的酵母菌接种于麦芽汁液体培养基中,36℃,180r/min培养16h,菌悬液浓度为1×107CFU/mL,待用。
1.3.6发酵试验
取新鲜葡萄,分选与除梗破碎,以葡萄汁体积为700 mL,调节总糖浓度30.0 g/L为标准,接入已活化的酵母菌。发酵控温28℃~30℃,发酵14 d。将酒体用8层纱布过滤,取滤液,置于棕色瓶中,25℃二次发酵21 d。发酵结束,静置,使其自然澄清,过滤,满瓶贮存,检测饮品各项理化指标。
1.3.7理化指标测定
1)酒精度检测[16]
取50 mL样品加50 mL水进行蒸馏,至馏液为50 mL,定容至100 mL,取1 mL于50 mL容量瓶,加入10 mL硫酸,10 mL重铬酸钾溶液(0.032 4 g/mL),用蒸馏水定容,混匀。30 min后,以空白作参比,在594 nm处测吸光值,根据回归方程计算得出样品的酒精浓度。
2)pH值检测
使用pH计直接检测样品的pH值。
3)总糖含量的测定[17]
准确移取样品10 mL至100 mL容量瓶中,用蒸馏水定容,摇匀,转入100 mL烧杯中,加1.5 g醋酸铅沉淀剂(加量由正交试验结果确定),搅拌,溶解,70℃,处理10 min(处理温度和时间由正交试验结果确定)。趁热过滤,依次准确移取2.0 mL滤液至具塞试管中,加4.0 mL蒸馏水、2.0 mL 6%苯酚,摇匀,快速加入10.0 mL浓硫酸,静置15min,于冷水浴中冷却,至室温,在495nm出测吸光值。对照标准曲线,计算总糖浓度。
4)总酚的测定[18]
吸取10 mL样品稀释至100 mL,取1 mL稀释液至100 mL容量瓶中,加60 mL蒸馏水,混匀,加入5 mL福林-肖卡试剂,充分混合。在30 s至8 min内加入15 mL 200 mg/L碳酸钠溶液,加水定容至100 mL,混匀,在20℃下放置2 h,在765 nm处测吸光值,以空白样为对照。对照标准曲线,计算出酚浓度。
5)总酸的测定[16]
吸取样品2 mL于250 mL锥形瓶中,加入50 mL水,同时加入2滴酚酞指示液,混匀,用氢氧化钠标准液(cNaOH=0.05 mol/L)滴定至终点,并保持30 s内不变色,记录下消耗氢氧化钠标准液的体积。同时做空白试验,计算得出样品的酸度。
6)单宁含量的测定[16]
取10 mL样品,用蒸馏水定容至100 mL,用滤纸过滤,取5 mL滤液,加入5 mL靛红溶液(0.1%),100 mL蒸馏水,用0.01 mol/L KMnO4溶液(0.01 mol/L)快速滴定至黄绿色,再缓慢滴定至明亮的金黄色为终点,记下消耗的KMnO4溶液体积。计算得到单宁的含量。
2 结果与分析
2.1酵母菌的菌落特征
平板培养的酵母菌如图1所示。
图1 平板培养的酵母菌Fig.1 The strain CSLG02 cultured on plates
经分离纯化获得的酵母菌,命名为CSLG02。菌落直径为1 mm~2 mm,奶白色,表面凸起、光滑,不透明,奶油状;培养到后期有酒香味。
2.2酵母菌的个体形态特征
酵母菌CSLG02的个体形态(×400)结果如图2所示。

图2 酵母菌CSLG02的个体形态(×400)Fig.2 The morphological character of strain CSLG02(×400)
通过普通光学显微镜对试验菌的菌体形态进行观察,菌株CSLG02具有典型的酵母细胞形态,椭圆形,单个排列,出芽繁殖。
2.3酵母菌生理生化鉴定
根据《酵母菌的特征与鉴定手册》提供的方法对酵母菌CSLG02的生理生化特征进行了初步鉴定,结果如表1。

表1 生理生化鉴定结果Table 1 Characterization of physiological and biochemical identification
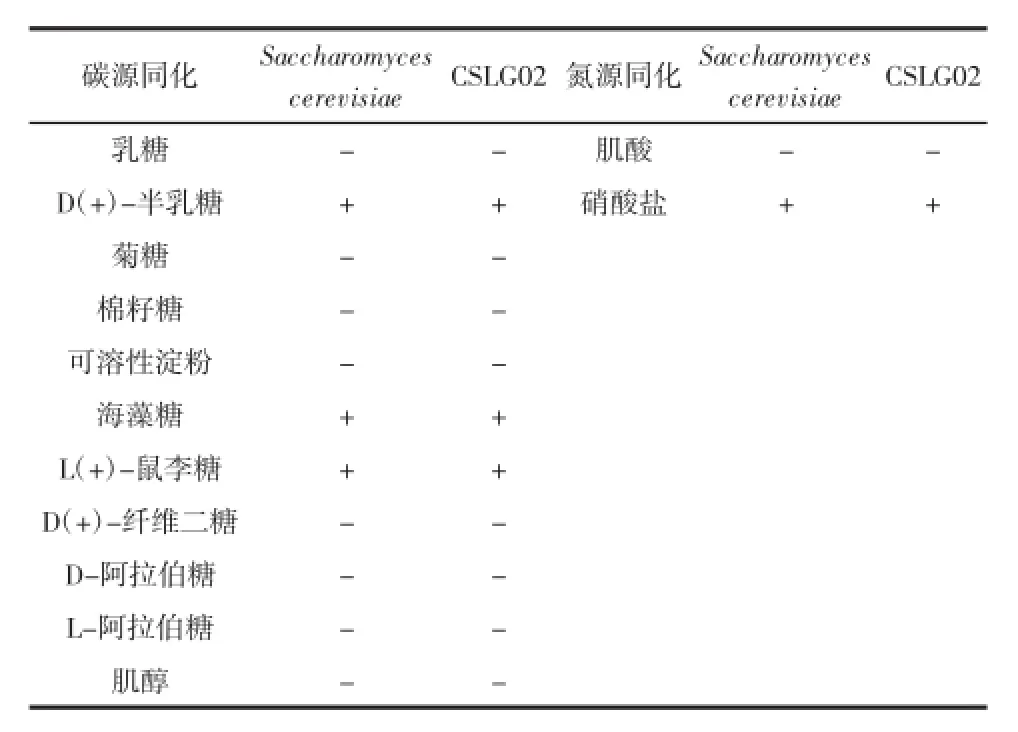
续表1 生理生化鉴定结果Continue table 1 Characterization of physiological and biochemical identification
查阅《酵母菌的特征与鉴定手册》并结合试验结果,推测菌株CSLG02为酵母属酿酒酵母(Saccharomyces cerevisiae)。
2.426S rDNA序列分析
酵母菌CSLG02的26S rDNA电泳图如图3所示。
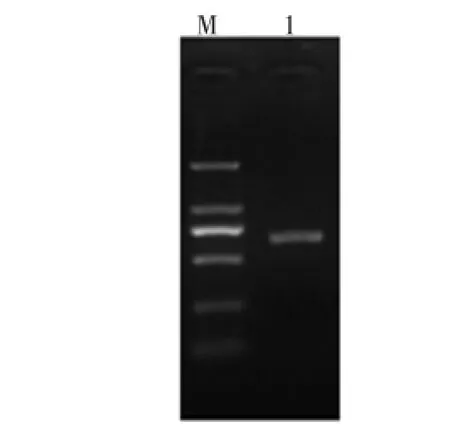
图3 酵母菌CSLG02的26S rDNA电泳图Fig.3 Electrophoresis patterns of 26S rDNA products from strain CSLG02
通过琼脂糖凝胶电泳分离后,得到PCR产物,切胶回收片段进行DNA测序。将菌CSLG02的26S rDNA序列与GeneBank数据库中的真菌26S rDNA序列进行BLAST同源性比对,结果发现酵母菌CSLG02的26S rDNA序列与数据库中酵母属酿酒酵母(Saccharomyces cerevisiae)的26S rDNA序列自然聚集。利用Clustalx1.83软件进行比对,利用MEGA6.0构建进化树,建树方法采用邻位归并法(Neighbor Joining)。
基于26S rDNA的菌株CSLG02的系统发育树见图4。
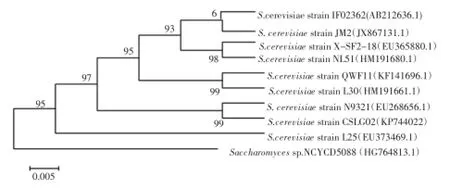
图4 基于26S rDNA的菌株CSLG02的系统发育树Fig.4 Phylogenetic tree of strain CSLG02 based on its 26S rDNA sequences
酵母菌CSLG02与酿酒酵母(Saccharomyces cerevisiae)的分支,其分支出现的可信度为99%,表明两者有较高的亲缘性关系。由于真菌的26S rDNA的分子结构具有高度的保守性,只在某些位置有少量的核苷酸序列改变,且这些改变具有种属特异性,故而利用26S rDNA构建基因进化树的可靠性很高。
2.5发酵试验
在葡萄汁中添加不同体积比例的S.cerevisiae CSLG02培养液,进行发酵试验,考察其对饮品不同理化指标的影响,结果如表2所示。
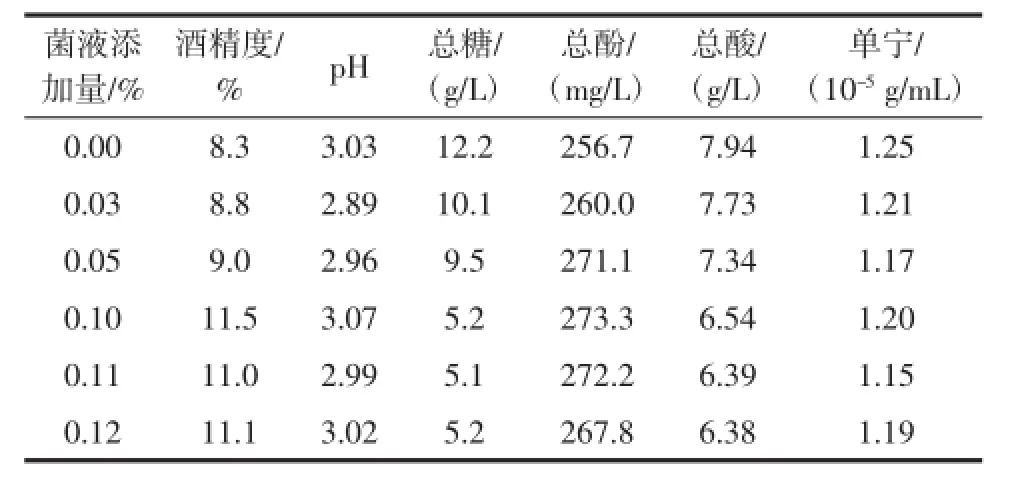
表2 S.cerevisiae CSLG02的不同添加量对葡萄汁饮品的影响Table 2 The effect of different S.cerevisiae CSLG02 addition on wine quality
2.5.1酒精度
用于葡萄汁发酵的酵母应具有较高的酒精产率,以符合酿造要求。本试验中,随着S.cerevisiae CSLG02添加量的增加,酒体的酒精度也逐步上升,最高值较未添加的对照组提高了38.6%,表明该菌的酒精转化率高于发酵过程中的其他微生物。
2.5.2pH
一般葡萄汁的pH在3~4,这就要求酵母菌种具有较宽的生长pH范围,才能用于葡萄汁的酿造。由于S. cerevisiae CSLG02来源于葡萄汁饮品中,因此完全能够在低pH值范围内(pH3.0)生长;同时,人为的添加S.cerevisiae CSLG02并未改变饮品的pH,表明试验菌株的增加对饮品的主导口感改变不大,仍能维持其葡萄汁的基本特性,且发酵较为彻底。
2.5.3总糖
糖是酵母菌生长和繁殖的碳源,同时也是酒精发酵的底物。葡萄汁饮品中的含糖量直接决定了感官味蕾中的甜度,一般残余总糖量在4.0 g/L~8.0 g/L,比较符合大众对葡萄汁饮品的接受度。随着S.cerevisiae CSLG02添加量的增加,样品中残余总糖量也随之下降;当试验菌株添加量为0.1%时,残余糖含量仅为5.2 g/L,很接近干型酒的要求(<4.0 g/L)。这一结果表明,S.cerevisiae CSLG02对于糖浓度的耐受性较好(初始总糖浓度为30 g/L),且其利用降解糖的能力显著,适用于葡萄汁的酿造。
2.5.4总酸
葡萄汁饮品中的总酸是指葡萄汁中游离酸的总量,即可滴定酸。S.cerevisiae CSLG02的人为添加,致使样品中总酸浓度显著下降(19.6%),表明试验菌株在无氧环境下糖代谢能力旺盛,有利于葡萄汁中的酒石酸等转化成饮品中的脂类物质,增加浓郁感。
2.5.5单宁类物质
葡萄汁中含有较多的单宁类物质,它们决定了酒的风味、结构与质地。添加S.cerevisiae CSLG02的试验组,较对照组总酚含量有所提高(0.06%),但单宁的含量并无明显变化。酚类物质具有特殊的芳香气味,因此添加S.cerevisiae CSLG02试验组的酒体,醇香饱满;而单宁来源于葡萄籽、皮及梗浸泡发酵而来,跟酵母菌的生理生化特性关系不大,因此,添加S.cerevisiae CSLG02并未改变饮品的单宁含量。
3 结论
本试验从家酿的葡萄汁饮品中,通过富集培养获得了一株优势菌株,经过显微结构、生理生化实验及分子生物学,鉴定其为酿酒酵母(Saccharomyces cerevisiae),命名为S.cerevisiae CSLG02(序列登录号:KP744022)。将S.cerevisiae CSLG02按照不同的比例添加进葡萄汁,发酵生成相应的饮品,检测其各个理化指标,表明S.cerevisiae CSLG02的添加有助于提高葡萄汁的发酵度,改善其风味。
试验结果显示,随着S.cerevisiae CSLG02添加量的增加,酒体的酒精度也逐步上升,最高值较未添加的对照组提高了38.6%。S.cerevisiae CSLG02对于糖浓度的耐受性也较好(初始总糖浓度为30 g/L),且其利用降解糖的能力显著,适用于葡萄汁的酿造。同时,人为添加S.cerevisiae CSLG02能导致样品中总酸浓度显著下降(19.6%),总酚含量有所提高(0.06%),有利于葡萄汁中的酒石酸等转化成饮品中的脂类物质,增加浓郁感。
常规葡萄酒是通过葡萄皮上天然的酵母菌发酵而来,不同的葡萄品种,其上附有的酵母菌的种类特性也不相同,造成了最终酿制葡萄酒风味的差异。目前研究较多的是,在酿造过程中参与协同作用的酵母菌的种群[18-22],以及葡萄酒体中风味物质的分类与来源[23-25];却很少有研究酵母菌和酒体之间的关联,原因是酿造过程是菌群发酵,给研究带来了难度。本研究旨在重点考察优势菌株在酿造过程中的作用,在不改变原先自然的、多菌发酵的基础上,着重添加这一优势菌株,以期改变样品的特性,使之更符合市场商品的需求,具有创新性。在后期的研究中,实验者将重点考察S.cerevisiae CSLG02对风味物质的影响,在此基础上得到最佳的添加时间和添加量。这一研究内容对葡萄汁酿造具有现实的使用价值和意义。
[1]FUGELSANG KC,EDWARD C,徐岩,等.葡萄酒酿造微生物学—实验技术与规程[M].2版.北京:中国轻工业出版社,2010: 92-96
[2]李记明.酵母活性剂在葡萄酒酿造中的应用研究[J].酿酒科技,2001(4):88-89
[3]Romano P,Capece A,Serafino V,et al.Biodiversity of wild strains of Saccharomyces cerevisiae as tool to complement and optimize wine quality[J].World Journal of Microbiology and Biotechnology,2008,24(9):1797-1802
[4]李双石,李浡,晋中美,等.霞多丽葡萄自然发酵过程中酵母种群的分布与变化规律[J].食品科技,2012,37(9):6-9
[5]Pretorius I S.Tailoring wine yeasts for the new millennium:Novel approaches to the ancient art of winemaking[J].Yeast,2000,16(8): 675-729
[6]Caruso M,Fiore C,Contursi M,et al.Formation of biogenic amines as criteria for the selection of wine yeasts[J].World Journal of Microbiology&Biotechnology,2002,18(2):159-163
[7]Cocolin L,Manzano M,Rebecca S,et al.Monitoring of yeast population changes during a continuous wine fermentation by molecular methods[J].American Journal of Enology and Viticulture,2002,53(1):24-27
[8]Espinosa J C,Fernandez-Gonzalea M,Ubeda J,et al.Identification of wine yeasts by PCR-RFLP without previous isolation on plate[J]. Food Technology and Biotechnology,2002,40(2):157-160
[9]Martinez C,Cosgaya P,Vasquez C,et al.High degree of correlation between molecular polymorphism and geographic origin of wine yeast strains[J].Journal of Applied Microbiology,2007,103(6):2185-2195
[10]汤晓宏,胡文效,魏彦锋,等.葡萄酒野生酿酒酵母的筛选及其生物特性的研究[J].山东大学学报(理学版),2014,49(3):12-17
[11]Andei N,Victor F L,Kalkut Sergey A.Abinitio stuedies of magnetism in transition-metal-doped silicon carbide[J].Physical Review B,2007,76:165204.1-165204.6
[12]Thompson J D,Gibson T J,Plewniak F,et al.The Clustal X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Research,1997,25(24): 4867-4882
[13]Kimura M.A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequence[J]. Journal of Molecular Evolution,1980,16(2):111-120
[14]Saitou N,Nei M.The neighbor-joining method:a new method for reconstructing phylogenetic tree[J].Molecular Biology and Evolution,1987,4(4):406-425
[15]Kumars S,Tamura K,Nei M.MEGA 3:integrated software for molecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics,2004,5(2):150-163
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T15038-2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006
[17]刘志明,唐彦君,吴海舟,等.苯酚-硫酸法测定葡萄酒中总糖含量的样品处理[J].中国酿造,2011(2):158-161
[18]王会会,刘天明,王可,等.烟台干红葡萄酒发酵过程中酵母种类鉴定[J].中国酿造,2011(1):33-36
[19]郭晶晶,董晓辉,刘延琳.赤霞珠葡萄自然发酵酵母菌的动态变化研究[J].中国酿造,2012,31(9):36-39
[20]孙悦,宋育阳,刘延琳.梅鹿辄葡萄自然发酵酵母菌群研究[J].中国酿造,2011,234(9):27-29
[21]Pallmann C,Brown J A,Olineka T L,et al.Use of WL medium to profile native flora fermentations[J].American Journal of Enology and Viticulture,2001,52(3):198-203
[22]卢君,李艳.分子生物学技术在葡萄酒相关酵母菌分类鉴定中的应用及研究发展[J].酿酒科技,2009(6):92-98
[23]Cheraiti N,Guezenec S,Sahnon J M.Redox interactions between Sacchanromyees cerevisiael and Saccharomyces uvarum in mixed culture under enological conditions[J].Appllied Environal Microbiology,2005,71(1):255-260
[24]Clemente-Jimenez J M,Mingorence-Cazorla L,Martine-Rodriguez F J,et al.Influence of wequential yeast mixtures on wine fermentation[J].International Journal of Food Microbiology,2005,98(3):301-308
[25]Mara A V,Juan F,Urbeda I,et al.Characterization of an exocellular β-glucosidase from Debaryomyees pseudopolymorphus[J].Enzyme and Microbial Technology,2006,39(2):229-234
Isolation and Identification of Dominant Yeast in Home Grape Juice Drink
YAO Lu-ye,ZHANG Qi,SHEN Bo-wen,LI Xin-yi,DONG Jun,WANG Kai-fang,TIAN Jia-long
(School of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,Jiangsu,China)
To isolation and study the dominant yeast in home grape juice drinks,thus to make basis of screening and subsequent using the yeast in home drink.The dominant yeast(named CSLG02)was isolated from the home wine.According to its microstucture,physiological,biochemical properties and 26S rDNA D1/D2 sequence,its position in phylogenetic development tree was defined.By measuring the physical and chemical indicators of wine forms,the effect of CSLG02 addition on drink-making was investigated.The results showed that:strain CSLG02 was identified as Saccharomyces cerevisiae.There were some changes of physicochemical paramenters between the control and experimental group,which was added the stain CSLG02 into drink making.The drink quality was enhanced by adding the strain CSLG02.It showed reality helpful value in the study of regional grape juice drink.
home grape juice drink;dominant yeast;Saccharomyces cerevisiae;characteristic
10.3969/j.issn.1005-6521.2016.13.036
常熟理工学院大学生课外学术科技作品项目(2014年);常熟理工学院生物与食品工程学院第二批SRP资助项目(201308);大学生实践创新创业训练计划项目(2015109)
姚璐晔(1983—),女(汉),实验师,硕士研究生,研究方向:生物工程发酵。
2015-06-23
