HPLC-MS/MS快速测定常见食品中羧甲基赖氨酸含量
2016-09-01刘慧琳陈晓默穆琳王静北京食品营养与人类健康高精尖创新中心北京市食品添加剂工程技术研究中心北京工商大学北京100048
刘慧琳,陈晓默,穆琳,王静(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京100048)
HPLC-MS/MS快速测定常见食品中羧甲基赖氨酸含量
刘慧琳,陈晓默,穆琳,王静
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京100048)
采用高效液相色谱串联质谱联用技术(HPLC-MS/MS)测定了几种高蛋白食品中羧甲基赖氨酸(CML)的含量,包括:液态牛奶,奶粉,饼干,面包和蛋白类发酵食品——酱油。对样品进行还原、沉淀、水解以及除杂后上样检测,对固相萃取柱及洗脱液进行了优化,采用外标法定量,HPLC-MS/MS的分析时间为25 min。其中酱油和饼干中CML的含量最高达到(385.59±7.73)mg/kg蛋白和(491.75±3.13)mg/kg蛋白,奶粉中CML的含量是最低的(45.66±2.89)mg/kg蛋白。
羧甲基赖氨酸;高效液相色谱串联质谱联用技术;食品;含量测定
食品在加工和储藏过程中,蛋白中的赖氨酸残基与还原糖的羰基或者脂质氧化产物形成晚期糖基化终产物(AGEs)和晚期脂质氧化终产物(ALEs)[1-2],包括羧甲基赖氨酸 [Nε-(carboxymethyl)lysine,CML],羧乙基赖氨酸,吡咯素,戊糖素等,其中研究最多的是CML。CML包括内源性和食源性两大类,膳食摄取的食源性CML是人体中CML的重要来源,动物实验和临床试验表明CML在人体内的积累和一些疾病如,肾病、阿兹海默症、动脉粥样硬化和人体的衰老密切相关[3-6]。因此人类日常膳食中CML的含量受到广泛的关注,Assar等利用超高相液相色谱与质谱联用技术(UPLC-MS)测定了西方常见的食品中CML的含量[7],Hull等利用UPLC-MS/MS技术测定了257中常见食物中CML的含量[8]。CML的定量检测对指导人们减少食源性CML的摄入,进而降低相关疾病的患病风险有重要的意义。
常见的CML检测方法包括酶联免疫法(ELISA)[12]、高效液相色谱荧光检测法(HPLC-FLD)[13],气相色谱-质谱联用法(GC-MS)[14],和液相色谱法(HPLC)[15],但是都存在不同程度的缺陷。ELISA法主要用于内源性CML的测定,由于食品体系的化学组分复杂,会产生干扰,因此不适合用于食源性CML的测定。而HPLCFLD、GC-MS、HPLC法都需要进行复杂的柱前衍生,操作繁琐,灵敏度低,HPLC-MS法检测样品前处理过程简单,不需要复杂的柱前衍生过程,而且保留时间稳定,重现性好。本文采用了HPLC-MS法检测了国内几种常见的高蛋白食品中CML的含量。
1 材料与方法
1.1材料与仪器
硼氢化钠(纯度≥98%):天津市福晨化学试剂厂;硼酸(纯度≥99.5%):北京益利精细化学品有限公司;十水合四硼酸钠、三氯乙酸、37%盐酸、氨水、甲醇(纯度≥99.5%):均购于国药集团化学试剂有限公司;所有待检测的食品样品均购自北京某大型超市;甲醇、乙腈、三氟乙酸(HPLC级):购于北京百灵威科技有限公司。
UGC-24M氮吹仪:北京优晟联合科技有限公司;KQ-700GVDV超声波清洗器:昆山市超声波清洗器;AL204万分之一电子天平:梅特勒-托利多仪器(上海)有限公司;Tilli-Q超纯水仪:山东莱索科技有限公司;QSE-24D固相萃取装置:上海鑫翁科学仪器有限公司;Cleanert PCX-SPE、Cleanert S C18-SPE(60 mg/3 mL):均购于天津博纳艾杰尔科技有限公司;MCX混合阳离子交换固相萃取小柱(60 mg/3 mL):美国Waters公司;安捷伦1260 infinity液相色谱-质谱联用:美国安捷伦公司。
1.2试验方法
1.2.1游离态CML检测样品前处理
取一定量等同于2 mg蛋白当量的样品,固态样品加入75%的甲醇(500 μL),液态样品加入无水甲醇至甲醇最终的浓度为75%,10 000 r/min离心10 min后沉淀杂质,然后过PCX固相萃取柱除杂,加5 mL甲醇(含5%氨水)洗脱,氮气吹干后用2 mL的超纯水复溶,过0.45 μm水相膜,等待上样。
1.2.2结合态CML检测样品前处理
参照Assar的前处理方法[7],并做适当的修改。取一定量等同于2 mg蛋白当量的样品,加入硼酸钠缓冲液(0.5 mol/L,pH 9.2),使其最终浓度为0.2 mol/L,混匀后加入硼氢化钠还原(2 mol/L,用0.1 mol/L NaOH配制),使其浓度为0.1 mol/L,样品在4℃下还原10 h。得到的溶液加入60%的三氯乙酸使得三氯乙酸的最终浓度为20%,10 000 r/min离心10 min以沉淀蛋白质,获得的蛋白用丙酮洗涤2次,沉淀后的蛋白加入1 mL,6 mol/L的HCl在110℃下水解24 h,然后氮气吹干,过PCX固相萃取柱除杂,洗脱液吹干后用2 mL的超纯水复溶,过0.45 μm的水系膜,等待上样。
1.2.3HPLC-MS检测条件
1.2.3.1液相条件
液相模块为安捷伦1260 Infinity二元液相色谱系统;色谱柱为InertsilODS-SP色谱柱(4.6 mm×150 mm,5μm,Shimadzu),进样量10μL,流动相速率0.2mL/min;柱温30℃;运行时间25 min;流动相A为含有0.1%三氟甲酸的高纯水,流动相B为乙腈,进行梯度洗脱,洗脱参数如表1所示。
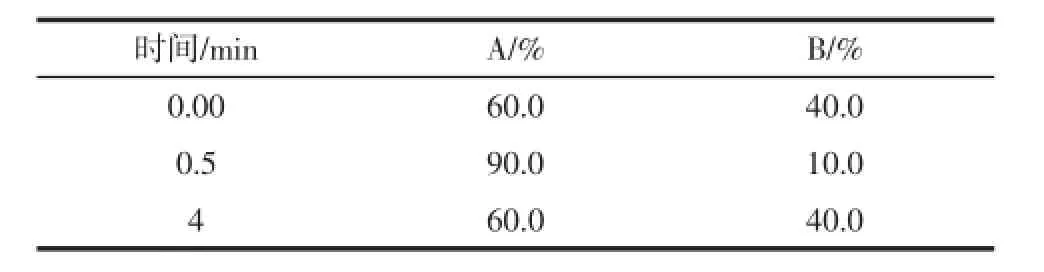
表1 梯度洗脱参数Table 1 Parameters for procedure of gradient elution
1.2.3.2质谱条件
质谱模块为三重四级杆质谱仪;仪器模式为电喷雾电离正离子模式(ESI+);监测模式:多反应监控模式(MRM);离子源温度:300℃;雾化气压力:0.1 MPa;毛细管电压:4 kV;MS1四级杆温度:100℃;MS2四级杆温度:100℃;MRM模式离子条件:m/z 205.0→m/z 84.0。
2 结果与讨论
2.1固相萃取柱的选择
比较了C18SPE小柱、PCX和MCX阳离子交换柱3种固相萃取柱对标准样品的保留时间和洗脱效果,如表2所示(其中标品中CML的含量为1 042 μg/L± 15.74 μg/L)。
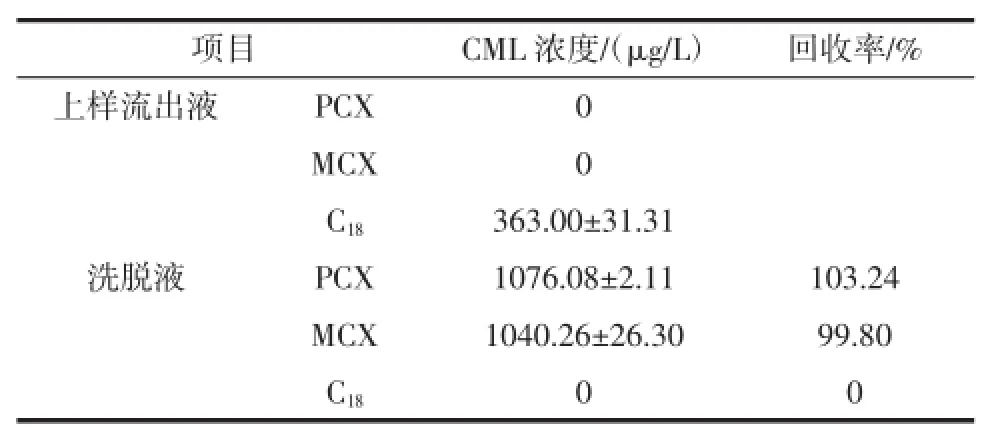
表2 固相萃取柱的优化Table 2 Optimization of solid phase extraction cartridges
由表2可知,其中C18小柱不能完全保留住CML,在上样流出液中检测出CML,而经过PCX和MCX阳离子交换柱净化后,保留效果好,最后基本被完全洗脱下来,回收率达到99%以上。因此本试验选择PCX阳离子交换柱。
2.2固相萃取柱洗脱液的优化
比较了不同浓度的氨水甲醇洗脱液,包括甲醇(不含氨水)、甲醇(5%氨水)、甲醇(10%氨水)、甲醇(15%氨水)结果如表3所示。
表3结果表明,含5%氨水的甲醇的洗脱效果最好,因此本试验使用的洗脱液为含有5%氨水的甲醇。
2.3流动相的选择
分别用甲醇-水和乙腈-水作为流动相,结果发现甲醇-水作为流动相时会出现拖尾现象,如图1所示,以乙腈-水作为流动相时峰型不佳,通过改变pH,提高离子化效率,改善峰型,试验表明当向超纯水中加入0.1%三氟甲酸时,CML的出峰时间和峰型较佳如图2所示。
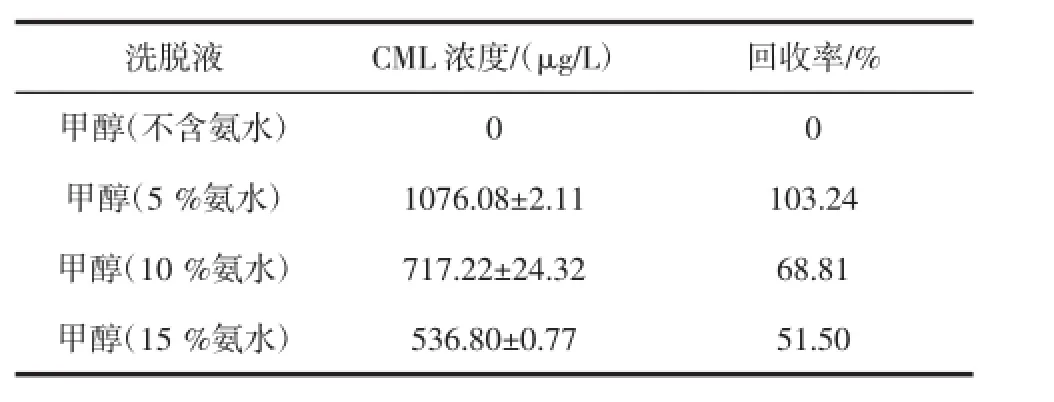
表3 固相萃取洗脱液的优化Table 3 Optimization of solid phase extraction eluents
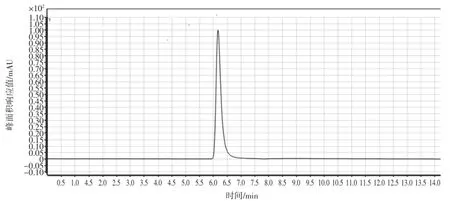
图1 甲醇-水作为流动相时的谱图Fig.1 Chromatogram for methanol-water as eluent

图2 乙腈-水(含0.1%三氟甲酸)作为流动相时的谱图Fig.2 Chromatogram for acetonitrile-water as eluent
2.4CML标准曲线的绘制
称取2 mg的CML用pH 7.0的磷酸缓冲溶液配制成1 000 μg/L的溶液,分别取2、1、0.5 mL的1 000 μg/L的溶液于容量瓶中,加入超纯水定容至10 mL,摇匀得到200、100、50 μg/L的CML的标准溶液,再分别从上述3种溶液中吸取1 mL的CML标准溶液溶液于10 mL容量瓶中配制成20、10、5 μg/L的CML的标准溶液,用HPLC-MS法测定6种不同浓度CML的峰面积,如表4所示,得到的标准曲线如图3所示。

表4 峰面积积分值Table 4 Peak area integral value
由图3可知,CML在5 μg/L~200 μg/L浓度范围内,峰面积与进样量呈良好的线性关系。经统计学计算的回归方程为Y=22.40x+38.24,R2=0.999。该方法的检测限是5 ng/L,定量限是16.67 ng/L。
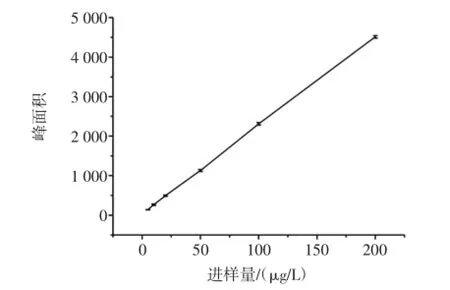
图3 CML标准曲线图Fig.3 The standard curve of CML
2.5常见高蛋白食品中CML的含量
蛋白质和碳水化合物是AGEs形成的前体物质,本文选取了国内常见的几种高蛋白食品作为研究对象,测定其中的CML的含量,结果见表5所示。
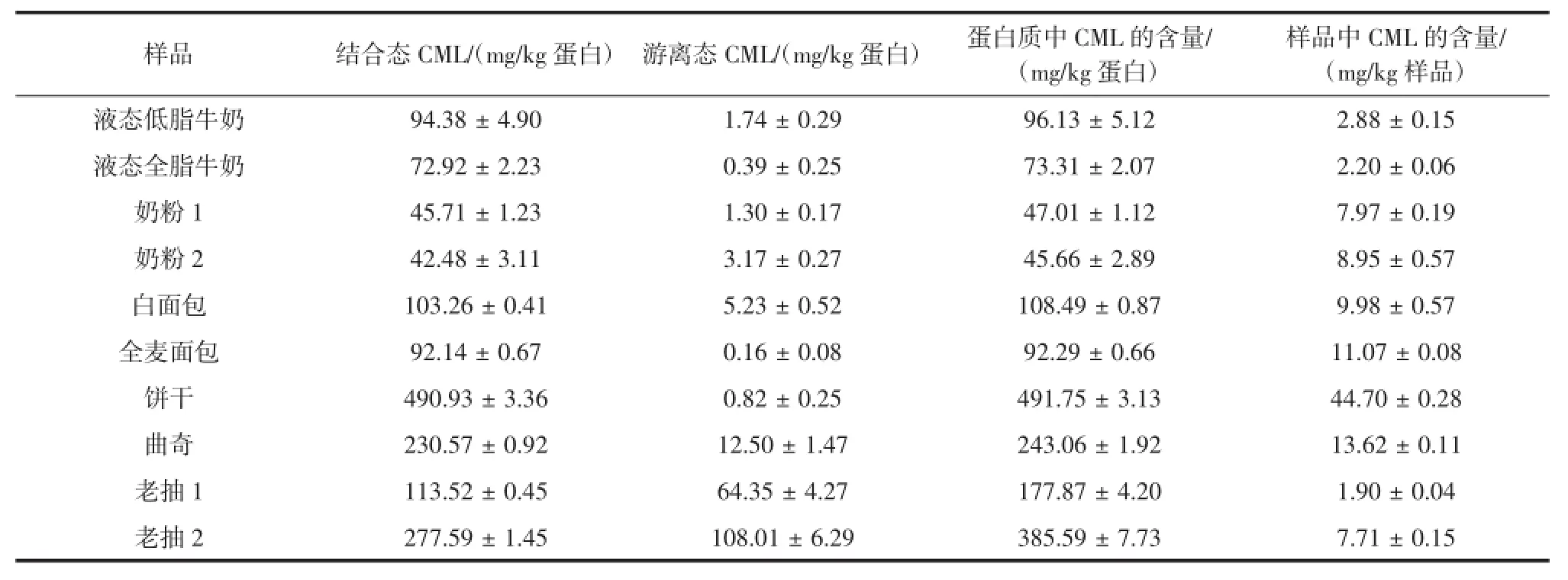
表5 几种高蛋白食品中CML的含量Table 5 The content of CML in several high protein foods
从表5可以看出,酱油和饼干中的CML的含量较高,Chao等[2]也发现经过酱油调味的肉制品的CML的含量要明显高于未经处理的肉制品,酱油中游离态CML含量很高,因为酱油是豆类发酵产品,在各种微生物的作用下大豆蛋白水解为多种游离的氨基酸。对于饼干类食品,由于饼干中蛋白质、糖类和油脂含量较高,再加上高温烘焙处理,所以饼干中CML的含量也较高。Assar等[7]利用UPLC-MS法测定了全脂和脱脂牛奶中CML的含量,结果表明全脂牛奶中CML的含量比脱脂的牛奶中CML的含量高(全脂牛奶的CML的含量为16.2 mg/kg蛋白,脱脂牛奶为10.4 mg/kg蛋白)。本试验中脱脂牛奶比全脂牛奶中CML的含量高,原因可能因为脱脂牛奶中碳水化合物的含量较高所导致的。奶粉中的CML要比液态牛奶中CML的含量高,可能是由于奶粉的真空干燥过程产生了较多的CML,结果与Fenaille等的结果相同,Fenaille等用GC-MS的方法测定了液态牛奶和粉末状牛奶中CML的含量,结果表明,粉末状牛奶的含量为212.4 mg/kg蛋白高于液态牛奶62.9 mg/kg蛋白[12]。Assar等[7]用U PLC-MS方法分别测定了面包皮和面包心的CML的含量,结果表明由于面包皮的高温烘烤导致皮的CML的含量比面包心的高,考虑到食用的习惯,本研究将面包冷冻干燥后混匀测定整体的CML的含量,结果表明全麦面包中的CML的含量比白面包的量低,是因为全麦面包中还原糖的含量较低所导致。
3 结论
本研究对实际样品中CML测定时前处理进行了优化,包括固相萃取柱的选择,固相萃取柱洗脱液的优化,以及流动相条件的优化,在实际样品检测中选用了PCX阳离子交换小柱,选用含5%氨水的甲醇为洗脱液,利用HPLC-MS法测定CML的含量,流动相A为含0.1%三氟甲酸,流动相B为乙腈,采用梯度洗脱的方法,出峰时间稳定在7.0 min左右,重现性好,适用于食品真实体系中的CML的含量,操作简单,快速,为进一步检测多种国内食品中的CML的含量提供技术依据,为后续食源性CML的抑制研究奠定基础。
[1]Ahmed N,Mirshekar-Syahkal B,Kennish L,et al.Assay of advanced glycation endproducts in selected beverages and food by liquid chromatography with tandem mass spectrometric detection[J]. Molecular nutrition&food research,2005,49(7):691-699
[2]Chao P,Hsu C,Yin M.Analysis of glycative products in sauces and sauce-treated foods[J].Food Chemistry,2009,113(1):262-266
[3]杨德庆,王艳萍,李霞,等.食物中的晚期糖基化终产物对5/6肾切除大鼠肾脏损害的作用的研究[J].新疆医学,2008,38(8):44-48
[4]Horie K,Miyata T,Yasuda T,et al.Immunohistochemical localization of advanced glycation end products,pentosidine,and carboxymethyllysine in lipofuscin pigments of Alzheimer's disease and aged neurons[J].Biochemical and biophysical research communications,1997,236(2):327-332
[5]许顶立,刘艳玲,孟素荣,等.冠心病患者血清晚期糖基化终产物Nε-羧甲基赖氨酸含量的变化[J].中华老年心脑血管病杂志,2000,2(3):161-163
[6]Singh R,Barden A,Mori T,et al.Advanced glycation end-products: a review[J].Diabetologia,2001,44(2):129-146
[7]Assar S H,Moloney C,Lima M,et al.Determination of N ε-(carboxymethyl)lysine in food systems by ultra performance liquid chromatography-mass spectrometry[J].Amino acids,2009,36(2): 317-326
[8]Hull G L J,Woodside J V,Ames J M,et al.Nε-(carboxymethyl)lysine content of foods commonly consumed in a Western style diet[J]. Food Chemistry,2012,131(1):170-174
[9]Wolff S P,Dean R T.Glucose autoxidation and protein modification. The potential role of‘autoxidative glycosylation’in diabetes[J].Biochemical Journal,1987,245(1):243-250
[10]Glomb M A,Monnier V M.Mechanism of protein modification by glyoxal and glycolaldehyde,reactive intermediates of the Maillard reaction[J].Journal of Biological Chemistry,1995,270(17):10017-10026
[11]Ahmed M U,Thorpe S R,Baynes J W.Identification of N epsiloncarboxymethyllysine as a degradation product of fructoselysine in glycated protein[J].Journal of Biological Chemistry,1986,261(11): 4889-4894
[12]Birlouez-Aragon I,Pischetsrieder M,Leclere J,et al.Assessment of protein glycation markers in infant formulas[J].Food Chemistry,2004,87(2):253-259
[13]Drusch S,Faist V,Erbersdobler H F.Determination of Nε-(carboxymethyl)lysine in milk products by a modified reversed-phase HPLC method[J].Food Chemistry,1999,65(4):547-553
[14]Charissou A,Ait-Ameur L,Birlouez-Aragon I.Evaluation of a gas chromatography/mass spectrometry method for the quantification of carboxymethyllysine in food samples[J].Journal of Chromatography A,2007,1140(1):189-194
[15]Hartkopf J,Erbersdobler H F.[Experiments with sausage meat on the formation of N epsilon-carboxymethyllysine.][J].Zeitschrift fur Lebensmittel-Untersuchung und-Forschung,1995,201(1):27-29
[16]Fenaille F,Parisod V,Visani P,et al.Modifications of milk constituents during processing:A preliminary benchmarking study[J]. International Dairy Journal,2006,16(7):728-739
Detection of Nε-(carboxymethyl)lysine in Foods by High Performance Liquid Chromatography-Mass Spectrometry
LIU Hui-lin,CHEN Xiao-mo,MU Lin,WANG Jing
(Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Engineering and Technology Research Center of Food Additives,Beijing Technology&Business University(BTBU),Beijing 100048,China)
High performance liquid chromatography-mass spectrometry(HPLC-MS/MS)was used to detect Nε-(carboxymethyl)lysine(CML)in several foods which contain high protein content,including liquid milk,powdered milk,biscuit,bread and soybean sauce.Samples were analyzed before pre-processing with sodium borohydride reduction,protein isolation,hydrolysis,and removing impurity.The optimization of different solid phase extraction cartridges and eluents in this study,and the analysis time of HPLC-MS/MS was 25 min.The CMLlevel in foods were as follows,soybean sauce and biscuit had the highest content,up to(385.59±7.73)mg/kg pro and(491.75±3.13)mg/kg pro,powdered milk had the least content,up to(45.66±2.89)mg/kg pro.
Nε-(carboxymethyl)lysine;high performance liquid chromatography-mass spectrometry;food;determination of content
10.3969/j.issn.1005-6521.2016.13.024
国家自然科学基金(31501559;31571940)
刘慧琳(1987—),女(汉),讲师,博士,研究方向:食品安全检测。
2016-03-27
