啤酒酵母细胞壁中甘露聚糖检测方法研究
2016-09-01陈志颖江建梅徐婷婷陈冠青张子健
■陈志颖 江建梅 徐婷婷 舒 媛 陈冠青 吴 振 张子健
(唐山拓普生物科技有限公司,河北唐山063000)
啤酒酵母细胞壁中甘露聚糖检测方法研究
■陈志颖江建梅徐婷婷舒媛陈冠青吴振张子健
(唐山拓普生物科技有限公司,河北唐山063000)
建立了啤酒酵母细胞壁中甘露聚糖含量的测定方法。用碱溶液进行前处理后,以甘露糖为标准品,采用苯酚-硫酸法测定甘露聚糖含量。试验结果表明,样品的前处理条件为NaOH浓度0.6%、浸提温度75℃、浸提时间30 min;检测条件为波长490 nm、反应温度100℃、反应时间20 min,在20.00~90.00 μg/ml范围内吸光度与被测物含量呈良好的线性关系,相关系数r为0.999 5,平均回收率100.78%,相对标准偏差(RSD)为2.23%。由此可见,该方法简便、重复性和稳定性好、结果可靠,可用于测定啤酒酵母细胞壁中甘露聚糖含量。
啤酒酵母;细胞壁;甘露聚糖;苯酚-硫酸法
2013年我国啤酒产量达到了5 062万吨,稳居世界第一,已成为啤酒生产和消费大国,同时也产生了300~400万吨副产物啤酒酵母,而这些啤酒酵母泥中含有48%~55%的蛋白质,23%~28%的碳水化合物,6%~8%的核酸,2%的维生素B族,1%的谷胱甘肽以及丰富的氨基酸和多种矿物质[1],这些营养成分并没有得到充分的利用,因此对啤酒酵母泥进行回收利用具有明显的社会效益和经济效益。
啤酒酵母细胞壁是以啤酒酵母为原料采用定向酶解与高效破壁技术精制生产制得,具有促进机体生长,提高免疫功能等作用。甘露聚糖位于酵母细胞壁的最外层,占细胞壁干重的40%左右,与处于中、内层的葡聚糖一起构成酵母细胞壁的主要多糖成分[2]。由于其具有免疫调节[3]、改善肠道健康[4]、选择性吸附病原微生物、吸附霉菌毒素[5]等功能,甘露聚糖是免疫功能最强的酵母细胞壁多糖[6],因此甘露聚糖含量是衡量酵母细胞壁质量的一个关键性指标。但目前关于啤酒酵母细胞壁甘露聚糖检测方法报道很少,目前饲料行业单一饲料中单细胞蛋白需要检测酿酒酵母细胞壁和酿酒酵母水解物中的甘露聚糖含量,但目前缺乏国家和行业相应的检测方法。因此本研究旨在提供一种简便、快速、准确度高的甘露聚糖的测定方法,对酵母源生物饲料产品应用具有指导意义。
1 材料与方法
1.1材料
样品为唐山拓普生物科技有限公司生产的啤酒酵母细胞壁粉。
1.2试剂
浓硫酸、苯酚、氢氧化钠,以上试剂均为国产分析纯试剂;
甘露糖标准品(纯度≥99%,Dr.Ehrenstorfer)。
1.3主要仪器
VIS-723N紫外可见分光光度计(北京瑞利分析仪器有限公司);DFD-700电子恒温水浴锅(北京中兴伟业仪器有限公司);电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司)。
1.4方法
1.4.1甘露糖标准溶液的配制
准确称取经(103±2)℃干燥至恒重的0.020 0 g甘露糖标准品,溶于水,定容至200 ml,得到浓度为100 μg/ml的甘露糖标准溶液。
1.4.25%苯酚溶液的配制
精密称取重蒸馏苯酚15.0 g,加适量水溶解后,转移至250 ml容量瓶中定容至刻度,摇匀后置于棕色试剂瓶。
1.4.3标准曲线的制备
分别吸取0.0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 ml甘露糖标准溶液于20.0 ml具塞试管中,各以水补至1.0 ml,加入1.0 ml 6%苯酚溶液,混匀,然后快速加入5.0 ml浓硫酸,使用漩涡振荡器使反应液混匀,然后将试管置于沸水浴中水解20 min,取出冷却至室温,在波长490 nm处测定吸光度值。以甘露糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.4.4样品的测定
准确称取样品0.200 0 g,用0.6%氢氧化钠溶液溶解,并完全转移至100 ml容量瓶中定容,75℃水浴30 min,取出立即冷却至室温,过滤,弃去初滤液,取10 ml滤液到100 ml容量瓶中定容。取待测样品溶液1.0 ml,按上述标准曲线操作步骤,测吸光度值,根据标准曲线线性回归方程计算甘露聚糖含量。
计算公式:
X=C×10-3×0.9×100/M
式中:X——甘露聚糖含量(%);
C——标准曲线计算出样品甘露糖含量(μg/ml);
M——样品质量(g);
0.9——甘露糖换算为甘露聚糖的系数。
2 结果与讨论
2.1提取条件的确定
甘露聚糖中大量碳水化合物短链与多肽残基上羟基结合,形成O-糖苷键,该键在碱性条件下很稳定,不易断裂,并且与甘露聚糖相连多肽为碱溶性,因此该复合物能以整体形式溶于碱性溶液中[7]。酵母葡聚糖是以β-(1,3)-D-葡聚糖为主链含有β-(1,6)分支的葡聚糖,或同时含有微量的β-1,6连接为主链的葡聚糖[8],符合碱不溶于葡聚糖的结构特征[9]。酵母β-D-葡聚糖的溶解性与几丁质的存在有着直接的关系[10],Mol等在研究酿酒酵母时,发现在酵母细胞壁中含量不到2%的几丁质以共价键的形式与β-1,3葡聚糖相连,致使酵母β-D-葡聚糖变为碱不溶性[11-13]。
因此,样品需要先经碱溶液提取处理后测定甘露聚糖含量,用以避免葡聚糖对检测结果的干扰。
2.1.1碱液浓度的确定
NaOH的浓度对甘露聚糖的提取具有显著的影响,碱液浓度高会使多糖降解,而且杂质增多。试验结果表明,NaOH的浓度为0.6%时提取效果最好。

表1 碱液浓度对吸光度的影响
2.1.2提取温度的确定
温度越高,多糖溶出就越多,当浸提温度达到75℃时,吸光度值趋于平稳,表示此时的甘露聚糖溶出也较多。因此,水浸提的温度选择75℃。
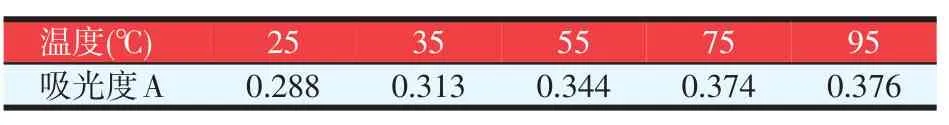
表2 提取温度对吸光度的影响
2.1.3提取时间的确定
延长提取时间有利于多糖的溶出,从表3数据可以看出,随着浸提时间的增加,吸光度也在增大,但30 min以后,增加幅度比较缓慢。因此,为了提高工作效率,确定浸提时间以30 min为宜。
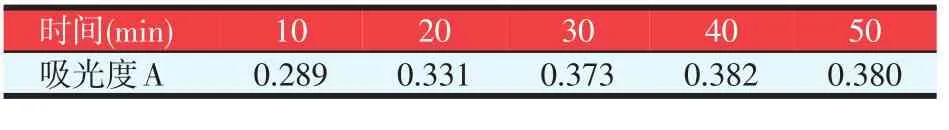
表3 提取时间对吸光度的影响
2.2测定条件的确定
2.2.1最大吸收波长的确定
取样品1.0 ml,与苯酚-硫酸试剂显色,以等量的蒸馏水作空白,紫外-可见光全波长扫描。由图1可知,在490 nm处有最大吸收,所以选择490 nm为测定波长。
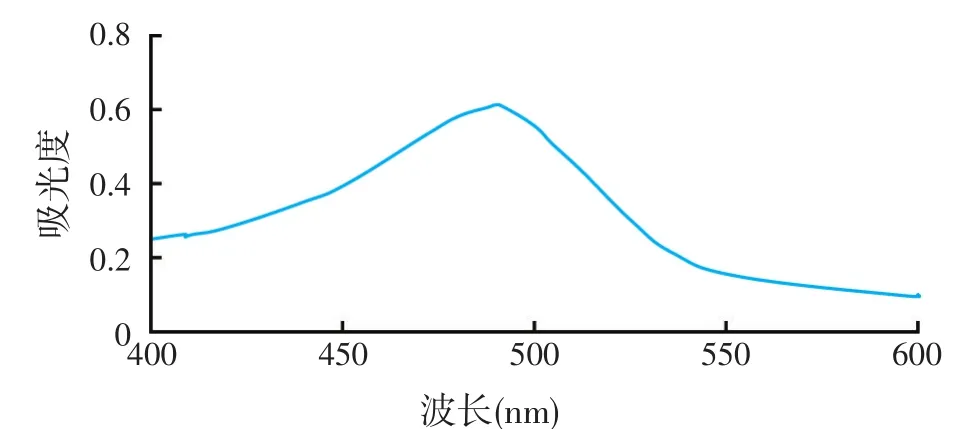
图1 400~600 nm波长扫描
2.2.2显色温度的确定
分别吸取50 μg/ml甘露糖标准溶液1.0 ml于具塞试管中,依次加入苯酚溶液1.0 ml、浓硫酸5.0 ml,摇匀,分别在40、60、80℃和100℃下反应20 min,取出冷却至室温,在波长490 nm处测定吸光度值。
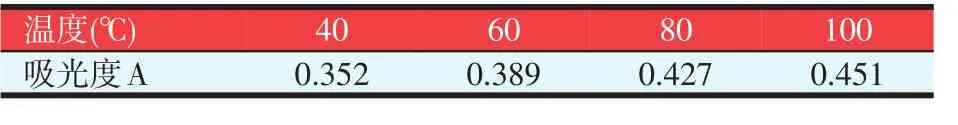
表4 显色温度对吸光度的影响
由表4可知,随着反应温度的升高吸光度有增大的趋势,所以选择100℃作为最佳显色温度。
2.2.3显色时间的确定
分别吸取50 μg/ml甘露糖标准溶液1.0 ml于具塞试管中,依次加入苯酚溶液1.0 ml、浓硫酸5.0 ml,摇匀,在100℃条件下分别反应0、5、10、15、20、25和30 min。取出冷却至室温,在波长490 nm处测定吸光度值。

表5 显色时间对吸光度的影响
由表5可知,反应20 min后吸光度趋于平缓,所以选择20 min为最佳显色时间。
2.2.4硫酸添加方式的确定
试验中硫酸的加入方式对测定结果有很大的影响。表6结果表明,垂直加入会造成测定结果出现较大波动,RSD 8.04%,重现性差;加入硫酸的同时旋转比色管,让硫酸能均匀的沿壁流下,RSD 1.06%,检测结果稳定。

表6 硫酸添加方式对吸光度的影响
2.3检测方法验证
2.3.1标准曲线的制作
在490 nm波长处测定吸光度,以试剂空白作参比,试验结果见表7。

表7 甘露糖标准溶液浓度与吸光度值
所得线性回归方程:y=0.008 9x+0.001 5(相关系数r=0.999 5),表明甘露糖在该反应体系符合朗伯-比尔定律。以吸光度为纵坐标,甘露糖为横坐标,绘制标准曲线,见图2。
2.3.2稳定性验证
连续2 h内每隔30 min测吸光度,考察其稳定性,结果表明,在显色120 min时间内吸光度稳定性较好,结果见表8。
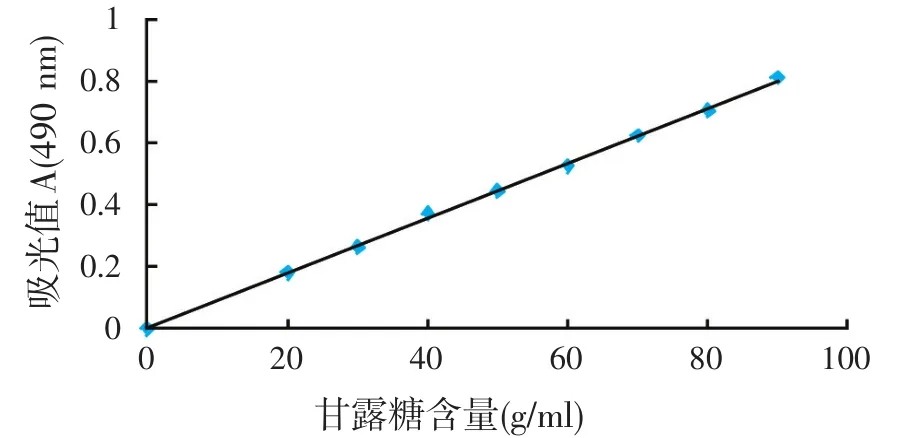
图2 甘露糖标准曲线
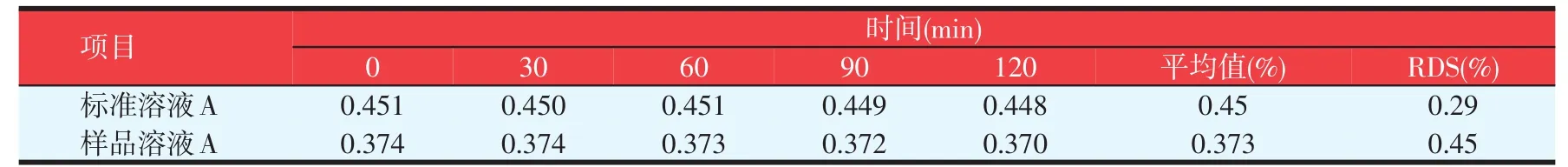
表8 稳定性试验结果
2.3.3精密度验证
按样品测定方法,将50 μg/ml甘露糖标准溶液和供试样品溶液重复测定6次的RSD值分别为1.01%和1.06%,表明精密度良好(见表9)。

表9 精密度试验结果
2.3.4重现性验证(见表10)
精密称取同一批次啤酒酵母细胞壁样品5份,按样品测定方法进行甘露聚糖含量的测定。计算相对标准偏差RSD,判断方法的重现性。经检测酵母细胞壁甘露聚糖含量23.47%,RSD 1.31%,结果表明此方法具有良好的检测重现性。

表10 重现性试验结果
2.3.5加标回收率测定(见表11)
在加标回收试验中,以啤酒酵母细胞壁为底样,加入不同量的甘露糖标准品进行试验。见表11可知,该试验方法的平均回收率为100.78%,RSD为2.23%,表明方法的准确率较高。
3 结论
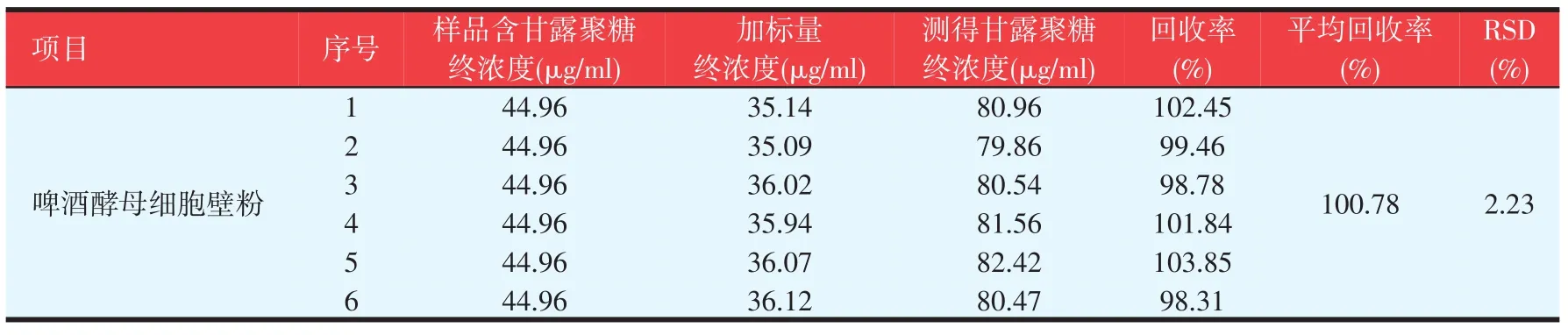
表11 加标回收试验结果
试验结果表明,样品的前处理的最佳条件为NaOH浓度0.6%、浸提温度75℃、浸提时间30 min;检测测定波长为490 nm、反应温度100℃、反应时间20 min,在20.00~90.00 μg/ml范围内吸光度与甘露糖含量呈良好的线性关系,相关系数r为0.999 5,平均回收率100.78%,RSD为2.23%。
苯酚-硫酸法测定啤酒酵母细胞壁中甘露聚糖含量的方法,具有操作简单,并且重现性好,显色稳定,常规仪器即可完成检验工作。试验中硫酸的加入方式对测定结果有很大影响,采用旋转加入硫酸至比色管的方式,让硫酸能均匀的沿壁流下探索,使测定结果更加准确稳定。
[1]高玉荣.啤酒酵母自溶条件的研究[J].酿酒科技,2002(2):74-76.
[2]汪立平,王锡昌,陈有容,等.啤酒废酵母甘露聚糖的制备[J].食品科学,2009(2):134-137.
[3]Ballon L,Cohen R E,Ballou C E.Saccharomyces cerevisiae mutants that make mannoproteins with a truncated carbohydrate outer chain[J].J Biol Chem,1980,255:5986-5991.
[4]Nathan S,Halina L.Carbohy rates in cell recognition[J].SciAmeri,1993(1):74-81.
[5]Castro D P,Moraes C S,Garcia E S,et al.Azambuja Inhibitory effects of D-mannose on trypanosomatidlysis induced by Serratia marcescens[J].Experimental Parasitology,2007,115:200-204.
[6]Ponton J,Omaetxebarria M J,Elguezabal N,et al.Immunoreactivit of the fungal cell wall[J].Medical Mycology,2001,39:101-110.
[7]徐希柱,樊祥东.啤酒酵母细胞壁中β-(1,3)-D-葡聚糖提取与应用[J].粮食与油脂,2008(3):41-43.
[8]张海波,戴军,罗必英,等.酵母葡聚糖分子结构分析[J].食品与发酵科技,2011(5):31-33.
[9]Bron A Donzis.Substantially purified beta(1,3)finely ground yeast cell wall glucan composition with dermatological and nutritional uses[P].U.S.patent:5,576,015,1996-11-19.
[10]刘晓永,王强,胡永金,等.啤酒酵母中β-葡聚糖分子结构及构象的研究进展[J].酿酒科技,2005(12):26-31.
[11]Hartl,R P,Vermeulen C A,Klis F M,et al.The linkage of(1,3)-β-glucan to chitin during cell wall assembly in Saccharomyces cerevisiae[J].Yeast,1994,10:1591-1599.
[12]Kollar R,Petrakova E,Ashwell G,et al.Architecture of the yeast cell wall.The linkage between chitin and β-(1,3)-glucan[J].Journal of Biological Chemistry,1995,270:1170-1178.
[13]Klis F M.Cell wall assembly in yeast[J].Yeast,1994,10:851-869.
(编辑:高雁,snowyan78@163.com)
Determination of mannosan in beer yeast cytoderm
Chen Zhiying,Jiang Jianmei,Xu Tingting,Shu Yuan,Chen Guanqing,Wu Zhen,Zhang Zijian
The method for quantitative determination of mannosan in beer yeast cytoderm was established successfully.Samples were extracted with alkali solution of mannan,on the basis of mannose,mannan content is determined by phenol-sulfuric acid method.The results showed that the optimum extracting were extraction at temperature 75℃ for 30 min in 0.6%NaOH concentration.Results showed that under the conditions of detection wavelength 490 nm,reaction temperature 100℃and reaction time 20 min,there is good linearity range from 20.00~90.00 μg/ml(r=0.999 0).The average recovery is 100.78%and the RSD is 2.23%.The assay method was proved to be simple,convenient,accurate with good reproducibility and can be used for the determ ination of beer yeast cytoderm.
beer yeast;cytoderm;mannosan;phenol-sulfuric acid method
10.13302/j.cnki.fi.2016.05.013
S816.32
A
1001-991X(2016)05-0056-04
陈志颖,研究方向为酵母深加工。
张子健,工程师,硕士。
2015-11-19
国家国际科技合作专项项目[2012DFA30390]
