单壁碳纳米管修饰玻碳电极直接测定绿植中的槲皮素*
2016-09-01张翠忠张贞发彭金云
张翠忠,连 欢,张贞发,刘 璐,彭金云
(广西民族师范学院,广西 崇左 532200)
单壁碳纳米管修饰玻碳电极直接测定绿植中的槲皮素*
张翠忠,连欢,张贞发,刘璐,彭金云
(广西民族师范学院,广西崇左532200)
构建了一种简单的单壁碳纳米管(SWNTs)修饰玻碳电极直接测定绿植中槲皮素的方法。不借助于酶,SWNTs电极对槲皮素催化氧化为醌表现出良好的伏安响应。最优条件下,槲皮素的线性范围为1.5×10-6~1.3×10-5mol·L-1,检出限为5.0×10-7mol·L-1(S/N=3)。该修饰电极灵敏性、重现性、稳定性好、便于携带。并能用于测定实际样品,获得满意的回收率。
单壁碳纳米管;槲皮素;微分脉冲伏安法
随着食品科学的迅速发展和人们消费理念的转变,含有天然活性成分的食品、化妆品和保健药品已成现代人追求的目标,而以纯天然、高活性[1]等特性著称的黄酮类化合物恰能满足这一要求并受到人们的青睐。国内外科研和临床试验进一步表明槲皮素兼具多种生物活性,尤其强氧化性[2]抗衰老,能防止低密度脂蛋白氧化,治疗冠心病,抑制恶性肿瘤生长和转移等作用[3-5]。目前,检测槲皮素的方法有高效液相色谱法[6]、光谱法[7]、毛细管电泳法[8-9]和电化学法[10-12]等。而电化学方法,因其仪器体积小方便现场检测、价格低廉易普及、分析速度快、灵敏度高等优势得到广泛应用。
碳纳米材料具有比表面积大、化学稳定性高、催化能力强、生物兼容性好,尤其对生物小分子表现出超高的电催化活性,已被用于槲皮素的测定[13-15],但是不一样的分离纯化方法得到的效果是不一样的,本实验采用回流法纯化碳纳米管法,碳纳米管经酸处理可以在其表面和两端引入许多含氧官能团和表面缺陷,可为电化学反应提供较多的活性点[16-17],基于单壁碳纳米管(SWNTs)对槲皮素良好的电催化作用,获得了相对低的检测限,利用该方法可直接分析食品或绿植中的槲皮素。
1 实验部分
1.1仪器和试剂
单壁碳纳米管修饰玻碳电极(SWNTs/GCE)为工作电极,铂柱电极为辅助电极、饱和甘汞电极为参比电极;CHI660D电化学分析仪,上海辰华仪器有限公司;AR224CN型电子天平,奥豪斯仪器上海有限公司;SD3200D超声波清洗器,昆山市超声仪器有限公司;pHS-3C型pH计,上海今迈仪器仪表有限公司;扫描电子显微镜,德国卡尔蔡司公司(EVO MA 15/LS 15)。
槲皮素购自国药集团化学试剂有限公司;N,N-二甲基甲酰胺(DMF)、磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)铁氰化钾/亚铁氰化钾[Fe(CN)6]3-/4-等均为分析纯;实验用水为二次水。
1.2电化学测试
在小烧杯中加入7 mL pH=7.0的0.1 mol·L-1的磷酸盐缓冲液(PBS),安装好三电极体系,以0.05 V·s-1的扫描速度在-0.1~0.5 V电位窗口内重复扫描电极20圈至循环伏安曲线稳定,增强其活性,活化该修饰电极。在缓冲溶液中加入一定量的槲皮素溶液,开路条件下搅拌富集150 s后,再进行电化学的测试。所有的电化学测试均在室温下进行。
2 结果与讨论
2.1SWNTs的电镜表征
图1为所观察到的SWNTs的管状结构,可以清晰地看到SWNTs线条明显,直径仅6 nm左右。早在1991年研究者在高倍透射电镜下观察到碳纳米管的导电性取决于管的正五边形或六边形的网状结构与管的直径,随着管中网格的结构和直径的变化可是金属型或半导体型[18-19],当管径小于6 nm时,可以被看成是具有良好导电性的准一维量子导线[20]。由于构成碳纳米管的碳原子基本上都处在表面位置,故其具有较大的比表面积,理论计算表明,碳纳米管的比表面积在50~1315 m2/g的较大范围内变化,并且单壁碳纳米管的比表面积比多壁碳纳米管的大一个数量级[21]。

图1 GCE(a)和SWNTs/GCE(b)的SEM形貌图
2.2修饰电极(SWNTs/GCE)的电化学表征及电极有效面积的计算


图2 两种电极GCE(a)和SWNTs/GCE(b)在1 mmol·L-1[Fe(CN)6]3-/4-+0.1 mol·L-1KCl溶液中的循环伏安图(A)和交流阻抗图(B)
分别以裸玻碳电极(a)和SWNTs修饰电极(b)为工作电极,采用循环伏安法(CV)和交流阻抗(EIS)在1 mmol·L-1[Fe(CN)6]3-/4-+0.1 mol·L-1KCl溶液中进行电化学扫描。如图2(A)所示,探针分子在裸玻碳电极上的氧化还原峰的电位差为75 mV,而在SWNTs/GCE上的氧化还原峰的电位差为69 mV,峰电位减少了6 mV,电位差明显的降低,这表明SWNTs/GCE可以有效的促进探针分子[Fe(CN)6]3-/4-在电极表面的电子转移;另一方面,发生在SWNTs/GCE电极上的氧化还原峰的峰电流明显大于裸玻碳电极,这说明修饰电极能有效的促进[Fe(CN)6]3-/4-探针分子在电极表面的传递速率。交流阻抗(EIS)是对电极表面的另一种有效表征工具。由图2(B)可以看出,GCE的阻抗曲线出现一个小圆弧,这表明GCE具有较高的阻抗,电子转移受到一定的阻碍,而当玻碳电极表面修饰SWNTs后,其圆弧基本消失,几乎呈一条直线,说明电荷转移速率加快,阻碍解除,这也与循环伏安法的表征结果相吻合。
在[Fe(CN)6]3-/4-探针分子的可逆体系,可用方程计算电极有效面[22]。其中修饰后的电极面积是裸电极面积的1.33倍,提高了电子转移的效率。以此类推,测定槲皮素,也会提高电子转移的效率。
2.3槲皮素在裸玻碳电极和修饰电极上的循环伏安行为

图3 两种电极在空白底液和0.5 mmol·L-1槲皮素+0.1 mol·L-1PBS (pH=7.0)溶液中的循环伏安图
CV考察了槲皮素在不同工作电极上的电化学行为,如图3所示:在空白底液中,修饰电极和裸电极都没有明显响应;而在0.5 mmol·L-1的槲皮素PBS(0.1 mol·L-1pH=7.0)缓冲液中,裸GCE和SWNTs/GCE电极都能产生一对氧化还原峰,但SWNTs/GCE电极的电化学响应远远大于裸玻碳电极,响应电流约为裸玻碳电极的6倍,因为碳纳米管经酸处理可以在其表面和两端引入许多含氧官能团和表面缺陷,可为电化学反应提供较多的活性点[16-17]。当SWNTs修饰电极对槲皮素测定槲皮素时,一般认为在酸性较强的条件下(pH 1.81)棚皮素CV曲线的峰形较好,有两个明显的氧化峰,分别为 B环上的儿茶酚3’,4’-双羟基供电子基团发生的二电子和二质子反应,[23]但是当pH接近中性时,只出现一对氧化还原峰,石慧霞等用密度泛函数探索出B环上的4’-OH活性贡献最大[24],所以经酸处理过的碳纳米管容易和槲皮素发生化学反应,反应式表示如下:

2.4缓冲溶液pH值的选择
缓冲溶液的pH值是影响电极反应过程的重要因素之一,本实验运用CV考察了不同pH值对槲皮素的氧化峰电位和峰电流的影响。分别以pH为4.0,5.0,6.0,7.0,8.0和9.0的PBS缓冲溶液作为底液,结果如图4所示:槲皮素的氧化峰电流先是随着pH值的增大而增大,在pH=7.0时,响应值达到最大值,当pH值超过9.0,槲皮素的氧化还原峰越变越小,可能随着碱性增大,槲皮素在电极表面的吸附逐渐减弱,直至氧化还原峰消失。所以,本实验选择0.1 mol·L-1pH=7.0的PBS缓冲溶液作为底液。
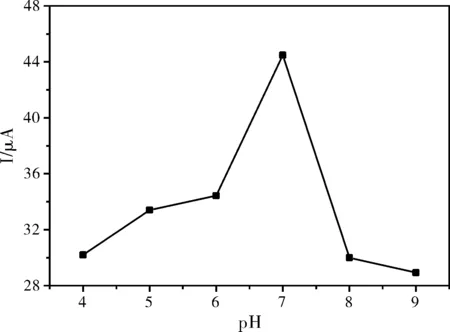
图4 不同pH值在SWNTs/GCE上对槲皮素氧化峰电流的影响
2.5扫描速度的影响
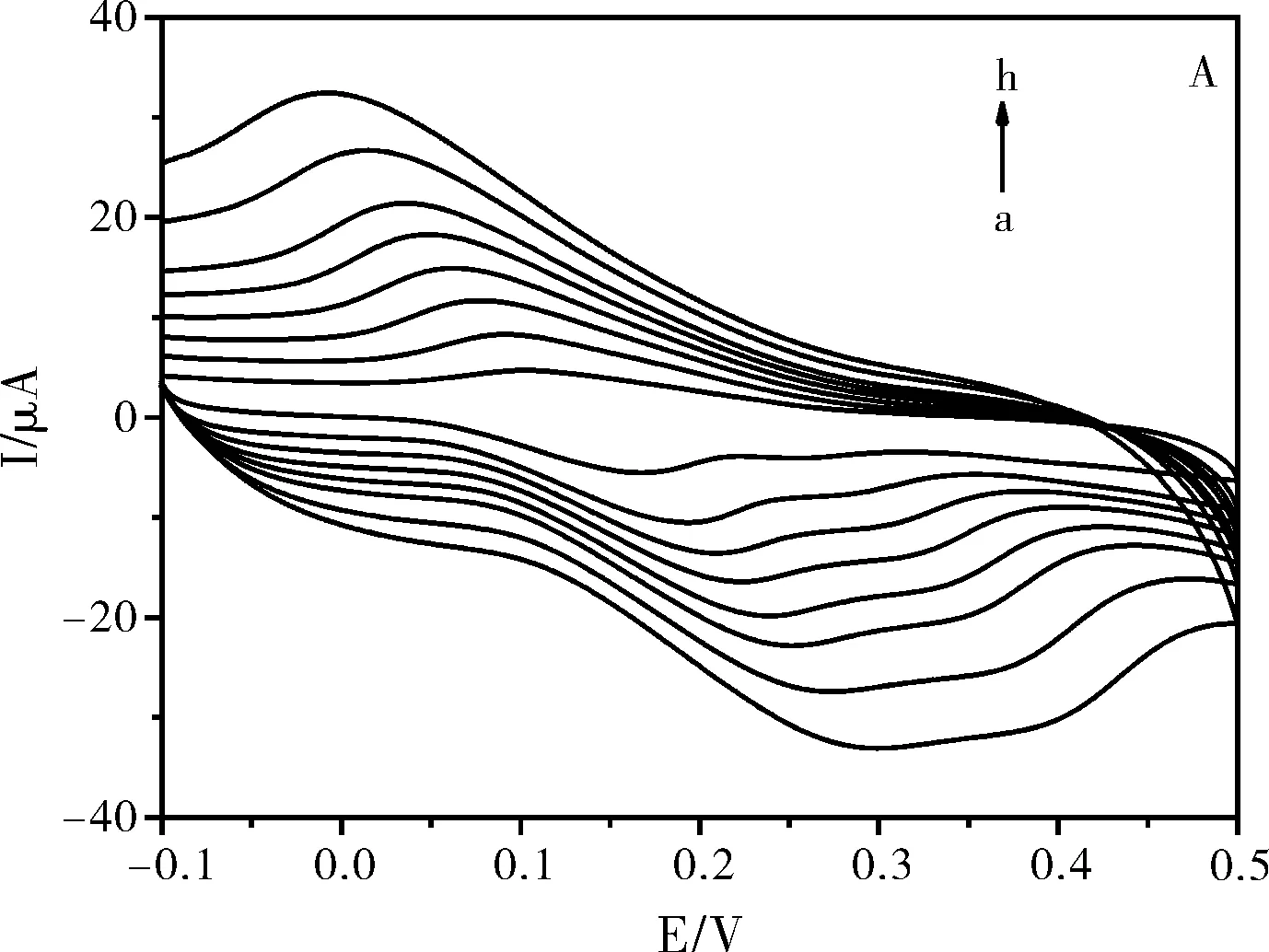

图5 扫描速度对槲皮素氧化还原峰电流的影响
通常有关电化学反应机理的有效信息我们可以从峰值电流和扫描速率间的关系来获得。图5(A)探究了在修饰电极上扫描速度对槲皮素的峰电流的影响,在0.02~0.16 V·s-1的扫描速度范围内,槲皮素的氧化峰电流和还原峰电流均呈明显增大趋势,与扫描速度成正比,并呈良好线性关系,线性方程为:Ipa=-0.68+184.71V(R2=0.9979),Ipc=-2.29-180.9V(R2=0.9941),如图5(B)所示。这表明,在低扫描速度下,槲皮素在SWNTs/GCE修饰电极上的电化学过程是受吸附控制的。当电子转移受吸附控制时,富集能提高修饰电极的灵敏度。
2.6富集电位和富集时间的影响
采用DPV对0.5 mmol·L-1的槲皮素溶液的富集电位和富集时间的影响进行了考察。如图6所示,调整富集电位,从-0.3~0.2 V,槲皮素的氧化峰电流与在开路富集时的峰电流基本一致,几乎没有改变,这说明富集电位对槲皮素在修饰电极上的富集程度基本没有影响;在开路富集的条件下,槲皮素在GR/GCE上的峰电流随着富集时间的增加而增大,富集时间150 s时,其峰电流达到最大值,随后增长缓慢,如图7所示,这表明电极表面吸附了一定量的槲皮素,几乎饱和,所以,本实验采用开路富集150 s作为最佳的富集条件。

图6 富集电位对槲皮素氧化峰电流的影响;

图7 富集时间对槲皮素氧化峰电流的影响
2.7微分脉冲伏安法测定槲皮素
配制一系列不同浓度的槲皮素溶液,并采用微分脉冲伏安法,进行-0.1~0.4 V电位之间槲皮素的含量的测定,其结果如图8所示。槲皮素的氧化峰电流与其的浓度在1.5×10-6~1.75×10-5mol·L-1范围内呈现出良好的线性关系。其线性方程为:Ip(μA)=-0.5242-1.018c(μmol·L-1)(R2=0.9995),检出限为5.0×10-7mol·L-1。它的高灵敏度主要是由于SWNTs材料提供了较大的有效活性面积,增加了槲皮素在电极表面的电子转移速率和吸附量。

图8 不同浓度的槲皮素在SWNTs/GCE上的DPV图(A)和浓度与氧化峰电流的线性关系(B)
2.8样品的测定
按照文献[25]所用的方法对芦丁进行水解,并对水解产物槲皮素进行测定。称取30.00 mg芦丁于烧杯中,加入10 mL 95%的乙醇和25 mL 6%的盐酸,用沸水浴加热1 h,冷却后乙醇定容100 mL。从中取5 mL,用缓冲溶液定容50 mL,此时的浓度为45.1 μmol·L-1。取适量进行测定,并进行回收实验,平行测定5次,结果如表8所示。由表1可知,回收率在95.0%~101.0%之间,说明该修饰电极具有较高的准确性。

表8 芦丁水解产物中槲皮素的含量测定
2.9电极的重现性和稳定性
为了验证实验结果的可靠性和确保检测的精密度,我们对修饰电极的重现性和稳定性进行了测试。用同一根修饰电极平行测定5.0×10-4mol·L-1的槲皮素溶液8次,结果发现其峰形几乎没有改变,峰电流的相对标准偏差(RSD)为1.572%。完成上述实验后,将这根修饰电极放置于冰箱中密封保存5天,5天后通过微分脉冲伏安法测定其氧化峰电流,与初始电极相比较,结果发现其对槲皮素的氧化峰电流的响应为原来的96.43%。这一实验结果表明:多壁碳纳米管修饰电极有着较好的重现性和稳定性,其检测结果是可靠的,所以该修饰电极可以用于对槲皮素的测定。
2.10干扰实验

3 结 论
本实验将纯化的单壁碳纳米管修饰玻碳电极用来检测芦丁中的槲皮素。通过电镜表征SWNT形貌,借助交流阻抗法和循环伏安法表征其修饰在电极上的导电性能,并通过微分脉冲伏安法对槲皮素的含量进行测定。其线性方程为:Ip(μA)=-0.5242-1.018c(μmol·L-1)(R2=0.9995),检出限为5.0×10-7mol·L-1,回收率在95.0%~101.0%。通过条件优化的实验,确定了最佳的实验条件。在最佳的实验条件下,槲皮素能被修饰电极检测出来。由于该电化学传感器制备简单,响应速度快,灵敏度高,稳定性和重现性较好,所以SWNTs/GCE可被用来测定槲皮素。
[1]裴凌鹏,惠伯棣,金宗濂,等. 黄酮类化合物的生理活性及其制备技术研究进展[J].食品科学,2004,25(2):203-207.
[2]MANACH C, MORANDA C, CRESPYA C, et al. Quercetin is recovered in human plasma as conjugated derivatives which retain antioxidant properties[J]. Febs Letters,1998, 426(3): 331-336.
[3]RODGERS E H, GRANT M H. The effect of the flavonoids, quercetin, myricetin and epicatechin on the growth and enzyme activities of MCF7 human breast cancer cells[J]. Chemico-Biological Interactions,1998,116(3): 213-228.
[4]HOLLMA P C, KATAN M B. Dietary Flavonids:Intake, Health Effects and Bioavai lability[J]. Food Chem Toxicol, 1999,37(9-10):93-942.
[5]裘天仙,徐长庆,李滨,等.槲皮素对阿霉素致小鼠心肌损伤的保护作用及其机制[J]. 药学学报,2007,42(10):1029-1033.
[6]PEJIC N, KUNTIC V, VUJIC Z, et al. Direct Spectrophotometric Determination of Quercetin in the Presense of Aseorbie Acid[J].Il Farmaco,2004,59(1):21-24.
[7]LEI R, XU X, YU F, et al. A method to determine quercetin by enhanced luminol electrogenerated chemiluminescence (ECL) and quercetin autoxidation[J]. Talanta, 2008, 75(4): 1068-1074.
[8]吕元琦,李玉美,李辉信.槐花和槐米中芦丁和槲皮素的毛细管电泳分析[J]. 化学分析计量,2008,17(3):16-18.
[9]DOLNIK V. Capillary electrophoresis of proteins 2003-2005[J]. Electrophoresis, 2006, 27(1): 126-141.
[10]董绍俊,车广礼,谢远武.化学修饰电极[M].北京:科学出版社,2003.
[11]岳莹,梁卿,郭勇,等.介孔碳纳米纤维修饰电极用于黄酮类化合物芦丁的电化学测定[J].分析测试学报,2012,31(8):915-921.
[12]MERKOCI A. Nanobiomaterials in electroanalysis[J]. Electroanalysis, 2007, 19(7-8): 739-741.
[13]孙延一.碳纳米管化学修饰电极测定槲皮素的研究[J].襄樊职业技术学院学报,2003,22(5):35-37.
[14]HE J B, LIN X Q, PAN J. Multi-Wall Carbon Nanotube Paste Electrode for Adsorptive Stripping Determination of Quercetin: A Comparison with Graphite Paste Electrode via Voltammetry and Chronopotentiometry[J]. Electroanalysis, 2005, 17(18): 1681-1686.
[15]周清海,黄宝华,莫金垣.聚酰胺修饰碳糊电极测定槲皮素的研究[J].分析测试学报,1998,17(6):53-55.
[16]HIURA H, EBBESEN T W, TANIGAKI K. Opening and Purification of Carbon Nanotubes in HighYields[J].AdvancedMaterials,1995(7):275-276.
[17]BRITTO P J, SANTHANAM K S V, ALONSO V, et al. Improved Charge Transfer at Carbon Nanotube Electrodes[J].Advanced Materials,1999(11):154-157.
[18]SUMIO L P, AJAYAN M, ICHIHASHI T. Growth Model for Carbon Nanotubes[J]. Physical review letters, 1992,69(21):3100-3105.
[19]IIJIMA S. Helical microtules of graphite carbon[J]. Nature,1991,354(6348):56-58.
[20]慈立杰,魏秉庆,粱吉,等.碳纳米管的制备[J].新型碳材料,1998,13(2):65-70.
[21]PEIGNEY A, LAURENT C H, FLAHAUT E,et al. SpecificcSurface Area of Carbon Nanotubes and Bundles of CarbonNanotubes[J].Carbon,2001,39:507-514.
[22]ARVAND M, ANVARI M. A graphene-based electrochemical sensor for sensitive detection of quercetin in foods[J]. Journal of the Iranian Chemical Society, 2013,10(5):841-849.
[23]余从立,何建波. 槲皮素在石蜡-石墨粉末电极上的电化学行为[J]. 化学与生物工程,2006(05):55-57.
[24]石慧霞,蒋刚,高涛,等. 槲皮素及其异构体分子的结构性质研究[J]. 化学研究与应用,2006(10):1204-1208.
[25]曾恚恚,林辉概,俞汝勤. 槲皮素荧光光度测定法的研究[J].分析试验室,1993(06):1-3.
A Single Walled Carbon Nanotubes Modified Glassy Carbon Electrode for Direct Detection of Quercetin in Plants*
ZHANG Cui-zhong, LIAN Huan, ZHANG Zhen-fa, LIU Lu, PENG Jin-yun
(Guangxi Normal University for Nationalities, Guangxi Chongzuo 532200, China)
A direct electrochemical detection of quercetin based on Single Walled Carbon Nanotubes (SWNTs)modified glassy carbon electrode was demonstrated. SWNTs electrode showed a well-defined voltammetric response to catalyze the oxidation of quercetin to quinone without the need of an enzyme. Under optimum conditions, the determination range for quercetin was from 1.5×10-6~1.3×10-5mol·L-1with a low detection limit of 5.0×10-7mol·L-1(S/N=3). Moreover, this modified electrode also displayed excellent sensitivity, fine reproducibility, stability and easy preparation. To further study the practical applicability of real samples was carried out with satisfactory recoveries.
Single Walled Carbon Nanotubes(SWNTs); quercetin; Differential Pulse Voltammetry(DPV)
广西民族师范学院校级项目(编号:2012XYYB003);国家自然科学基金资助项目(No.21465004)。
张翠忠(1981-),女,讲师,研究方向:光电化学。
O657.1
A
1001-9677(2016)01-0112-05
