β-乳球蛋白结构稳定性的光谱研究*
2016-09-01王志清董又铭于志月李慧卿
贾 慧,王志清,魏 晶,董又铭,于志月, 李慧卿
(忻州师范学院化学系,山西 忻州 034000)
科学实验
β-乳球蛋白结构稳定性的光谱研究*
贾慧,王志清,魏晶,董又铭,于志月, 李慧卿
(忻州师范学院化学系,山西忻州034000)
在pH=7的缓冲溶液及室温条件下,通过盐酸胍、尿素对β-乳球蛋白的结构稳定性进行了研究。β-乳球蛋白在盐酸胍溶液中的Cm为2.3 mol·L-1、结构稳定化能为14.051 kJ/(mol·L-1)。β-乳球蛋白可以结合与结合N-苯基-1-萘胺,结合该配体使蛋白在盐酸胍中的结构稳定化能提高到17.443 kJ/(mol·L-1)。在尿素溶液中结合N-苯基-1-萘胺后的β-乳球蛋白,其稳定化能也从14.250 kJ/(mol·L-1) 提高到17.736 kJ/(mol·L-1),与蛋白在盐酸胍溶液中的变化趋于一致。
N-苯基-1-萘胺;β-乳球蛋白;荧光光谱
β-乳球蛋白(β-LG),它是一种分子量约18.4 kD的球形蛋白,由162个氨基酸残基组成,单体由8条反平行的β带组成的β桶装结构。它是乳清蛋白的主要组成部分,具有较强的结合脂溶性维生素、脂肪酸的能力及提高这些小分子在机体中的转运效率; 在机体内清除维生素A代谢物所形成的色素沉淀,抑制酪氨酸酶活性的能力;在体内VE缺乏的情况下,它还能够显著增加肝脏中的还原型谷胱甘肽,有效提高细胞膜的抗氧化能力[1-3]。由于这些丰富的生物功能,使得其在化妆业、保健食品及医药等相关领域有着巨大的应用前途。而所有这些性质和功能是建立在β-乳球蛋白的结构基础上的,因而对其构象变化及结构稳定性的研究也一直是热点。
本文通过光谱手段测定了β-乳球蛋白在尿素、盐酸胍中遭受的构象变化,并通过比较不同浓度下空蛋白和结合配体N-苯基-1-萘胺后蛋白的吉布斯自由能,获得了二者的稳定化能。
1 实验部分
1.1试剂和仪器
N-苯基-1-萘胺,β-乳球蛋白(生物试剂),美国 Sigma公
司;其他试剂均为分析纯,购于天津市光复精细化工研究所,实验用水均为二次蒸馏水。
F-4500荧光光度计,日本日立公司;UV-2550紫外可见分光光度计,日本岛津公司;AL204电子天平,梅特勒-托利多仪器上海有限公司。
1.2光谱测定
荧光发射光谱实验:在室温下,使用1 cm荧光池,用F-4500荧光光度计测定,激发和发射狭缝宽度均为固定值10 nm。荧光发射光谱测定中激发波长Ex=280 nm,扫描范围300~600 nm。
2 结果与讨论
2.1盐酸胍对β-LG构象的影响
色氨酸残基的荧光对环境的变化非常敏感,常常作为蛋白质构象变化的指针。色氨酸荧光光谱的红移通常被认为是微环境极性增加的结果。通常认为色氨酸处于疏水环境时最大发射波长λmax=331 nm,部分暴露于水中时λmax=341 nm,完全暴露于水中 时λmax=351 nm[4]。

图1 盐酸胍对β-LG最大发射峰位的影响(CLG=1×10-6 mol·L-1)
由图1可以看出,在没有出现盐酸胍时,β-LG的色氨酸残基荧光发射在332 nm附近,表明色氨酸残基主要表现为埋在蛋白内部;随着盐酸胍浓度的增加,其波长逐渐红移。当盐酸胍浓度在2.3 mol·L-1附近时,出现明显的突跃点,当盐酸胍浓度大于4.3 mol·L-1时,其波长红移至354 nm处,显示色氨酸完全暴露于水,蛋白二级结构已经瓦解。
根据“两态模型”[5-7],变性过程中β-LG只以未变性状态N(nature)或完全变性状态D(denature)存在。有如下平衡存在:
(1)
YN+YD=1
(2)
YN,YD分别为未变性以及变性的摩尔分数。
F=YN·FN+YD·FD
(3)
FN,FD分别代表未变性以及完全变性时β-LG的荧光强度,F为任一实验点测量的荧光强度。
按照式(3)计算各实验点变性百分数,并作图。

图2 盐酸胍对β-LG构象稳定性的影响(CLG=1×10-6 mol·L-1)
如图2所示:起始时β-LG的变性较不明显,当盐酸胍浓度大于4 mol·L-1时β-LG完全变性。
由式(2)、(3)可得到式(4)、(5):
YD=(F-FN)/(FD-FN)
(4)
YN=(FD-F)/(FD-FN)
(5)
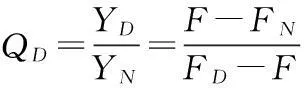
(6)
(7)
根据式(7)可求出各点变性自由能ΔGD。
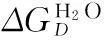

(8)
按照式(7)、(8)计算每个实验点的吉布斯自由能ΔGD。

图3 盐酸胍对蛋白构象吉布斯自由能的影响
2.2AN结合对β-LG构象的影响
2.2.1β-LG与AN的结合
在β-LG溶液中逐渐滴加AN,结果发现β-LG荧光强度随着AN增加而逐渐减弱;反之,在AN 溶液中逐渐滴加β-LG,结果发现AN的发射峰从440紫移至420 nm,荧光强度也逐渐增强,如图4所示。从滴定曲线(图5)可看出,当两者比例在1:1附近,AN的荧光强度增强变缓,从而推断,两者间形成1:1复合物。

图4 不同浓度β-LG中AN的荧光变化

图5 β-LG对AN的滴定曲线
2.2.2与AN的结合的β-LG在盐酸胍中的构象变化
在β-LG-AN复合物(CLG:CAN=1:1)溶液中逐渐加入盐酸胍,发现蛋白的最大发射波长也逐渐红移,变化趋势如图6所示。
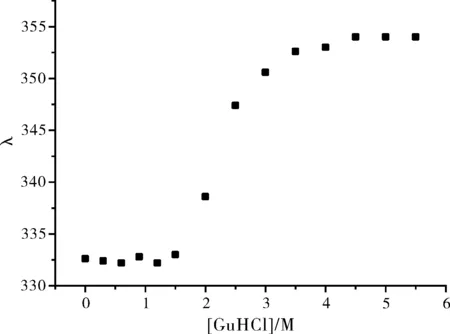
图6 盐酸胍浓度对β-LG-AN中蛋白发射波长的影响(CLG=1×10-6 mol·L-1,CAN=1×10-6 mol·L-1)
按照式(3)把图6转化为变性曲线,并计算不同浓度盐酸胍下蛋白的吉布斯自由能如图7所示。
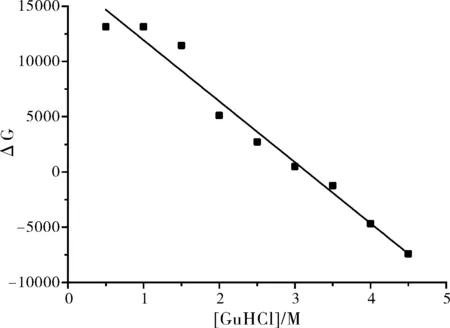
图7 盐酸胍对β-LG-AN复合物中蛋白吉布斯自由能的影响
2.3尿素对β-LG构象的影响
在尿素中比较 β-LG与 β-LG-AN的变性曲线,可以看出:类似于在盐酸胍中,蛋白结合小分子AN后,Cm从4.3 提高到5.0 mol·L-1附近,蛋白稳定性明显增强。通过计算二者在不同尿浓度下的吉布斯自由能,推出空蛋白β-LG与 结合配体后的β-LG-AN稳定化能分别为14.250和17.736 kJ/(mol·L-1),与盐酸胍溶液中推出的结果基本一致。
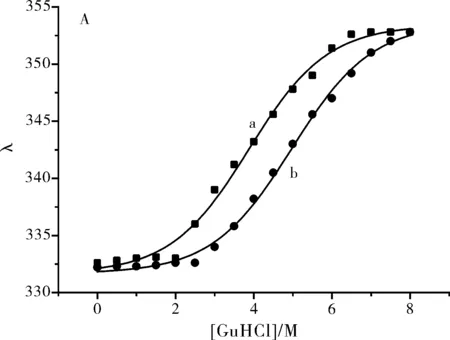
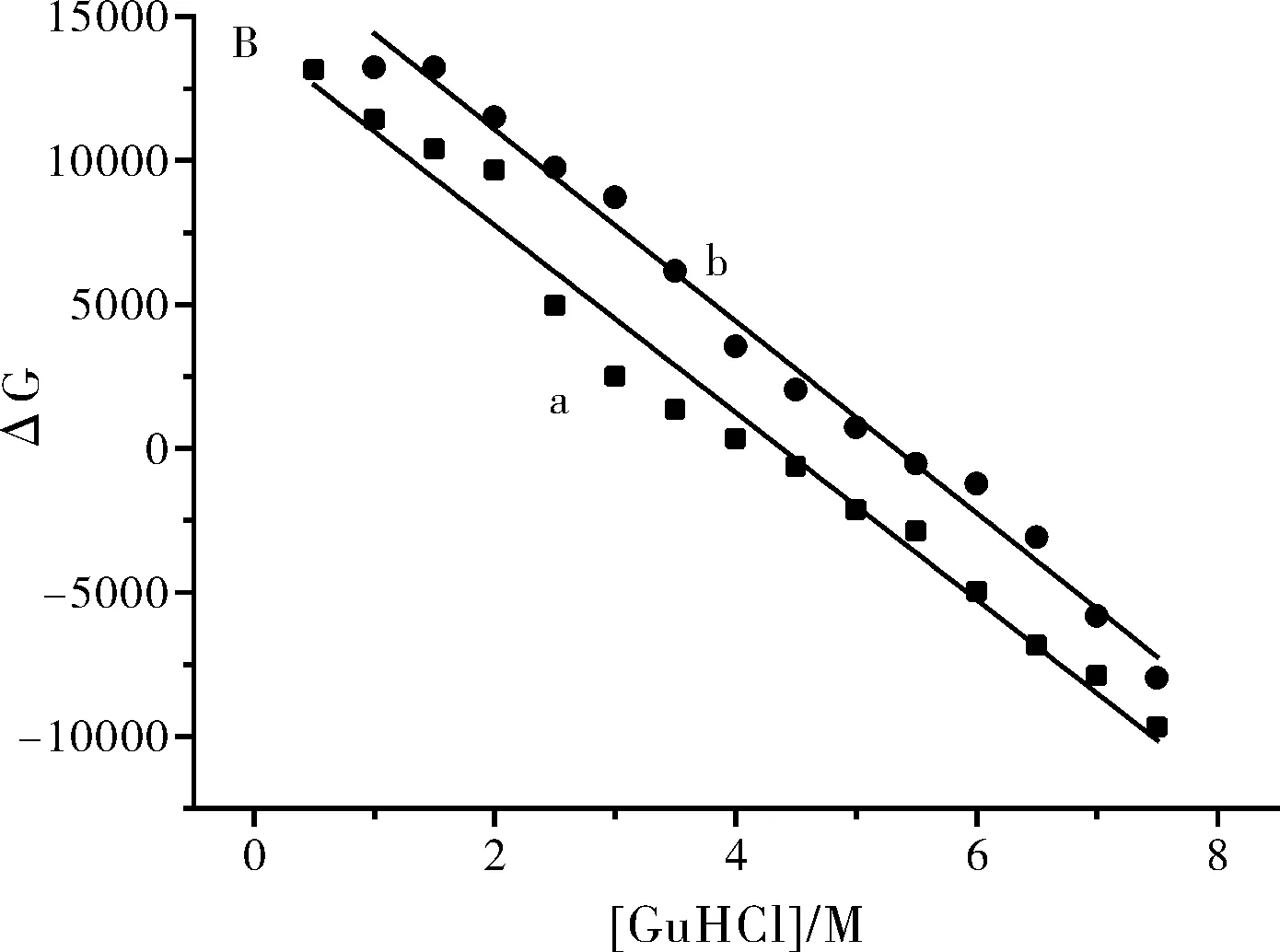
图8 β-LG (a)与 β-LG-AN (b) 在盐酸胍中的变性曲线(A)和不同浓度盐酸胍下两者的吉布斯自由能图 (B)
3 结 论

[1]MCKENZIE H A, SAWYER W H. Effect of pH on β-Lactoglobulins[J]. Nature, 1967, 214:1101-1104.
[2]STOJADINOVIC M, RADOSAVLJEVIC J, OGNJENOVIC J, et al. Binding affinity between dietary polyphenols and β-lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed[J]. Food Chemistry, 2013, 136:1263-1271.
[3]SHI L, PALLEROS D R, FINK A L. Protein conformational changes induced by 1,1’-bis(4-anilino-5-naphthalenesulfonic acid): preferential binding to the molten globule of DnaK[J]. Biochemistry, 1994, 33(24):7536-7546.
[4]马林,何维仁,黄爱民,等. 丝素蛋白在甲醇-水混合溶剂中构象变化的光谱学研究[J]. 光谱 学与光谱分析,2010,30(11):3047-3051.
[5]李向荣,郭伟,卢雁.牛血清蛋白在盐酸胍和尿素体系中变性的微量热研究[J].化学学报,2008,66(5): 515-519.
[6]LI H, ZHAO Y, YANG B. Fluorescence Spectra Study the Perturbations of CopC Native Fold by 2-p-Toluidinynaphthalene-6-sulfonate Spectrochimica[J]. Acta Part A: Molecular and Biomolecular Spectroscopy, 2009, 72:56-60.
[7]郭晓娜,姚惠源.光谱法研究变性剂对苦荞麦蛋白质构象的影响[J]. 光谱学与光谱分析,2011,31(6):1611-1614.
Spectra Study on the Stability of β-lactoglobulin*
JIA Hui, WANG Zhi-qing, WEI Jing, DONG You-ming, YU Zhi-yue, LI Hui-qing
(Chemistry Department, Xinzhou Teachers’ University, Shanxi Xinzhou 034000, China)
The stability of β-lactoglobulin (β-LG)in guanidine hydrochloride(GuHCl) acid or nrea solution was investigated by fluorescence spectroscopy at room temperature in pH 7.0 phosphate buffer. The denaturation transition midpoint of β-LG in GuHCl (Cm) was 2.3 mol·L-1, the free energy of stabilization was 14.051 kJ/(mol·L-1). β-LG can binding N-phenyl-1-naphthylamine (AN). Thus, the free energy of stabilization was increased to 17.443 kJ/(mol·L-1), and it was consistent with the free energies of stabilization of the β-LG (14.250 kJ/(mol·L-1)) and β-LG-AN complex (17.736 kJ/(mol·L-1)) obtained from urea.
β-lactoglobulin;N-phenyl-1-naphthylamine;the free energy of stabilization
山西省自然基金项目(No:2014011014-2);山西省高等学校大学生创新创业训练项目(No:2014393);忻州师院化学化工创新基地项目。
李慧卿(1972-),女,博士,副教授,主要从事生物分子研究。
O657
A
1001-9677(2016)01-0048-03
