Serratiamarcescens非特异性核酸酶研究进展
2016-09-01顾剑飞石陆娥
张 瑜,郑 伟,顾剑飞,石陆娥
(杭州师范大学生命与环境科学学院,浙江 杭州 310016)
Serratiamarcescens非特异性核酸酶研究进展
张瑜,郑伟,顾剑飞,石陆娥
(杭州师范大学生命与环境科学学院,浙江杭州310016)
Serratiamarcescens核酸酶是一种非特异性核酸内切酶,可降解不同形式的DNA和RNA。本文综合国内外的研究概况,主要介绍了Serratiamarcescens非特异性核酸酶的水解位点、催化机制及其降解底物的特点,另外也阐述了Serratiamarcescens非特异性核酸酶的原核表达的研究以及其应用现状,为Serratiamarcescens非特异性核酸酶更深层次的研究提供理论基础。
Serratiamarcescens;非特异性核酸酶;催化机制;原核表达;应用
非特异性核酸内切酶是一类高活性水解酶,其最大的特点是能非特异地降解几乎所有类型的核酸,包括单链、双链、线状及环状的DNA和RNA,且对核酸的序列没有严格的要求。到目前为止,研究人员已从病毒、细菌、真菌和动物中分离得到30余种非特异性核酸酶[1],其中Serratiamarcescens非特异性核酸酶(SMNE)来源于粘质沙雷氏菌,是一种分泌至胞外的磷酸二酯酶,具有广阔的应用前景。
1 SMNE的结构
SMNE的一级、二级、三级和四级结构均已被证实[2-5]。通过沉降速度实验、交联研究、动态光散实验及X-射线晶体分析均证明SMNE是由两个相同的亚基通过羧基末端的氨基酸残基通过互补作用聚合而成,且两个亚基中的H184残基之间的相互作用占主导地位。由图1A所示,在聚合的两个亚单位接触面,A亚基的His-174和B亚基的Ser-179通过非共价连接相互作用。图1B所示,A亚基的Ser179,Pro180,Ala181,Val182和Asn183形成一定的空间结构与B亚基的His184互补聚合[6]。
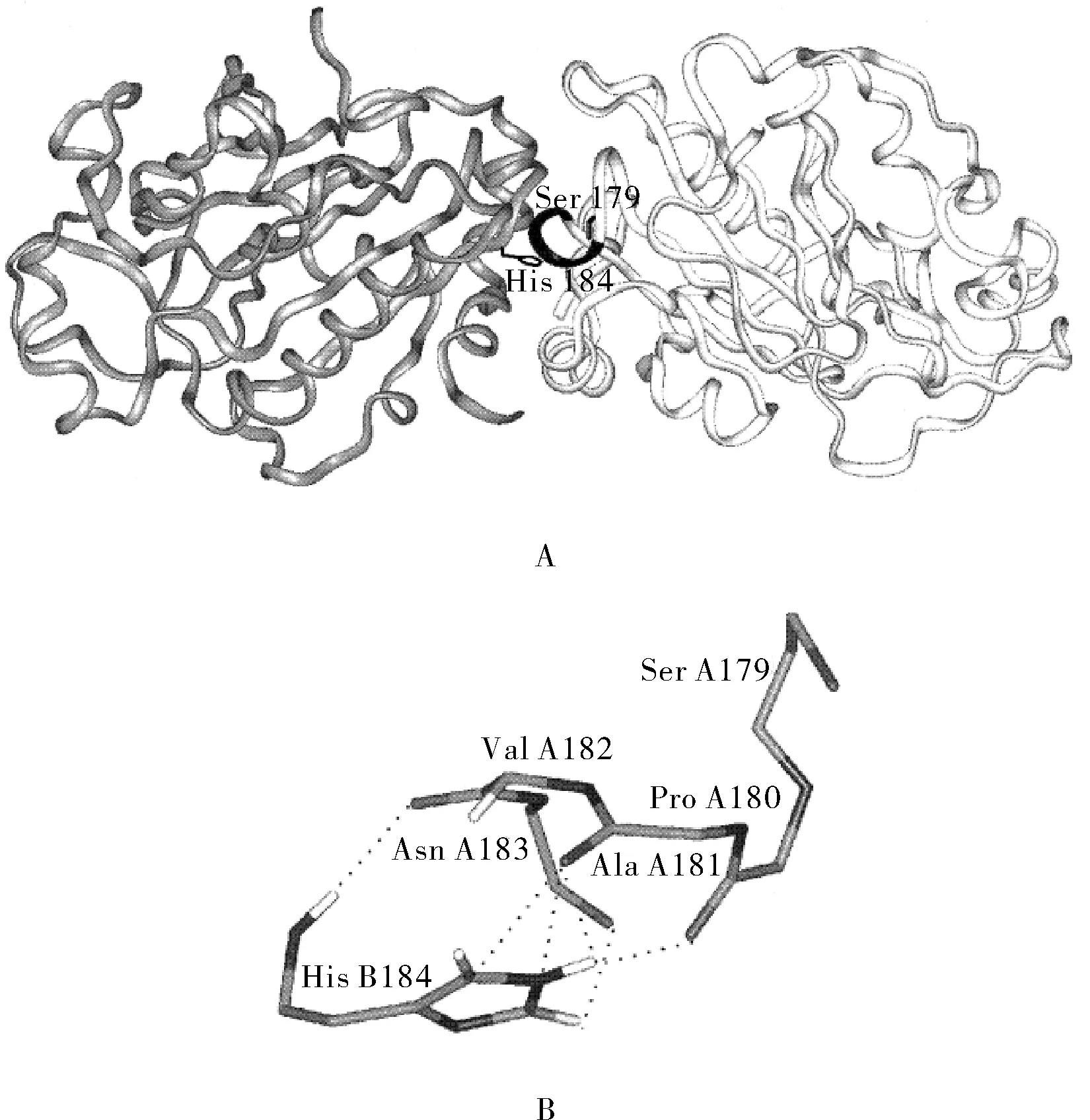
图1 Serratia marcescens非特异性核酸酶的结构
2 SMNE降解核酸
2.1核酸酶的催化作用
DNA中的磷酸二酯键极其稳定,在25 ℃,pH 7.0的中性水溶液中半衰期可达千亿年。磷酸二酯键的高度稳定性被认为是核酸作为遗传物质的重要原因之一。若使DNA中的磷酸二酯键在数分钟之内发生水解则要求催化剂能够提供高达1017数量级的速率增强因子[7]。天然核酸酶能加速磷酸二酯键1012~1017倍的水解速率,其催化性均靠直接的亲核取代反应及构象转换来实现,这一原则普遍适用于限制性内切酶和非特异性核酸酶。非特异性核酸酶催化磷酸二酯键水解实质也是一个亲核取代过程,该过程可简单描述为两步(图 2)。第一步,金属离子活化后的水分子解离产生氢氧根离子,氢氧根离子作为亲核试剂攻击磷原子,形成一个五配位的中间物,这一步是可逆性的;第二步,P-O键发生断裂,带有3’-羟基的2’-核苷酸离去,形成产物。上述过程中涉及三种基团:活化亲核水分子的广义碱,稳定五价过渡态磷原子上负电荷的Lewis酸(通常为二价金属离子)和促进3'-羟基离去的广义酸[8]。

图2 磷酸二酯键水解简化两步示意图
2.2SMNE的催化机制
在非特异性核酸酶中,与催化功能相关的基团通常是由位于活性中心的一些特定氨基酸残基或二价金属离子。Miller等[9]发现SMNE的两个活性位点在裂解核酸的过程中可以独立的发挥作用。Biedermann[10]等研究发现SMNE的催化活性很高,在它的催化中心,Mg2+与Asn119结合,His89作为广义的碱,活化亲核水分子。Arg 57残基参与过渡态的稳定,而水化的Mg2+作为Lewis酸,稳定5价过渡态P原子上的负电荷,起质子化离去基团的作用[11]。
SMNE的活性中心参与催化作用的氨基酸残基为Arg 57,His89,Asn119和Glu127[12]。另外Tyr76和Trp123在所有Serratia核酸酶家族分子的活性位点较为保守,可能是由于核酸残基间的堆积作用,这些氨基酸残基的芳香侧链可能在核酸酶与底物结合时发挥作用。Gregor等[13]获得了几种SMNE突变型分子,将Tyr76和Trp123分别突变为Ala和Phe,记作Y76A、Y76F、W123A和W123F。用野生型的酶分子作为对照,结果表明,突变体Y76A和W123A分别引起催化活性降低了104和25倍,而Phe突变体只引起催化活性的略微改变。
2.3SMNE对底物的选择性
非特异性核酸酶虽然对底物没有特殊的要求,但其降解核酸时也并非绝对的无碱基优先。通过对非特异性核酸酶ColocinE7[14]的研究表明,在核酸酶的诱导下,DNA骨架容易发生变形的位点更易被核酸酶水解,且通过点突变对ColicinE7进行改造后,其优先水解的位点也可以得到改变,而且核酸酶的活力也得到了提高。
SMNE虽然对底物的特异性要求较低,能降解单链、双链、线状、环状和超螺旋形式的DNA和RNA,产生5’-磷酸化的单核苷酸、 二核苷酸、三核苷酸和四核苷酸,但对Poly结构的DNA和RNA降解效率较低。这些特殊结构的DNA和RNA分别作为SMNE的底物时,SMNE无法降解PolyU, PolyG和PolyC结构的底物,也不降解Poly[d(A)]和Poly[d(T)]结构的底物,可微量降解PolyA结构和PolyA·PolyU结构的底物,但可高效降解Poly(I)·Poly(C)这种结构的底物[15]。相对于嘌呤DNA作为底物,其表现出对嘧啶DNA作为底物的偏爱性[16]。
SMNE对底物的降解表现出序列偏爱性[15]。Gregor等设计不同的DNA作为此种核酸酶的底物。在给定的条件下,SMNE倾向于降解dsDNA中GC含量高的序列[17],尤其是d(G)·d(C)序列,不降解d(A)·d(T)序列。当改变反应体系中的一些指标,SMNE对序列的选择性发生相应的改变。
3 SMNE的原核表达
SMNE来源于粘质沙雷氏菌(Serratiamarcescens),而粘质沙雷氏菌是一种致病菌,其培养菌液用于核酸酶的分离纯化存在潜在的风险,因此有必要探索该酶安全高效的重组表达体系。由于核酸酶的胞内表达可能造成重组核酸酶自身核酸的降解而对宿主细胞产生毒性,因此已报道的SMNE的重组表达均采用胞外分泌的方式,但表达效率较低,每升仅可生产1.23×104U的酶。张开俊等[18]通过合成SMNE的基因,应用PCR技术在基因的5'端引入6个组氨酸标签序列,将其插入分泌表达载体pET-20b(+)中并转化到大肠杆菌BL21(DE3)pLysS中,IPTG诱导表达SMNE,表达产物经镍离子螯合琼脂糖凝胶进一步纯化后,重组蛋白的表达量为8.0 mg/L,纯度达到95%,比活达1.1×106U/mg,成功的构建了SMNE的原核高效表达体系。陈鹏等[19]以粘质沙雷氏菌的基因组DNA为模板,PCR扩增非特异性核酸酶(NU)的基因,并克隆到pMAL-c4X载体上构建重组表达载体,重组质粒转化到大肠杆菌BL21,经IPTG诱导实现胞内78 kDa的麦芽糖结合蛋白-NU融合蛋白,其最佳诱导表达条件为37 ℃,0.75 mmol/L 诱导时间1.5 h。
4 SMNE的应用
非特异性核酸酶已在各领域得到非常普遍的应用,在工业领域中最主要的应用是生物制品中外源核酸的去除[19-20]。在治疗用重组生物制品的质量标准中,外源性核酸的残留量是一个重要的指标,直接关系到产品的安全性。美国FDA和我国SFDA对其残留量的要求越来越严格。美国FDA制定的治疗用重组生物制品生产准则规定,成品的外源性核酸残留量应不超过100 pg/剂[21-22]。此外,SMNE在遗传机制方面[23]的应用有避免突变、DNA修复、DNA复制和重组、为生长代谢清除核苷和磷酸、宿主防御外源的核酸分子、病毒感染宿主的建立和细胞凋亡等[24];在医药方面如治疗肿瘤[25]、纤维性囊肿、红斑性狼疮、儿童急性气喘[26]等;分子研究方面如核酸结构的检测、RNA的快速检测、抗病毒试剂的应用等[27]。SMNE已有商品化的产品Benzonase,主要用途是在蛋白质纯化的过程中消除核酸的污染,加入该核酸酶可以减小加工处理过程中蛋白样品的粘稠度。
5 展 望
利用定点突变等技术,结合蛋白质的空间结构研究SMNE的酶学性质,有望为SMNE的功能进化研究奠定一定的理论基础。SMNE的催化高效性使得其在生物技术领域中具有较为积极的应用价值,尤其是SMNE在蛋白质纯化过程中消除核酸污染方面的显著效果。利用比较成熟的定向进化技术,如DNA改组、易错PCR等基因突变和高通量筛选等方法,有望加快SMNE的工业化应用。由于核酸酶本身会对宿主细胞造成强的毒害作用,因此构建其原核表达系统以获得更高核酸酶的表达量有望成为研究的热点之一。
[1]Li L,Shumei L,Feng Y.Functional identification of the non-specific nuclease from white spot syndrome virus[J].Virology,2005,337(2):399-406.
[2]Ball TK,Saurugger PN,Benedik M J.The extracellular nuclease gene ofSerratiamarcescensand its secretion from Escherichia coli[J].Gene,1987,57(2-3):183-192.
[3]Friedhoff P,Gimadutdinow O,Pingoud A.Identification of catalytically relevant amino acids of the extracellularSerratiamarcescensendonuclease by alignment-guided mutagenesis[J].Nucleic Acids Research,1994,22(16):3280-3287.
[4]Miller MD,Tanner J,Alpaugh M,et al.A structure ofSerratiaendonuclease suggests a mechanism for binding to double-stranded DNA[J].Nature Structural Biology,1994,1:461-468.
[5]Miller MD,Krause KL.Identification of the Serratia endonuclease dimer:structural basis and implications for catalysis[J].Protein Science A Publication of the Protein Society,1996,5(1):24-33.
[6]Franke I,Meiss G,Blecher D,et al.Genetic engineering, production and characterisation of monomeric variants of the dimericSerratiamarcescensendonuclease[J].Febs Letters,1998, 425(3):517-522.
[7]Williams NH,Takasaki B,Wall M, et al.Structure and Nuclease Activity of Simple Dinuclear Metal Complexes: Quantitative Dissection of the Role of Metal Ions[J].Accounts of Chemical Research,1999,32(33):485-493.
[8]高飞,阴彩霞,杨频.核酸酶催化磷酸二酯键水解断裂的配位化学模拟[J].科学通报,2004,49(15):1472-1482.
[9]Deng P,Tan X,Wu Y,et al.Cloning and sequence analysis demonstrate the chromate reduction ability of a novel chromate reductase gene fromSerratiasp.[J].Experimental&Therapeutic Medicine,2015,9(3):795-800.
[10]Zhu Y,Li H,Hui N,et al.Molecular cloning and characterization of a thermostable lipase from deep-sea thermophile Geobacillus sp.EPT9[J].World Journal of Microbiology&Biotechnology, 2015,31(2):295-306.
[11]Friedhoff P,Franke I,Meiss G,et al.A similar active site for non-specific and specific endonucleases[J].Nature Structural Biology,1999,6(2):112-113.
[12]Friedhoff P, Meiss G, Kolmes B,et al.Kinetic analysis of the cleavage of natural and synthetic substrates by theSerratianuclease[J].European Journal of Biochemistry,1996,241(2):572-580.
[13]Meiss G,Gimadutdinow O,Haberland B,et al.Mechanism of DNA cleavage by the DNA/RNA-non-specific Anabaena sp. PCC 7120 endonuclease NucA and its inhibition by NuiA[J].Journal of Molecular Biology,2000,297(2):521-534.
[14]Yi-Ting W,Wei-Jen Y,Chia-Lung L,et al.Structural basis for sequence-dependent DNA cleavage by nonspecific endonucleases[J].Nucleic Acids Research,2007,35(2):584-594.
[15]Zhang F,Zhu D,Xie L, et al.Molecular epidemiology of carbapenemase-producing Escherichia coli and the prevalence of ST131 subclone H30 in Shanghai,China[J].European Journal of Clinical Microbiology&Infectious Diseases,2015,34:1-7.
[16]Dawid G,Dariusz P,Sulej AA,et al.Sequence-specific cleavage of dsRNA by Mini-III RNase[J].Nucleic Acids Research,2015,43:2864-2873.
[17]Meiss G,Friedhoff PM,Gimadutdinow O,et al.Sequence preferences in cleavage of dsDNA and ssDNA by the extracellularSerratiamarcescensendonuclease[J].Biochemistry,1995, 34(37):11979-119788.
[18]张开俊,杨莉.Serratiamarcescen非特异性核酸内切酶的原核表达及其应用[J].中国生物制品学杂志,2009(7):667-670.
[19]陈鹏,杨海艳,李慧婧,等.灵杆菌非特异性核酸酶的原核表达、纯化及活性分析[J].生物工程学报,2011(8):1247-1257.
[20]Benedik MJ,Strych U.Serratia marcescens and its extracellular nuclease[J].Fems Microbiology Letters,1998,165(1):1-13.
[21]Cooke GD,Cranenburgh RM,Hanak JAJ,et al.A modified Escherichia coli protein production strain expressing staphylococcal nuclease, capable of auto-hydrolysing host nucleic acid[J].Journal of Biotechnology,2003,101(3):229-239.
[22]Xing DKL,Corbel MJ,Dobbelaer R,et al.WHO working group on standardisation and control of acellular pertussis vaccines-report of a meeting held on 16-17 March 2006,St.Albans,United Kingdom[J].Vaccine,2007,25(15):2749-2757.
[23]Song Q,Zhang X.Characterization of a novel non-specific nuclease from thermophilic bacteriophage GBSV1[J].Bmc Biotechnology,2008,8(4):43.
[24]Oliveri M,Daga A,Lunardi C,et al.DNase I behaves as a transcription factor which modulates Fas expression in human cells[J].European Journal of Immunology,2004,34(1):273-279.
[25]陶风云,赵伟,林强,等.中国林蛙卵核糖核酸酶的分离纯化及其抗肿瘤作用[J].中国生物工程杂志,2010,30(5):103-109.
[26]陶风云,赵伟,林强,等.中华眼镜蛇毒核糖核酸酶的分离纯化及其特殊生物学活性[J].中国生化药物杂志,2010,31(3):145-149.
[27]Durward A,Forte V,Shemie SD.Resolution of mucus plugging and atelectasis after intratracheal rhDNase therapy in a mechanically ventilated child with refractory status asthmaticus[J].Critical Care Medicine,2000,28(2):560-562.
Reseach Progress onSerratiamarcescensNon-specific Nuclease
ZHANGYu,ZHENGWei,GUJian-fei,SHILu-e
(College of Life and Environmental Sciences, Hangzhou Normal University, Zhejiang Hangzhou 310016,China)
Serratiamarcescensnuclease is a non-specific endonuclease, which is able to cleave different forms of DNA and RNA. The cleavage sites and the catalytic mechanism of the non-specific nuclease ofSerratiamarcescen, its characteristics of the degrade substrate were mainly summarized. In addition, the research on prokaryotic expression and application of this nuclease was briefly introduced in order to provide the theoretical basis for further research ofSerratiamarcescensnon-specific nuclease.
Serratiamarcescens; non-specific nuclease; catalytic mechanism; prokaryotic expression; application
张瑜(1991-),女,硕士研究生,主要从事微生物资源的开发利用研究。
石陆娥(1979-),女,副教授,博士,主要从事微生物工程、分子生物学等方面的研究。
Q71
A
1001-9677(2016)05-0016-03
