鸡肉干中金刚乙胺和3,5-二甲基金刚胺残留量的测定
2016-09-01王智玮
王智玮
(上海天祥质量技术服务有限公司,上海 200233)
鸡肉干中金刚乙胺和3,5-二甲基金刚胺残留量的测定
王智玮
(上海天祥质量技术服务有限公司,上海200233)
采用固相萃取柱对样品中的金刚乙胺和3,5-二甲基金刚胺进行浓缩与净化,建立了一种灵敏测定鸡肉干中金刚乙胺和3,5-二甲基金刚胺残留量的超高效液相色谱-质谱串联仪法。试验结果表明,采用MCX固相萃取柱进行富集与净化,金刚乙胺和3,5-二甲基金刚胺在1~20 μg/L浓度范围内与其响应值呈良好的线性关系,检出限均为0.5 μg/kg。该方法分析速度快,灵敏度高,重复性好,适用于动物源食品中金刚乙胺和3,5-二甲基金刚胺残留量的测定。
金刚乙胺;3,5-二甲基金刚胺;美金刚;超高液相色谱-串联质谱法
金刚乙胺和3,5-二甲基金刚胺,属于金刚烷胺类,3,5-二甲基金刚胺又称美金刚。金刚烷胺类属于三环胺类抗病毒药物,在人类上有广泛应用。据其药理作用,国内现在主要将金刚烷胺类药物用于鸡、猪流感的预防和早期治疗,及猪传染性胃肠炎的防治。但是,将人用抗病毒药物用于畜禽,不仅容易导致动物性食品中药物残留、动物中毒、动物机体产生免疫抑制和耐药性等问题,还可导致病毒发生变异, 影响动物疫病控制及人用抗病毒药物的有效性[1-3]。我国于2005 年 12 月发布《关于清查金刚烷胺等抗病毒药物的紧急通知》,禁止金刚烷胺等抗病毒药作为兽用药,但由于其价格低廉、效果良好,仍有不法分子大量使用金刚烷胺类药物用于动物疾病的预防和治疗。滥用金刚烷胺类药物会导致动物中毒,使病毒产生不同程度的耐药性,并诱发病毒产生变异,严重影响了国家动物疫病防控工作[4]。我国对于动物源性食品中金刚烷胺残留含量的相关研究报道较少,少数的报道主要集中在液相色谱法[5]、气相色谱法[6-10]和液相色谱-串联质谱法[11-15],也未曾制定或立项过国家标准。因此,研究建立动物源食品中金刚烷胺类的残留检测方法具有重要意义。
1 实 验
1.1仪器与试剂
AB 4500超高效液相色谱-质谱联用仪;XS105分析天平,METLER;XW-80A涡旋混合器,上海精科;SF-DL-4M冷冻离心机,上海菲恰尔分析仪器有限公司;SK3300HP超声波清洗器,KUDOS;N-EVAP111氮吹仪,ASSOCIATES;57265固相萃取装置,SUPELCO。
甲醇、异丙醇和甲酸为色谱纯,盐酸、正己烷、三氯乙酸、氨水和乙酸铵为分析纯,实验用水为去离子水。盐酸金刚乙胺、3,5-二甲基金刚胺和盐酸金刚烷胺-D15,购自德国Dr. Ehrenstorfer公司。
1.2标准溶液配制
1.2.1标准储备液
准确称量1.0 mg金刚烷胺-d15标准品至5 mL容量瓶中,用甲醇溶解并定容,混匀,浓度为200 μg/mL。-18 ℃保存12个月。
分别准确称量金刚乙胺和3,5-二甲基金刚胺标准品至50 mL 容量瓶中,用甲醇溶解并定容,混匀,浓度均为200 μg/mL。-18 ℃保存12个月。
1.2.2标准中间液
精确吸取金刚烷胺-d15储备液0.25 mL至50 mL的容量瓶中,用甲醇定容,混匀,浓度为1.0 μg/mL。-18 ℃保存6个月。
精确吸取标准储备液0.25 mL至50 mL的容量瓶中,用甲醇定容,混匀,金刚乙胺和3,5-二甲基金刚胺浓度均为1.0 μg/mL。-18 ℃保存6个月。
1.2.3标准工作液的配制
从标准中间液中分别吸取0.01 mL、0.02 mL、0.05 mL、0.1 mL、0.2 mL至10 mL容量瓶中,再从金刚烷胺-d15标准中间液中分别吸取0.25 mL至10 mL容量瓶中,用水定容,混匀,金刚乙胺和3,5-二甲基金刚胺浓度为1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL,内标金刚烷胺-d15浓度为25.0 ng/mL。标准工作液现配现用。
1.3样品制备
准确称取2 g(精确到0.01 g)试样至50 mL塑料离心管中,加入内标(金刚烷胺-D15,浓度为1.0 μg/mL)0.025 mL,再加入10 mL甲醇:1%三氯乙酸(1:1),涡旋振荡1 min,超声30 min,4000 r/min冷冻离心15 min。上清液转移至另一50 mL 离心管中,加入5 mL正己烷轻微振摇3 min,4000 r/min冷冻离心5 min,除去上层正己烷层,取下层液待净化。取下层液转移至已活化(用3 mL甲醇,3 mL水活化)MCX固相萃取柱中,依次用3 mL 0.1 mol/L盐酸溶液、3 mL甲醇淋洗,弃去全部流出液,在负压下干燥5 min,然后用5 mL氨水-甲醇-异丙醇(5+80+15)洗脱。收集洗脱液于45 ℃ 氮吹至干,精密加入1 mL水至残渣中,涡旋振荡溶解残渣,如浑浊,以13000 r/min离心10 min,取上清液供LC-MS/MS测定。
1.4仪器条件
1.4.1液相条件
色谱柱:C18柱(100 mm×2.1 mm,1.8 μm)或相当者;
流动相:A相5 mmol/L乙酸铵水溶液(含0.1%甲酸),B相甲醇。
流速:0.3 mL/min;
进样量:5 μL;
柱温:30 ℃。
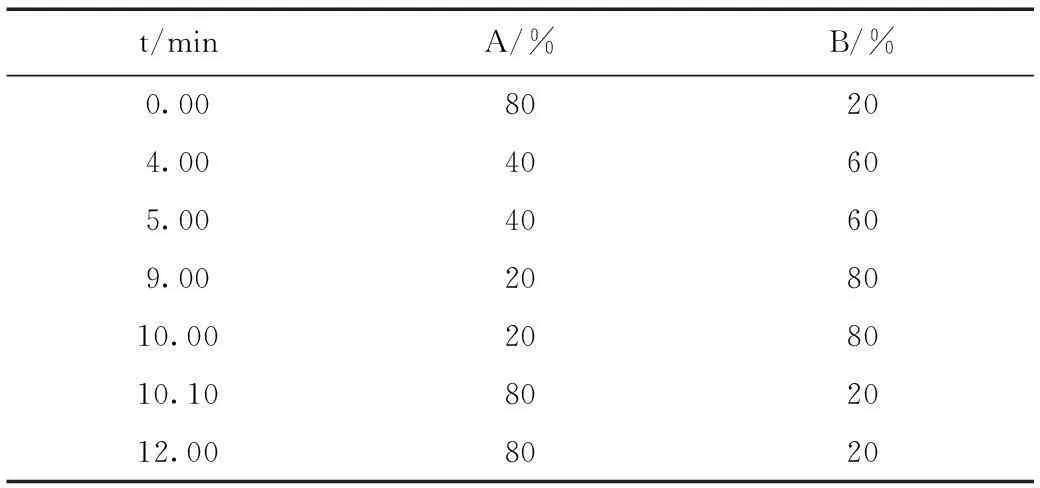
表1 流动相梯度条件Table 1 The elution conditions of mobile phase
1.4.2质谱条件
离子源:电喷雾ESI离子源;
扫描方式:正离子扫描;
检测方式: MRM;
电喷雾电压:5500 V ;
雾化气压力:50 psi;
气帘气压力:35 psi;
辅助气压力:50 psi;
碰撞气压力:9 psi;
离子源温度:500 ℃;
碰撞室入口电压:10 V;
碰撞室出口电压:6 V。
监测离子对情况见表2。
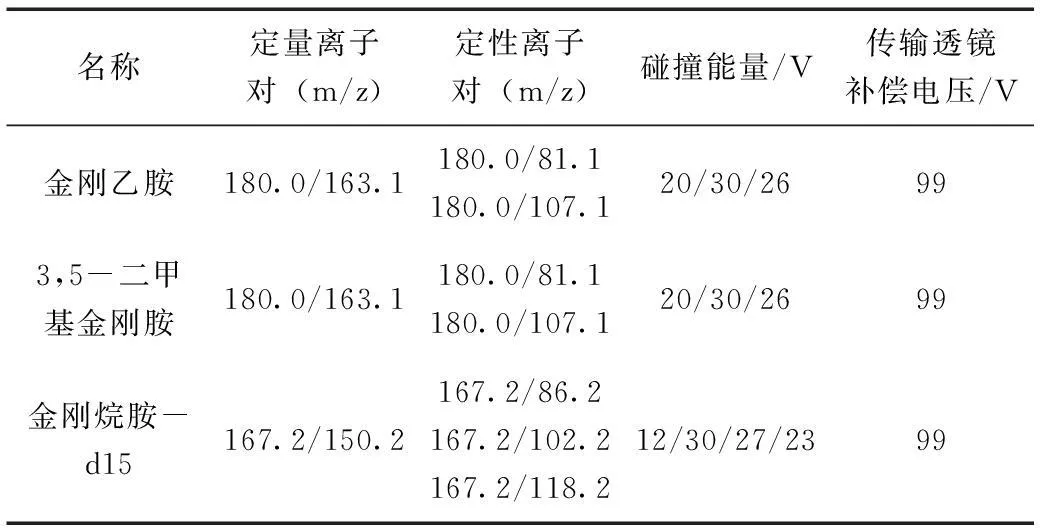
表2 金刚乙胺和3,5-二甲基金刚胺及金刚烷胺-d15的离子对Table 2 The MS parameters for detecting rimantadine and memantine
2 结果与讨论
2.1线性关系及检出限
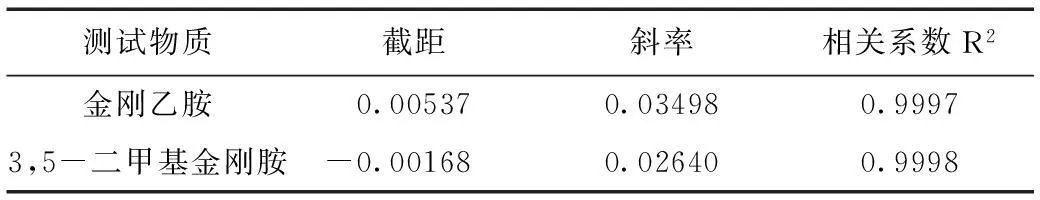
表3 测试结果Table 3 Testing results of calibration curve
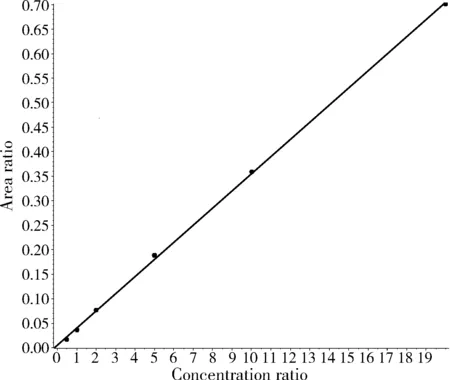
图1 金刚乙胺标准曲线Fig.1 The standard curve of rimantadine
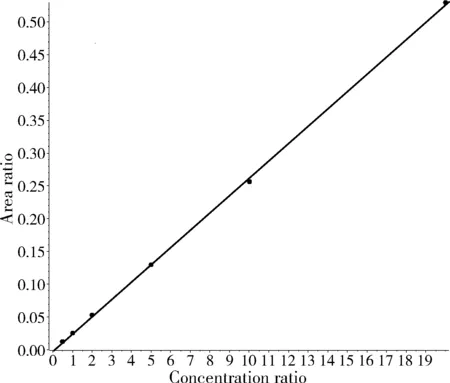
图2 3,5-二甲基金刚胺标准曲线Fig.2 The standard curve of memantine
准确移取金刚乙胺和3,5-二甲基金刚胺储备液适量,用水稀释成一系列的标准工作液,其浓度分别为0.5、1.0、2.0、5.0、10、20 μg/L。以标准溶液中被测组分峰面积为纵坐标,以浓度为横坐标,绘制标准曲线。平行测定10次空白试剂加标(1.0 ng/mL)的标准偏差为Sb,检出限CL=3Sb,得出该方法的检出限为0.5 μg/kg。
线性方程为:
金刚乙胺:y=0.03498x+0.00537 (r=0.99974)
3,5-二甲基金刚胺:y=0.02640x+-0.00168(r=0.99985)
2.2回收率
本方法选择鸡肉干作为加标基质。分别选取0.5 μg/kg、2.5 μg/kg、10 μg/kg进行加标回收实验,每个水平重复测定7次,加标情况见表4、表5,回收率见表6、表7。
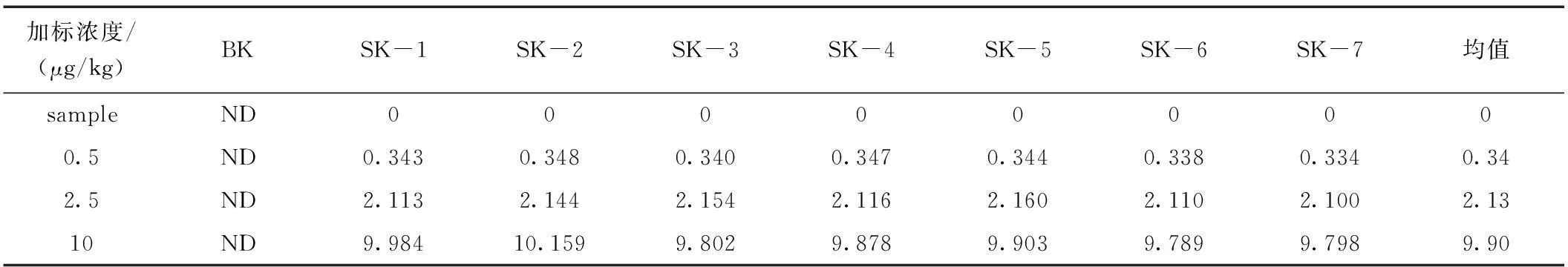
表4 鸡肉干中金刚乙胺的加标情况Table 4 Measured values of Rimantadine in chicken dry
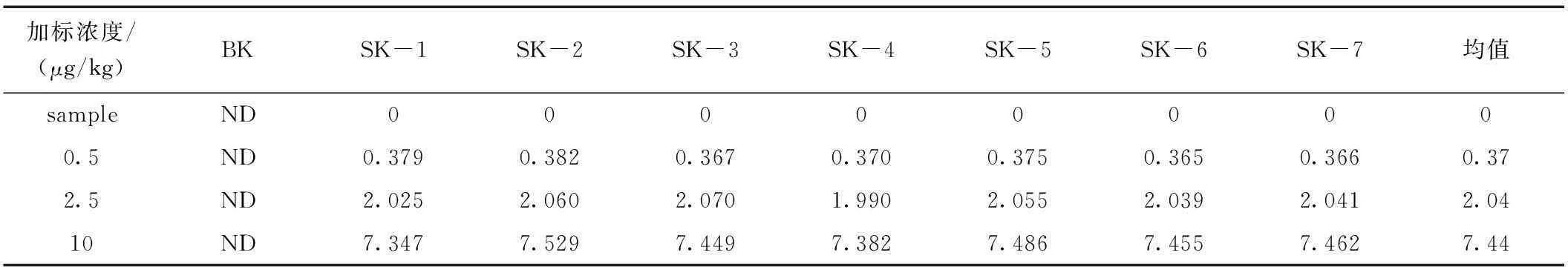
表5 鸡肉干中3,5二甲基金刚胺的加标情况Table 5 Measured value of Memantine in chicken dry
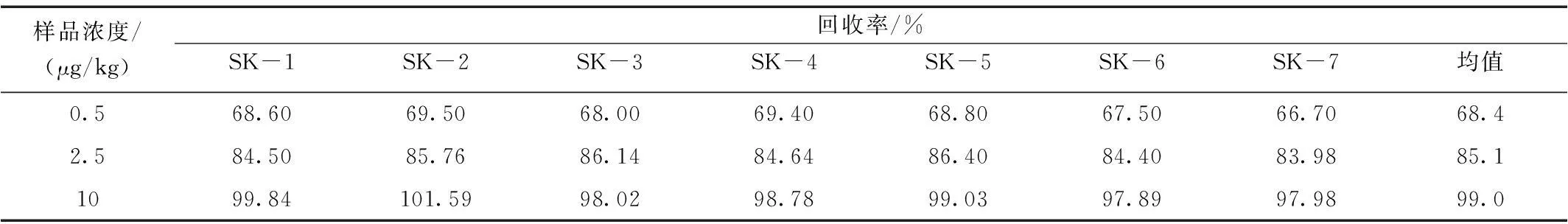
表6 鸡肉干中金刚乙胺加标回收Table 6 The recovery rate of Rimantadine in chicken dry
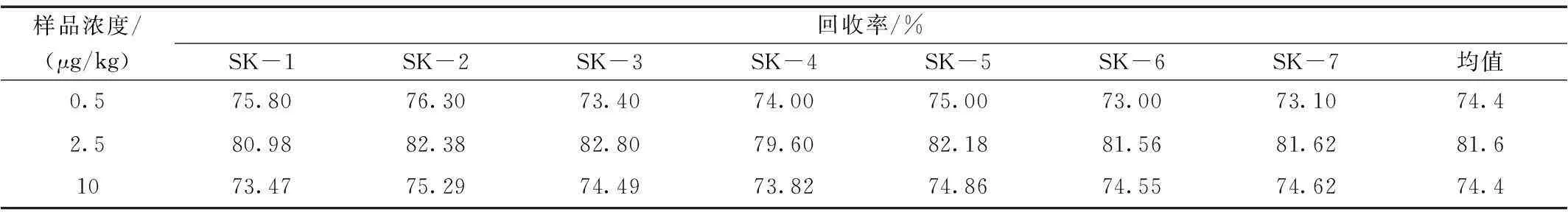
表7 鸡肉干中3,5-二甲基金刚胺加标回收Table 7 The recovery rate of Memantine in chicken dry
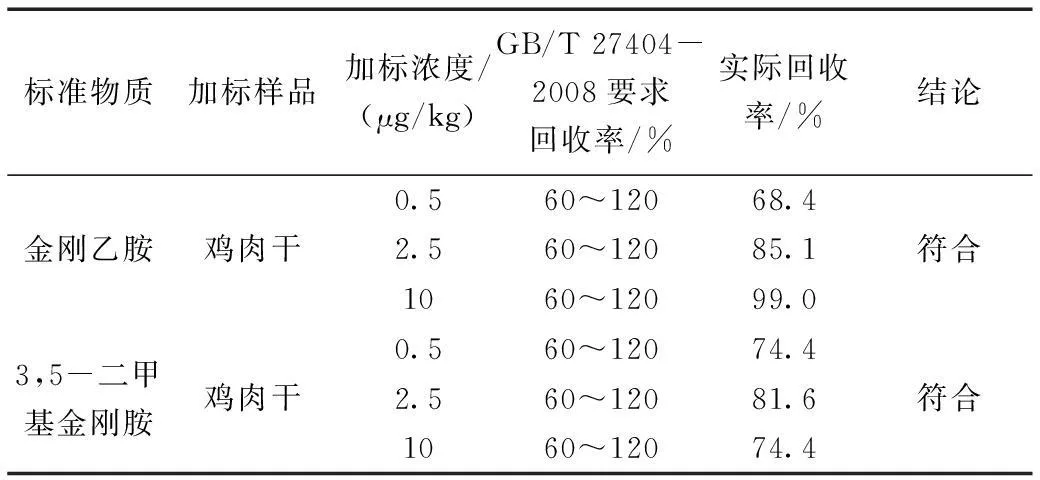
表8 基质加标一览表Table 8 The recovery rate list
2.3实验谱图
2.3.1标准物质色谱图(0.5 ng/mL)
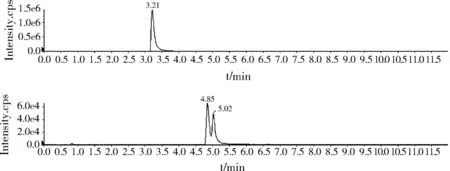
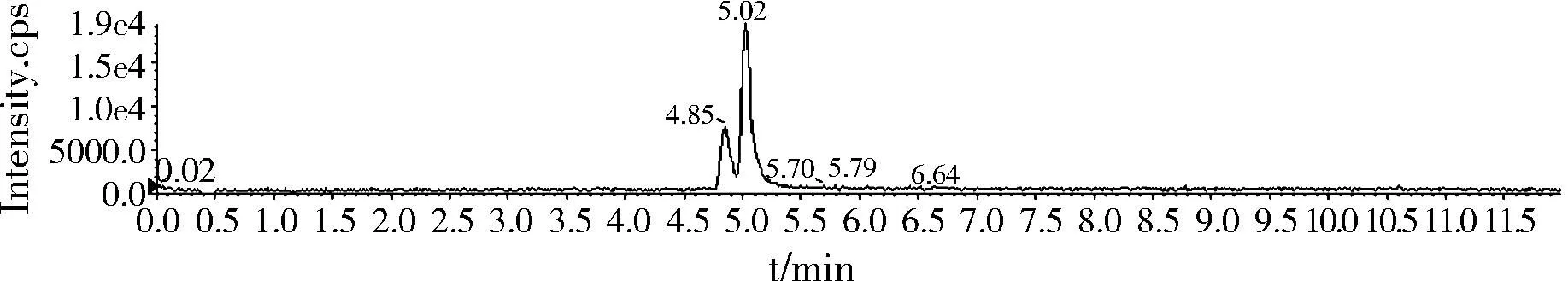
图3 0.5 ng/mL标准物质色谱图Fig.3 The UPLC-MS/MS of rimantadine and memantine (0.5 ng/mL)
金刚乙胺和3,5二甲基金刚胺为同分异构体,4.85 min为金刚乙胺,5.02 min为3,5-二甲基金刚胺。
2.3.2空白基质色谱图(鸡肉干)
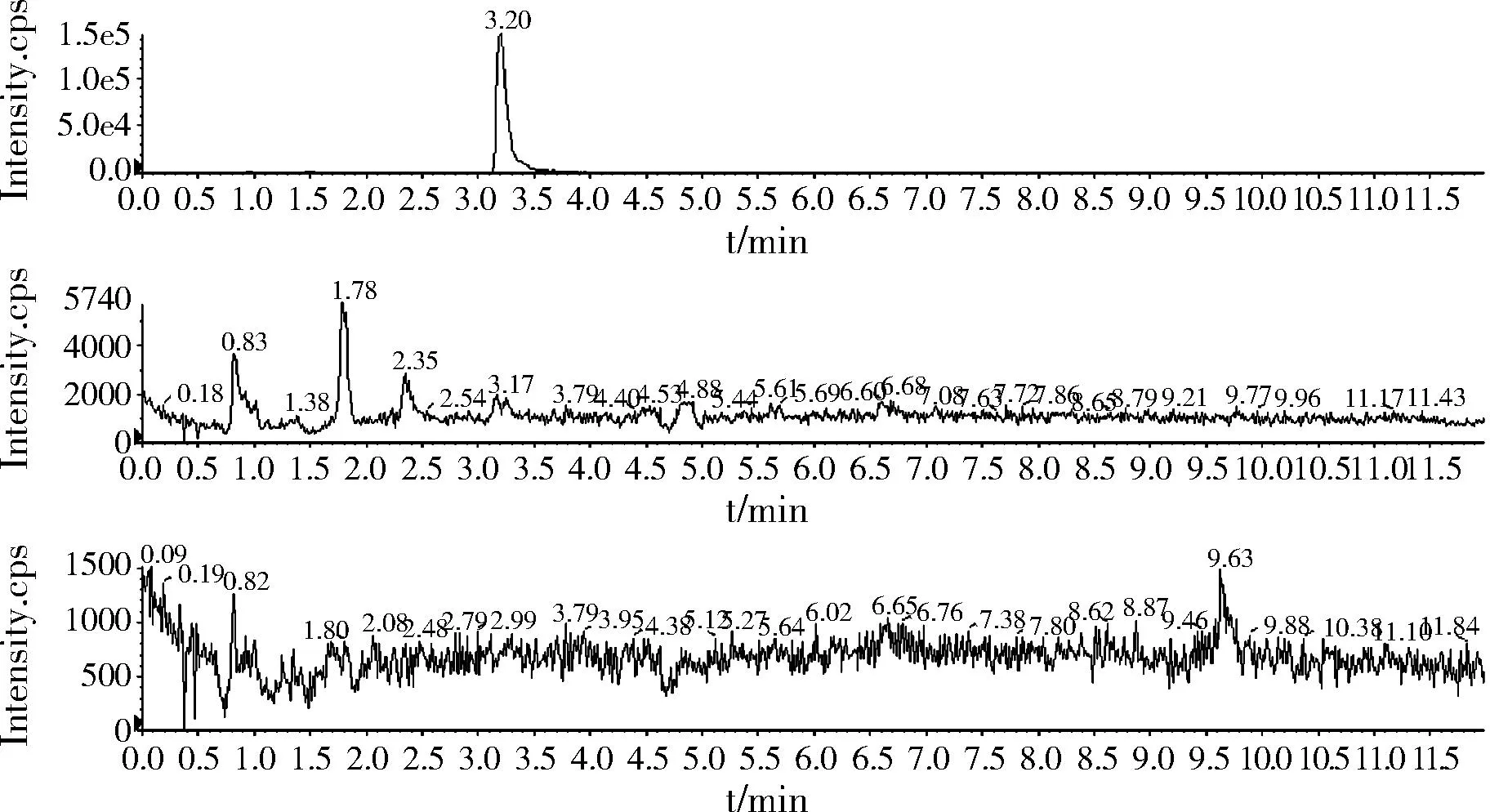
图4 空白基质色谱图(鸡肉干)Fig.4 The UPLC-MS/MS of blank sample(chicken dry)
2.3.3空白样品(鸡肉干)加标色谱图(加标浓度0.5 μg/kg)
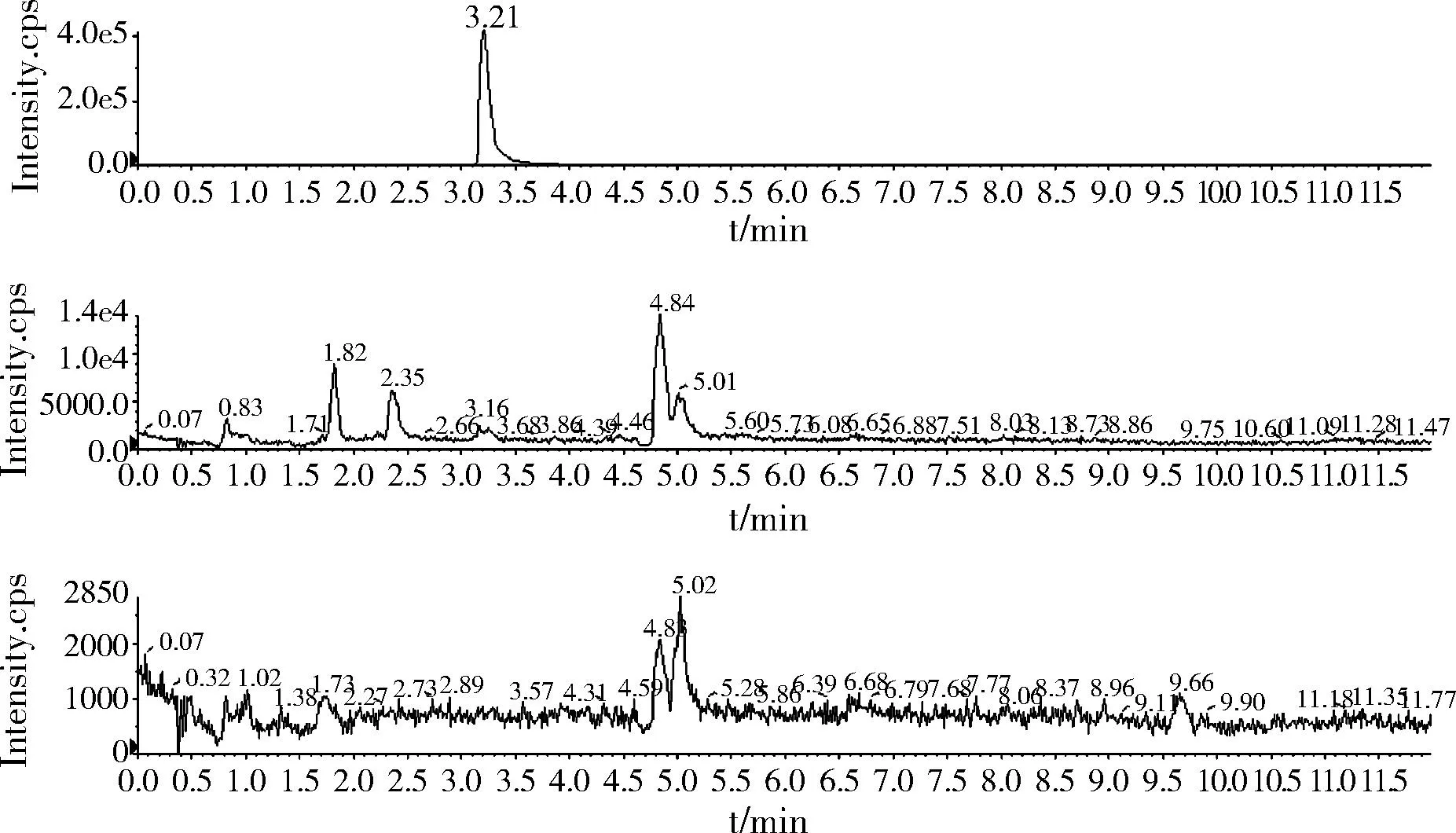
图5 空白样品加标色谱图Fig.5 The UPLC-MS/MS of rimantadine and memantine in samples after adding standard concentration
2.4精密度分析
同回收率部分选择鸡肉干作为加标基质。进行三个水平加标回收实验,每个水平重复测定7次,基质添加回收的变异系数(CV)与GB/T 27404-2008要求的变异系数(CV)范围比较见表9和表10。
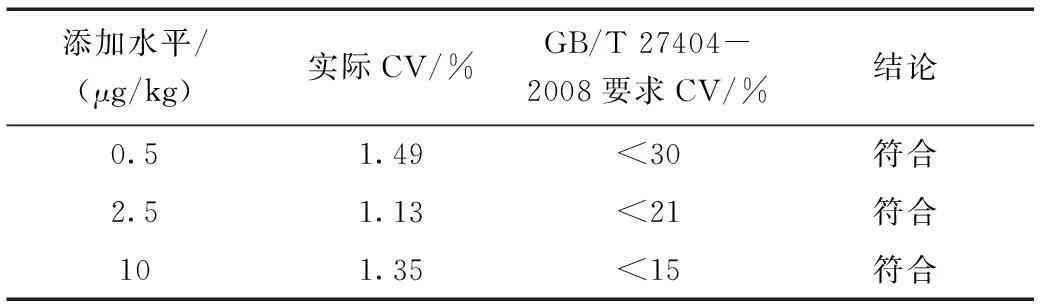
表9 基质添加回收的变异系数与GB/T 27404-2008要求的 变异系数范围比较(金刚乙胺)Table 9 The comparison of coefficient of variation (rimantadine)
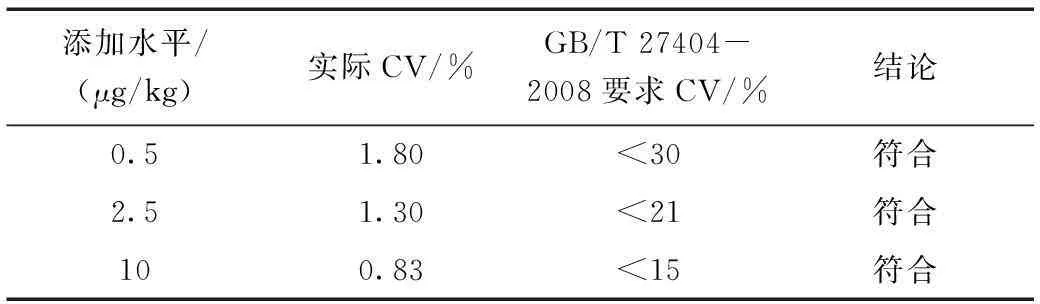
表10 基质添加回收的变异系数与GB/T 27404-2008要求的 变异系数范围比较(3,5-二甲基金刚胺)Table 10 The comparison of coefficient of variation (memantine)
3 结 论
本实验采用弱酸性溶液提取,固相萃取法进行净化与富集,运用UHPLC-MS/MS技术对金刚乙胺和3,5-二甲基金刚胺进行测定。固相萃取法能够更有效的分离分析物与杂质,回收率以及富集倍数高,有毒溶剂用量少,通过简单的操作就能达到无相分离,提升了前处理操作安全性,节省了前处理时间,提高了实验效率。本法的检出限、回收率、精密度能够满足实验要求。相较传统的化学方法而言,本方法快速、高效、重现性好,可以应用于常规分析检测。
[1]尹晖,孙雷,毕言锋,等.鸡肉和鸡蛋中金刚烷胺与金刚乙胺残留检测UPLC-MS/MS法研究[J].中国兽药杂志,2014,48(6):32-35.
[2]陆学胜,朱天夫,许敏,等.金刚烷胺对帕金森病患者角膜内皮细胞损害作用的研究[J].世界临床药物,2010,31(7):417-421.
[3]叶金朝,叶菲.美多巴及金刚烷胺诱发精神分裂症及下肢水肿病案分析[J].药物流行病学杂志,2002,11(4):219-220.
[4]胡丽芳,张金艳,罗林广.超高效液相色谱-电喷雾串联质谱法测定猪尿中金刚烷胺与金刚乙胺的残留量[J].分析测试学报,2014,33(6):678-682.
[5]朱胜平,钟华,何飞,等.高效液相色谱法测定盐酸美金刚脘胺片的含量[J].中南药学,2005,3(4):209-210.
[6]徐文彤,刘红.气相色谱法测定硫酸金刚烷胺的含量[J].中国药师,2007,10(11):1082-1083.
[7]姜大为,范振莉.气相色谱法测定硫酸金刚烷胺的含量[J].黑龙江科技信息,2012(7):32.
[8]龚美义.气相色谱法测定1-溴-3,5-二甲基金刚烷的含量[J].化学工程与装备,2008(11):121-122.
[9]张丽,张迪,黄海,等.气相色谱法测定盐酸金刚乙胺中3种有关物质[J].中国药师,2012,15(10):1450-1452.
[10]姜小林,应志洪,吴宁苹.气象色谱内标法测定盐酸美金刚含量和有关物质[J].化学工业与工程技术,2014,35(5):75-77.
[11]刘正才,杨方,余孔捷,等.液相色谱-电喷雾串联质谱法同时检测鸡组织中5种抗病毒类药物的残留量[J].色谱,2012,30(12):1253-1259.
[12]陈慧华,韦敏珏,周炜,等.液相色谱-串联质谱法测定动物组织中金刚烷胺和金刚乙胺的残留量[J].质谱学报,2013,34(4):226-232.
[13]魏秀丽,高迎春,陈玲,等.超高效液相-串联质谱法测定鸡肉组织中金刚烷胺残留[J].中国兽药杂志,2013,47(6):53-55.
[14]张秀芹,杜柏林.鸡组织中金刚烷胺、金刚乙胺残留检测及消减规律研究[J].实验室检测,2014(9):210-213.
[15]吴银良,赵健,叶宇飞,等.同位素稀释液相色谱-串联质谱法测定鸡蛋中金刚烷胺类药物残留量[J].分析测试学报,2014,33(8):905-910.
Determination of Rimantadine and Memantine Residues in Chicken Dry by UHPLC-MS/MS
WANG Zhi-wei
(Shanghai Intertek Testing Services Co., Ltd., Shanghai 200233, China)
A simple, fast, accurate method for determination of rimantadine and memantine in chicken dry was developed by ultra high performance liquid chromatography-tandem quadrupole mass spectrometry (UPLC-MS/MS). The sample was concentrated by solid phase extraction column. The linear range of the method was from 1 μg/L to 20 μg/L with a good correlation coefficient, and the detection limit was 0.5 μg/kg. The proposed method exhibited high sensitivity and good reproducibility for determining rimantadine and memantine.
rimantadine;3,5-dimethyl amantadine; memantine; UHPLC-MSMS
王智玮(1990-),检测工程师,主要从事食品检测。
TS207.3
A
1001-9677(2016)09-0120-04
