脂肪酶手性拆分的研究进展*
2016-09-01黄冠廷杜育芝张文承
黄冠廷,杜育芝,彭 昆,张文承,叶 鹏
(浙江理工大学化学系,浙江 杭州 310018)
专论与综述
脂肪酶手性拆分的研究进展*
黄冠廷,杜育芝,彭昆,张文承,叶鹏
(浙江理工大学化学系,浙江杭州310018)
手性拆分广泛应用于手性药物的制备,具有重要的科学意义与实用价值。脂肪酶由于其独特的界面催化特性,可在有机相中进行酶促合成,已成为手性拆分研究中的热点之一。本文重点综述了脂肪酶对手性醇、手性酯和手性胺类等有机合成中间体催化拆分作用的最新研究进展,并从脂肪酶来源、底物分子结构和固定化方法等角度对脂肪酶催化手性拆分机理进行了介绍。
脂肪酶;手性拆分;对映体选择性;酶固定化
手性拆分有结晶法、化学法、酶法和色谱法等方法[1]。酶法拆分具有活性高、反应条件温和和立体选择性高等优点,而被广泛应用。脂肪酶(Lipase,三酰基甘油水解酶,EC 3.1.1.3)在油水界面催化酯水解,也可在有机相中酶促合成,是一种重要的手性拆分酶。
脂肪酶手性拆分在手性药物产业具有巨大的潜能。为提高脂肪酶的稳定性,以及控制其在反应过程中产品的纯度, 常采用固定化的方法脂肪酶稳定其分子结构,并增加其重复使用性[2-3]。脂肪酶用于手性醇、手性胺及手性酯的拆分,具有重要的科学意义与实用价值,本文对其最新研究进展进行综述,并对其机理进行了介绍。
1 手性醇(含羟基化合物)的拆分
(R)-3-氨基-2-[(苯氧基)甲基]-丙醇盐酸盐是一种重要的手性中间体。Shinya等[4]用荧光假单胞菌属(Pseudomonas fluorescens,LAK Amano)在DMSO中催化2-羟甲基-1,3-丙二醇选择性酯化,游离LAK Amano反应24 h,转化率达到74%,产物eep=85%,见图1。
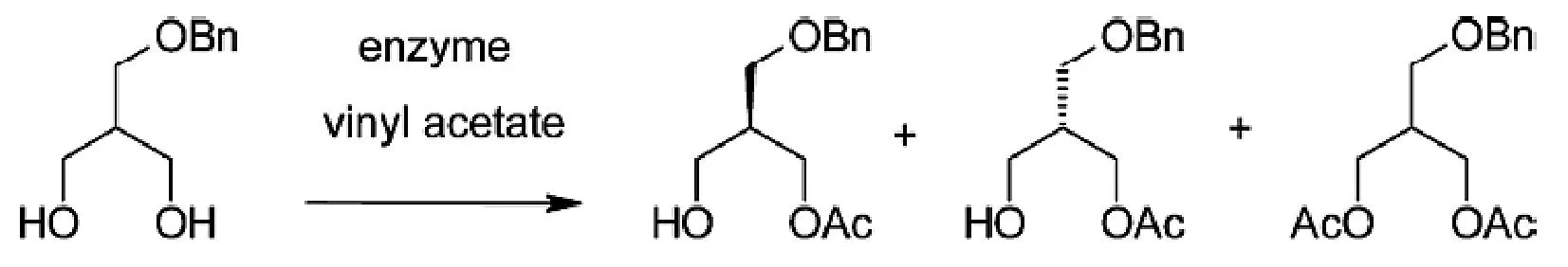
图1 脂肪酶拆分手性2-羟甲基-1,3-丙二醇Fig.1 The resolution of chiral 2-hydroxymethyl-1,3-propanediol by lipase
光学纯化合物1,2-二芳基-2-羟基乙酮在药物合成中是非常有用的砌块。Antonio等[5]报道了在2-甲基四氢呋喃中用施氏假单胞菌脂肪酶(Lipase from Pseudomonas stutzeri,PTL)结合钌催化剂,丁酸乙烯酯做酰基供体,动力学拆分1,2-二芳基-2-羟基乙酮,转化率达到50%,对映体选择率E>200,产物eep>99%,见图2。

图2 脂肪酶拆分手性1,2-二芳基-2-羟基乙酮Fig.2 The resolution of chiral 1,2-carbonyl-2-hydroxy-ethanone by lipase
1-苯乙醇可作为手性中间体被广泛应用于手性药物的合成。Yoshikazu等[6]用离子液体涂覆洋葱伯克霍尔德菌脂肪酶(Burkholderia cepacia lipase,IL1-PS)催化1-苯乙醇和乙酸乙烯酯选择性酯化,用三丁基((2-甲氧基乙基)-甲基)鏻双(三氟甲烷磺酰)亚胺([P444MEM][NTf2])做溶剂比i-Pr2O(二异丙醚)做溶剂,反应速率提高了1.6倍。使得反应转化率为42%,产物eep=99%,对映体选择率E>200。
(R,S)-1-苯乙基醋酸,是一些生物活性物质的手性合成子。Ru等[7]将被羰二咪唑活化的离子液体通过赖氨酸耦合共价连接到猪胰脂肪酶(Porcine pancreatic lipase,PPL)上,相对于天然脂肪酶PPL,展现了很高的水解活性,转化率明显得到了提高。反应转化率为49%,产物eep=94%,对映体选择率E由39提高到101,见图3。

图3 脂肪酶拆分手性(R,S)-1-苯乙基醋酸Fig.3 The resolution of chiral (R, S) -1- phenyl ethyl acetate by lipase
终上所述,脂肪酶广泛应用于手性醇的手性拆分[8],可以用超临界CO2[9]和离子液体[10]作为酶手性拆分的反应介质,而且固定化的脂肪酶在转化率和对映体选择性方面优于游离的脂肪酶。脂肪酶拆分手性醇的反应汇总于表1。

表1 脂肪酶拆分手性醇
2 手性酯的拆分
布洛芬(异丙酚酸)是一种手性药物。Lau等[13]将皱褶假丝酵母脂肪酶(Candida rugosa lipase,CRL)固定在聚丙烯腈(PAN)膜上,然后对酶用量和反应温度等工艺参数进行了研究,在最佳条件下转化率可以达到96%~98%,产物对映体过量eep达到97%~99%。
(2S,3R)-二甲基-1-乙酰吡啶-2,3-二羧酸酯,是一个莫西沙星中间体。Perla等[14]采用南极假丝酵母脂肪酶B(Candida antarctica lipase B,CAL B)催化(顺)-(±)-二甲基-1-乙酰吡啶-2,3-二羧酸酯,采用自由酶,反应需16 h,而具有相似活性的固定化酶,反应需140 h。对映体选择率E=80,在对映体过量eep>99%,转化率为53%。
Hedwig等[15]对2-庚醇己酸酯进行动力学拆分,以七(2,3-二-O-甲基-6-O-叔丁基二甲基)-β-环糊精作为手性固定相,固定化的CAL B作为催化剂,得到(R)-烷基酯(eep>99.9%),随后用柱状假丝酵母脂肪酶(Candida cylindracea lipase,CCL)催化酯化反应,得到(S)-酯(eep>81.4%)。
对-甲基磺酰基苯基丝氨酸乙酯的D-苏型(MPSE)是合成氟苯尼考的关键中间体。Rui等[16]研究了脂肪酶催化手性拆分DL-苏-对-MPSE(DL-threo-p-MPSE),诺维信435(Novzyme 435)脂肪酶的拆分效果最好,转化率为36.83%,ee值为35.13%;发现对-甲基磺酰苯甲醛是副反应的关键中间体,通过加入锌离子来抑制酶催化的副反应,提高了转化率和ee值,达到69.29%和46.26%。
羟丙茶碱[(±)-3,7-(2-羟丙基)-1,3-二甲基-3,7-二氢-1H-嘌呤-2,6-二酮]是一种用于强心剂的化合物。Pawet等[17]报道了用固定化的CAL B催化反应,见图4。反应两天后的产率为45%和46%。反应到第六天时,(S)-(+)-丁酸甲酯被分离出来(ee值>99%,对映选择性E=90)。动力学拆分的产品可以根据醇和酯的不同的溶解度在室温下进行分离。

图4 脂肪酶拆分手性酯Fig.4 The resolution of chiral ester by lipase
Enise等[18]将CRL脂肪酶分别在存在和不存在杯芳烃羧酸衍生物的情况下嫁接到磁性纳米颗粒上,用于对萘普生甲酯的对映选择性水解。封装的脂肪酶没有支撑物相对于封装在Calix[n]COOH-based的脂肪酶具有较低的转化率和对映体选择性,Calix[4]COOH-based封装的脂肪酶具有高的对映体选择性(对映体比率E>400),无封装的脂肪酶对映体选择性E=137。
Mata等[19]用洋葱假单胞菌脂肪酶(Lipase from Pseudomonas cepacia,PCL)催化甲氧基乙酸乙酯酰化氨基,转化率达到50%,对映体选择率E>200,产物eep=98%。不同的苯环的取代方式对酶促反应的转化率和对映选择性值有影响。这种酶法路线可应用于制备中间体 (S)-达泊西汀。
3 手性胺的拆分
(S)-1-环丙基-2-甲氧基乙胺是合成促肾上腺皮质激素释放因子-1受体拮抗剂的关键手性中间体。William等[20]通过转氨酶(Vibrio fluvalis)拆分外消旋胺得到S-胺产率38%,ee值为53%。通过CAL B催化癸酸乙酯酰化拆分外消旋胺得到S-胺产率35%,ee值为91%。随后通过甲基环酮来制备(S)-1-环丙基-2-甲氧基乙胺,总产率为62%,没有检测到R-对映体,见图5。
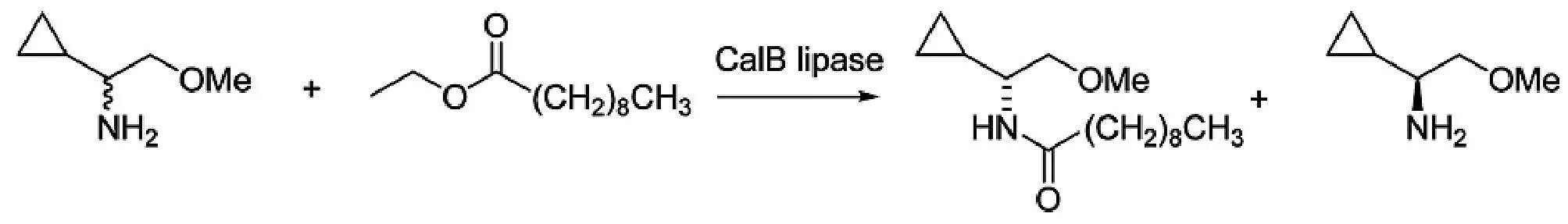
图5 脂肪酶拆分手性胺Fig.5 The resolution of chiral amine by lipase


图6 脂肪酶拆分手性苯乙胺Fig.6 The resolution of chiral phenethylamine by lipase
Florent等[22]研究了酶法动态动力学拆分伯胺。结合CAL B关联辛硫醇作为自由基消旋剂,甲基β-甲氧基丙酸酯作为酰基供体,在玻璃器皿中350 nm光照射下反应。反应转化率由50%提高到了89%,对映体过量ee值为>99%,对映体选择率E>200。

图7 脂肪酶拆分手性伯胺Fig.7 The resolution of chiral primary amine by lipase
Mari等[23]用CAL B(诺维信435)催化拆分N-酰化的外消旋伯胺和异丙基乙酸甲酯,在无溶剂条件下拆分效果为未反应的(S)-胺(ee≥98%),产物(R)-酰胺(ee≥95%),转化率为50%,见图7。催化反应中,诺维信435的重复使用稳定性不好,利用溶胶-凝胶法对CAL B催化剂进行修饰可以有效的提高其稳定性。
钯纳米颗粒负载的氨基官能化的氧化硅介孔泡沫材料催化剂(Pd-AmP-MCF)用于酶法动态动力学拆分(DKR)伯胺为酰胺,具有高的产率和ee值。Karl等[24]以1-苯乙胺和苄基胺为例,使用诺维信-435(CAL B)和天野脂肪酶PS-CI(Burkholderia cepacia lipase)催化,转化率为99%,ee值为99%,见图8。第二种酶超过60 ℃不稳定,所以不常用于DKR。多相的Pd-AmP-MCF催化剂可重复使用5次。

图8 脂肪酶拆分手性伯胺Fig.8 The resolution of chiral primary amine by lipase
Leandro等[25]用酶法动态动力学拆分含硒手性胺(有机硒-1-苯乙胺),相应的酰胺具有高的对映选择性和产率(产率为40%,ee值为>99%,E值>200)。该一锅法采用两种不同类型的催化剂:Pd/BaSO4为外消旋催化剂,CAL B为拆分催化剂。
4 拆分机理
脂肪酶催化的底物及其底物的立体选择性与脂肪酶的结构有关,这主要由脂肪酶结合位点结构的不同所决定。Pleiss等[26]报道了6种脂肪酶,根据其结合位点结构的不同,分为:隧道状结合位点(来源于皱褶假丝酵母);疏水缝隙状结合位点(来源于根霉菌类);漏斗状结合位点(来源于南极假丝酵母、假单胞菌属、哺乳动物胰腺)。不同脂肪酶适用于不同大小底物分子,因此表现出不同的选择性。
脂肪酶的手性选择性与来源有关。如脂肪酶CAL B在底物(仲醇类、胺类及酯类)催化可优先对R-构型底物反应[27],而脂肪酶CRL则优先对S-构型底物反应[28]。光假单胞菌脂肪酶(Pseudomonas fluorecens lipases,PFL)在乙酸乙酯作为共溶剂下优先对R-构型底物反应[29]。假单胞菌脂肪酶(Pseudomonas cepacia lipase,PSL)优先对R-构型底物反应[30]。洋葱伯克霍尔德菌脂肪酶(Burkholderia cepacia lipase,BCL)优先对R-构型底物反应[31]。米赫根毛霉(Rhizomucor miehei lipase,RML)则优先对S-构型底物反应[32]。
脂肪酶的手性拆分机理引起了研究者的浓厚兴趣。Jusuk等[33]研究了脂蛋白脂肪酶(Lipoprotein lipase,LPL-D1)对于仲醇的选择性,见图9。LPL-D1的对映选择性随着在底物的羟基次甲基中心两个芳基大小之间的差异而增大,一卤代的对映选择性很低,而卤素被叔丁基或者三甲基硅烷基取代,对映选择性明显增大,令人惊讶的是异丙基在提高对映体选择性上比三甲基硅烷基显著。在其他芳香环上的第二取代降低了对映选择性,第二取代基体积的增大,对映选择性降低(E=H>F>Cl>OMe>NO2)。用较小的芳杂环取代苯基,对映选择性增加(Ar=Ph,E=45;Ar=2-furyl,E=93;Ar=3-furyl,E=78),见图13a。用相同大小的吡啶环取代苯环,对映体选择性增加(Ar=Ph,E=114;Ar=3-pyridyl,E≥200;Ar=4-pyridyl,E≥200),见图13b,这表明基本吡啶环似乎结合酶的活性位点更有利。作者认为所有测试的底物,LPL-D1应该有相同的立体偏好,这在很大程度上由底物的两个芳环的空间位阻控制的。
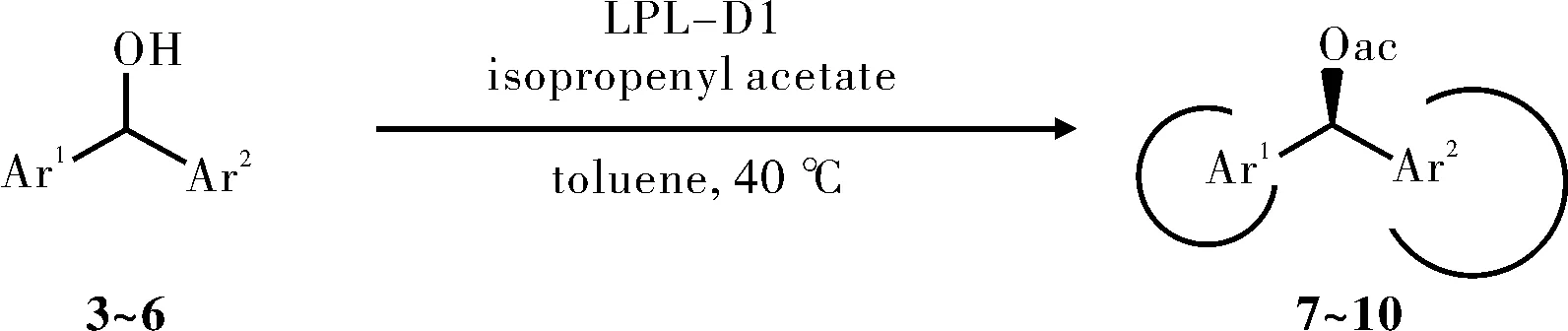
图9 脂肪酶拆分仲醇Fig.9 The resolution of secondary alcohol by lipase
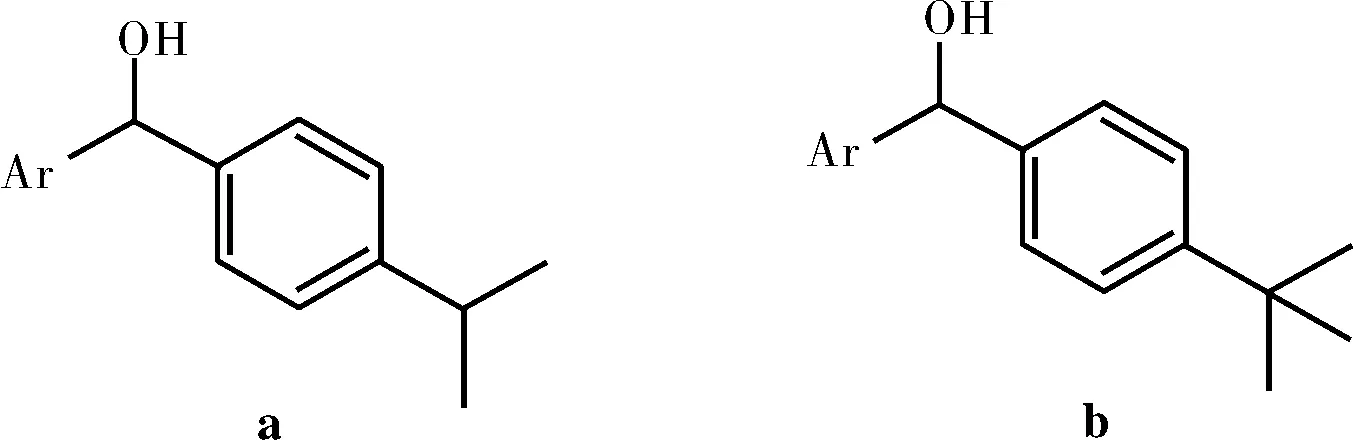
图10 底物a、bFig.10 Substrate a and b
使用中脂肪酶常被固定化,使其稳定性增加、易于与产物分离[34-35]。固定化也成为影响脂肪酶手性拆分效果的一个重要因素。脂肪酶有一个疏水性的的“盖子”,根据此特点,将其固定在疏水性载体上通常具有良好的活性。Yang等[36]将少根根霉脂肪酶(Rhizopus arrhizus lipase,RAL)分别采用包埋法固定于疏水性乙烯基和甲基丙烯基改性的凝胶和通过共价结合法固定于环氧树脂,仍是优先对R-底物酰化,选择性比自由酶得到提高(ee值为98%,转化率为52%,E值为99)。
蛋白质定向进化可以改变酶的底物特异性和对映异构体特异性,是研究脂肪酶手性拆分催化机理和提高其手性拆分效果的重要方法。Reetz等[37]最初选择epPCR在低突变率下只有一个氨基酸取代每个酶分子。经过四个周期突变筛选(每轮有2000~3000突变),水解动力学拆分手性酯的选择性E从1.1增加到11.3。已经证实定向进化产生的突变体(变种J)在动力学拆分酯的过程中显示出更高的对映体选择性(E>51)[38],作者做了一个详细的分子模型量子力学研究[39]。变种J有六个突变(D20N,S53P,S155M,L162G,T180I和T234S),其中大部分是再次远程。
5 结 语
脂肪酶广泛适用于非天然底物的催化,表现出优良的立体选择性,在手性药物的合成中具有重要的应用价值[40]。脂肪酶的种类繁多,其结构具有显著的差异,从而使得来源不同的脂肪酶具有不同的底物专一性,扩大了脂肪酶手性拆分的范围。脂肪酶对手性醇、手性酯和手性胺进行拆分,表现出良好的拆分效果。其中CAL B酶的手性拆分效果最为显著,已大量用于手性分子合成,并进行了商业开发。在各种催化体系中,研究工作多集中于布洛芬、萘普生等具有极高应用价值的医药中间体上。
然而脂肪酶的手性拆分仍存在很多问题。其中之一是脂肪酶在应用过程中稳定性较差,使得其使用成本相对较高。因此,通过固定化提高脂肪酶的稳定性仍是一个重要的研究方向。对于拆分机理的研究,由于脂肪酶种类较多,底物体系繁杂,不易进行定量化比较,从而难以对实际催化反应进行理论指导。蛋白质定向进化技术可以对酶结构加以调控,从而改变酶的底物特异性,将是这一领域的重要发展方向。
[1]Ward T J, Ward K D. Chiral separations: a review of current topics and trends[J]. Analytical chemistry, 2011, 84(2): 626-635.
[2]DiCosimo R, McAuliffe J, Poulose A J, et al. Industrial use of immobilized enzymes[J]. Chemical Society Reviews, 2013, 42(15): 6437-6474.
[3]韩祝平,叶鹏,王新平.脂肪酶的固定化及其手性拆分的研究进展[J].应用化工,2011,40(10):1823-1827.
[4]Yoshida S, Obitsu K, Hayashi Y, et al. Development of a Practical and Scalable Synthesis of (R)-and (S)-3-Amino-2-[(benzyloxy) methyl] propan-1-ol Monohydrochloride: A Useful C-4 Chiral Building Block[J]. Organic Process Research & Development, 2012, 16(9): 1527-1537.
[5]Aires-Trapote A, Hoyos P, Alcántara A R, et al. Covalent Immobilization of Pseudomonas stutzeri Lipase on a Porous Polymer: An Efficient Biocatalyst for a Scalable Production of Enantiopure Benzoin Esters under Sustainable Conditions[J]. Organic Process Research & Development, 2015, 19(7): 687-694.
[6]Abe Y, Yagi Y, Hayase S, et al. Ionic liquid engineering for lipase-mediated optical resolution of secondary alcohols: Design of ionic liquids applicable to ionic liquid coated-lipase catalyzed reaction[J]. Industrial & Engineering Chemistry Research, 2012, 51(30): 9952-9958.
[7]Jia R, Hu Y, Liu L, et al. Enhancing catalytic performance of porcine pancreatic lipase by covalent modification using functional ionic liquids[J]. ACS Catalysis, 2013, 3(9): 1976-1983.
[8]Sontakke J B, Yadav G D. Kinetic modeling and statistical optimization of lipase catalyzed enantioselective resolution of (R, S)-2-pentanol[J]. Industrial & Engineering Chemistry Research, 2011, 50(23): 12975-12983.
[9]Benaissi K, Poliakoff M, Thomas N R. Dynamic kinetic resolution of rac-1-phenylethanol in supercritical carbon dioxide[J]. Green Chemistry, 2009, 11(5): 617-621.
[10]Eckstein M, Wasserscheid P, Kragl U. Enhanced enantioselectivity of lipase from Pseudomonas sp. at high temperatures and fixed water activity in the ionic liquid, 1-butyl-3-methylimidazolium bis [(trifluoromethyl) sulfonyl] amide[J]. Biotechnology letters, 2002, 24(10): 763-767.
[11]Amin R, Chen J X, Cotterill I C, et al. Improved Synthesis of the C16-C20 Segment of Resolvin E1 Using Enantioselective Ketone Reduction and Lipase-Catalyzed Resolution[J]. Organic Process Research & Development, 2013, 17(6): 915-920.
[12]Kim C, Lee J, Cho J, et al. Kinetic and dynamic kinetic resolution of secondary alcohols with ionic-surfactant-coated Burkholderia cepacia lipase: substrate scope and enantioselectivity[J]. The Journal of organic chemistry, 2013, 78(6): 2571-2578.
[13]Sie Yon L, Gonawan F N, Kamaruddin A H, et al. Enzymatic deracemization of (R, S)-ibuprofen ester via lipase-catalyzed membrane reactor[J]. Industrial & Engineering Chemistry Research, 2013, 52(27): 9441-9453.
[14]Ramesh P, Harini T, Fadnavis N W. Efficient Resolution of cis-(±)-Dimethyl 1-Acetylpiperidine-2, 3-dicarboxylate with Soluble Candida antarctica Lipase B (CAL B)[J]. Organic Process Research & Development, 2014, 19(1): 296-301.
[15]Strohalm H, Dold S, Pendzialek K, et al. Preparation of passion fruit-typical 2-alkyl ester enantiomers via lipase-catalyzed kinetic resolution[J]. Journal of agricultural and food chemistry, 2010, 58(10): 6328-6333.
[16]Guo R, Fan Y X, Chen X L, et al. Chiral Resolution of Racemic p-Methylsulfonylphenyl Serine Ethyl Ester with Lipases: The Mechanism of Side Reaction and Its Suppression[J]. Journal of agricultural and food chemistry, 2012, 61(1): 157-166.
[17]Borowiecki P, Paprocki D, Dudzik A, et al. Chemoenzymatic synthesis of proxyphylline enantiomers[J]. The Journal of organic chemistry, 2015.
[18]Akoz E, Akbulut O Y, Yilmaz M. Calix [n] arene carboxylic acid derivatives as regulators of enzymatic reactions: enhanced enantioselectivity in lipase-catalyzed hydrolysis of (R/S)-naproxen methyl ester[J]. Applied biochemistry and biotechnology, 2014, 172(1): 509-523.
[19]Rodríguez-Mata M, García-Urdiales E, Gotor-Fernández V, et al. Stereoselective Chemoenzymatic Preparation of β-Amino Esters: Molecular Modelling Considerations in Lipase-Mediated Processes and Application to the Synthesis of (S)-Dapoxetine[J]. Advanced Synthesis & Catalysis, 2010, 352(2-3): 395-406.
[20]Parker W L, Hanson R L, Goldberg S L, et al. Preparation of (S)-1-cyclopropyl-2-methoxyethanamine by a chemoenzymatic route using leucine dehydrogenase[J]. Organic Process Research & Development, 2012, 16(3): 464-469.
[21]Pilissão C, Carvalho P O, Nascimento M G. Potential application of native lipases in the resolution of (RS)-phenylethylamine[J]. Journal of the Brazilian Chemical Society, 2010, 21(6): 973-977.
[22]Poulheès F, Vanthuyne N, Bertrand M P, et al. Chemoenzymatic Dynamic Kinetic Resolution of Primary Amines Catalyzed by CAL-B at 38~40 ℃[J]. The Journal of organic chemistry, 2011, 76(17): 7281-7286.
[23]Päiviö M, Perkiö P, Kanerva L T. Solvent-free kinetic resolution of primary amines catalyzed by Candida antarctica lipase B: effect of immobilization and recycling stability[J]. Tetrahedron: Asymmetry, 2012, 23(3): 230-236.
[24]Gustafson K P J, Lihammar R, Verho O, et al. Chemoenzymatic dynamic kinetic resolution of primary amines using a recyclable palladium nanoparticle catalyst together with lipases[J]. The Journal of organic chemistry, 2014, 79(9): 3747-3751.
[25]Andrade L H, Silva A V, Pedrozo E C. First dynamic kinetic resolution of selenium-containing chiral amines catalyzed by palladium (Pd/BaSO4) and Candida antartica lipase (CAL-B)[J]. Tetrahedron Letters, 2009, 50(30): 4331-4334.
[26]Pleiss J, Fischer M, Schmid R D. Anatomy of lipase binding sites: the scissile fatty acid binding site[J]. Chemistry and physics of lipids, 1998, 93(1): 67-80.
[27]Cabrera Z, Gutarra M L E, Guisan J M, et al. Highly enantioselective biocatalysts by coating immobilized lipases with polyethyleneimine[J]. Catalysis Communications, 2010, 11(11): 964-967.
[29]Machado A C O, da Silva A A T, Borges C P, et al. Kinetic resolution of (R,S)-1,2-isopropylidene glycerol (solketal) ester derivatives by lipases[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 69(1): 42-46.
[30]Mangas-Sánchez J, Rodriíguez-Mata M, Busto E, et al. Chemoenzymatic synthesis of rivastigmine based on lipase-catalyzed processes[J]. The Journal of organic chemistry, 2009, 74(15): 5304-5310.
[31]Tasnádi G, Forró E, Fülöp F. Burkholderia cepacia lipase is an excellent enzyme for the enantioselective hydrolysis of β-heteroaryl-β-amino esters[J]. Tetrahedron: Asymmetry, 2009, 20(15): 1771-1777.
[32]Foresti M L, Galle M, Ferreira M L, et al. Enantioselective esterification of ibuprofen with ethanol as reactant and solvent catalyzed by immobilized lipase: experimental and molecular modeling aspects[J]. Journal of chemical technology and biotechnology, 2009, 84(10): 1461-1473.
[33]Lee J, Oh Y, Choi Y K, et al. Dynamic Kinetic Resolution of Diarylmethanols with an Activated Lipoprotein Lipase[J]. ACS Catalysis, 2014, 5(2): 683-689.
[34]DiCosimo R, McAuliffe J, Poulose A J, et al. Industrial use of immobilized enzymes[J]. Chemical Society Reviews, 2013, 42(15): 6437-6474.
[35]Zhou Z, Hartmann M. Recent progress in biocatalysis with enzymes immobilized on mesoporous hosts[J]. Topics in Catalysis, 2012, 55(16-18): 1081-1100.
[36]Yang G, Wu J, Xu G, et al. Enantioselective resolution of 2-(1-hydroxy-3-butenyl)-5-methylfuran by immobilized lipase[J]. Applied microbiology and biotechnology, 2009, 81(5): 847-853.
[37]Reetz M T, Zonta A, Schimossek K, et al. Creation of enantioselective biocatalysts for organic chemistry by in vitro evolution[J]. Angewandte chemie international edition in english, 1997, 36(24): 2830-2832.
[38]Reetz M T, Wilensek S, Zha D, et al. Directed Evolution of an Enantioselective Enzyme through Combinatorial Multiple-Cassette Mutagenesis[J]. Angewandte Chemie International Edition, 2001, 40(19): 3589-3591.
[39]Bocola M, Otte N, Jaeger K E, et al. Learning from directed evolution: theoretical investigations into cooperative mutations in lipase enantioselectivity[J]. Chem Bio Chem, 2004, 5(2): 214-223.
[40]Singh A K, Mukhopadhyay M. Overview of fungal lipase: a review[J]. Applied biochemistry and biotechnology, 2012, 166(2): 486-520.
Research Progress on Lipase for Chiral Resolution*
HUANG Guan-ting, DU Yu-zhi, PENG Kun, ZHANG Wen-cheng, YE Peng
(Department of Chemistry, Zhejiang Sci-tech University, Zhejiang Hangzhou 310018, China)
Chiral resolution is widely applied in the preparation of chiral drug, which has important scientific significance and practical value. Due to the unique interface catalytic propertirs, lipase can catalysize in organic phase and has become a hot research in chiral resolution. The application of lipase in resolution of some important intermediates for medical and fine chemicals was summarized, such as chiral alcohols, chiral esters and chiral emines. Furthermore, the mechanism of lipase chiral resolution was introduced.
lipase; chiral resolution; enantioselectivity; enzyme immobilization
国家自然科学基金面上项目(No:51473148)。
黄冠廷(1994-),男,大学生。
叶鹏,浙江理工大学副教授,硕士生导师。
TQ 932
A
1001-9677(2016)09-0005-05
