基于毛细管电泳的胡椒碱光诱导异构化反应研究*
2016-09-01陈文豪
惠 阳, 陈文豪
(海南师范大学化学与化工学院,热带药用植物化学省部共建教育部重点实验室, 海南 海口 571127)
基于毛细管电泳的胡椒碱光诱导异构化反应研究*
惠阳, 陈文豪
(海南师范大学化学与化工学院,热带药用植物化学省部共建教育部重点实验室, 海南海口571127)
基于高效毛细管电泳平台研究了胡椒中胡椒碱的光诱导顺反异构化反应,并依次考察了可能对反应效果产生影响的几种因素,并计算了反应的速率常数。通过实验,观察到溶液浓度较小的溶液光诱导异构化反应越容易进行;考察不同波长的光源,发现仅有大于反应物本身最大吸收波长的光源才能引发光诱导异构化反应;另外延长照射时间到一定程度,光诱导异构化反应进行越完全,而一旦达到反应平衡状态,则反应物不再减少,相应的产物也不再增多;另外值得注意的是,用丙酮溶剂溶解反应物,发现对光诱导异构化反应有一定程度的抑制作用,推测是因为该种溶剂的结构含有能吸收紫外光的官能团;计算得到反应速率常数k为0.077 min-1。
光诱导异构化;毛细管电泳;胡椒碱
现代药理研究表明,胡椒中所含胡椒碱具有抗菌[1]、抗癌[2]、抗抑郁[3]、止泻[4]、抗氧化[5]、杀虫[6]、抗溃疡[7]、抗惊厥作用[8]等作用。基于以上药理活性,胡椒碱是一种极其具有发展前景的抗癌、保护心血管和肝脏的免疫调节天然药品。
胡椒碱属于酰胺类化合物,其分子结构见图1,具有两个烯键。其光稳定性差,在紫外光照射下,很容易发生顺反异构化反应而转化为另外三种顺反异构体[9-10]。而这三种异构体的生物活性与胡椒碱存在一定差异[11],因此由自然光照就能诱导产生的异构化反应引起的失活效应,极有可能限制胡椒的应用。针对胡椒碱的分析,目前已有核磁共振[12]、振动光谱[13]、紫外光谱[14]及高效液相色谱[15-16]和色质联用[17-18]及薄层色谱[19]等研究报道,但分离时间长且未达到基线分离。海南省作为我国胡椒种植主产区,产量占全国总产的80%,产值居热作产品前列,本文采用毛细管电泳这一现代分离分析新技术对胡椒中所含的具有抗菌抗癌活性的胡椒碱类成分进行系统的分离鉴定,研究日光及紫外光照射等条件对其活性的影响,并利用该体系研究光诱导异构化的反应动力学。
1 实 验
1.1仪器与试剂
Agilent7100毛细管电泳仪,配备二极管阵列检测器(检测波长范围190~600 nm)。分离用石英毛细管长48 cm(有效长度40 cm)、内径50 μm、外径375 μm,购于Agilent。第一次使用的毛细管要依次用甲醇、0.1 M的NaOH和水分别冲洗10、5、15 min,然后再用分离缓冲溶液冲洗10 min。过夜后每次实验之前也需用0.1 M NaOH溶液、水及分离缓冲溶液再依次冲洗5、1、3 min。每单次运行前,仍需用蒸馏水及分离缓冲溶液各自冲洗2 min。另外,所有进入毛细管的溶液都需要经由0.45 μm孔径的膜过滤后方可使用。样品的进样时间设为5 s,进样压力设为0.5 psi。
WFH-203型双波长紫外分析仪用于提供254和365 nm的照射光源。胡椒碱标准品购自Sigma-Aldrich。胡椒碱的光学异构体容易受光照影响而变质,因此无法购买到商业标准品。根据文献方法,三种异构体均由100 μM的胡椒碱标准品通过紫外光照而得到,并用高效液相色谱分离得到,核磁共振鉴定结构[10]。实验所用其他试剂均为分析纯级别。
1.2溶液配制
准确称取胡椒碱标准品10.0 mg,在10.0 mL的甲醇-水混合溶剂中(体积比为1:1)配成质量浓度1.0 g/L的储备液,样品需放置在4 ℃下避光处。
1.3实验方法
光照实验所选波长为日光、红外光、254 nm和365 nm紫外光。光照不同时间,计时结束后立即取出样品,进行毛细管电泳-DAD分离检测。
2 结果与讨论
2.1毛细管电泳分离条件的优化
依次研究了分离缓冲溶液中的各个组分浓度对分离效果的影响,包括15、20、25、30 mM的硼砂、0、2、5 mM的β-CD及不同种类有机改性剂,包括5%~15% 的甲醇、乙腈、丙酮。并考察了分离缓冲溶液pH值(8.5~10.0)的影响。结果表明25 mM硼砂、13 mM SDS、10%甲醇、2 mM β-CD、pH 8.7为最佳电泳分离条件。胡椒碱标准品溶液在365 nm紫外光照射2 h后所得的异构体混合物的电泳谱图如图2所示。

图2 胡椒碱标准品溶液光照不同时间后的异构体混合物的电泳图Fig.2 The electropherogram of standard solution of after irradiation
2.2溶液浓度对异构化反应的影响
实验考察了溶液中胡椒碱浓度大小对光诱导异构化反应的影响。依次用365 nm紫外光照射不同浓度的胡椒碱溶液相同时间后,发现在低浓度的溶液中,光诱导异构化反应更容易进行,反应速率较快。
2.3照射光源波长对异构化反应的影响
分别使用254 nm和365 nm紫外光、日光及红外光源照射胡椒碱标准品溶液相同时间段。由图3可知,日光和254 nm紫外光对顺反异构有不同程度的影响,且胡椒碱的响应信号不断减小的趋势一致,而红外光几乎没有什么影响。其中365 nm紫外光能较大程度地使得胡椒碱转化为其顺反异构体。可能因为在365 nm波长光源的作用下胡椒碱跃迁至激发态变型的几率较高。
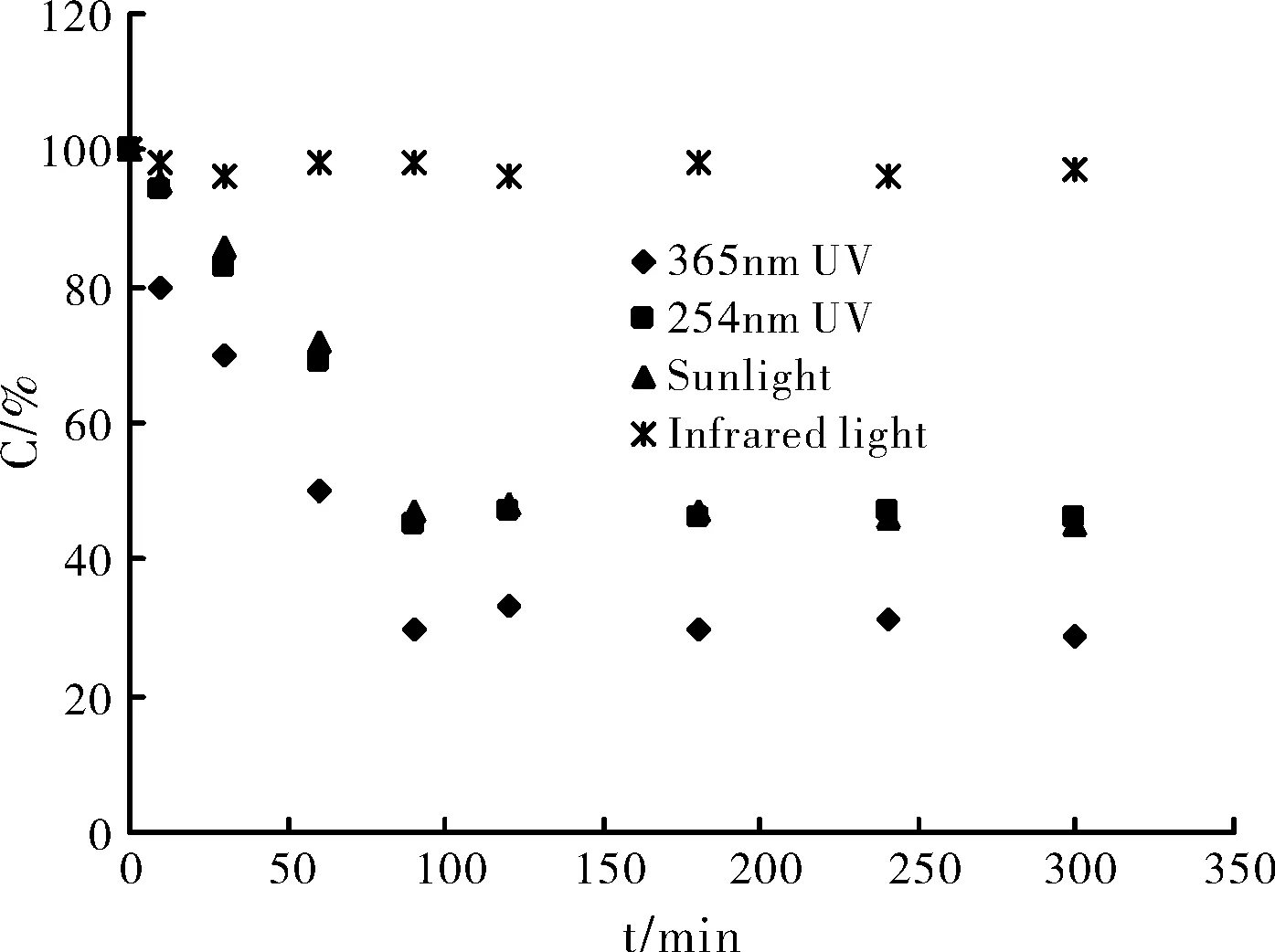
图3 光源波长影响Fig.3 The effect of wavelength
2.4照射时间对异构化反应的影响
CE-DAD信号强度随光照时间变化的曲线,从图3中可以看出除红外光之外,其他三种光源,随照射时间延长,反应的趋势都一致,在100 min之内胡椒碱信号明显下降,而100 min以后,即使延长照射时间,胡椒碱的信号也不再有明显变化。据文献报道[11]双键结构的光诱导异构化反应速率是光波长和强度的函数,这与我们的实验结论吻合。
2.5溶剂对异构化反应的影响
考察了包括甲醇、乙醇、丙酮和水四种溶剂的影响。如图4所示,甲醇溶剂中胡椒碱浓度下降速度最快,其次为乙醇和水,两者区别并不明显。而丙酮溶剂中光诱导异构化反应速率最慢。推测原因,可能是由于丙酮结构中带有羰基,它作为发色团,可能会吸收一部分紫外光,导致胡椒碱转化比例降低。

图4 溶剂影响Fig.4 The effect of solvent
2.6异构化反应速率常数计算
据文献[20]中的模拟方法,我们可以用k代表胡椒碱异构化反应的速率常数。设反应起始时的胡椒碱浓度为c0,光照时间为t,光照后的浓度设为ct,可知Δct为:
Δct=c0-ct
反应速率方程的微分式如下:
再对此式作不定积分可得:
Δct=Δcmax(1-e-kt)
(1)
其中的Δct指反应过t时间后的浓度变化值,Δcmax则指反应时间无限延长后,即反应达到平衡状态后,反应物的浓度变化值。其次,峰吸光强度的大小和物质的浓度成正比:
ΔAt=ΔAmax(1-e-kt)
(2)
ΔAt指反应过t时间后的峰吸光强度变化值,而ΔAmax则指反应时间时间t无限延长后,也就是反应达到平衡状态后时各个峰的吸光强度变化值。拟合实验中所得各个数据,计算得到ΔAmax与反应速率k分别是55.34 mAU和0.077 min-1。
3 结 论
通过实验,观察到溶液浓度低的溶液光诱导异构化反应越容易进行;考察不同波长的光源,发现仅有大于反应物本身最大吸收波长的光源才能引发光诱导异构化反应;另外延长照射时间到一定程度,光诱导异构化反应进行越完全,而一旦达到反应平衡状态,则反应物不再减少,相应的产物也不再增多;更值得注意的是,用丙酮溶剂溶解反应物,发现对光诱导异构化反应有一定程度的抑制作用,推测是因为该种溶剂的结构含有能吸收紫外光的官能团;这与我们之前对二苯乙烯类物质如白藜芦醇、土大黄苷的光诱导异构化反应的特点有相似之处,具体可见文献[22]。最后,通过模拟计算得到反应速率常数k为0.077 min-1。上述工作的完成,有望为作为我省主要经济作物之一的胡椒的种植,保存,运输,深加工提供科学依据。
[1]Khan I A, Mirza Z M, Kumar A, et al. Piperine, a phytochemical potentiator of ciprofloxacin against Staphylococcus aureus[J]. Antimicrob. Agents Chemother,2006, 50:810-812.
[2]Pradeep C R,Kuttan G. Effect of piperine on the inhibition of lung metastasis induced B16F-10 melanoma cells in mice[J]. Clin Exp Metastasis,2002,19(8):703-708.
[3]胡园,廖红波,刘屏,等. 胡椒碱调节大鼠下丘脑-垂体-肾上腺轴抗抑郁作用的实验研究[J]. 中西医结合学报,2009,7(7):667-670.
[4]Bajad S, Bedi K L, Singla A K, et al. Antidiarrhoeal activity of piperine in mice[J]. Planta Med,2001, 67:284-287.
[5]Price S E,Harris S A D,Deborah J,et al. Piperine,an active ingredient of black pepper attenuates acetaminophen induced hepatotoxicity in mice[J]. Asian Pacific Journal of Tropical Medicine,2010,3(12):971-976.
[6]Scott I M, Gagnon N, Lesage L, et al. Efficacy of botanical insecticides from Piper species (Piperaceae) extracts for control of Ruropean chafer (Coleoptera: Scarabaeidae)[J]. J. Econ. Entomol,2005, 98:845-855.
[7]Morikawa T,Matsuda H,Yamaguchi I,et al. New amides and gastroprotective constituents from the fruit of Piper chaba[J]. Planta Med,2004,70: 152-159.
[8]D’Hooge R,Pei Y Q,Raes A,et al. Anticonvulsant activity of piperine on seizures induced by excitatiory amino acid receptor agonists[J]. Arzneimittel-Forschung,1996, 46(6):557-560.
[9]Ternes W,Krause E L. Characterization and determination of piperine and piperine isomers in eggs[J]. Anal Bioanal Chem,2002,374: 155-160.
[10]Kozukue N,Park M S,Choi S H,et al. Kinetics of lightinduced cis-trans isomerization of four piperines and their levels in ground black pepper as determined by HPLC and LC/MS[J]. J Agric Food Chem,2007,55: 7131-7139.
[11]黄鸿新, 罗一帆, 许旋. 桂皮酰胺类化合物分子扭角与抗惊活性的关系 [J]. 数理医药学杂志,1997,10 (3): 256-258.
[12]Catchpole O J, Grey J B, Perry N B, et al. Extraction of chili, black pepper, and ginger with near-critical CO2, propane, and dimethyl ether: analysis of the extracts by quantitative nuclear magnetic resonance[J]. J. Agric. Food Chem., 2003, 51:4853-4860.
[13]Schulz H, Baranska M, Quilitzsch R, et al. Characterization of peppercorn, pepper oil, and pepper oleoresin by vibrational spectroscopy methods[J]. J. Agric. Food Chem., 2005, 53:3358-3363.
[14]Lupina T, Cripps H. UV spectrophotometric determination of piperine in pepper preparations: collaborative study[J]. J. AOAC Int., 1987, 70:112-113.
[15]Wood A B, Barrow M L, James D J. Piperine determination in pepper (Piper nigrum L.) and its oleoresinssa reversed-phase high-performance liquid chromatographic method[J]. Flavour Fragrance J, 1988, 3:55-64.
[16]Wu S, Sun C, Pei S, et al. Preparative isolation and purification of amides from the fruits of Piper longum L. by upright counter-current chromatography and reversed-phase liquid chromatography[J]. J. Chromatogr. A, 2004, 1040:193-204.
[17]Scott I M, Puniani E, Jensen H, et al. Analysis of Piperaceae germplasm by HPLC and LC-MS: a method for isolating and identifying unsaturated amides from Piper extracts[J]. J. Agric. Food Chem., 2005, 53:1907-1913.
[18]Hashimoto K, Yaoi T, Koshiba H, et al. Phtotochemical isomerization of piperine, a pungent constituent in pepper[J]. Food Sci. Technol. Int. (Tokyo), 1996, 2:24-29.
[19]Marutolu C, Gogoasa I, Oprean I, et al. Separation and Identification of piperine and chavicine in black pepper by TLC and GC-MS[J]. J. Planar Chromatogr., 2006, 19:250-252.
[20]Nobuyuki K, Sukhyun C, Hyun C, et al. Kinetics of Light-induced cis-trans isomerization of four piperines and their levels in ground black peppers as determined by HPLC and LC/MS [J]. J. Agric. Food Chem., 2007, 55:7131-7139.
[21]Kozukue N,Park M S,Choi S H,et al. Kinetics of lightinduced cis-trans isomerization of four piperines and their levels in ground black pepper as determined by HPLC and LC/MS[J]. J Agric Food Chem, 2007, 55: 7131-7139.
[22]惠阳. 毛细管电泳在研究二苯乙烯类化合物的光诱导顺反异构化反应及环境水样中氨和烷基胺测定中的应用[M]. 兰州:兰州大学,2011.
Study on Light Induced Isomerization of Piperine Based on Capillary Electrophoresis*
HUI Yang, CHEN Wen-hao
(Key Laboratory of Tropical Medicinal Plant Chemistry of Ministry of Education, College ofChemistryandChemicalEngineering,HainanNormalUniversity,HainanHaikou571127,China)
High performance capillary electrophoresis platform based on the piperine in pepper photoinduced CIS trans isomerization reactions was researched, and several factors which may influence the effect of the reaction were sequentially investigated, the rate constant of reaction was calculated. Through experiments, the solution concentration of small light induced isomerization reacted more easily and effected by different wavelength of light source, the light source can be found only greater than the reactant itself the maximum absorption wavelength of light induced isomerization reaction induced by prolonged exposure time, also to a certain extent, the light induced isomerization reaction was more complete. And once to reach equilibrium, then the reactants will no longer reduce, the corresponding products will no longer increase. It was also worth noting that with acetone solvent. The reaction was found to have a certain degree of inhibition on the photo induced isomerization reaction, because the structure of the solvent was able to absorb UV light, and the reaction rate constantkwas calculated to be 0.077 min-1.
light induced isomerization; capillary electrophoresis; piperine
海南省自然科学基金(214030);海南省高等学校科学研究项目(HNKY2014-40);海南省高等学校教育教学改革研究项目(Hnjg2015-40)。
惠阳(1982-),女,兰州大学博士学位,副教授,主要从事高效毛细管电泳的理论及应用等研究工作。
陈文豪,男,博士,副教授,主要从事天然产物及植物药的分析研究工作。
O657
A
1001-9677(2016)09-0056-04
