一种玉米新型细菌性褐腐病的病原鉴定
2016-09-01伍辉军高学文
顾 沁, 张 昊, 黄 海, 丁 正, 伍辉军, 高学文
(南京农业大学植物保护学院, 华东作物有害生物综合治理农业部重点实验室, 南京 210095)
一种玉米新型细菌性褐腐病的病原鉴定
顾沁,张昊,黄海,丁正,伍辉军,高学文*
(南京农业大学植物保护学院, 华东作物有害生物综合治理农业部重点实验室, 南京210095)
本研究从河北省武邑、献县、阜城和永年采集感病玉米植株。病株症状为叶梢枯死卷曲,叶脉产生黄色病斑,茎秆处黄褐色干腐。从发病植株中分离得到了10株疑似病原细菌菌株,经过回接验证和16S rDNA和gyrB基因的序列分析,结果表明,引起该病害的病原物为菠萝泛菌(Pantoeaananatis)和分散泛菌(Pantoeadispersa)。这是国内首次报道菠萝泛菌和分散泛菌引起玉米细菌性病害。
玉米病害;gyrB基因;菠萝泛菌;分散泛菌
我国是玉米生产和消费大国,玉米播种面积以及产量都位居世界第二。近年来,由于玉米播种面积扩大、气候条件变化、新品种的推广以及耕作制度的改变,玉米病害的发生呈上升趋势,给农业生产以及食品安全带来了严重危害。迄今全世界报道的136种玉米病害中,细菌性病害仅有13种[1],所以人们给予细菌性病害的关注也较少,但近年来玉米细菌性病害在局部地区发生严重,而且,由于缺乏有效的防控手段,玉米细菌性病害给农业生产带来的损失往往十分严重[2]。河北是玉米种植大省,无论种植面积还是产量均居华北地区首位,玉米病害是影响河北地区玉米产量与品质的主要原因。近年来在河北局部地区大规模暴发一种新的疑似玉米细菌性病害,症状表现为叶梢枯死卷曲,叶脉产生黄色病斑,茎秆处黄褐色干腐,给河北地区农业生产带来了较大的损失。
本研究对河北地区大规模发生的新的疑似玉米细菌性病害样品进行病原物分离鉴定,并对所分离的病原细菌进行了形态观察和致病性测定,同时,结合细菌16S rDNA和gyrB基因序列分析对其进行了鉴定,旨在为该病害的防治提供参考。
1 材料与方法
1.1菌体来源
用于病原菌分离的玉米病害样本采自河北省武邑、献县、阜城和永年等县处于灌浆期的夏玉米,采集时间为2014年8月。
1.2病原菌的分离纯化以及保存
在病原菌分离前对研钵进行高温灭菌处理,用灭菌刀切取发病玉米植株茎秆或者叶片组织病健交界处,用70%乙醇表面消毒15 s,再用30%次氯酸钠消毒2 min,最后用无菌水冲洗3~5遍。之后将处理过的组织用灭菌剪刀剪碎,放在无菌研钵中加入适量无菌水充分研磨,静置约10 min。吸取悬浮液上清于离心管中,依次稀释101、102、103、104、105、106倍。将稀释104、105、106倍的悬浮液涂布于LB平板上,30℃培养24~48 h。观察并记录菌落形态特征,选取具有分离优势的单菌落接种于LB液体培养基中,37℃, 200 r/min过夜培养。吸取过夜培养的菌液500 μL加到含500 μL灭菌的60%甘油中,-20℃保存。采用此方法共分离到10株细菌,分别命名为WYJ1、WYY2、XXJ1、XXY2、FCJ1、FCY2、FCY3、YNJ1、YNY2和YNY3。
1.3分离菌株的致病性测定及再分离
玉米种子(品种为‘中科11’)经70%乙醇表面消毒30 min后,用无菌水冲洗3~5遍,之后用30%次氯酸钠消毒20 min,并用无菌水冲洗3~5遍,于50℃下放置4 d。玉米在温室中生长4周后,备用。将分离菌株接种到LB液体培养基中,过夜振荡培养。采用针刺接种和剪叶接种两种方法,针刺接种:用注射器针头蘸取菌液,在玉米叶片上划出伤口,以无菌水作对照。剪叶接种:剪刀先在酒精灯上灭菌,之后蘸取菌液,直接剪去叶片,无菌水作对照。接种后将植株保湿7 d,随后置于28℃下培养。每个菌株每种接种方法在相同条件下做5个重复,10 d后统计发病情况。在植株发病后将与样本发病情况相似的叶片进行表面消毒之后,采用上述方法进行再分离培养。
1.4分离细菌16S rDNA和gyrB基因序列的测定与分析
16S rDNA的 扩增引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′;gyrB的扩增引物为F1:5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGG-NAARTTYGA-3′和R1:5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′[3]。引物由南京金斯瑞生物科技有限公司合成。PCR扩增程序:95℃预变性5 min;94℃变性1 min,65℃退火30 s,72℃延伸2 min,循环30次;分别取3 μL PCR产物经过1%的琼脂糖凝胶电泳检测,电泳结束后,拍照记录电泳结果。PCR产物送至南京金斯瑞生物科技有限公司进行测序, 用http:∥blast.ncbi.nlm.nih.gov/Blast.cgi的BLAST程序进行同源性比较, 并用软件MEGA 4.0构建基于gyrB基因序列的系统树。
2 结果与分析
2.1玉米田间发病情况
河北省武邑县、献县、阜城县和永年县的玉米田中发病较为严重的玉米表现为茎秆表面呈现黄褐色干腐,沿叶脉产生黄色病斑,叶梢枯死卷曲。
2.2病原细菌形态特征
切取植株病健交界处组织研磨后使用无菌水稀释菌悬液在LB培养基上涂板,置于恒温培养箱中培养。观察并记录菌落的形态特征,选取具有分离优势的10株分离菌分别命名为WYJ1、WYY2、XXJ1、XXY2、FCJ1、FCY2、FCY3、YNJ1、YNY2和YNY3。菌落圆形,淡黄色或乳白色,微微凸起,边缘光滑整齐。显微镜下观察细菌形态发现细胞呈短杆状,大小为(0.5~1)μm×(1~3)μm(图1)。
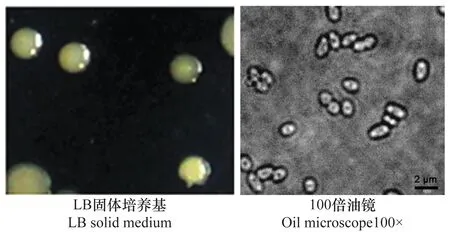
图1 主要分离菌的菌落和细胞形态Fig.1 Morphology of bacterial isolates
2.3分离菌株的致病性测定
将所分离到的10株病原菌接种到玉米叶片上进行致病性测定,10 d后观察植株的发病情况,试验发现这10株分离菌所造成的玉米病害症状与田间的发病症状相似(图2)。对于接种病原菌后观察到与田间相似病症的玉米植株,按照上述方法在 LB 培养基上进行分离菌的再分离,分离到的菌株菌落形态与接种菌一致。
2.4病原菌的16S rDNA基因和gyrB基因序列测定
采用16S rDNA的通用引物27F/1492R对分离得到的10株细菌基因组进行PCR扩增,其扩增片段均在1.5 kb左右(图3)。 PCR产物经纯化并测序分析,并与GenBank中登录的16S rDNA序列进行同源性比较。BLAST结果表明,与这10株分离菌同源性较高的细菌都属于泛菌属,相似度都大于98%。进一步使用gyrB基因的通用引物F1/R1对10株分离菌的gyrB基因进行PCR扩增,结果表明,其gyrB扩增片段均在1.2 kb左右(图4),BLAST结果表明,与这10株分离菌同源性较高的细菌都属于泛菌属,相似度都大于99%,选择与这10个菌株相似度较高菌株的gyrB基因序列,构建系统发育树(图5)。鉴定结果表明,XXY2、WYY2、YNY3和FCY3为菠萝泛菌(Pantoeaananatis), FCY2、YNJ1、FCJ1、YNY2、XXJ1和WYJ1为分散泛菌(P.dispersa)(表1),对2.3试验中所得到的再分离菌进行16S rDNA和gyrB基因分析表明,再分离菌和接种菌的分类地位完全相同。

图2 分离菌株回接玉米后的发病症状Fig.2 Symptoms on corn leaves inoculated by the isolated strains
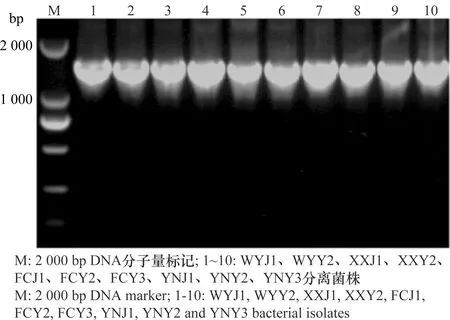
图3 分离菌株16S rDNA PCR 扩增结果Fig.3 16S rDNA PCR products of the isolates
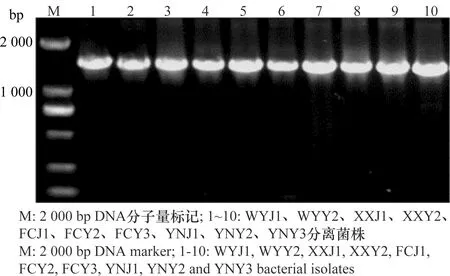
图4 分离菌株gyrB PCR 扩增结果Fig.4 gyrB PCR products of the isolates

图5 基于gyrB基因的菌株系统发育树Fig.5 Phylogenetic relationship analysis based on the gyrB gene sequences of the isolated strains
3 讨论
泛菌属细菌广泛存在于植物表面、种子、土壤和水及动物和人的伤口、血液和尿液中,人们对泛菌属是否含有植物致病菌存在许多争议,一般认为该菌是一种腐生菌或植物病斑上的次生菌[4]。但现在许多研究表明,泛菌属细菌对很多植物都存在致病性,而其所引起的玉米细菌性病害也同样引起人们的广泛关注。例如P.stewartii可引起玉米细菌性枯萎,由于其所具有的危害性,目前已将该病害列为我国进境检疫对象[57]。Pantoeaagglomerans可引起玉米叶疫病、维管束枯萎病[8]和玉米细菌干茎腐病[9];P.ananatis则会引起玉米细菌性褐腐病[10];P.ananatis和P.stewartii也是加州高粱叶斑病的病原[11],但目前还未报道由分离到的P.dispersa引起的植物病害。近年来,国外报道由泛菌属菠萝泛菌(P.ananatis)所引起的细菌性病害发生面积和危害程度逐渐增大,引起人们的广泛关注[1216],但在我国有关菠萝泛菌(P.ananatis)所引起的细菌性病害报道与研究则相对较少。
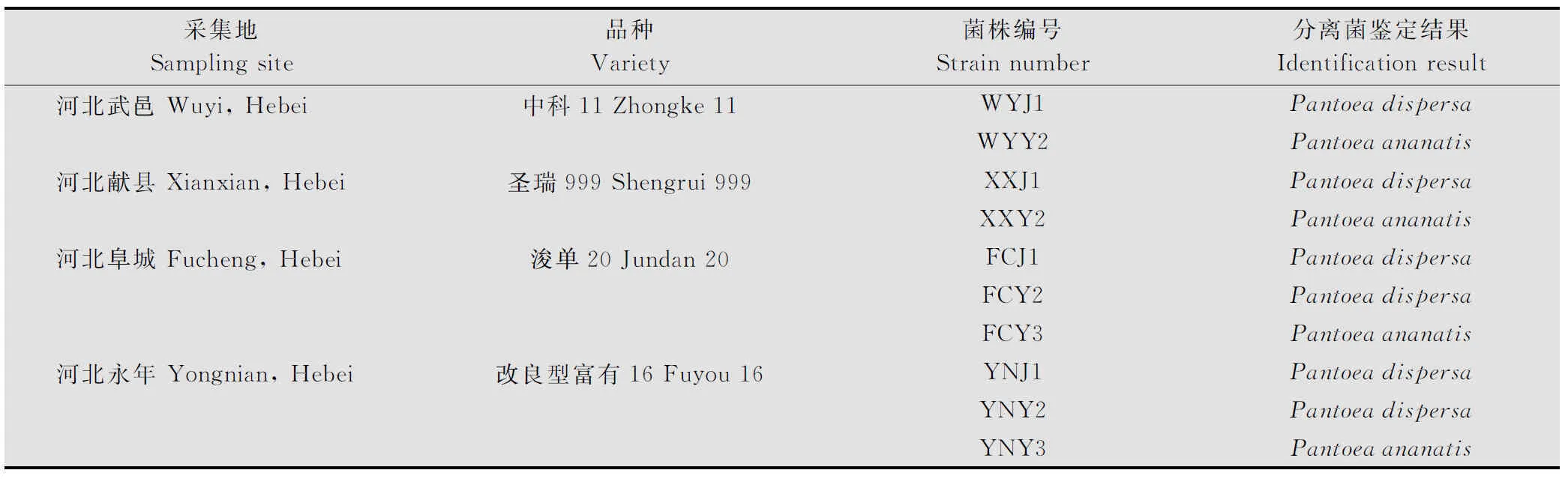
表1 玉米细菌性病害病原物分离鉴定结果
本研究中,对采集到的河北4个地点(武邑县、献县、阜城县、永年县)发病玉米植株的病原菌进行分离后,得到10株分离细菌,采用基于16S rDNA和gyrB基因检测技术对分离得到的10株细菌进行鉴定。比对结果鉴定病原菌为P.ananatis和P.dispersa。根据科赫氏法则在温室进行P.ananatis和P.dispersa的致病性初步验证,发现P.ananatis和P.dispersa在温室条件下,可以引起与田间相似的病害症状,确定P.ananatis和P.dispersa对玉米具有致病性,为河北地区发生的玉米新型细菌性病害的病原菌,这是国内首次报道的由P.ananatis和P.dispersa所引起的玉米细菌病害。研究将为该玉米新型细菌性病害的防治提供理论基础。
[1]McGee D C. Maize disease:A reference source for seed technologists [M]. St. Paul,MN:APS Press, 1988.
[2]张小利, 王晓鸣, 何月秋. 玉米细菌性叶斑病—上升中的玉米病害[J]. 植物保护, 2009,35(6):114118.
[3]Nazina T N, Shumkoya E S, Sokolova D S, et al.Identification of hydrocarbon-oxidizingDietziabacteria from petroleum reservoirs based on phenotypic properties and analysis of the 16S rRNA and gyrB genes [J].Mikrobiologiia,2015,84(3):331343.
[4]de Maayer P, Chan Waiyin, Rubagotti E, et al. Analysis of thePantoeaananatispan-genome reveals factors underlying its ability to colonize and interact with plant, insect and vertebrate hosts [J]. BMC Genomics, 2014, 15:404418.
[5]姚文国. 中国进出境植物检疫手册[M]. 第7版. 北京:中国农业出版社, 1996.
[6]郑雅楠, 吕国忠, 杨宇, 等. 玉米细菌性茎腐病鉴别与防治[J]. 安徽农业科学, 2006, 34(10):21282133.
[7]王岭, 田世民, 高海霞, 等. 玉米细菌性枯萎病菌改良Dot-ELISA检测研究[J]. 微生物学通报, 2008, 35(2):230234.
[8]Morales-Valenzuela G, Silva-Rojas H V, Ochoa-Martinez D, et al. First report ofPantoeaagglomeranscausing leaf blight and vascular wilt in maize and sorghum in Mexico [J]. Plant Disease, 2007, 91(10):1365.
[9]曹慧英. 玉米新病害—细菌干茎腐病的研究[D]. 北京:中国农业科学院, 2010.
[10]Goszczynska T, Botha W J, Venter S N, et al. Isolation and identification of the causal agent of brown stalk rot, a new disease of maize in South Africa [J]. Plant Disease, 2007, 91(6):711718.
[11]Azad H R, Holmes G J, Cooksey D A. A new leaf blotch disease of sudangrass caused byPantoeaananasandPantoeastewarrii[J]. Plant Disease, 2000, 84(9):973979.
[12]Cother E J, Reinke R, McKenzie C, et al. An unusual stem necrosis of rice caused byPantoeaananasand the first record of this pathogen on rice in Australia[J]. Australasian Plant Pathology, 2004, 33(4):495503.
[13]Shyntum D Y, Venter S N, Moleleki L N, et al. Comparative genomics of type Ⅵ secretion systems in strains ofPantoeaananatisfrom different environments[J]. BMC Genomics, 2014, 15:163178.
[14]Choi O, Kim H, Lee Y, et al. First report of sheath rot of rice caused byPantoeaananatisin Korea[J]. Plant Pathology Journal, 2012, 28(3):331.
[15] Kido K, Adachi R, Hasegawa M, et al. Internal fruit rot of netted melon caused byPantoeaananatis(=Erwiniaananas)in Japan[J]. Journal of General Plant Pathology, 2008, 74(4):302312.
[16]Walcott R R, Gitaitis R D, Castro A C, et al. Natural infestation of onion seed byPantoeaananatis, causal agent of center rot [J]. Plant Disease, 2002, 86(2):106111.
(责任编辑:杨明丽)
Identification of the bacteria causing a new brown stalk rot on maize
Gu Qin,Zhang Hao,Huang Hai,Ding Zheng,Wu Huijun,Gao Xuewen
(College of Plant Protection, Key Laboratory of Integrated Pest Management on Crops in East China,Ministry of Agriculture,Nanjing Agricultural University, Nanjing210095, China)
To identify the pathogens of newly occurred maize disease, we collected the samples of maize disease from four areas (Wuyi, Xianxian, Fucheng and Yongnian)in Hebei Province. The symptoms of the disease showed yellowish-brown dry rot in corn stalk, curl and blight symptoms on leaf tips and yellow spots on leaf veins. Pathogenic tests were assayed by inoculating the bacteria isolated from the diseased corn plants. The pathogens were identified asPantoeaananatisandP.dispersaaccording to the sequence analysis of 16S rDNA andgyrBgene.To our knowledge, it is the first report ofP.ananatisandP.dispersacausing maize disease in China.
corn disease;16S rDNA;gyrBgene;Pantoeadispersa;Pantoeaananatis
20151029
20151130
公益性行业(农业)科研专项(20130315);国家高技术研究发展计划(2012AA101106);江苏省重点研发计划(现代农业)(BE2015354)
E-mail:gaoxw@njau.edu.cn
S 435.131
A
10.3969/j.issn.05291542.2016.03.014
致谢:全国农业技术推广服务中心、河北省植保植检站和武邑、献县、阜城和永年县技术人员联系或采集病株,一并表示感谢。
