小菜蛾钙黏蛋白片段对Cry1Ac蛋白的增效作用
2016-09-01龚莉君袁哲明杨中侠
龚莉君, 彭 鹏, 袁哲明,2, 柳 傲, 杨中侠,2*
(1. 植物病虫害生物学与防控湖南省重点实验室, 湖南农业大学植物保护学院, 长沙 410128; 2. 湖南省生物农药与制剂加工工程技术研究中心, 长沙 410128)
小菜蛾钙黏蛋白片段对Cry1Ac蛋白的增效作用
龚莉君1,彭鹏1,袁哲明1,2,柳傲1,杨中侠1,2*
(1. 植物病虫害生物学与防控湖南省重点实验室, 湖南农业大学植物保护学院, 长沙410128; 2. 湖南省生物农药与制剂加工工程技术研究中心, 长沙410128)
根据已报道的昆虫毒素结合区钙黏蛋白片段对Cry1Ac蛋白有增效作用,本文以3龄小菜蛾幼虫为研究对象,选取其钙黏蛋白相同功能区的两个片段,将两个片段进行克隆。通过pGEX-6p-1载体,在大肠杆菌中表达了功能区片段PxCAD1及PxCAD2。使用致死中浓度剂量的CrylAc蛋白(1 μg/mL)及较高浓度的PxCAD1(556 μg/mL)与PxCAD2(551.25 μg/mL)对小菜蛾幼虫进行体外复配生测,结果表明,PxCAD1可使小菜蛾幼虫的致死率上升为85.56%,PxCAD2则不能增强CrylAc蛋白的杀虫活性;而PxCAD1与PxCAD2本身对于小菜蛾幼虫并无毒性。研究结果为筛选有效的协同片段提供了理论依据,对于揭示Bt杀虫蛋白的毒理机制和害虫对Bt杀虫蛋白的抗性机制具有重要意义。
小菜蛾;钙黏蛋白片段;Cry1Ac;增效作用;表达
苏云金芽胞杆菌(Bacillusthuringiensis,Bt)是目前世界上产量最大、应用最广泛、杀虫范围最广的微生物杀虫剂[12]。Bt晶体毒素被敏感昆虫取食后,其在幼虫肠道碱性环境和蛋白酶的作用下被激活,释放出活性毒素蛋白。活性毒素蛋白随后与幼虫中肠上皮细胞的特异性受体结合形成毒素寡聚体,诱导毒素分子的空间构象发生变化。多个毒性肽分子在细胞膜中聚集围成外表面疏水、内表面亲水的膜离子通道,进而破坏细胞渗透平衡、细胞吸胀破裂,导致肠壁破裂昆虫死亡[3]。害虫抗药性的增强成为Bt毒素长期有效使用的最大威胁,理解Bt的作用模型及害虫的抗性机制对于寻找策略提高Bt的功效及克服害虫抗性具有重要意义。
据报道,除杀虫晶体蛋白和外毒素具有杀虫作用外,还有许多与杀虫相关的增效物质可增强Bt的杀虫功效。鞘翅目、鳞翅目及双翅目昆虫中的几种丝氨酸酶抑制剂(serine protease inhibitors)可增强Cry 毒素的毒性[45];增加昆虫中肠内切几丁质酶(endochitinases)的水平或于Cry毒素制剂中增加外源几丁质酶(chitinase)的水平可将Cry毒素的效果增加10倍[67];Cyt蛋白(Cyt proteins)可与Cry4A、Cry4B 及 Cry11Aa等蛋白协同作用,克服致倦库蚊(Culexpipiensquinquefasciatus)种群对Cry毒素的抗性[8];且研究表明Cyt1Aa通过作为膜结合受体,可增强Cry11Aa对致倦库蚊的毒性等[9]。另有研究表明,烟草天蛾(Manducasexta)的钙黏蛋白作为协同增效剂能显著增强Bt Cry1A对鳞翅目幼虫小地老虎(Agrotisipsilon)、甜菜夜蛾(Spodopteraexigua)和玉米夜蛾(Helicoverpazea)的毒性[10]。Hua等[11]的研究表明钙黏蛋白AdCad1是鞘翅目黑粉虫(Alphitobiusdiaperinus)幼虫中Bt毒素Cry3Bb的一个受体,且沉默AdCad1基因后可显著降低黑粉虫幼虫对Cry3Bb的敏感性。
本研究依据Peng等[12]报道的棉铃虫氨基酸毒素结合区HaCad1(GenBank登录号:AF519180)第1 217~1 461位氨基酸能增强Cry毒素活性,及Chen等[6]报道的对Bt毒素具有增效作用的烟草天蛾CR12MPED片段(GenBank登录号:AF319973)第1 362~1 567位序列,克隆并表达了2个小菜蛾钙黏蛋白编码基因相应片段,并进一步测定了原核表达并纯化后的相应蛋白PxCAD1及PxCAD2对小菜蛾的毒力,明确了PxCAD1对Cry1Ac杀虫蛋白的增效特性。
1 材料与方法
1.1供试昆虫、试剂、质粒及菌株
小菜蛾(Plutellaxylostella)美国敏感品系(Cry1Ac-S),由中国农业科学院蔬菜花卉研究所昆虫组惠赠,于室内饲养多年,期间未施任何杀虫剂。
RNA抽提所用TRIzol、cDNA合成试剂盒、T4DNA连接酶购自TaKaRa公司;限制性内切酶EcoRI、XholI及SalI,购自NEB及Thermo公司;TaqDNA聚合酶、琼脂糖凝胶回收试剂盒购自Tiangen公司;抗生素、溶菌酶及其他主要生化试剂购自长沙布兰哲生物科技、上海生工生物工程有限公司和北京全式金生物技术有限公司;细菌蛋白抽提试剂、普通DNA产物纯化试剂盒、SDS-PAGE凝胶制备试剂盒、Bradford蛋白测定试剂盒购于康为世纪公司;pEASY-T1 Cloning Kit、表达载体pGEX-6p-1购自全式金生物技术有限公司;SanPrep柱式质粒DNA小量抽提试剂盒购自上海生工生物工程有限公司;GST标签蛋白纯化试剂盒购自Merck Millipore公司。
1.2总RNA的抽提及检测
按照TRIzoL抽提RNA法的说明书提取小菜蛾幼虫中肠总RNA,抽提的总RNA纯度符合试验要求后,存于-80℃备用。
1.3RT-PCR法克隆基因片段PxCAD1及PxCAD2
按照说明书合成cDNA第一链。根据Peng等[12]报道的棉铃虫氨基酸毒素结合区HaCad1第1 217~1 461位氨基酸能增强Cry毒素活性。在NCBI上下载其棉铃虫(AF519180)及小菜蛾(EF541176)的氨基酸序列,通过DNAMAN软件比对,找出对应的核苷酸序列,并以此为依据设计引物Cad-1f:ACGATCAGGGCCACCGACG;Cad-1r:GTACACCTTCACCTCCGCAC对PxCAD-1 (735 bp)片段进行PCR扩增。以合成的cDNA第一链为模板,进行第2步PCR反应,反应参数和程序为:94℃ 5 min;94℃ 1 min;62.2℃ 1 min;72℃ 1 min,30个循环;72℃ 10 min。PCR产物经电泳检测后,回收产物,与pEASY-T1载体连接,转化大肠杆菌,挑选阳性克隆进行酶切与PCR鉴定,后由上海生工生物工程公司进行测序。
根据已发表的对Bt毒素具有增效作用的烟草天蛾钙黏蛋白基因序列信息CR12MPED片段(序列登录号AF319973),通过DNAMAN软件比对,找出小菜蛾(序列登录号EF541176)相对应的钙黏蛋白核苷酸序列,并设计其引物Cad-2f:ATCAACAGGGAACTATTTACGG;Cad-2r:GCCCAACAGGTAGATGATGACG用于PxCAD2的PCR扩增,产物大小约627 bp。以合成的cDNA第一链为模板,进行第2步PCR反应,反应参数和程序为:94℃ 5 min;94℃ 1 min;61.7℃ 1 min;72℃ 1 min,30个循环;72℃ 10 min。PCR产物经电泳检测后,回收产物,与pEASY-T1载体连接,转化大肠杆菌,挑选阳性克隆进行酶切与PCR鉴定,后由上海生工生物工程公司进行测序。
1.4重组蛋白的表达及纯化
目的片段先与pEASY-T1载体连接转入大肠杆菌DH5α感受态细胞,挑选阳性克隆提取质粒后用双酶切,回收目的片段,再与表达载体pGEX-6p-1连接,转入大肠杆菌感受态BL21(DE3)中,挑取单菌落阳性鉴定,将阳性鉴定子加入含Chl及Amp抗生素的LB液体培养基中37℃过夜培养。经最适温度加入IPTG诱导表达,检测是否成功获得与预测大小一致的总蛋白,后裂解检测总蛋白为包涵体还是可溶性蛋白,确定可溶性蛋白后,通过改变诱导温度、诱导IPTG浓度和诱导时间来筛选最优的表达条件,尽可能多地获得可溶性蛋白。最后用GST蛋白纯化试剂盒纯化筛选出单一的目的蛋白,操作方法按照试剂盒内的说明书进行,先加入树脂和洗涤缓冲液洗涤,再加入样品悬浮树脂进行孵育结合后漂洗,最后加入洗脱液收集纯化后的蛋白溶液。通过SDS-PAGE检测后,用Brandford标准曲线法对蛋白进行定量。
1.5表达蛋白的生物活性测定
小菜蛾的生物测定方法同Yang等[13]。将定量后的PxCAD1(556 μg/mL)蛋白与Cry1Ac混合液、PxCAD2(551.25 μg/mL)蛋白与Cry1Ac混合液、Cry1Ac(1 μg/mL)溶液、PxCAD1(556 μg/mL)蛋白溶液及PxCAD2(551.25 μg/mL)蛋白溶液,分别采用叶片浸渍法对小菜蛾幼虫进行毒力测定,以表达载体pGEX-6p-1与Cry1Ac毒素的混合液为对照。药后72 h观察并记录死亡虫数,每个蛋白的生物测定重复3次,数据统一采用SPSS 11.5统计软件进行分析。
2 结果与分析
2.1PxCAD1及PxCAD2基因片段的获得
PCR扩增得到了大小为735 bp与627 bp的PxCAD1及PxCAD2特异性DNA片段(图1),前者编码245个氨基酸,后者编码209个氨基酸序列。为明确棉铃虫及烟草天蛾源增效位置片段与得到的小菜蛾相应位置片段PxCAD1与PxCAD2的异同,故将得到的小菜蛾PxCAD1与棉铃虫毒素结合区相对应的序列(序列登录号AF519180)比对,结果发现具有50.83%的相似性(图2);PxCAD2片段为根据已报道的烟草天蛾毒素结合区相对应的序列进行克隆,故将得到的小菜蛾PxCAD2与烟草天蛾毒素结合区相对应的序列(序列登录号AF319973)比对,结果发现具有55.56%的相似性(图3)。

图2 小菜蛾PxCAD1片段与棉铃虫钙黏蛋白片段序列比对Fig.2 Sequence alignment between PxCAD1 fragment and cadherin fragment of Helicoverpa armigera

图3 小菜蛾PxCAD2片段与烟草天蛾钙黏蛋白片段序列比对Fig.3 Sequence alignment between PxCAD2 fragment and cadherin fragment of Manduca sexta
2.2小菜蛾钙黏蛋白毒素结合区PxCAD1及PxCAD2的表达与纯化
2.2.1目的片段与载体pEASY-T1重组质粒的双酶切
根据Primer 5.0软件找到合适的酶切位点,PxCAD1片段用EcoRI和SalI进行双酶切,结果其重组质粒几乎被酶完全切开,获得了含有黏性末端的735 bp的PxCAD1目的片段和剩下切开的线性质粒片断,PxCAD2用EcoRI和XhoI进行双酶切,结果其重组质粒大部分被酶切成功,少量酶切失败,获得了大部分含黏性末端的627 bp的PxCAD2目的片段、剩下已切开的大部分的线性质粒片段及少量的未切开的环状重组质粒(图4)。
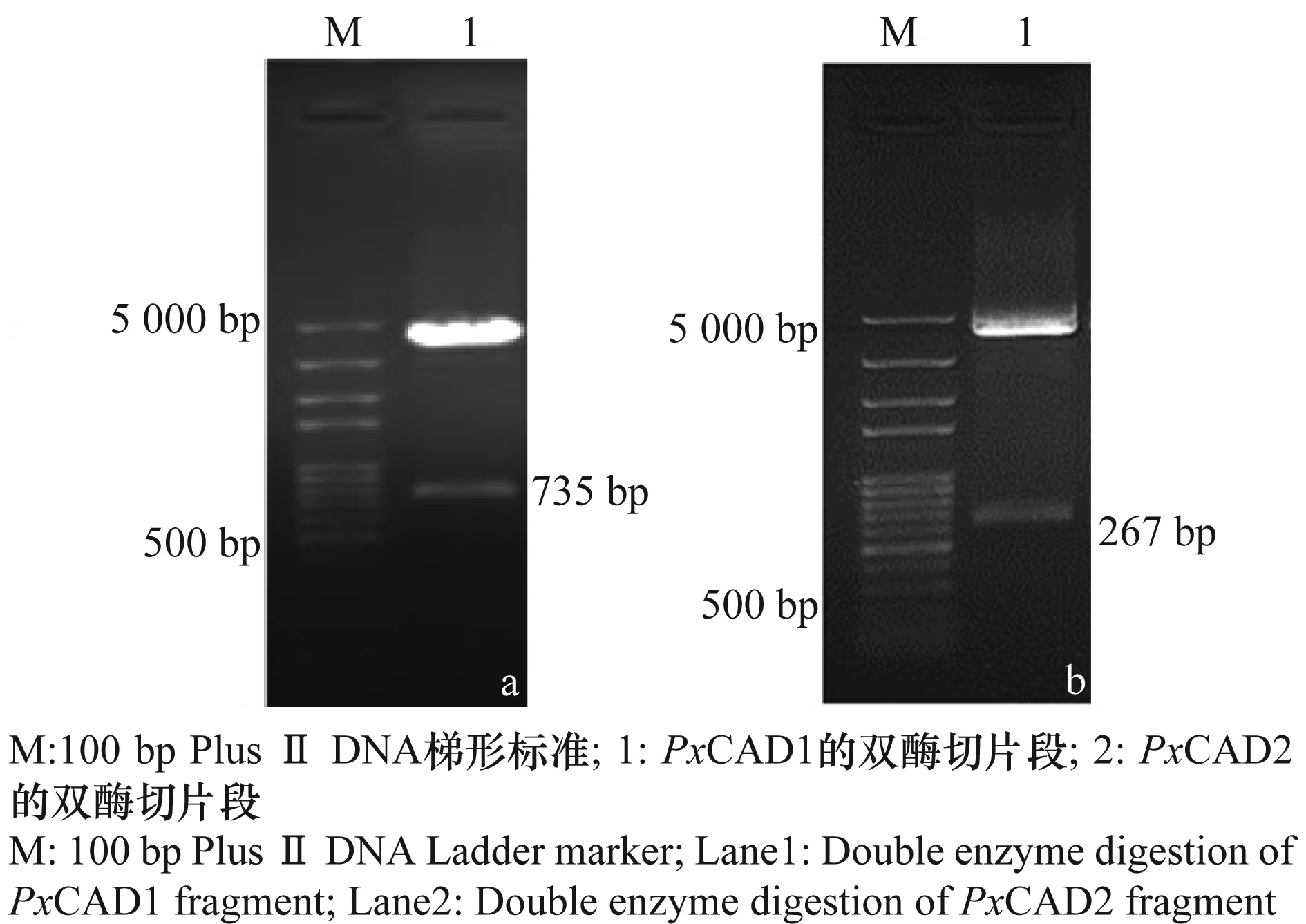
图4 PxCAD1(a)和PxCAD2(b)重组质粒的双酶切Fig.4 Double enzyme digestion of the recombinant plasmid with PxCAD1(a) and PxCAD2(b) fragment
2.2.2重组表达载体的构建及其表达与纯化
(1)PxCAD1可溶性蛋白诱导表达条件的优化
首先选择最适生长温度 37℃,转速160 r/min,参考已发表文献中所采用的IPTG终浓度1 mmol/L及诱导时间3 h进行诱导,SDS-PAGE结果如图5,在3泳道55 kDa左右出现与预测GST-PxCAD1大小一致的目的条带,可知重组蛋白PxCAD1成功表达。
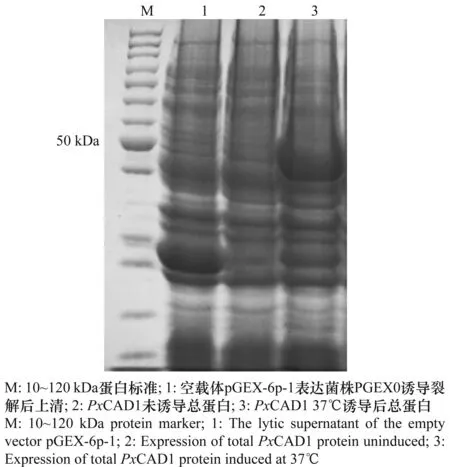
图5 37℃条件下诱导PxCAD1表达的总蛋白Fig.5 Expression of total PxCAD1 protein induced at 37℃
经检测后发现在上清中获得的PxCAD1可溶性蛋白只有少量,为获得更多的可溶性蛋白对诱导条件进行了一系列的优化。优化条件为22℃、0.5 mmol/L IPTG、4 h时,扩大培养,超声波裂解菌体,纯化筛选出单一目的蛋白,如图6(a),用Brandford标准曲线法对蛋白进行定量,得到PxCAD1的浓度为556 μg/mL。
(2)PxCAD2可溶性蛋白诱导表达条件的优化
首先选择最适生长温度 37℃下诱导,参考已发表文献中所采用的IPTG终浓度1 mmol/L,诱导时间6 h,转速150 r/min进行诱导,SDS-PAGE结果如图6(b),在2泳道51 kDa左右出现与预测GST-PxCAD2大小一致的目的条带,可知重组蛋白PxCAD2成功得到表达。
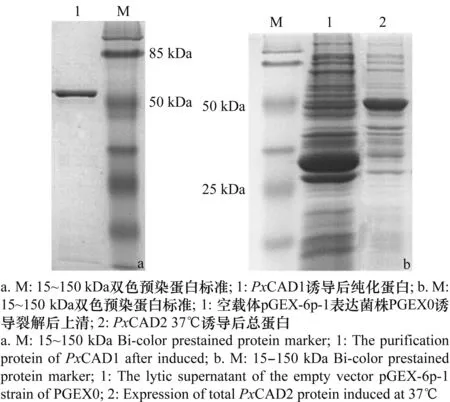
图6 PxCAD1(a)和PxCAD2(b)的SDS-PAGE检测Fig.6 SDS-PAGE of PxCAD1(a)and PxCAD2(b)polypeptides
为获得更多的可溶性蛋白,对诱导条件优化后选择乳糖自诱导法的表达,并根据优化条件扩大培养,超声波裂解菌体,纯化筛选出单一目的蛋白(图7),用Brandford标准曲线法对蛋白进行定量,得到PxCAD2的浓度为551.25 μg/mL。
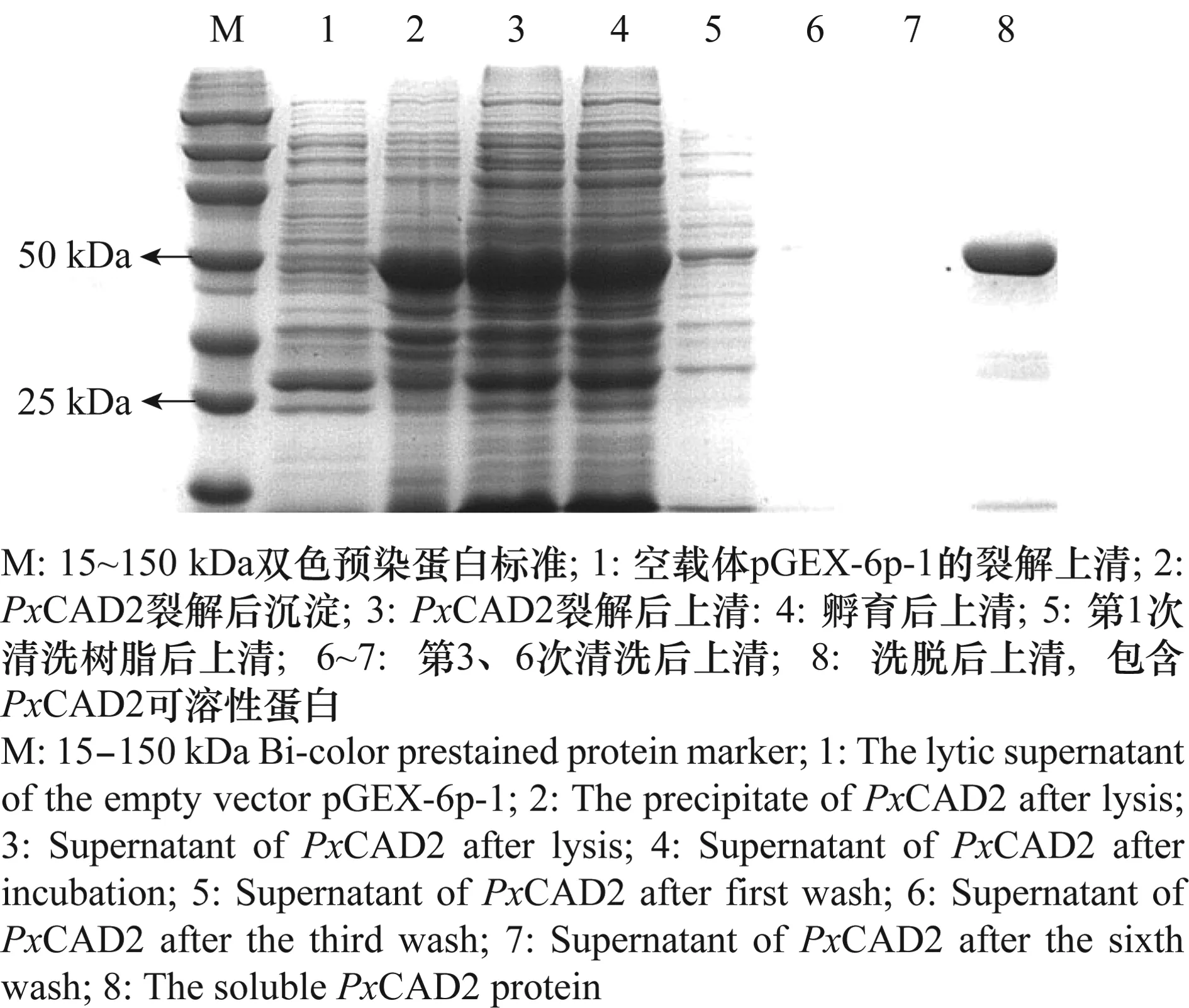
图7 PxCAD2的SDS-PAGE检测Fig.7 SDS-PAGE of PxCAD2 peptide
2.3表达蛋白的生物测定
制备用作生物测定的经过纯化的Cry1Ac蛋白、PxCAD1及PxCAD2,并分别测定其浓度。以小菜蛾敏感品系3龄幼虫(LC50=1.873 μg/mL,见表1)作为生物测定对象,分别测定了在Cry1Ac致死中浓度(1 μg/mL),及较高浓度的PxCAD1(556 μg/mL)或PxCAD2(551.25 μg/mL)存在时的死亡率(图8)。结果表明,1 μg/mL的Cry1Ac可引起小菜蛾幼虫46.7%的死亡率;当加入浓度为556 μg/mL的PxCAD1时,小菜蛾3龄幼虫的死亡率为85.6%,当加入浓度为551.25 μg/mL的PxCAD2时,死亡率为45%;而对照组在1 μg/mL的Cry1Ac中,加入浓度为300.27μg/mL的pGEX-6p-1载体时,小菜蛾3龄幼虫的死亡率为45.6%,处理与对照之间差异显著。浓度为556 μg/mL的GST-PxCAD1蛋白溶液与浓度为551.25 μg/mL的GST-PxCAD2蛋白溶液均不会显著引起小菜蛾幼虫的死亡,表明表达后的PxCAD1与PxCAD2蛋白本身并无毒性,而PxCAD1蛋白可增强Cry1Ac蛋白的杀虫活性,而较高浓度的PxCAD2也无增效作用。

表1 小菜蛾对Cry1Ac毒素的敏感性测定

图8 PxCAD1与PxCAD2对Cry1Ac杀虫活性的增效作用Fig.8 Enhancement of PxCAD1 and PxCAD2 of Plutella xylostella to Cry1Ac insecticidal activity
3 讨论
钙黏蛋白属依赖于钙离子的跨膜蛋白家族中的一类,在多细胞间起连接和保持细胞完整性的作用,还在细胞增殖、分化过程中起连接蛋白的作用,并能调节胞外结构域与胞质结构域的信号转导途径[14]。其作为Bt Cry毒素的初级受体,介导Bt Cry毒素毒杀害虫的过程,在鳞翅目[12,1518,22]、鞘翅目[8, 23]及双翅目[10]等多种昆虫中钙黏蛋白的氨基酸序列均已确定。昆虫的钙黏蛋白从N端至C端依次是信号肽、由9~12个重复子(cadherin repeats,CR)组成的重复区、近膜区(membrane proximal extracellular domain,MPED)、跨膜区(transmembrane domain)及胞质区(intracellular domain)[11, 18]5个功能区域。钙黏蛋白已被证实为鳞翅目害虫Cry1Ac毒素的首选靶标[18]。
已有的报道证明,烟草天蛾、烟芽夜蛾及甜菜夜蛾体内的钙黏蛋白毒素结合片段,在Bt毒素反应过程中起着协同作用,且在烟草天蛾中无论钙黏蛋白片段大小,均能在不同水平上影响毒素毒性的增强[10]。Pacheco等[24]的分析表明,杀虫活性的增强是由于钙黏蛋白片段CR12与Cry1A毒素结合促进了低聚物的形成。除此之外,他还指出钙黏蛋白片段CR7和CR11增强了Cry1Ac、Cry1Ab毒素对烟草天蛾幼虫的杀虫活性,但是效率不如CR12片段。
Peng等[19]的研究结果表明棉铃虫钙黏蛋白片段毒素结合区HaCad1显著增强了Cry1A毒素的毒性。本研究选取了小菜蛾钙黏蛋白的相同位置序列PxCAD1,测序后与棉铃虫的该段序列氨基酸比对的相似性为50.83%,经表达纯化后,加入Cry1Ac毒素对小菜蛾进行室内毒力测定,致死率与对照有显著差异,由此表明,该肽段对Cry1Ac毒素有显著增效作用。
Chen等[1]的研究结果表明,烟草天蛾钙黏蛋白片段毒素结合区CR12MPED显著增强了Cry1A毒素的毒性,并发现CR12MPED 片段能够高亲和力地结合烟草天蛾中肠上皮细胞膜(Kd = 32 nM),并认为增效作用的产生是由于CR12MPED 片段在昆虫中肠BBMV 上增加了毒素结合位点,这些结合位点能够吸引Cry1A毒素与中肠上皮细胞膜结合[1]。本研究选取了小菜蛾钙黏蛋白的相同位置序列PxCAD2,其与烟草天蛾的该段序列氨基酸比对的相似性为55.56%,经表达纯化后,加入Cry1Ac毒素并对小菜蛾进行室内毒力测定,结果发现处理组与对照组对小菜蛾的致死率并无显著差异,显然该肽段对Cry1Ac毒素并无增效作用。
郑晓旭等[26]用大肠杆菌进行表达的条件,构建了小菜蛾钙黏蛋白片段基因的重组载体,优化了一系列条件,但发现温度的改变对融合蛋白的可溶性几乎没有影响,其得到的蛋白均为包涵体蛋白。本研究选择了与其不同位置的钙黏蛋白片段,并选用了适合的原核表达载体pGEX-6p-l,经一系列优化条件后,得到了大量的可溶性蛋白,并将其纯化后对小菜蛾幼虫进行体外复配生测,本文首次针对小菜蛾的CAD1及CAD2两个片段研究了它们的增效作用。另有研究结果表明,多肽片段的空间结构是影响Cry毒素协同增效的因素之一,钙黏蛋白片段对Cry毒素起增效作用的多肽片段大都为包涵体,处于展开状态[6],也有报道可溶性钙黏蛋白片段对毒素呈减效作用[27]。本研究中,表达的PxCAD1及PxCAD2蛋白均为可溶性蛋白片段,其中较高浓度的PxCAD1蛋白片段表现出了增效活性,但PxCAD2蛋白片段即使高浓度对Cry1Ac毒素也没有表现出增效或减效作用,具体原因尚需进一步研究。该结果将为筛选有效的小菜蛾钙黏蛋白增效片段即寻找Cry1A毒素新的增效因子提供理论基础。
[1]Sanahuja G, Banakar R, Twyman R M, et al.Bacillusthuringiensis:a century of research, development and commercial applications [J]. Plant Biotechnology Journal, 2011, 9(3):283300.
[2]Raymond B, Wright D J, Bonsall M B. Effects of host plant and genetic background on the fitness costs of resistance toBacillusthuringiensis[J]. Heredity, 2011, 106(2):281288.
[3]Griffitts J S, Aroian R V. Many roads to resistance:how invertebrates adapt to Bt toxins [J].Bioessays, 2005, 27(6):614624.
[4]MacIntosh S C, Kishore G M, Perlak F J, et al. Potentiation ofBacillusthuringiensisinsecticidal activity by serine protease inhibitors [J]. Journal of Agricultural Food Chemistry, 1990,38(4):11451152.
[5]Hilder V A, Gatehouse A M R, Sheerman S E, et al. A novel mechanism of insect resistance engineered into tobacco[J]. Nature,1987,330:160163.
[6]Ding Xuezhi, Luo Zhaohui, Xia Liqiu, et al. Improving the insecticidal activity by expression of a recombinant cry1Ac gene with chitinase-encoding gene in acrystalliferousBacillusthuringiensis[J]. Current Microbiology, 2008,56(5):442446.
[7]Regev A, Keller M, Strizhov N. Synergistic activity of aBacillusthuringiensisdelta-endotoxin and a bacterial endochitinase againstSpodopteralittoralislarvae [J]. Applied and Environmental Microbiology, 1996,62(10):35813856.
[8]Wirth M C, Georghiou G P, Federici B A. CytA enables CryIV endotoxins ofBacillusthuringiensisto overcome high levels of CryIV resistance in the mosquitoCulexquinquefasciatus[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997;94(20):1053610540.
[9]Pardo-Lopez L, Munoz-Garay C, Porta H, et al. Strategies to improve the insecticidal activity of Cry toxins fromBacillusthuringiensis[J]. Peptides, 2009, 30(3):589595.
[9]Pérez C, Fernandez L E, Sun J, et al.BtiCry11Aa and Cyt1Aa toxins interactions support the synergism-model that Cyt1Aa functions as membrane-bound receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102:1830318308.
[10]Abdullah M A, Moussa S, Taylor M D, et al.Manducasexta(Lepidoptera:Sphingidae) cadherin fragments function as synergists for Cry1A and Cry1CBacillusthuringiensistoxins against noctuid mothsHelicoverpazea,AgrotisipsilonandSpodopteraexigua[J]. Pest Management Science, 2009, 65(10):10971103.
[11]Hua G, Park Y, Adang M J. Cadherin AdCad1 inAlphitobiusdiaperinuslarvae is a receptor of Cry3Bb toxin fromBacillusthuringiensis[J]. Insect Biochemistry and Molecular Biology, 2014, 45:1117.
[12]Peng Donghai, Xu Xiaohui, Ye Weixing, et al.Helicoverpaarmigeracadherin fragment enhances Cry1Ac insecticidal activity by facilitating toxin-oligomer formation [J]. Applied Microbiology and Biotechnology, 2010, 85(4):10331040.
[13]Yang Zhongxia, Zhang Wenli, Wu Qingjun, et al. Effects of injecting cadherin gene dsRNA on growth and development in diamondback mothPlutellaxylostella(Lep.:Plutellidae)[J]. Journal of Applied Entomology, 2009, 133(2):7581.
[14]Angst B D, Marcozzi C, Magee A I. The cadherin superfamily:diversity in form and function [J]. Journal of Cell Science, 2001, 114:629641.
[15]Gahan L J, Gould F, Heckel D G. Identification of a gene associated with Bt resistance inHeliothisvirescens[J]. Science, 2001,293(5531):857860.
[16]Jurat-Fuentes J L, Adang M J. TheHeliothisvirescenscadherin protein expressed inDrosophilaS2 cells functions as a receptor forBacillusthuringiensisCry1A but not Cry1Fa toxins[J]. Biochemistry, 2006, 45(32):96889695.
[17]Xie R, Zhuang M, Ross L S, et al. Single amino acid mutations in the cadherin receptor fromHeliothisvirescensaffect its toxin binding ability to Cry1A toxins [J].Journal of Biological Chemistry, 2005, 280(9):84168425.
[18]Xu Xijun, Yu Liangying, Wu Yidong. Disruption of a cadherin gene associated with resistance to Cry1Ac δ-endotoxin ofBacillusthuringiensisinHelicoverpaarmigera[J].Applied and Environmental Microbiology, 2005, 71(2):948954.
[19]Wang Guirong, Wu Kongming, Liang Gemei, et al. Gene cloning and expression of cadherin in midgut ofHelicoverpaarmigeraand its Cry1A binding region [J].Science in China Series C:Life Sciences, 2005, 48(4):346356.
[20]Flannagan R D, Yu C G, Mathis J P, et al. Identification, cloning and expression of a Cry1Ab cadherin receptor from European corn borer,Ostrinianubilalis(Hübner) (Lepidoptera:Crambidae)[J].Insect Biochemistry and Molecular Biology, 2005, 35(1):3340.
[21]Morin S, Biggs R W, Sisterson M S, et al. Three cadherin alleles associated with resistance toBacillusthuringiensisinpinkbollworm[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(9):50045009.
[22]杨峰山,张友军,张文吉,等. 小菜蛾类钙黏蛋白cDNA片段的克隆和序列分析[J]. 农业生物技术学报, 2005, 13(3):396397.
[23]Fabrick J, Oppert C, Lorenzen M D, et al. A novel Tenebrio molitor cadherin is a functional receptor forBacillusthuringiensisCry3Aa toxin [J]. Journal of Biological Chemistry, 2009, 284(27):1840118410.
[24]Pacheco S, Gomez I, Gill S S, et al. Enhancement of insecticidal activity ofBacillusthuringiensisCry1A toxins by fragments of a toxin-binding cadherin correlates with oligomer formation [J]. Peptides, 2009, 30(3):583588.
[25]Dorsch J A, Candas M, Griko N B, et al.Cry1A toxins ofBacillusthuringiensisbind specifically to a region adjacent to the membrane-proximal extracellular domain of BT-R1 inManducasexta:involvement of a cadherin in the entomopathogenicity ofBacillusthuringiensis[J]. Insect Biochemistry and Molecular Biology, 2002, 32:10251036.
[26]郑晓旭,杨峰山,朱勋,等. 小菜蛾类钙黏蛋白片段的原核融合表达载体构建及其条件优化[J]. 中国蔬菜, 2013(14):715.
[27]Liu Chenxi, Wu Kongming, Wu Yidong, et al. Reduction ofBacillusthuringiensisCry1Ac toxicity againstHelicoverpaarmigeraby a soluble toxin-binding cadherin fragment [J].Journal of Insect Physiology, 2009, 55(8):686693.
(责任编辑:田喆)
Synergistic effects of two cadherin gene fragments in functional region fromPlutellaxylostellato CrylAc protein toxicity
Gong Lijun1,Peng Peng1,Yuan Zheming1,2,Liu Ao1,Yang Zhongxia1,2
(1. Hunan Provincial Key Laboratory for Biology and Control of Plant Diseases and Insect Pests, College of Plant Protection, Hunan Agricultural University, Changsha410128, China; 2. Hunan Provincial Engineering & Technology Research Center for Biopesticide and Formulation Processing, Changsha410128, China)
It was reported that peptide from toxin-binding region of cadherin receptor in some insects had a synergistic effect on Cry1Ac toxin. Two cadherin gene fragments (PxCAD1 andPxCAD2) fromPlutellaxylostellawere cloned. The functional region fragmentsPxCAD1 andPxCAD2 were expressed inEscherichiacoliby using vector pGEX-6p-1. Bioassays with CrylAc (1 μg/mL) in the presence ofPxCAD1(556 μg/mL) polypeptide andPxCAD2(551.25 μg/mL)polypeptide were performed againstP.xylostellalarvae. The results showed thatPxCAD1 caused a mortality of 85.56% to the larvae, while there was no significant enhancement of CrylAc toxicity toP.xylostellalarvae withPxCAD2 peptide. Meanwhile,PxCAD1 andPxCAD2 alone were non-toxic toP.xylostellalarvae. Our results provided theoretical basis for screening effective synergistic fragments, and had great significance in revealing the mechanism of Bt insecticidal protein and insect resistance to Bt.
Plutellaxylostella;cadherin fragment;CrylAc;synergism;expression
20150407
20150420
国家自然科学基金(31171861);湖南省高等学校科学研究青年项目(12B065)
E-mail:yzxmichelle@aliyun.com
Q 966
A
10.3969/j.issn.05291542.2016.03.007
