向日葵锈菌夏孢子萌发条件的研究
2016-09-01胡文婕郭丹丹
胡文婕, 郭丹丹, 梁 宇, 景 岚
(内蒙古农业大学农学院, 呼和浩特 010019)
向日葵锈菌夏孢子萌发条件的研究
胡文婕,郭丹丹,梁宇,景岚*
(内蒙古农业大学农学院, 呼和浩特010019)
以向日葵锈菌330生理小种为材料,研究了夏孢子萌发的适宜条件和培养载体。向日葵锈菌夏孢子萌发适宜温度范围10~25℃,最适温度15℃。15℃下在琼脂薄膜上1 h即可萌发,12 h达到萌发高峰,萌发率最高可达97%。孢子在无菌水中萌发最适浓度为20 mg/L,萌发率随浓度增大而降低。光照在前5 h均抑制夏孢子萌发,但7 h后光照对夏孢子总萌发率基本无影响。新鲜夏孢子萌发率较高,在室温放置270 d后基本丧失萌发能力。最适条件下,在供试的6种不同萌发载体上,夏孢子萌发率、芽管长度及萌发形态显著不同,琼脂薄膜载玻片、尼龙纱网、玻璃纸较适宜夏孢子萌发,萌发率超过90%;在PVDF膜和亲水滤膜上可观测到芽管内部黄色物质转移和特殊结构的形成。
向日葵锈菌;夏孢子;萌发条件;萌发率
向日葵锈菌(Pucciniahelianthi)引起的向日葵锈病是向日葵生长发育过程中常见的真菌性病害,1822年美国科学家Schweinitz首次描述了向日葵锈菌[1]。近年来,随着向日葵种植面积的扩大以及连年种植,致病力更强的小种的出现和发展[24]致使向日葵锈病流行的潜在威胁和涉及范围不断增加,从而严重威胁向日葵的生产。锈菌长期以来受到高度重视的主要原因,一方面是其给农业生产和国民经济带来巨大的损失,另一方面是锈菌具有其独特的生物学特性,具有很高的研究价值[5]。夏孢子作为锈菌的主要无性孢子形态,是锈菌唯一能不断重复发生的阶段,不需要经过休眠就能萌发,落到新寄主上24 h内即可萌发产生芽管变成双核菌丝,双核菌丝在几天内就可以形成新的夏孢子堆,对锈病的大规模暴发起着决定性作用。目前,锈菌夏孢子萌发相关研究较多,如小麦条锈菌(Pucciniastriiformisf.sp.tritici)[67]、松杨栅锈菌(Melampsoralarici-populina)[8]、苜蓿锈菌(Uromycesstriatus)[9]等,但是关于向日葵锈菌夏孢子萌发条件,仅1970年Hennessy等[10]有过简单报道。本研究采用超声波水雾法[6],对向日葵锈菌夏孢子进行萌发试验,以探明影响向日葵锈菌夏孢子萌发的主要因素,并研究了不同载体对向日葵锈菌萌发率和芽管形态的影响,旨在通过对向日葵锈菌夏孢子人工萌发条件的研究,掌握适宜于其他研究目的的试验基础条件,为进一步研究夏孢子对寄主侵染和致病机制提供参考依据。
1 材料与方法
1.1供试菌株
供试向日葵锈菌(PucciniahelianthiSchw.)330生理小种由内蒙古农业大学植病研究室提供。在感病品种‘黑大片’上进行隔离繁殖,收集新鲜锈菌夏孢子进行萌发试验。
1.2试验方法
将1%的琼脂培养基融化后用移液枪取500 μL于亲水载玻片上制成琼脂薄膜,用双层纱网将少量夏孢子均匀抖落于琼脂薄膜上,将载玻片置于保鲜盒中的玻璃弯管上,同时在保鲜盒底部加少量无菌水,用超声波加湿器使保鲜盒内处于水雾饱和,然后加盖密闭培养。(以下试验如无特别说明,均采用此方法。)
1.2.1温度对夏孢子萌发的影响
在黑暗条件下培养温度分别设置为-20、0、5、10、15、20、25、30、35、40℃,分别在2、4、8、12 h时统计各处理下新鲜夏孢子的萌发率。
1.2.2光照对夏孢子萌发的影响
将光照环境设置为全黑暗和全光照(2 400 lx)2种,置于15℃恒温培养8 h,每小时观察一次,统计各时间段夏孢子萌发率。
1.2.3存放时间对夏孢子萌发的影响
收集病叶上新鲜夏孢子,分别在20℃环境下干燥处理后密封离心管中并分别存放1、30、90、150、210、270 d,然后对夏孢子进行萌发处理,置于黑暗条件下15℃恒温培养,分别于4、8、12、24 h观察并统计夏孢子萌发率。
1.2.4孢子浓度对夏孢子萌发的影响
将200 mL无菌水倒入30 cm×45 cm的盘中,再将称量好的新鲜夏孢子均匀抖落于水面,使最终浓度为20、30、40、50 mg/L,置于黑暗条件下15℃恒温培养。分别于2、4、8、12 h观察并统计夏孢子萌发率。
1.2.5不同培养载体对夏孢子萌发的影响
采用亲水载玻片、琼脂薄膜载玻片、PVDF膜(polyvinylidene fluoride film, 0.45 μm孔径)、亲水滤膜(0.45 μm孔径)、玻璃纸(cellophane paper)、尼龙纱网(250 μm孔径)6种不同载体。将玻璃纸和尼龙纱网湿润后置于亲水载玻片上,亲水滤膜和PVDF膜安放在铺有水饱和滤纸的亲水载玻片上,用琼脂培养基在亲水载玻片上制成薄膜,并用亲水载玻片作为参照进行萌发试验,分别于2、4、8 h观测萌发率和芽管长度,亲水滤膜和PVDF膜采用侧光照射,仪器型号为OLYMPLUS SZX16。
1.3统计与分析
以芽管长度大于孢子直径的1/2以上作为夏孢子萌发标准[11]。在普通光学显微镜下观察夏孢子的萌发情况。每个处理3个重复,每个重复取不同视野观察不少于300个孢子。统计镜检总孢子数和萌发的孢子数,计算夏孢子萌发率,运用Microsoft Excel和SPSS软件对各处理进行差异显著性分析。
2 结果与分析
2.1培养温度对夏孢子萌发的影响
试验结果(图1)表明,在供试温度范围内,夏孢子在-20℃和40℃时未见萌发,其余0~35℃环境下均可萌发,其中适宜萌发温度为10~25℃,夏孢子在最适温度15℃时2 h萌发率可达到51.5%,至4~8 h达到萌发高峰,12 h萌发率达97%。当温度低于5℃或高于30℃时,夏孢子萌发率显著降低,在35℃时只有极少量萌发。适宜的温度条件下,培养时间越长,孢子萌发率越高。
2.2光照对夏孢子萌发的影响
如图2所示,夏孢子在黑暗条件下处理1 h萌发率便可达33%,显著高于光照条件下处理1 h 的萌发率(14%)。在夏孢子萌发初期,黑暗条件明显促进孢子萌发,在1~5 h萌发率存在显著差异,培养至6 h后萌发率无显著差异,8 h均可达到95%左右。
2.3存放时间对夏孢子萌发的影响
研究结果显示,新鲜夏孢子在培养24 h时萌发率为97%,显著高于室温干燥条件下存放的孢子萌发率。夏孢子在20℃,干燥条件下存放30、90、150、210、270 d后的24 h的萌发率分别为77%、24%、18%和7%,存放270 d后的夏孢子萌发率仅为3%,基本丧失萌发能力,说明夏孢子萌发率随着存放时间的增长而明显降低。
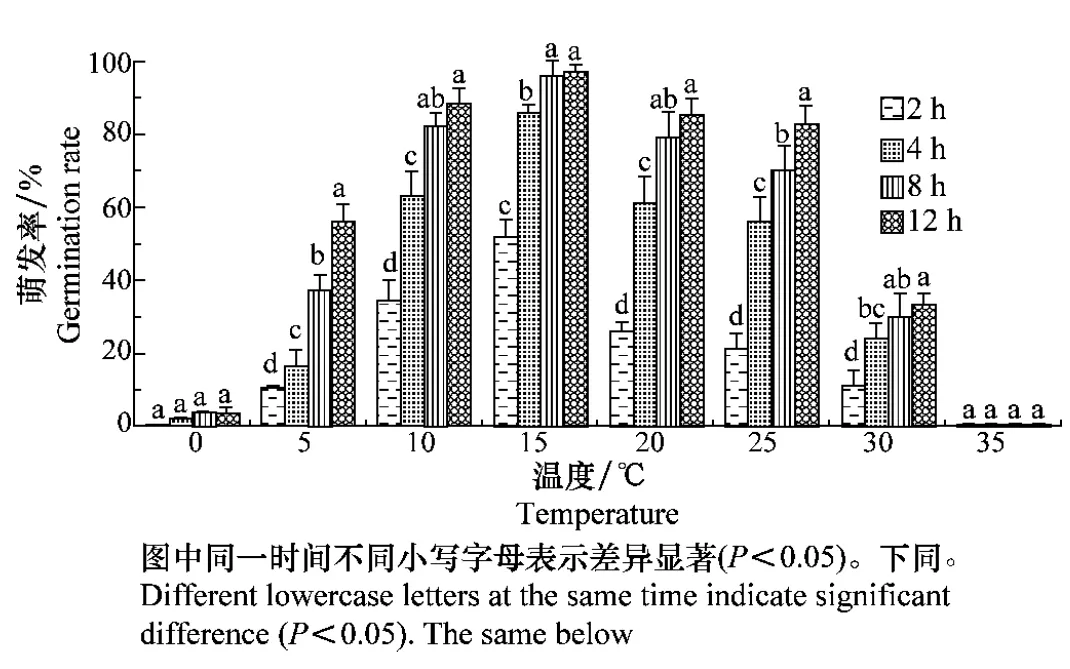
图1 温度对向日葵锈菌夏孢子萌发的影响Fig.1 Effects of temperature on the germination of urediniospores of Puccinia helianthi

图2 光照对向日葵锈菌夏孢子萌发的影响Fig.2 Effects of light on the germination of urediniospores of Puccinia helianthi

图4 孢子浓度对向日葵锈菌夏孢子萌发的影响Fig.4 Effects of spore concentration on the germination of urediniospores of Puccinia helianthi
2.4孢子浓度对夏孢子萌发的影响
由图4可以看出,在与空气接触面积一致条件下,使用水培法使夏孢子萌发,不同孢子浓度对夏孢子萌发影响很大,当孢子浓度为20 mg/L时萌发率最高,12 h时可达到93%,随着孢子浓度的增大,孢子萌发率呈下降趋势,当孢子浓度为50 mg/L时,12 h时萌发率仅为37%。
2.5不同培养载体对夏孢子萌发的影响
表1数据显示,在不同培养载体上夏孢子萌发率存在显著差异。供试的6种培养载体中,琼脂薄膜最适合孢子的萌发,培养8 h后萌发率可达93.5%,明显高于其他载体。其次是尼龙纱网和玻璃纸,分别达到88.75%和86.13%,而孢子在PVDF膜、亲水滤膜和亲水载玻片上萌发率基本无差异,均在46%左右。
从芽管长度来看(表2),培养2 h后,琼脂薄膜上夏孢子萌发芽管最长,载玻片上的最短;PVDF膜、亲水滤膜、玻璃纸及尼龙纱网上的芽管长度没有显著差异,8 h时夏孢子芽管在琼脂薄膜上平均长度为473.85 μm,明显高于其他载体,然后依次为是尼龙纱网、玻璃纸、亲水滤膜。而亲水载玻片和PVDF膜上芽管生长与其他载体相比较慢,8 h时平均长度分别为178.90 μm和168.16 μm。

表1 不同培养载体上向日葵锈菌夏孢子萌发率1)
1) 同列数据后不同小写字母表示差异显著(P<0.05)。下同。
Different lowercase letters in the same column indicate significant difference (P<0.05). The same below.

表2 不同培养载体上向日葵锈菌夏孢子萌发芽管长度
观察不同载体上孢子萌发形态,在琼脂薄膜载玻片(图5a)上可以清晰地看到夏孢子芽管伸长和移动,芽管在琼脂中伸长没有方向性;尼龙纱网(图5b)上孢子萌发芽管较其他载体更为顺直;在亲水载玻片(图5c)上可以观察到夏孢子萌发时孢子内部物质随芽管伸长在芽管内部颗粒状不均匀分布。夏孢子在玻璃纸(图5d)上萌发芽管清晰且萌发程度较为一致。使用侧光照射亲水滤膜(图5e)可以观察到孢子鲜黄色且有光泽,芽管伸长时有黄色物质从孢子内流入芽管,而在PVDF膜(图5f)上萌发后可观察到芽管尾部膨大,黄色物质随芽管伸长流入尾部膨大处,呈鲜黄色水滴状,其他载体均未发现此现象。

图5 不同培养载体上向日葵锈菌萌发夏孢子形态Fig.5 Forms of germinated urediniospores of Puccinia helianthi on different culture substrates
3 结论与讨论
夏孢子反复侵染是向日葵锈病大规模发生的主要原因,研究锈病首先必须明确夏孢子的萌发因素及受环境影响的程度。国内外对向日葵锈菌夏孢子的研究主要集中于侵染条件和侵染结构方面[1213],对影响夏孢子萌发因素鲜有报道,因此本试验在前人研究的基础上对温度、光照、存放时间和孢子浓度以及不同培养载体对锈菌夏孢子萌发的影响进行了研究。
试验结果表明,向日葵锈菌夏孢子的萌发与外界环境条件密切相关,条件适宜的情况下,新鲜孢子1 h便开始萌发,8 h萌发率可达90%以上,萌发时芽管顶端略微膨大,一般每个夏孢子产生1个芽管,少数产生2个芽管,未发现多个芽管的现象。萌发时孢子内部黄色的物质随着芽管伸长流入芽管尾部。夏孢子萌发温度范围较广,0~35℃均可萌发,10~25℃为适宜萌发温度,与Kochman等[10]在1983年得出的15~25℃最适侵染温度及Shtienberg和Vintal[14]在1993年的研究结果10~24℃基本一致。黑暗环境在孢子萌发初期可以促进孢子萌发,但达到一定时间,光照对新鲜孢子萌发率基本无影响,这与小麦条锈菌持续光照抑制夏孢子萌发,但光照对新鲜夏孢子影响较小的结果相近[1516]。使用新鲜的孢子进行生物测定可以确保较高萌发率[17],试验证明锈菌夏孢子存放时间对孢子萌发影响很大,室温条件下存放270 d的夏孢子基本丧失萌发能力。与新鲜夏孢子相比,即使存放30 d的夏孢子萌发率也存在显著差异,结果与张永红对小麦条锈菌夏孢子萌发研究结论一致[7]。存放时间影响孢子萌发率的现象在其他非专性寄生菌如苹果树腐烂病菌(Valsamali)[18]、稻曲病菌(Ustilaginoideavirens)[19]中也同样存在,孢子萌发率会随存放时间增长而下降。夏孢子浓度低于20 mg/L时萌发率最高,超过30 mg/L时萌发率显著降低。浸没水中会抑制夏孢子萌发,可能与其萌发需氧有关;而夏孢子在水面上漂浮时,萌发率会因孢子浓度过高或孢子聚集而降低[2021]。所以在水培条件下应尽量降低孢子浓度。
鉴于水培法不利于对孢子萌发进行观察,试验设置了不同培养载体进行夏孢子萌发试验。结果表明,在其他载体上孢子浓度对萌发率影响很小,只要均匀分散几乎不受浓度影响。并且载体对夏孢子萌发的影响直接取决于它的保水性能,证明水分是夏孢子萌发的关键因素之一[56]。琼脂薄膜载玻片上夏孢子萌发情况最佳,培养8 h后萌发率可达93.5%,芽管平均长度为473.85 μm,便于开展实时观察,适用于观察不同条件对孢子萌发的影响,但由于芽管在琼脂薄膜上伸长没有方向性而且易长入到琼脂薄膜内,收集萌发孢子较为困难;亲水载玻片上孢子萌发过程清晰易于观察,但保湿能力较差,萌发率低且萌发程度差异较大;玻璃纸较亲水载玻片保湿能力强,8 h时萌发率为86.13%,萌发程度较为一致且透光性好,方便实时观察和收集孢子,作为萌发载体较其他载体更具有优越性;使用尼龙纱网做萌发载体,虽观察孢子萌发芽管形态具有局限性,但萌发率高且芽管较长,适用于大量收集萌发孢子及芽管时使用;PVDF膜和亲水滤膜作为载体虽然萌发率较低,但通过侧光照射可全方位观察到孢子萌发过程和形态,并且可以清晰地看到芽管内的黄色物质的转移过程,这与马青、康振生等观察到的向日葵叶片表面锈菌夏孢子芽管结合现象时芽管表现一致[12, 22]。使用纱网和亲水滤膜进行试验的结果与范龙泉等[6]针对不同载体对小麦条锈菌夏孢子萌发影响结果基本一致,但以PVDF膜为载体时观察到向日葵锈菌夏孢子萌发时芽管尾部有明显黄色水滴状膨大,而小麦条锈菌夏孢子在PVDF膜上萌发时未见说明。
鉴于目前针对向日葵锈菌夏孢子萌发条件和方法研究较少,对于研究向日葵锈病的发生规律和防治方法缺乏基础依据,本研究在探明向日葵锈菌夏孢子萌发的基本条件的同时通过对不同载体上夏孢子萌发率和萌发形态的比较,掌握了适用于不同试验目的的夏孢子萌发方法,为向日葵锈菌相关研究奠定了基础条件,对于今后向日葵锈菌侵染机制及夏孢子萌发侵染相关的生物学研究具有重要意义。
[1]Putt E D, Sackston W E. Studies on sunflower rust.Ⅰ. Some sources of rust resistance[J]. Canadian Journal of Plant Science, 1957, 37(1):4354.
[2]Lambrides C J, Miller J F. Inheritance of rust resistance in sunflower [C] ∥ Proceedings of the 13th Sunflower Research Workshop. Fargo, ND, USA. 1991:115118.
[3]Friskop A, Gulya T, Jordahl J, et al. Determination ofPucciniahelianthiraces in the Unites States Northern Great Plains[C] ∥ Proceedings of the 18th international sunflower conference. Mardel Plata and Balcarce, 2012:214218.
[4]Bulos M, Ramos M L, Altieri E, et al. Molecular mapping of a sunflower rust resistance gene from HAR6 [J]. Breeding Science, 2013, 63(1):141146.
[5]Kolmer J A, Ordonez M E, Groth J V. The rust fungi [C] ∥ Encyclopedia of Life Sciences. John Wiley & Sons,Ltd. Chichester. 2009. DOI:10.1002/9780470015902.
[6]范龙泉, 高洪波, 潘映红. 不同培养载体对小麦条锈菌夏孢子人工萌发的影响[J]. 植物保护,2012, 38(2):9295.
[7]张永红, 黄丽丽, 康振生. 小麦条锈菌CY32夏孢子萌发研究[J]. 菌物学报,2006, 25(4):656659.
[8]余仲东, 李秀信, 郭志清, 等. 温度和叶表化学物质对松杨栅锈菌夏孢子萌发的影响[J]. 东北林业大学学报, 2010, 38(7):109112.
[9]周淑清,侯天爵,白儒, 等. 影响苜蓿锈病夏孢子萌发因素的研究[J]. 中国草地,1996, 17(6):4850.
[10]Kochman J K, Goulter K C. The occurrence of a second race of rust (Pucciniahelianthi) in sunflower crops in Eastern Australia [J]. Australasian Plant Pathology, 1984, 13(1):34.
[11]方中达.植病研究方法[M]. 北京:中国农业出版社,1998:151155.
[12]马青, 魏国荣, 康振生, 等. 向日葵锈菌夏孢子芽管在向日葵叶片上的结合现象及核相研究[J]. 西北农业学报,1994, 3(3):8284.
[13]景岚, 王丽芳, 康俊, 等. 向日葵锈菌侵染过程的超微结构研究[J]. 中国油料作物学报,2009, 31(1):7074.
[14]Shtienberg D,Vintal H. Environmental influences on the development ofPucciniahelianthion sunflower[J]. Phytopathology, 1995, 85(11):13881393.
[15]Lucas J A, Kendrick R E, Givan C V. Photocontrol of fungal spore germination [J]. Plant Physiology, 1975, 56(6):847849.
[16]Burrage S W. Environmental factors influencing the infection of wheat byPucciniagraminis[J]. Annals of Applied Biology, 1970, 66(3):429440.
[17]Macko V, Staples R C, Renwick J A A, et al. Germination self-inhibitors of rust urediospores [J]. Physiological Plant Pathology, 1972, 2(4):347355.
[18]刘如香,王树桐,司丽丽,等.环境因素对苹果树腐烂病菌分生孢子萌发与存活的影响[J].安徽农业科学,2011,39(26):912.
[19]李卫平, 王洪凯, 林福呈. 稻曲病菌厚垣孢子的萌发特性[J]. 浙江农业学报,2008, 20(4):278281
[20]Staples R C, Macho V. Germination of urediospore and differentiation of infection structures [J]. The Cereal Rusts, 1984, 1:255289.
[21]Ayliffe M A, Lawrence G J, Ellis J G, et al. Production of self-inhibitor of urediospore germination inMelampsoralini(flax rust) segregates as a recessive, single gene trait [J]. Canadian Journal of Botany, 1997, 75(1):7476.
[22]康振生, 李振岐, 商鸿生, 等. 小麦条锈菌夏孢子和芽管细胞核荧光染色技术[J]. 西北农业大学学报(自然科学版),1993, 21(1):1114.
(责任编辑:田喆)
Germination conditions of the urediospores ofPucciniahelianthi
Hu Wenjie,Guo Dandan,Liang Yu,Jing Lan
(College of Agronomy, Inner Mongolia Agricultural University, Hohhot010019, China)
The urediniospores of the race 330 ofPucciniahelianthiwere used to explore the optimal germination conditions and culture substrates. The urediniospores began to germinate in 1 h at 15℃ and reached the maximum germination rate of 97% in 12 hoursinvitro. The results showed that the suitable range of temperature for urediniospore germination was 10-25℃, and the optimal temperature was around 15℃. The optimal inoculation concentration was 20 mg/L in water. Light had inhibitive effect on germination within 5 hours after inoculation, but no inhibitive effect at 7 h. Fresh spores were used for study to assure a high percentage of germination, and it was ascertained that the urediniospores had lost their germination abilities after stored for nine months at room temperature. By microscopy,we found that there was significant difference in germination rate and length of urediniospore germ tubes on the six culture substrates under the optimal temperature and humidity conditions. The germination rate of urediniospores exceeded 90% on hydrophilic slide, nylon gauze and cellophane paper. Moreover, we could observe movement of yellow particulates in the germinated tubes and formation of special structure on PVDF film and millipore filter.
Pucciniahelianthi;urediniospore;germination condition;germination rate
20150429
20150721
国家自然科学基金(3136042);国家向日葵现代产业技术体系(CARS-16)
E-mail:jinglan71@126.com
S 435.655
A
10.3969/j.issn.05291542.2016.03.012
