择期经皮冠状动脉介入治疗患者普通肝素抗凝强度不足的预测因素
2016-09-01黎婧怡刘震宇张抒扬沈珠军范中杰曾勇谢洪智王崇慧金晓峰方全
黎婧怡 刘震宇 张抒扬 沈珠军 范中杰 曾勇 谢洪智 王崇慧 金晓峰 方全
·临床研究·
择期经皮冠状动脉介入治疗患者普通肝素抗凝强度不足的预测因素
黎婧怡刘震宇张抒扬沈珠军范中杰曾勇谢洪智王崇慧金晓峰方全
目的分析择期经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)患者使用普通肝素(unfractionated heparin,UFH)抗凝后活化凝血时间(activated clotting time,ACT)<300 s的预测因素。方法连续入选2011年5月1日至2012年12月31日在北京协和医院行择期PCI且术中使用UFH抗凝的患者,根据首次静脉注射UFH 5 min时的ACT水平将患者分为抗凝不足组(ACT<300 s)和对照组(ACT≥300 s),比较两组患者的临床和冠状动脉造影资料,分析抗凝强度不足的预测因素和预测界值。结果(1)共入选1062例患者,男752例(70.8%),女310例(29.2%),平均年龄(63.0±10.6)岁,平均体重(70.5±11.7)kg,UFH首次平均给药剂量(100.7±9.1)U/kg。(2)ACT均数为(299.1±82.9)s,中位数为285(240,352)s。其中,ACT<300 s的患者598例(56.3%),ACT为300~350 s的患者183例(17.2%),ACT≥350 s的患者281例(26.5%)。(3)与对照组相比,抗凝不足组的ACT[(242.3±33.9)s比(372.3±68.8)s,P<0.0001]、UFH剂量[(100.1±8.9)U/kg比(101.4±9.2)U/kg,P=0.03]和白蛋白水平[(39.7±4.2)g/L比(40.7±3.8)g/L,P=0.001]更低;而血小板计数[(219.6±62.5)×109/L比(208.9±66.7)×109/L,P=0.008]更高,差异均有统计学意义。(4)logistic回归分析显示,血清白蛋白水平(OR0.940,95%CI0.900~0.980,P<0.01)和血小板计数(OR1.003,95%CI1.001~1.006,P=0.01)是ACT<300 s的独立预测因素。(5)根据受试者工作特征曲线,血清白蛋白<42 g/L和血小板计数>215×109/L为预测ACT<300 s的最佳界值。结论择期PCI患者术中使用UFH后出现抗凝强度不足的比例较高,基线血清白蛋白和血小板计数是抗凝强度不足的独立预测因素。
经皮冠状动脉介入治疗;普通肝素;活化凝血时间;预测因素
Predictors of under-coagulation with unfractionated heparin in patients undergoing elective percutaneous coronary interventionLIJing-yi,LIUZhen-yu,ZHANGShu-yang,SHENZhu-jun,FANZhong-jie,ZENGYong,XIEHong-zhi,WANGChong-hui,JINXiao-feng,FANGQuan.DepartmentofCardiology,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100730,China
普通肝素(unfractionated heparin,UFH)是目前我国经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)中最常使用的抗凝药物[1],但UFH抗凝效果的个体差异很大[2-3]。因此,2011年美国心脏病学会基金会(ACCF)/美国心脏协会(AHA)/心血管造影和介入学会(SCAI)PCI指南[4]明确推荐不仅要根据体重设定UFH的剂量,而且要通过监测活化凝血时间(activated clotting time,ACT)进一步调整UFH的剂量,以使ACT达到300~350 s。抗凝强度不足(ACT<300 s)与PCI围术期血栓事件的发生相关[5-6]。为及时识别使用UFH后抗凝强度不足的患者,本研究对择期PCI患者根据体重调整UFH剂量后抗凝强度不足的发生率及其预测因素进行了分析。
1 对象与方法
1.1研究对象
连续入选2011年5月1日至2012年12月31日在北京协和医院行择期PCI且术中使用UFH抗凝的患者。根据首次静脉注射UFH 5 min时的ACT水平将患者分为抗凝不足组(ACT<300 s)和对照组(ACT≥300 s),比较两组患者的临床和冠状动脉造影资料,分析抗凝强度不足的预测因素和预测界值。排除标准:(1)PCI术前12 h内皮下注射过UFH或6 h内静脉注射过UFH;(2)PCI术前12 h内应用过低分子肝素或24 h内应用过磺达肝癸钠;(3)长期服用华法林抗凝,且国际标准化比值>1.5;(4)PCI术前1个月内有内脏出血;(5)PCI术前6周内行外科手术或有严重器官损伤;(6)有肝素诱导的血小板减少症史或UFH过敏等使用UFH的禁忌证;(7)联合应用血小板糖蛋白Ⅱb/Ⅲa抑制剂;(8)术中使用比伐卢定、低分子肝素抗凝;(9)未记录ACT。
1.2研究方法
记录患者的人口学资料(性别、年龄、身高、体重),冠心病危险因素(高血压病、糖尿病、高脂血症、目前吸烟情况),基线实验室检查结果[白细胞计数、血小板计数、谷丙转氨酶、谷草转氨酶、白蛋白、肌酸酐(肌酐)、低密度脂蛋白胆固醇及部分激活的凝血活酶时间]。患者常规接受阿司匹林和氯吡格雷双联抗血小板治疗。择期PCI相关的技术操作和器械使用由术者根据指南和诊疗常规进行,记录血管入路、病变血管支数、是否置入支架、术中首次静脉注射UFH的剂量和注射5 min时的ACT测量值。
1.3UFH剂量和ACT测定
经桡动脉或股动脉穿刺成功后,参照PCI相关指南[4,7-8],经静脉注射UFH 70~100 U/kg。首次给药5 min后经动脉鞘管取血,使用HEMOCHRON Jr. Signature型多功能医用凝血自动测定仪(International Technique Corp[ITC],Edison,NJ,USA)测量ACT[4]。ACT目标值定义为300~350 s。若首次给予UFH后ACT 250~300 s,追加UFH 1000 U;ACT 200~250 s,追加UFH 2000 U;ACT<200 s,追加UFH 3000 U。若手术时间超过1 h,常规追加UFH 2000 U。追加UFH后未复测ACT。追加的UFH剂量不计入本研究结果。
1.4统计学分析
应用SPSS 20.0统计学软件进行数据分析。计量资料用均数±标准差表示,组间比较采用t检验及ANOVA检验;计数资料用例数(百分率)表示,组间比较采用χ2检验。应用多因素logistic回归分析ACT<300 s的独立预测因素。通过绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积评估上述因素预测UFH抗凝强度不足的界值。以P<0.05为差异有统计学意义。
2 结果
2.1患者的基本情况
共入选1062例患者,男752例(70.8%),女310例(29.2%),平均年龄(63.0±10.6)岁,平均体重(70.5±11.7)kg,UFH首次平均给药剂量(100.7±9.1)U/kg。
2.2ACT的测量值
择期PCI患者首次静脉注射UFH 5 min时,ACT均数为(299.1±82.9)s,中位数为285(240,352)s。其中,ACT<300 s的患者598例(56.3%),ACT为300~350 s的患者183例(17.2%),ACT≥350 s的患者281例(26.5%)(图1)。
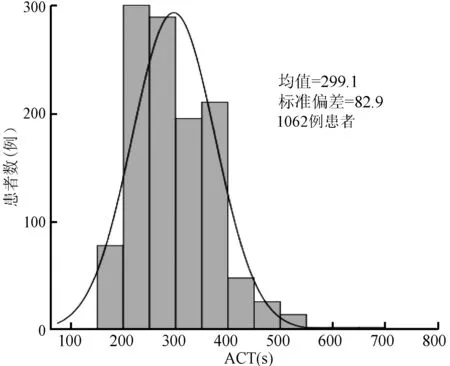
ACT,活化凝血时间;PCI,经皮冠状动脉介入治疗;UFH,普通肝素图1 择期PCI患者首次静脉注射UFH 5 min时ACT的分布情况
2.3两组患者基线资料的比较
根据首次静脉注射UFH 5 min时的ACT值,抗凝不足组(ACT<300 s)共598例,对照组(ACT≥300 s)共464例。与对照组相比,抗凝不足组的ACT[(242.3±33.9)s比(372.3±68.8)s,P<0.0001]、UFH剂量[(100.1±8.9)U/kg比(101.4±9.2)U/kg,P=0.03]和白蛋白水平[(39.7±4.2)g/L比(40.7±3.8)g/L,P=0.001]更低;而血小板计数[(219.6±62.5)×109/L比(208.9±66.7)×109/L,P=0.008]更高,差异均有统计学意义;两组的其他临床资料和冠状动脉造影资料比较,差异均无统计学意义(表1)。
2.4ACT<300 s的独立预测因素
以ACT为因变量,将可能影响ACT的基线因素(性别、年龄、身高、体重、高血压病、糖尿病、高脂血症、目前吸烟情况、白细胞计数、血小板计数、谷丙转氨酶、谷草转氨酶、白蛋白、肌酸酐、低密度脂蛋白胆固醇、部分激活的凝血活酶时间、三支病变比例、UFH剂量)作为自变量,进行多因素logistic回归分析。结果显示,白蛋白水平和血小板计数是ACT<300 s的独立预测因素(表2)。

表1 两组患者基线资料的比较
注:LDL-C,低密度脂蛋白胆固醇;APTT,部分激活的凝血活酶时间;UFH,普通肝素;ACT,活化凝血时间

表2 ACT<300 s的多因素logistic回归分析
注:ACT,活化凝血时间
2.5ACT<300 s的预测界值
以白蛋白水平作为测试变量,ACT<300 s作为状态变量绘制ROC曲线,曲线下面积为(0.56±0.21)(P<0.01,图2),白蛋白水平=42 g/L为最佳界值,此时敏感度为45%,特异度为66%,Youden指数为0.11。以血小板计数作为测试变量,以ACT<300 s作为状态变量绘制ROC曲线,曲线下面积为(0.56±0.18)(P<0.01,图3),血小板计数=215×109/L为最佳界值,此时敏感度为49%,特异度为66%,Youden指数为0.15。
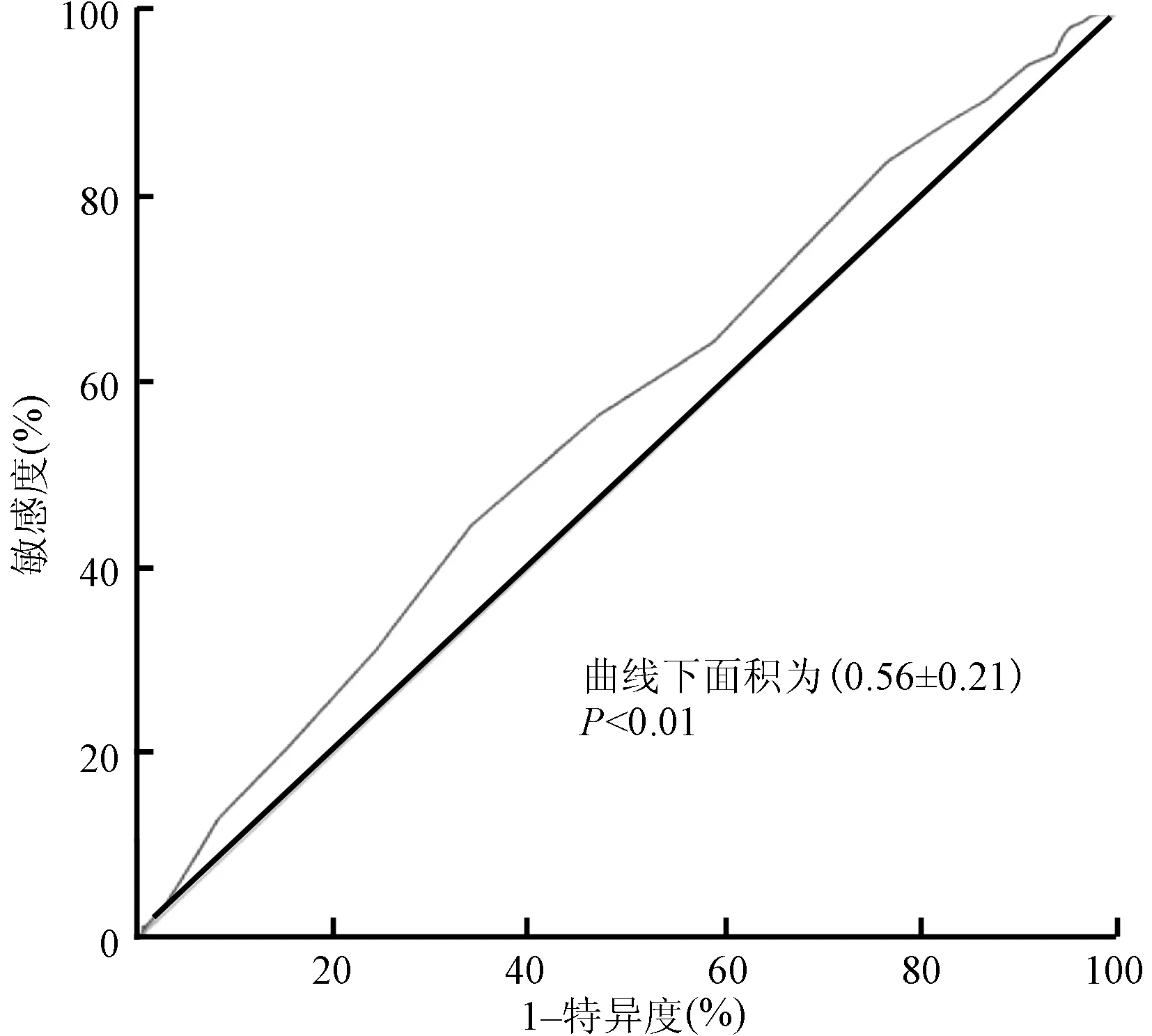
ACT,活化凝血时间;ROC,受试者工作特征图2 白蛋白水平预测ACT <300 s的ROC曲线 白蛋白水平=42 g/L为最佳界值,敏感度为45%,特异度为66%,Youden指数为0.11
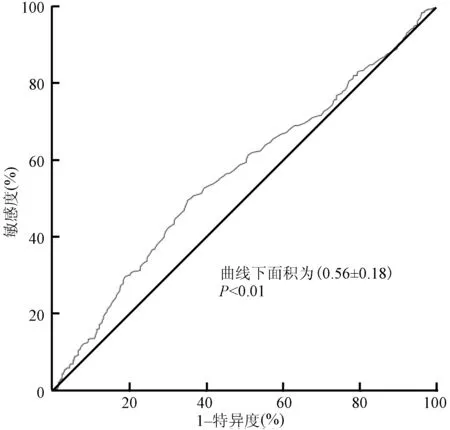
ACT,活化凝血时间;ROC,受试者工作特征图3 血小板计数预测ACT<300 s的ROC曲线 血小板计数=215×109/L为最佳界值,敏感度为49%,特异度为66%,Youden指数为0.15
3 讨论
本研究显示,择期PCI患者即使按照指南推荐根据体重调整UFH剂量,ACT<300 s的患者仍占56.3%,即超过半数患者的ACT未达到抗凝目标的下限。患者的基线白蛋白水平和血小板计数是UFH抗凝强度不足(ACT<300 s)的独立预测因素。
UFH是主要从猪小肠中提取的混合物,其分子量不均一,容易与血浆蛋白和内皮细胞结合[1,9-10]。UFH是凝血因子的间接抑制剂,需要与抗凝血酶结合才能发挥抗凝作用,但仅约三分之一的UFH分子具有与抗凝血酶结合的戊糖序列[11]。UFH可激活血小板,并可被血小板所分泌的血小板因子4(platelet factor 4,PF4)灭活[11]。以上机制使得UFH的抗凝效果难以预测。在本研究中,择期PCI患者使用UFH后,ACT的均数和标准差分别为299.1 s和82.9 s,中位数和四分位间距分别为285 s和240~352 s。在STEEPLE研究[5]中,择期PCI患者采用同样的UFH给药方案,ACT的中位数和四分位间距分别为336 s和302~378 s。虽然本研究与STEEPLE研究的ACT分布情况不完全相同,但两项研究均显示,在择期PCI患者中UFH抗凝效果的变异性很大,不仅需要根据体重调整剂量,而且需要通过监测ACT进一步调整剂量,以保证抗凝强度在目标范围(300~350 s)内。
既往研究显示,UFH抗凝强度不足(ACT<300 s)与PCI围术期血栓事件的发生相关[5-6]。在本研究中,UFH抗凝强度不足的患者比例高达56.3%,及时识别使用UFH后抗凝强度不足的患者并积极监测ACT对于保证PCI的疗效和安全性至关重要。已有研究显示,在因冠状动脉旁路移植行体外循环的患者中,基线白蛋白水平和血小板计数是影响UFH抗凝效果的独立预测因素[12]。本研究则进一步证实,在接受择期PCI的患者中,基线白蛋白水平和血小板计数仍是UFH抗凝强度不足的独立预测因素。根据ROC曲线,基线白蛋白水平<42 g/L或血小板计数>215×109/L的患者与基线白蛋白水平≥42 g/L或血小板计数≤215×109/L的患者相比,即使根据体重调整UFH的剂量,仍然更可能出现抗凝强度不足(ACT<300 s)的情况。
白蛋白对UFH的抗凝效果具有促进作用[12-15]。Jorgensen等[13]对因尿毒症行透析患者的研究显示,为达到相同的抗凝目标,所需要的UFH剂量与患者的白蛋白水平呈负相关。体外研究显示,UFH与白蛋白结合后仍可保持抗凝活性,但与其他血浆蛋白结合后则抗凝活性下降[14]。白蛋白还具有促进抗凝血酶灭活凝血因子的“拟肝素”活性[15]。此外,既往研究显示,白蛋白水平与抗凝血酶水平呈正相关[16-17]。在本研究中,白蛋白<42 g/L是ACT<300 s的独立预测因素,结合以往文献,推测白蛋白水平低的患者UFH抗凝效果欠佳可能与其抗凝血酶水平低有关。但抗凝血酶不是临床常规检测项目,故本研究无抗凝血酶的检测数据,尚无法直接证实以上推测。
血小板可以通过多种途径降低UFH的抗凝效果。血小板以及PF4可直接中和UFH[18-19],使血浆中可与抗凝血酶结合并发挥作用的游离UFH减少。此外,血小板还可保护性地与凝血因子Ⅹa结合,从而避免凝血因子Ⅹa被UFH-抗凝血酶复合物灭活[20]。有文献报道,血小板计数高的患者与血小板计数低的患者相比,使用UFH的抗凝效果更差。血小板计数≥240×109/L的患者与血小板计数<240×109/L的患者相比,更容易出现肝素抵抗现象[12]。
本研究为单中心回顾性研究,不可避免地存在一定的局限性。(1)未测定PCI术前的基线ACT,不能排除基线ACT可能对术中使用UFH后的ACT产生影响。(2)通过ROC曲线所获得的白蛋白界值和血小板计数界值的敏感度和特异度不高,提示根据上述界值预测UFH抗凝强度不足的可靠性仍然不足。
综上所述,择期PCI患者术中使用UFH后出现抗凝强度不足(ACT<300 s)的比例较高,基线白蛋白水平和血小板计数是抗凝强度不足的独立预测因素。即使根据体重设定UFH的剂量,白蛋白水平<42 g/L和血小板计数>215×109/L的患者更易出现抗凝强度不足,应特别注意监测ACT并根据ACT进一步调整UFH的剂量。
[1] 胡大一. 肝素及低分子量肝素在冠心病抗凝中的应用. 临床荟萃, 2004, 19(7):403-404.
[2] Levine MN, Hirsh J, Gent M, et al. A randomized trial comparing activated thromboplastin time with heparin assay in patients with acute venous thromboembolism requiring large daily doses of heparin. Arch Intern Med, 1994, 154(1):49-56.
[3] Cheng S, Morrow DA, Sloan S, et al. Predictors of initial nontherapeutic anticoagulation with unfractionated heparin in ST-segment elevation myocardial infarction. Circulation, 2009, 119(9):1195-1202.
[4] Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. Circulation, 2011, 124(23):e574-651.
[5] Montalescot G, Cohen M, Salette G, et al. Impact of anticoagulation levels on outcomes in patients undergoing elective percutaneous coronary intervention: insights from the STEEPLE trial. Eur Heart J, 2008, 29(4):462-471.
[6] Chew DP, Bhatt DL, Lincoff AM, et al. Defining the optimal activated clotting time during percutaneous coronary intervention: aggregate results from 6 randomized, controlled trials. Circulation, 2001, 103(7):961-966.
[7] 中华医学会心血管病学分会介入心脏病学组. 中国经皮冠状动脉介入治疗指南. 中华心血管病杂志, 2012, 40(4):18-26.
[8] Windecker S, Kolh P, Altonso F, et al. 2014 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J, 2014, 35(37):2541-2619.
[9] Bussey H, Francis JL, Heparin Consensus G. Heparin overview and issues. Pharmacotherapy, 2004, 24(8Pt2):103S-107S.
[10] Hirsh J. Heparin. N Engl J Med, 1991, 324(22):1565-1574.
[11] Hirsh J, Warkentin TE, Raschke R, et al. Heparin and low-molecular-weight heparin: mechanisms of action, pharmacokinetics, dosing considerations, monitoring, efficacy, and safety. Chest, 1998, 114(5 Suppl):489S-510S.
[12] Chan T, Hwang NC, Lim CH. A statistical analysis of factors predisposing patients to heparin resistance. Perfusion, 2006, 21(2):99-103.
[13] Jorgensen KA, Stoffersen E. Antithrombin III in uremia. Scand J Urol Nephrol, 1979, 13(3):299-303.
[14] Teien AN, Odegard R, Christensen TB. Heparin coupled to albumin, dextran and ficoll: influence on blood coagulation and platelets, and in vivo duration. Thromb Res, 1975, 7(2):273-284.
[15] Joorgensen KA, Stoffersen E. Heparin like activity of albumin. Thromb Res, 1979, 16(3-4):569-574.
[16] Jong JB, Pohan HT, Zulkarnain I, et al. The correlation between coagulation test and albumin with antithrombin III in Dengue hemorrhagic fever. Acta Med Indones, 2004, 36(2):57-61.
[17] Ogawa M, Matsuda Y, Kobayashi A, et al. Plasma antithrombin levels correlate with albumin and total protein in gestational hypertension and preeclampsia. Pregnancy Hypertens, 2014, 4(2):174-177.
[18] Lane DA, Denton J, Flynn AM, et al. Anticoagulant activities of heparin oligosaccharides and their neutralization by platelet factor 4. Biochem J, 1984, 218(3):725-732.
[19] Lane DA, Pejler G, Flynn AM, et al. Neutralization of heparin-related saccharides by histidine-rich glycoprotein and platelet factor 4. J Biol Chem, 1986, 261(9):3980-3986.
[20] Horne MK 3rd, Chao ES. Heparin binding to resting and activated platelets. Blood, 1989, 74(1):238-243.
LIUZhen-yu,Email:pumch_lzy@163.com
ObjectiveTo study the predictors of under-coagulation activated clotting time (ACT) <300 s using unfractionated heparin (UFH) in patients undergoing elective percutaneous coronary intervention (PCI). MethodsWe retrospectively and consecutively recruited patients who underwent elective PCI with UFH as intra-procedural anticoagulant in our hospital from May 1, 2011 to December 31, 2012. The baseline clinical and angiographic characteristics were compared between the under-coagulation group (ACT<300 s 5 mins after first dose of UFH) and the control group (ACT≥300 s) and to determine the predictors as well as their cut-off values of under-coagulation. Results(1) A total of 1062 patients were recruited, of whom 752 (70.8%) were male with mean age of (63.0±10.6) years, body weight (70.5±11.7) kg, and mean initial UFH dose (100.7±9.1) U/kg. (2) The average and median value of ACT were (299.1±82.9) s and 285 (240, 352) s, respectively. The number of patients with ACT<300 s was 598 (56.3%), ACT between 300-350 s was 183 (17.2%) and ACT>350 s was 281 (26.5%). (3) As compared with the control group, the value of ACT [(242.3±33.9) svs. (372.3±68.8) s,P<0.0001], UFH dose [(100.1±8.9) U/kgvs. (101.4±9.2) U/kg,P=0.03], and serum albumin [(39.7±4.2) g/Lvs. (40.7±3.8) g/L,P=0.001] were lower, but platelet count [(219.6±62.5)×109/Lvs.(208.9±66.7)×109/L,P=0.008] was higher in the under-coagulation group. (4) Logistic regression analysis demonstrated that serum albumin and platelet count were independent predictors of ACT<300 s. (5) Based on the receiver operating characteristic curve, serum albumin < 42 g/L and platelet count >215×109/L were the best cut-off values of ACT<300 s. ConclusionsUnder-coagulation (ACT<300 s) with UFH was not uncommon in patients undergoing elective PCI. Baseline serum albumin and platelet count were independent predictors of under-coagulation.
Percutaneous coronary intervention;Unfractionated heparin;Activated clotting time;Predictors
10.3969/j.issn.1004-8812.2016.07.002
100730北京,中国医学科学院 北京协和医学院 北京协和医院心内科
刘震宇,Email:pumch_lzy@163.com
R541.4
2016-03-21)
