产前应激孕鼠子代抑郁样行为观察及机制探讨
2016-08-31贾宁孙钦儒苏倩
贾宁,孙钦儒,苏倩
(1 西安交通大学医学部,西安710061;2西安交通大学医学部第一附属医院)
产前应激孕鼠子代抑郁样行为观察及机制探讨
贾宁1,孙钦儒1,苏倩2
(1 西安交通大学医学部,西安710061;2西安交通大学医学部第一附属医院)
目的观察产前应激孕鼠子代鼠的抑郁样行为,并探讨产前应激导致子代鼠出现抑郁样行为的作用机制。方法将孕鼠20只随机分观察组和对照组各10只。妊娠第14天(孕鼠进入孕晚期)起对观察组给予束缚应激,45 min/次,3次/d,共束缚7 d。对照组孕鼠孕期不做任何处理,常规饲养。两组子代鼠出生30 d时各取20只(雌雄对半),进行糖水偏爱试验,计算两组雌、雄性子代鼠1%糖水消耗比(1%糖水消耗比表示抑郁性行为严重程度);随之将试验后子代鼠断头处死,采用液相色谱串联质谱分析法检测两组子代鼠海马组织谷氨酸(Glu)、γ-氨基丁酸(GABA)和5-羟色胺(5-HT)。结果观察组雌、雄性子代鼠1%糖水消耗比分别为63.13±3.47和59.67±3.33,对照组分别为79.22±7.07和78.67±4.72;观察组雌、雄性子代鼠1%糖水消耗比与对照组相比,P均<0.05。观察组雌、雄子代鼠海马组织Glu的相对含量分别为(24.30±1.00)、(31.22±1.57)ng/g,对照组分别为(21.20±0.90)、(24.01±0.28)ng/g,观察组雌、雄性子代鼠海马组织Glu的相对含量与对照组相比,P均<0.05;观察组雌、雄子代鼠海马组织GABA的相对含量分别为(7.42±0.36)、(8.35±0.39)ng/g,对照组分别为(13.28±0.38)、(9.94±0.30)ng/g,观察组雌、雄性子代鼠海马组织GABA的相对含量与对照组相比,P均<0.05;观察组雌、雄子代鼠海马组织5-HT的相对含量分别为(0.27±0.02)、(0.26±0.01)ng/g,对照组分别为(0.35±0.03)、(0.29±0.02)ng/g,观察组雌性子代大鼠海马组织5-HT的相对含量与对照组相比,P<0.05。结论产前应激可导致子代鼠出现抑郁样行为,其机制可能与产前应激升高子代鼠海马组织Glu含量及降低GABA、5-HT的水平有关。
产前应激;抑郁样行为;海马;谷氨酸;γ-氨基丁酸;5-羟色胺;动物实验
产前应激(PS)是孕期母体受到各种内外界环境因素、社会和心理因素刺激时,所表现出的全身性非特异性适应反应,可导致子代出现抑郁、焦虑等情感性精神障碍(MD)[1,2]。抑郁症致残占所有疾病致残的40.5%[3]。5-羟色胺(5-HT)等单胺系统功能不足被认为是抑郁症的发病原因,但近期研究发现谷氨酸(Glu)、γ-氨基丁酸(GABA)等非单胺类递质及其受体在MD的发生、发展中起重要作用[4,5]。2014年1月~2016年2月,我们观察了PS孕鼠子代鼠的抑郁样行为,并探讨PS导致子代鼠抑郁样行为的机制。现将结果报告如下。
1 材料与方法
1.1实验动物、试剂及仪器妊娠SD大鼠20只[晚上9:00将20只成年雌性大鼠(体质量260~280 g)与7只成年雄性大鼠(体质量280~350 g)按3∶1合笼,次日早上8:00进行阴道涂片检查,精子阳性定为妊娠第0天],单笼喂养,饲养于22 ℃、60%湿度、12 h光/暗循环的动物房中,自由饮水、饮食。大鼠均由西安交通大学医学院实验动物中心提供。标准品Glu、GABA和5-HT均购自美国Sigma 公司;甲醇、乙腈为色谱级,水为超纯水,其余试剂均为分析纯。取Glu、GABA和5-HT标准品各5 mg,分别用含0.2%甲酸的甲醇-水(v/v=1∶1,以下同)溶液充分溶解配制成1 g/L的标准品储备液。取100 μL的Glu、GABA和5-HT标准品储备液,加入0.2%甲酸至1 mL。混匀后制成1×105μg/L的混合标准品溶液,在对此混合标准品溶液进行稀释,制备成500、100、50、10、5、1、0.5、0.1 μg/L的混合标准品溶液,冰上放置备用。超高效液相色谱仪Nexera LC-20ADXR、SIL-20AXR自动进样器,CTO-20AC恒温柱箱、CBM-20A 通信总线模块、LCMS-8040型三重串联四极杆液相色谱质谱联用仪均购自日本岛津公司。
1.2孕鼠分组及其产前应激方法、子代鼠饲养方法将妊娠孕鼠20只随机分为观察组和对照组各10只。妊娠第14天(孕鼠进入孕晚期)起对观察组给予束缚应激[4]:将孕鼠束缚置于透明的塑料质地圆柱形装置(内径6.0 cm)中,装置两端留有通风口。为防止大鼠出现应激模式习惯化,每天随机给予束缚应激,间隔不少于2 h,45 min/次,3次/d,共束缚6 d。对照组孕期不做任何处理,常规饲养。待两组子代鼠出生21 d断奶,雌雄分笼喂养。
1.3子代鼠抑郁样行为观察采用糖水偏爱试验(SPT)。出生29 d时各取20只子代鼠(雌雄对半)进行糖水适应训练:每笼同时放置两瓶1%蔗糖的自来水溶液24 h。出生30 d时取两组子代鼠,禁食、禁水3 h后,同时予一瓶蔗糖水和一瓶自来水。为防止大鼠对饮水瓶位置产生习惯性,0.5 h将蔗糖溶液和自来水交换位置放置。1 h后取走两瓶液体进行称重,观察两组蔗糖水、自来水的消耗量,计算两组雌、雄性子代鼠1%糖水消耗比(糖水消耗/糖水消耗 + 自来水的消耗)。糖水消耗比表示大鼠抑郁样行为的程度,糖水消耗比越低表示大鼠抑郁样行为(快感缺失)程度越高[6]。
1.4子代鼠海马组织中Glu、GABA和5-HT检测①子代大鼠海马组织取材:将做完SPT的子代鼠断头取脑,冰上快速分离海马,称重后加入预冷的10倍体积的0.2%甲酸-水溶液,匀浆,取0.2 mL脑匀浆液,加入冰冷的0.2%甲酸乙腈溶液0.4 mL,混匀后于4 ℃放置30 min,4 ℃下12 000 r/min离心3 min,取上清液冰上放置备用。②Glu、GABA和5-HT标准曲线绘制:LC-MS /MS条件见文献[7],各种递质检测条件的参数见表1。取100 μg/L混合标准品溶液50 μL,检测后见各色谱峰无杂质干扰,峰型良好。取各浓度的混合标准品溶液进行LC-MS /MS分析,以Glu、GABA和5-HT的质量浓度为横坐标,被测物与内标峰面积比为纵坐标,进行线性回归,得到线性回归方程,并绘制标准曲线。标准曲线的回归方程包含最低检测限(见表2)。③子代大鼠海马组织Glu、GABA和5-HT的检测:取两组子代大鼠海马组织匀浆50 μL 进行LC-MS /MS分析,参照②中Glu、GABA和5-HT的标准曲线回归方程和所取两组海马组织的质量(g)计算海马组织Glu、GABA和5-HT的相对含量。

表1 Glu、GABA、5-HT检测离子对及质谱离子化条件
注:Q1和Q3是质量分析器,其质荷比反映串联质谱的扫描模式;m/z即质荷比,是离子质量(以相对原子量单位计)与它所带电荷(以电子电量为单位计)的比值。
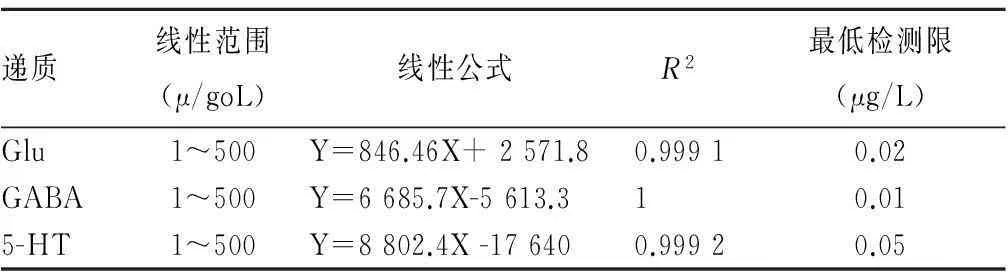
表2 Glu、GABA、5-HT的线性公式及最低检测限
2 结果
2.1两组雌、雄子代大鼠抑郁样行为比较观察组雌、雄性子代大鼠1%糖水消耗比分别为63.13±3.47和59.67±3.33,对照组分别为79.22±7.07和78.67±4.72。观察组雌、雄性子代大鼠1%糖水消耗比与对照组相比,P均<0.05。
2.2两组子代大鼠海马组织Glu、GABA和5-HT含量的比较观察组雌、雄子代大鼠海马组织Glu的相对含量分别为(24.30±1.00)、(31.22±1.57)ng/g,对照组分别为(21.20±0.90)、(24.01±0.28)ng/g,观察组雌、雄性子代大鼠海马组织Glu的相对含量与对照组相比,P均<0.05。观察组雌、雄子代大鼠海马组织GABA的相对含量分别为(7.42±0.36)、(8.35±0.39)ng/g,,对照组分别为(13.28±0.38)、(9.94±0.30)ng/g,观察组雌、雄性子代大鼠海马组织GABA的相对含量与对照组相比,P均<0.05。观察组雌、雄子代大鼠海马组织5-HT的相对含量分别为(0.27±0.02)、(0.26±0.01)ng/g,对照组分别为(0.35±0.03)、(0.29±0.02)ng/g,观察组雌性子代大鼠海马组织5-HT的相对含量与对照组相比,P<0.05。
3 讨论
近年来,产前应激对子代情感、认知和行为影响的研究受到越来越多的关注,但由于应激的方式、强度、时间及检测方法的不同,结果也不完全一致。Richardson等[8]的流行病学调查发现,雌性胎儿受到产前应激的影响更加敏感;而动物实验的研究[9]发现,产前应激的雌性子代在成年更易感焦虑、抑郁等精神障碍,而雄性子代更易出现认知障碍。本研究通过糖水偏爱试验,检测大鼠的糖水消耗比,观察大鼠抑郁样行为。结果显示晚期产前应激组雌、雄子代大鼠的糖水消耗比均显著降低,且雌、雄之间无显著性差异,提示晚期产前应激可以导致1月龄子代大鼠产生抑郁样行为,与我们实验室以往的旷场实验和强迫游泳的结果一致[6]。
突触是神经细胞之间信息传递的重要结构,突触前膜产生的神经递质通过特异性的作用于突触后膜的相应受体将信息在神经元之间单向传递。脑内神经递质的含量和功能正常对于突触信息传递功能非常重要。海马是大脑边缘系统的一部分,富含5-HT、Glu及GABA受体,它不仅参与记忆的形成和巩固,而且在情感精神行为调控中具有重要作用[10]。以往的研究认为,5-HT及其受体的减少或活性下降是抑郁等情感性障碍发生的内在机制[11]。而近年来的研究还发现,通过上调谷氨酸转运体1(GLT-1)在海马的表达,减少突触间隙的谷氨酸含量,可以减轻应激大鼠的抑郁样行为[12];抗抑郁药AP5和Ro-25-6981的作用可能是通过增加海马GABA受体A的表达实现的[13]。为进一步探索产前应激引起子代抑郁症发生的机制,我们运用LC-MS/MS分析方法检测大鼠海马组织中多种递质的含量。结果显示,晚期产前应激可以引起1月龄子代大鼠海马的Glu含量显著增加,GABA的含量显著降低,与我们实验室此前使用高效液相色谱法对衍生化的样品的检测结果一致[14],但是本研究中运用的LC-MS/MS法不需要柱前衍生化,操作简便、快速、准确。Glu是脑内的兴奋性神经递质,当细胞间的Glu异常增多时会引起神经细胞的兴奋性毒性损害,表现为突触后神经元的树突减少,细胞内的Ca2+超载和反应性氧化产物的增加,甚至发生细胞不可逆死亡。我们以往的研究发现谷氨酸的离子型受体拮抗剂MK-801能够改善子代大鼠的抑郁样行为可能与减少海马神经细胞内的Ca2+和反应性氧化产物的水平有关[6,15]。这些结果说明海马Glu的含量异常增多参与产前应激子代大鼠抑郁样行为的发生。突触间隙的谷氨酸含量增加可能与谷氨酸的代谢异常相关,在神经细胞和胶质细胞之间存在Glu和谷氨酰胺(Gln)的代谢循环,此循环的异常可能会改变突触间隙的Glu含量。我们实验室以往的研究也发现产前应激可以导致子代大鼠海马组织的兴奋性氨基酸转运体(EAAT)2和3的表达显著减少[11]。这些结果说明,产前应激可以引起子代大鼠海马组织谷氨酸转运体减少,Glu代谢障碍,突触间隙的Glu含量增加,海马神经细胞损害,最终导致大鼠抑郁样行为的发生。
近年来,抑制性神经递质GABA在情感性精神障碍中的作用得到越来越多的关注。研究[5]表明,GABA能传递损害可能参与人类抑郁症的发生。本研究结果发现,晚期产前应激子代大鼠海马组织的GABA含量显著减少,结合行为学结果,我们认为GABA的减少可以导致海马组织内GABA能系统的活性减弱,不但可能直接参与了大鼠抑郁样行为的发生,而且还可以继发性的升高兴奋性递质Glu的水平,进一步恶化大鼠的抑郁样行为。Yan等[16]最近研究也表明五味子提取物的抗抑郁作用与上调GABA能系统的活性和下调谷氨酸能系统的活性有关。这些结果均说明,中枢兴奋性递质和抑制性递质的失衡可能是促使抑郁症发生的原因,在未来的研究中,可以通过下调谷氨酸能系统的活性,上调GABA能系统的活性改善抑郁症。
5-HT能系统的活性降低一直是被认为是抑郁症的发病基础。本研究结果显示,晚期产前应激组的雌性子代大鼠海马组织的5-HT显著减少,而雄性子代的5-HT虽较对照组减少,但是无显著性差异。此结果说明晚期产前应激导致的1月龄子代大鼠的海马5-HT含量的变化具有性别差异,似乎与行为学的表现不完全一致。这个结果也侧面反映了不是所有抑郁症患者都是因为单胺能活动的缺陷,正如我们研究中发现的,产前应激雄性大鼠产生抑郁样行为,但其海马5-HT水平却未发生显著改变。Rayen等[17]近期研究也发现,5-HT再摄取抑制剂-氟西汀,可以促进产前应激雌性子代大鼠海马细胞的增生,改善产前应激导致的雌性子代大鼠的抑郁行为。这些结果说明产前应激对子代大鼠海马5-HT水平的影响存在性别差异,但是造成性别差异的原因还有待于进一步的研究。
综上所述,孕鼠晚期产前应激可导致子代大鼠出现抑郁样行为,且未见性别差异;其机制可能为晚期产前应激增加海马组织Glu,降低GABA、5-HT含量。
[1] Keeley K.Prenatal influence on behavior of offspring of crowded mice[J].Science,1962,135(3497):44-45.
[2] Walker SP,Wachs TD,Grantham-McGregor S,et al.Inequality in early childhood: risk and protective factors for early child development[J].Lancet,2011,378(9799):1325-1338.
[3] Whiteford HA,Degenhardt L,Rehm J,et al.Global burden of disease attributable to mental and substance use disorders: findings from the Global Burden of Disease Study 2010[J].Lancet,2013,382(9904):1575-1586.
[4] Li X,Need AB,Baez M,et al.Metabotropic glutamate 5 receptor antagonism is associated with antidepressant-like effects in mice[J].J Pharmacol Exp Ther,2006,319(1):254-259.
[5] Fatemi SH,Stary JM,Earle JA,et al.GABAergic dysfunction in schizophrenia and mood disorders as reflected by decreased levels of glutamic acid decarboxylase 65 and 67 kDa and Reelin proteins in cerebellum[J].Schizophr Res,2005,72(2-3):109-122.
[6] Guan L,Jia N,Zhao X,et al.The involvement of ERK/CREB/Bcl-2 in depression-like behavior in prenatally stressed offspring rats[J].Brain Res Bull,2013,99:1-8.
[7] 张蕾,孔令提,孙兰,等.LC-MS/MS同时测定小鼠脑组织中7种神经递质含量[J].中国实验方剂学杂志,2013,(20):132-136.
[8] Richardson HN,Zorrilla EP,Mandyam CD,et al.Exposure to repetitive versus varied stress during prenatal development generates two distinct anxiogenic and neuroendocrine profiles in adulthood[J].Endocrinology,2006,147(5):2506-2517.
[9] Glover V,Hill J.Sex differences in the programming effects of prenatal stress on psychopathology and stress responses: an evolutionary perspective[J].Physiol Behav,2012,106(5):736-740.
[10] Galea LA,Wainwright SR,Roes MM,et al.Sex,hormones and neurogenesis in the hippocampus: hormonal modulation of neurogenesis and potential functional implications[J].J Neuroendocrinol,2013,25(11):1039-1061.
[11] Gemmel M,Rayen I,Lotus T,et al.Developmental fluoxetine and prenatal stress effects on serotonin,dopamine,and synaptophysin density in the PFC and hippocampus of offspring at weaning[J].Dev Psychobiol,2016,58(3):315-327.
[12] Liu WX,Wang J,Xie ZM,et al.Regulation of glutamate transporter 1 via BDNF-TrkB signaling plays a role in the anti-apoptotic and antidepressant effects of ketamine in chronic unpredictable stress model of depression[J].Psychopharmacology(Berl),2016,233(3):405-415.
[13] Workman ER,Haddick PC,Bush K,et al.Rapid antidepressants stimulate the decoupling of GABA(B)receptors from GIRK/Kir3 channels through increased protein stability of 14-3-3η[J].Mol Psychiatry,2015,20(3):298-310.
[14] 杨琨,贾宁,宋茜,等.产前应激对子代大鼠海马神经递质含量的影响[J].第四军医大学学报,2009,(17):1567.
[15] Sun H,Guan L,Zhu Z,et al.Reduced levels of NR1 and NR2A with depression-like behavior in different brain regions in prenatally stressed juvenile offspring[J].PLoS One,2013,8(11):e81775.
[16] Yan T,Xu M,Wu B,et al.The effect of Schisandra chinensis extracts on depression by noradrenergic,dopaminergic,GABAergic and glutamatergic systems in the forced swim test in mice[J].Food Funct,2016,7(6):2811-2819.
[17] Rayen I,Gemmel M,Pauley G,et al.Developmental exposure to SSRIs,in addition to maternal stress,has long-term sex-dependent effects on hippocampal plasticity[J].Psychopharmacology(Berl),2015,232(7):1231-1244.
Observation of prenatal stress-induced depression-like behavior in offspring rats and its mechanism
JIA Ning1,SUN Qinru,SU Qian
(1 Xi'an Jiaotong University Health Science Center,Xi'an 710061,China)
ObjectiveTo observe the depression-like behavior of the offspring rats from pregnant rats with prenatal stress(PS)and to investigate its mechanism.MethodsTwenty pregnant rats were randomly divided into the PS group and control(CON)group,10 in each.From the 14th d of pregnancy(in late pregnancy),rats in the observation group were given restraint stress,45 min/time,3 times/d,a total of 7 d.Rats in the control group were conventionally fed without any treatment.We took 20 offspring rats(male and female in half)which were born 30 d from each group to undergo sucrose preference test(SPT),and calculated the percentage of 1% sugar water consumption in male and female offspring rats of the two groups.Meanwhile,the concentrations of glutamate(Glu),γ-aminobutyric acid(GABA)and serotonin(5-HT)in hippocampus of the rats were measured by Liquid Chromatography-Tandem Mass Spectrometry(LC-MS/MS).ResultsThe percentages of 1% sugar water consumption in male and female offspring rats of the PS groups was 63.13±3.47 and 59.67±3.33,respectively,and 79.22±7.07 and 78.67±4.72 in the control group(P<0.05).Furthermore,the concentration of Glu was(24.30±1.00)ng/g in the female PS group which was more than that 〔(21.20±0.90)ng/g〕 in the female CON group(P<0.05).Similarly,the concentration of Glu in male PS group was(31.22±1.57)ng/g,which was more than that 〔(24.01±0.28)ng/g〕 in the male CON group(P<0.05).Contrarily,the concentration of GABA in female PS group was(7.42±0.36)ng/g,which was significantly lower than that 〔(13.28±0.38)ng/g 〕 in the female CON group(P<0.05).The concentration of GABA in male PS group was(8.35±0.39)ng/g,which was significantly lower than that 〔(9.94±0.30)ng/g〕 in the female CON group(P<0.05).Only the female PS offspring showed lower 5-HT concentration 〔(0.27±0.02)ng/g〕 as compared with that of the CON group 〔(0.35±0.03)ng/g〕(P<0.05).ConclusionPrenatal stress can result in the depression-like behavior of offspring rats,and its mechanism may be related to that prenatal stress increases the Glu content of hippocampal tissue and decreases the levels of GABA,5-HT of offspring rats.
prenatal stress;depression-like behavior;hippocampus;glutamic acid;γ-aminobutyric acid;5-hydroxytryptamine;animal experiment
国家自然科学基金青年基金项目(31200843);中央高校基本科研业务费专项资金项目(xjj2015077)。
贾宁(1974-),女,博士,讲师,硕士研究生导师,主要研究方向为产前应激与子代行为、认知科学。E-mail: jianing@mail.xjtu.edu.cn
10.3969/j.issn.1002-266X.2016.27.005
R749
A
1002-266X(2016)27-0016-04
2016-02-23)
