噻吗洛尔对人多发性骨髓瘤细胞株RPMI 8226增殖、凋亡的影响及其机制
2016-08-31李婷郭鹏翔雷霆雯王季石
李婷,郭鹏翔,雷霆雯,王季石
(1 贵州医科大学,贵阳550004;2.贵州省人民医院;3 贵州医科大学生物化学与分子生物学教研室;4 贵州医科大学附属医院)
噻吗洛尔对人多发性骨髓瘤细胞株RPMI 8226增殖、凋亡的影响及其机制
李婷1,郭鹏翔2,雷霆雯3,王季石4
(1 贵州医科大学,贵阳550004;2.贵州省人民医院;3 贵州医科大学生物化学与分子生物学教研室;4 贵州医科大学附属医院)
目的观察非选择性β-肾上腺素能受体阻断剂噻吗洛尔对人多发性骨髓瘤细胞株RPMI 8226增殖及凋亡的影响,并探讨其可能机制。方法取对数生长期RPMI 8226细胞分为实验1、2、3、4、5、6组,分别加入终浓度为1、2.5、5、20、50、100 μmol/L的噻吗洛尔培养,以不添加细胞和药物的培养液为空白对照组,以不添加药物的细胞液为阴性对照组,观察培养24、48、72 h时各组细胞增殖情况。另取适量RPMI 8226细胞,分为A、B、C组,分别加入终浓度为 2.5、20、50 μmol/L噻吗洛尔培养,设只加细胞培养液的对照组。取培养72 h时各组细胞,观察细胞凋亡情况,检测细胞Bax、B细胞淋巴瘤因子2(Bcl-2)、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、Caspase-9 mRNA和蛋白表达。结果随浓度升高,细胞增殖抑制率升高,且随干预时间增加,细胞增殖抑制率升高,P均<0.05。培养72 h时A、B、C组及对照组细胞凋亡率分别为7.17%±0.06%、10.56%±0.65% 、15.27%±0.86%、3.93%±0.25%,组间两两比较,P均<0.05。A、B、C组 Bax mRNA及蛋白的相对表达量均高于对照组(P均<0.05)。B、C组Bcl-2 mRNA及蛋白的相对表达量均高于对照组(P均<0.05);C组Bcl-2 mRNA相对表达量高于A组(P<0.05)。B、C组Caspase-3 mRNA相对表达量高于A组(P均<0.05)。A、B、C组 Caspase-9 mRNA相对表达量均高于对照组(P均<0.05)。结论噻吗洛尔可抑制RPMI 8226 细胞增殖、促进细胞凋亡,其机制可能与噻吗洛尔可上调Bax、Caspase-3、Caspase-9表达,抑制Bcl-2表达有关。
噻吗洛尔;多发性骨髓瘤;细胞增殖;细胞凋亡;B细胞淋巴瘤因子2;Bax;半胱氨酸天冬氨酸蛋白酶3;半胱氨酸天冬氨酸蛋白酶9
多发性骨髓瘤(MM)是一种浆细胞恶性克隆性疾病,病理特征为异常增生的浆细胞分泌大量单克隆免疫球蛋白及其片段,临床可表现为广泛骨质破坏,伴有反复感染、贫血、高钙血症、高黏滞综合征、肾功能不全等[1]。研究发现,细胞增殖和凋亡的失衡是其发生、发展的重要因素,B细胞淋巴瘤因子2(Bcl-2)、Bax是细胞凋亡的重要信号分子,可激活半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、Caspase-9,促进细胞凋亡。放、化疗及造血干细胞移植是临床常用的治疗方法,可改善MM预后[3],但具有价格昂贵等缺点。以往临床常用β受体阻滞剂治疗心血管疾病[4],近年研究发现其可抑制肿瘤细胞增殖、促进细胞凋亡、抑制肿瘤新生血管形成、抑制肿瘤的浸润和转移[5,6]。噻吗洛尔同为非选择性β受体阻滞剂,具有生物利用度高等优点。2014年9月~2016年2月,我们观察了噻吗洛尔对人MM细胞株RPMI 8226增殖及凋亡的影响,并探讨其可能机制。现将结果报告如下。
1 材料与方法
1.1细胞、药物、仪器及试剂RPMI 8226细胞由重庆医科大学附属医院血液科所惠赠,用含10%灭活胎牛血清(FBS)的RPMI1640培养液中培养,37 ℃、5% CO2培养箱中隔天换液,24~48 h传代1次。噻吗洛尔购自德国Dr Ehrenstorfer公司,RPMI 1640培养液购自美国Gibco公司,FBS购于杭州四季青公司,四甲基偶氮唑蓝(MTT)、二甲亚砜(DMSO)购自美国Sigma公司,FITC Annexin V Apoptosis Detection Kite I购自美国BD Biosciences公司,HiFiScript cDNA 第一链合成试剂盒、UltraSYBR Mixture(With ROX)购自北京康为世纪生物科技有限公司。PCR引物由上海生工生物科技有限公司设计合成。兔抗人Bcl-2多克隆抗体、兔抗人Bax 多克隆抗体、兔抗人Caspase-3多克隆抗体、兔抗人Caspase-9多克隆抗体均购自美国Proteintech公司。
1.2噻吗洛尔对RPMI 8226细胞增殖的影响观察采用MTT法。取适量对数生长期RPMI 8226细胞,1×105/孔接种于96孔板,将细胞分为实验1、2、3、4、5、6组,分别加入噻吗洛尔使药物终浓度为1、2.5、5、20、50、100 μmol/L,以不添加细胞和药物的培养液为空白对照,以只添加细胞不添加药物为阴性对照。分别于干预24、48、72 h各取200 μL 细胞培养液接种于适量各组细胞,每组5个复孔,每孔加入5 mg/mL MTT 20 μL,孵育4 h,离心后取上清,加入150 μL DMSO,振荡 10 min,使结晶物充分溶解,采用酶标仪检测各组在490 nm 波长处的吸光度(A),重复3次,取平均值计算各组细胞增殖抑制率。细胞增殖抑制率=(A对照组-A给药组)/A对照组×100%。
1.3噻吗洛尔对RPMI 8226细胞凋亡的影响及细胞Bax、Bcl-2、Caspase-3及Caspase-9 mRNA和蛋白检测①噻吗洛尔对RPMI 8226细胞凋亡的影响观察:采用流式细胞仪。取对数生长期RPMI 8226细胞,1×106/mL接种于96孔培养板中,分为A、B、C组,分别加入终浓度为 2.5、20 、50 μmol/L的噻吗洛尔,每组5个复孔,同时设只加培养液的5个复孔为对照组,于37 ℃、5% CO2培养箱中培养72 h,取适量各组细胞,1 000 r/min离心8 min,弃上清,3 mL PBS冲洗两次。加入AnnexinV Binding Buffer和PI各5 μL,混匀后室温避光孵育15 min。加入400 μL AnnexinV Binding buffer后混匀,采用流式细胞仪检测各组干预72 h细胞的凋亡情况,计算细胞凋亡率。②各组RPMI 8226细胞Bax、Bcl-2、Caspase-3及Caspase-9 mRNA和蛋白检测:采用RT-PCR法。检测各组干预72 h时细胞Caspase-3、Caspase-9、Bax和Bcl-2 mRNA:采用TRIzol试剂盒提取总RNA,HiFiScript cDNA 第一链合成试剂盒逆转录合成cDNA,所有操作均严格按照使用说明书进行。UltraSYBR Mixture试剂盒进行荧光定量PCR检测,其中GAPDH作为内参。Bcl-2上游引物5′-TGTGTGTGGAGAGCGTCAAC-3′,下游引物5′-GATCCAGGTGTGCAGGTG-3′);Bax上游引物5′-TCTGACGGCAACTTCAACTG-3′,下游引物5′-GTCCCAAAGTAGGAGAGGAGG-3′;Caspase-3上游引物5′-CAAATGGACCTGTTGACCTG-3′,下游引物5′-ATGGCACAAAGCGACTGGATG-3′;Caspase-9上游引物5′-TGGATGCCCTGTGTCGGTC-3′,下游引物5′-CTGAAGACGAGTCCCCTGGC-3′;GAPDH上游引物5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物5′-AGGGGCCATCCACAGTCTTC-3′。PCR反应条件:预变性95 ℃、10 min,变性95 ℃、15 s,退火60 ℃、1 min,延伸60 ℃、1 min。以GAPDH作为内参校正,采用2-ΔΔCt法来分析基因的相对表达量。采用Western blotting法检测1.4方法中各组干预72 h细胞Caspase-3、Caspase-9、Bax和Bcl-2蛋白表达:取适量对数生长期各组细胞,按照蛋白抽提试剂盒说明提取细胞总蛋白,BCA法测定蛋白浓度,取50 μg变性后蛋白样品进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,转膜至PVDF膜上;5%牛血清蛋白TBS溶液室温封闭1 h,加入一抗4 ℃孵育过夜,TBST洗膜,加二抗室温孵育1 h。TBST 洗涤,显影、曝光。实验均重复3次,取平均值
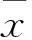
2 结果
2.1各组不同时间点细胞增殖抑制率比较不同时间点各组细胞增殖抑制率见表1,与对照组相比,各实验组的细胞增殖抑制率均降低(P均<0.05),且呈浓度、时间依赖性(P均<0.05)。
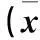
表1 不同时间点各组细胞增殖抑制率±s)
2.2各组RPMI 8226细胞凋亡率比较干预72 h时A、B、C组及对照组细胞凋亡率分别为7.17%±0.06%、10.56%±0.65% 、15.27%±0.86%、3.93%±0.25%,组间两两比较,P均<0.05。
2.3各组Caspase-3、Caspase-9、Bax、Bcl-2 mRNA及蛋白表达比较各组Caspase-3、Caspase-9、Bax、Bcl-2 mRNA及蛋白比较见表2。

表2 干预72 h各组Caspase-3、Caspase-9、Bax、Bcl-2 mRNA及蛋白表达比较
注:与对照组比较,*P<0.05;与B组比较,△P<0.05;与A组比较,◇P<0.05。
3 讨论
目前,MM发病率占恶性血液疾病中的13.4%,病死率占血液系统恶性肿瘤病死率的19%[5]。研究发现,MM是一种克隆性B细胞疾病,其特征为骨髓浆细胞异常增生伴有单克隆免疫球蛋白过度生成,常伴有多种并发症,且极易出现细菌性感染[6]。MM发病机制目前仍不明确,与遗传因素、细胞因子异常以及骨髓微环境等密切相关,目前的主要治疗方法是化疗及造血干细胞移植,普通化疗以及蛋白酶抑制剂和免疫调节剂等新药的应用生存率有所提高[7],但该病仍无法治愈,化疗耐药及副作用是难以逾越的难题。而造血干细胞移植其昂贵的价格也限制了其在中国患者中的应用。多发性骨髓瘤及其治疗常影响肾脏、免疫、骨骼、血液和神经系统功能等。由此造成的器官功能障碍往往影响患者的生活质量,并限制随后的治疗,甚至可能导致死亡,因此寻求有效药物提高疗效十分必要。
噻吗洛尔又叫噻吗心安,是一种非选择性β-肾上腺素能拮抗剂,临床常用于其治疗高血压病、心绞痛、心动过速及青光眼,是治疗青光眼的一线药物。其主要作用机制是通过抑制肾上腺素能受体从而减慢心率、减弱心肌收缩力、降低血压、减少心肌耗氧量,改善左室和血管的重构以及减少房水生成。最新研究发现,噻吗洛尔可用于治疗婴幼儿血管瘤[8],其作用机制可能是:早期通过减少一氧化氮释放使血管收缩;中期通过抑制促血管生成的信号如血管内皮生长因子、碱性成纤维细胞生长因子、基质金属蛋白酶9,并导致生长停滞;后期通过诱导血管内皮细胞凋亡从而造成肿瘤消退[9]。
本研究结果发现,噻吗洛尔能明显抑制RPMI 8226细胞的增殖,并呈时间剂量依赖性,其对RPMI 8226增殖的IC50值约为20 μmol/L。在相同药物时间作用下,细胞凋亡率随药物浓度升高而逐渐增加。细胞凋亡是由基因控制的细胞程序性死亡,与维持细胞自身的稳定及肿瘤的发生有密切关联。研究显示,凋亡抑制基因过表达及促凋亡基因活性减低与骨髓瘤的发病、治疗耐药及预后密切相关[10],因此,干预细胞凋亡途径,诱发肿瘤细胞凋亡已成为骨髓瘤治疗的重要手段。目前凋亡发生的途径有:线粒体途径、死亡受体途径和内质网途径。线粒体途径,也叫内源性途径,在细胞凋亡中起中心作用。Bcl-2家族是细胞凋亡通路中最为重要的一组信号分子,此家族分子包括抗细胞凋亡(如 Bcl-2、Bcl-xl、Mcl-1)和促细胞凋亡(如Bax、Bad、Bak)蛋白两大类[11],其中Bax/Bcl-2在细胞凋亡过程中相互作用,调控细胞色素C等物质从线粒体的释放,最终调控线粒体凋亡途径。Bax 可通过在细胞内质膜结构上打孔、改变构象或者发生寡聚化,破坏线粒体膜,引起细胞色素C释放,从而促进细胞凋亡[12]。而Bcl-2则相反,其主要分布于细胞膜及细胞质中,控制着线粒体膜的通透性,抑制细胞色素C的释放及Caspase的激活进而抑制凋亡。另外,Bcl-2还可通过与 Bax 形成复合物阻断其功能从而抑制细胞凋亡[13]。在本研究显示,与对照组相比抗凋亡蛋白Bcl-2在mRNA和蛋白水平表达均下调,而促凋亡蛋白Bax 表达增加,使得Bax/Bcl-2比值升高,从而促进肿瘤细胞的凋亡,提示噻吗洛尔诱导人多发性骨髓瘤细胞RPMI 8226凋亡可能是通过Bcl-2家族的变化而实现的。
Caspase细胞凋亡家族也与Bax/Bcl-2密切相关,Bax表达增多或Bcl-2表达减少均可诱导Caspase家族蛋白激活,继而发挥促凋亡作用[14]。目前研究发现Caspase家族成员共14个,其中Caspase-3被认为是该家族中最关键的蛋白酶[15],有“死亡执行蛋白酶”的称号。正常情况Caspase-3以无活性酶原形式存在于胞浆中,被活化后可酶解切割DNA依赖的蛋白激酶等,从而干扰DNA复制及损伤修复等。Caspase-9是凋亡启动蛋白,位于级联反应的上游,常参与启动下游的蛋白酶,引起凋亡[16]。在本次噻吗洛尔对RPMI 8226细胞的凋亡诱导过程中Caspase-3及Caspase-9的mRNA表达均上调,而在蛋白水平未见明显变化,出现以上差异的原因可能与转录、转录后调控、翻译等众多因素有关。由此我们推测噻吗洛尔可能是通过抑制Bcl-2和激活Bax信号通路途径促进骨髓瘤细胞凋亡来实现抗肿瘤的,但是否还通过其它凋亡相关蛋白促进其凋亡仍需进一步研究。
综上所述,噻吗洛尔可抑制RPMI 8226 细胞增殖、促进细胞凋亡,其机制可能与上调Bax、Caspase-3、Caspase-9表达,抑制Bcl-2的表达有关。
[1] Gentile M,Recchia AG,Mazzone C,et al.Perspectives in the treatment of multiple myeloma[J].Expert Opin Biol Th,2013,13(1):1-22.
[2] Wildes TM,Vij R,Petersdorf SH,et al.New Treatment Approaches for Older Adults with Multiple Myeloma[J].J Geriatr Oncol,2012,3(3):279-290.
[3] Shi M,Liu D,Yang Z,et al.Central and peripheral nervous systems:master controllers in cancer metastasis[J].Cancer Metastasis Rev,2013,32(3/4):603-621.
[4] 房晶雪,程刚.β受体阻滞剂在癌症中应用的研究进展[J].实用药物与临床,2015,18(11):1375-1378.
[5] Mahindra A,Hideshima T,Anderson KC.Multiple myeloma: biology of the disease[J].Blood Rev,2010,24(1):5-11.
[6] Buckmiller LM,Munson PD,Dyamenahalli U,et al.Propranolol for infantile hemangiomas: early experience at a tertiary vascular anomalies center[J].Laryngoscope,2010,120(4):676-681.
[7] Minnema MC,Van der Spek E,Van de Donk NW,et al.New developments in the treatment of patients with multiple myeloma[J].Neth J Med,2010,68(1):24-32.
[8] Leaute-Labreze C,Dumas de la Roque E,Hubiche T,et al.Propranolol for severe hemangiomas of infancy[J].N Engl J Med,2008,358(24):2649-2651.
[9] 胡梦叶,汤建萍.普萘洛尔治疗婴幼儿血管瘤的分子机制[J].儿科药学杂志,2014,20(6):61-64.
[10] Baliga BC,Kumar S.Role of bcl-2 family of proteins in malignancy[J].Hematol Onco1,2002,20(2):63-74.
[11] Nika N.Bel-2 family proteins:critical checkpoints of apoptitie cell death[J].Clin Cancer Res,2007,13(24):7254-7263.
[12] 周薇,戴奇刚,利华,等.EGCG 通过下调Bcl-2、NF-κB(p65)表达,活化Caspase-3诱导人胃癌细胞凋亡的实验研究[J].现代肿瘤医学,2008,16(4):530-534.
[13] Antonsson B,Conti F,Ciavatta A,et al.Inhibition of Bax channel-forming activity by Bcl-2[J].Science,1997,277(5324):370-372.
[14] 姚峰,陈倩,陶琳,等.Caspase-3基因在肺癌中的表达及其与Bcl-2和Bax蛋白表达的关系[J].肿瘤防治杂志,2004,3(1):4-6.
[15] Kaneko Y,Tajiri N,Yu S,et al.Nestin over expression precedes caspase-3 upregulation in rats exposed to controlled cortical impact traumaticbrain injury[J].Cell Med,2012,4(2):55-63.
[16] Hao Z,Yang P,Eckert RL,et al.Caspase-8:a key role in the pathogenesis of diabetic embryopathy[J].Birth Defects Res B Dev Reprod Toxicol,2009,86(1):72-77.
Effects of timolol on proliferation and apoptosis of human multiple myeloma cell line RPMI 8226
LI Ting1,GUO Pengxiang,LEI Tingwen,WANG Jishi
(1 Guizhou Medical University,Guiyang 550004,China)
ObjectiveTo investigate the effects of timolol on cell proliferation and apoptosis of human multiple myeloma cell line RPMI-8226,and to explore its potential anti-tumor mechanism.MethodsThe RPMI 8226 cells in the logarithmic phase were divided into groups 1,2,3,4,5,and 6,and then were added with 1,2.5,5,10,20,50 and 100 μmol/L timolol,respectively.The nutrient solution without adding cells and drugs was taken as the blank control group.The negative control group was only added with cells.At 24,48 and 72 h of cultivation,MTT method was used to observe the proliferation of different groups.In addition,the appropriate amount of RPMI 8226 cells were divided into groups A,B and C which were added with 2.5,20 and 50 μmol/L timolol as the final concentrations,respectively.Meanwhile,the control group was only added with cell culture fluid.And then flow cytometry was used to detect the apoptosis effect.Changes in the expression of Caspase-3,Caspase-9,Bax and Bcl-2 protein and mRNA were detected by Western blotting and RT-PCR,respectively.ResultsAfter treated with timolol for 24,48 and 72 h,the inhibition rate increased with the increase of drug concentrations and the extension of the time(all P<0.05).After treated with timolol for 72 h,the apoptotic rates of groups A,B,C were 7.17%±0.06%,10.56%±0.65%,15.27%±0.86% and 3.93%±0.25%(all P<0.05).The mRNA and protein expression of Bax in the group A,B and C was significantly high than that of the control group(all P<0.05).The mRNA and protein expression of Bcl-2 in the groups B and C was much higher than that in the control group(all P<0.05).Compared with group A,the mRNA expression of Bcl-2 in the group C was higher.Meanwhile,the Caspase-3 mRNA expression was higher in groups B and C as compared with that of group A(all P<0.05).And the mRNA expression of Caspase-9 in the groups A,B and C was higher than that in the control group(all P<0.05).ConclusionTimolol inhibits the proliferation and promotes apoptosis of RPMI 8226 cells,the mechanism may be that it can up-regulate the expression of Bax,Caspase-3 and Caspase-9,and inhibit the Bcl-2 expression.
timolol;multiple myeloma;cell proliferation;apoptosis;Bcl-2;Bax;Caspase-3;Caspase-9
贵州省科技计划资助项目(黔科合LH字2014-7010)。
李婷(1990-),女,硕士研究生在读,主要研究方向为恶性血液病。E-mail:1044207658@qq.com。
简介:郭鹏翔(1971-),男,硕士,主任医师,主要研究方向为血液病的治疗。E-mail:gxgdx118@sna.com
10.3969/j.issn.1002-266X.2016.27.007
R730.2
A
1002-266X(2016)27-0024-04
2016-02-25)
