短期UVB辐照对抱茎风毛菊光合作用的影响
2016-08-31常宗强祁淑云
常宗强,祁淑云
(1.中国科学院 寒区旱区环境与工程研究所,甘肃 兰州 730000;2.中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
短期UVB辐照对抱茎风毛菊光合作用的影响
常宗强1,祁淑云2
(1.中国科学院 寒区旱区环境与工程研究所,甘肃 兰州730000;2.中国农业科学院 兰州兽医研究所,甘肃 兰州730046)
以抱茎风毛菊(Saussureachingiana)为实验材料,利用短期中波紫外线(UVB,Ultraviolet B)辐照对比实验(CK:对照组,自然大气UVB强度;UVB:UVB辐照度为205 μw·cm-2,短期辐照时间为4 h)研究了光合色素含量、叶绿素荧光快速诱导动力学曲线(OJIP)和光合蛋白表达量的变化。结果显示:UVB辐照降低了抱茎风毛菊的叶绿素质量分数,增大了叶绿素a/b比值和类胡萝卜素质量分数;UVB辐照导致PSII反应中心蛋白(D1、D2)、捕光色素蛋白(CP43)、Cytb6f复合物和ATP酶复合体蛋白均发生降解,外周捕光色素蛋白(LHCII)的表达量升高;UVB辐照抑制了从QA-往下的电子传递,增加了热耗散能量,阻碍了光合作用的碳同化过程,进而降低光能利用率。叶绿素a/b比值、类胡萝卜素含量的增大虽然缓解了短期UVB辐照对抱茎风毛菊的伤害,但是UVB辐照对光合作用仍具有显著的负影响。
叶绿素荧光;光合色素;光合蛋白;抱茎风毛菊;UVB
UVB辐射在太阳短波辐射中所占的比例较小,但是却能够被生物有机体的一些重要组分(如核酸、蛋白质等)吸收,给地球生物圈带来多方面的影响。随着平流层臭氧的减少,到达地球表面的UVB辐射将显著增加,这是我们目前面临的全球性环境问题之一[1]。已有研究表明,UVB辐射增加能够降低植物光合速率,破坏叶片光合色素,损害细胞膜结构,影响蛋白质代谢等[2-8]。
高山环境相对平原地区具有更强烈的UVB辐射、低温、低气压等不利于植物生长的生态条件。研究表明,由于在整个生长发育的过程中都经历着强太阳UVB辐射的驯化,高山植物形成了一套生态适应机制,来抵御强太阳UVB辐射所带来的伤害。UVB辐射对光合作用的影响包括引起植物光系统II反应中心的失活、光合色素水平的降低、破坏植物类囊体的完整性等[9,10]。风毛菊属(SaussureaD C.)植物为一年生、两年生或多年生草本,有时为小半灌木。本属有400余种,分布亚洲与欧洲。我国已知近264种,遍布全国[11]。目前对风毛菊(SaussureaD C.)的研究主要集中在其药用价值的分析、生长繁殖对策、核型等方面[12-16]。有关风毛菊应对UVB辐射的研究中较多关注其光合生理特性的变化[17,18],研究UVB辐照对其光合蛋白表达量影响的报道很少。实验选用抱茎风毛菊(Saussureachingiana)作为研究材料,采用UVB辐射光源对抱茎风毛菊进行照射处理,研究了光合色素含量及叶绿素荧光诱导动力学的变化特征,并且利用Western Blotting技术分析了UVB辐照对抱茎风毛菊光合蛋白表达量的影响,揭示了抱茎风毛菊对UVB辐射的适应性反应和伤害机理,为未来环境变化背景下生态安全评估及防治UVB损伤提供实验基础。
1 材料与方法
1.1材料及处理
抱茎风毛菊为多年生植物,生于路边、杨树林下、沟堤等处,多分布于高海拔区域。实验所用抱茎风毛菊种子是2012年9—10月份采集于四川省北部松潘县毛尔盖岔路附近海拔3 855 m处(32°06′~33°09′N,102°38′~104°15′E)。2013年1月24日将种子进行春化,1月27日将种子移入装有灭菌泥炭土的塑料盆中,温室栽培,光照时间为16 h。生长约50天之后,当风毛菊长到4、5片叶时用于实验。将风毛菊幼苗分为对照组(CK:自然大气UVB强度)和处理组(UVB),每组各处理10株苗。将处理组风毛菊幼苗置于UVB辐射灯管(8 w×5)下照射4 h,辐照度为205 μw·cm-2。UVB辐射强度用紫外辐射计测定(北京师范大学光电仪器厂,波长峰值297 nm)。
1.2实验方法
(1)光合色素质量分数的测定分别取UVB辐照处理前后抱茎风毛菊新鲜叶片0.1 g(每组3个重复),用80%丙酮溶液充分研磨后,将匀浆转移到15 mL离心管内,并用适量80%丙酮洗涤研钵,一并转入离心管中,12 000 g离心1 min,将上清液转移到其他容器,用80%丙酮悬浮沉淀,再离心,直至沉淀完全变成白色。合并各次所得上清液,定容至8 mL备用。取1 mL定容后的溶液,加入3 mL 80%丙酮(稀释4倍)。利用紫外分光光度计测定OD470、OD646和OD663,根据以下公式计算样品中各种色素的质量浓度(mg·L-1):叶绿素的质量浓度C(a+b)=7.18 OD663+17.32 OD646;叶绿素a的质量浓度Ca=12.21 OD663-2.81 OD646;叶绿素b的质量浓度Cb=20.13 OD646-5.03 OD663;类胡萝卜素的质量浓度Ccar=(1 000 OD470-3.27Ca-104Cb)/229。叶绿素含量质量分数(mg·g-1FW)=色素浓度×提取液体积×稀释倍数/样品鲜重。
(2) 叶绿素荧光快速诱导动力学曲线(OJIP)利用OS-30P+植物胁迫快速测量仪测定抱茎风毛菊叶片叶绿素荧光快速诱导动力学曲线(OJIP)。曲线由3 500 μmol·m-2·s-1的饱和光诱导,荧光信号记录是从10 μs开始,至3 s结束。测量前利用暗适应夹子使叶片暗适应至少30 min,同时打开仪器预热并设置测量参数。荧光参数测量时,每个处理设置5个重复。从叶绿素荧光快速诱导动力学曲线(OJIP)中获得参数的意义见表1。
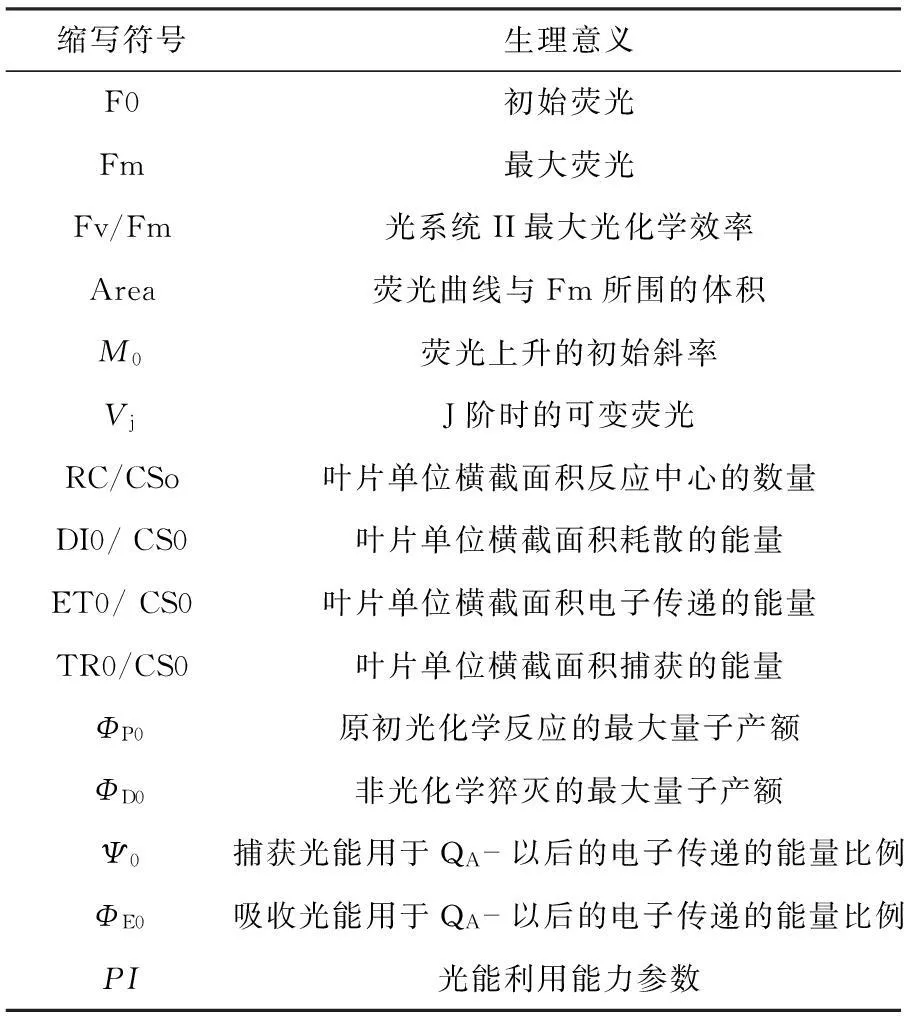
表1 OJIP曲线荧光参数
(3)类囊体膜的提取主要参照文献[19]中的方法,进行少许改动。称取抱茎风毛菊新鲜叶片,加适量预冷HMSN提取液(400 mmol sucrose,10 mmol NaCl,5 mmol MgCl2,10 mmol HEPES,5 mmol EDTA pH值7.6),冰上研磨。利用3层纱布对匀浆进行过滤,4 ℃,5 000 g离心10 min。弃上清,沉淀用0.2 mL HMSN提取液悬浮,所得悬浮液即为提取的类囊体膜蛋白。取一定量类囊体膜,加入80%丙酮,混匀,8 000 g,室温离心10 min以去除类囊体膜中的淀粉。取上清测定OD663、OD646,根据公式:Chla+Chlb=稀释倍数×(7.18×E663+17.32×E646)计算色素含量。将类囊体膜分装后用液氮速冻并储存于-70 ℃。
(4) SDS-PAGE电泳和免疫印迹SDS-PAGE电泳参照Laemmli体系,采用4%浓缩胶和12%分离胶,分离胶中含6 mol·L-1的尿素。将提取好的风毛菊类囊体膜进行色素定量后,加入等体积的2×SDS上样缓冲液,蛋白变性后上样,然后进行电泳。电泳结束后,采用半干法将蛋白转移到硝酸纤维素膜上。将膜置于含5%脱脂奶粉的TBST(50 mmol Tris-HCL,PH值7.4,150 mmol NaCL,0.05% Tween-20)中室温封闭1 h。利用TBS将膜漂洗3次,每次5 min。之后加入用含5%脱脂奶粉的TBST稀释的特异性抗体室温孵育1 h后,4 ℃孵育过夜。然后用TBST漂洗3次,加入二抗稀释液(DyLight 680TM1∶7 500),室温孵育1 h。之后再用TBST洗膜3次。最后进行红外激光影像扫描和分析。
2 结果与分析
2.1UVB辐照对叶片光合色素质量分数的影响
通过短期UVB辐照对抱茎风毛菊色素质量分数的影响(见图1)可以看出,短期UVB辐照对抱茎风毛菊叶片中光合色素质量分数产生了显著影响。经过UVB照射处理后,叶绿素a、叶绿素b等质量分数均呈显著降低的趋势,和对照组相比分别下降了28.0%、47.8%;而叶绿素a/b比值、类胡萝卜素质量分数显著增加,分别增加了37.9%、25.8%。
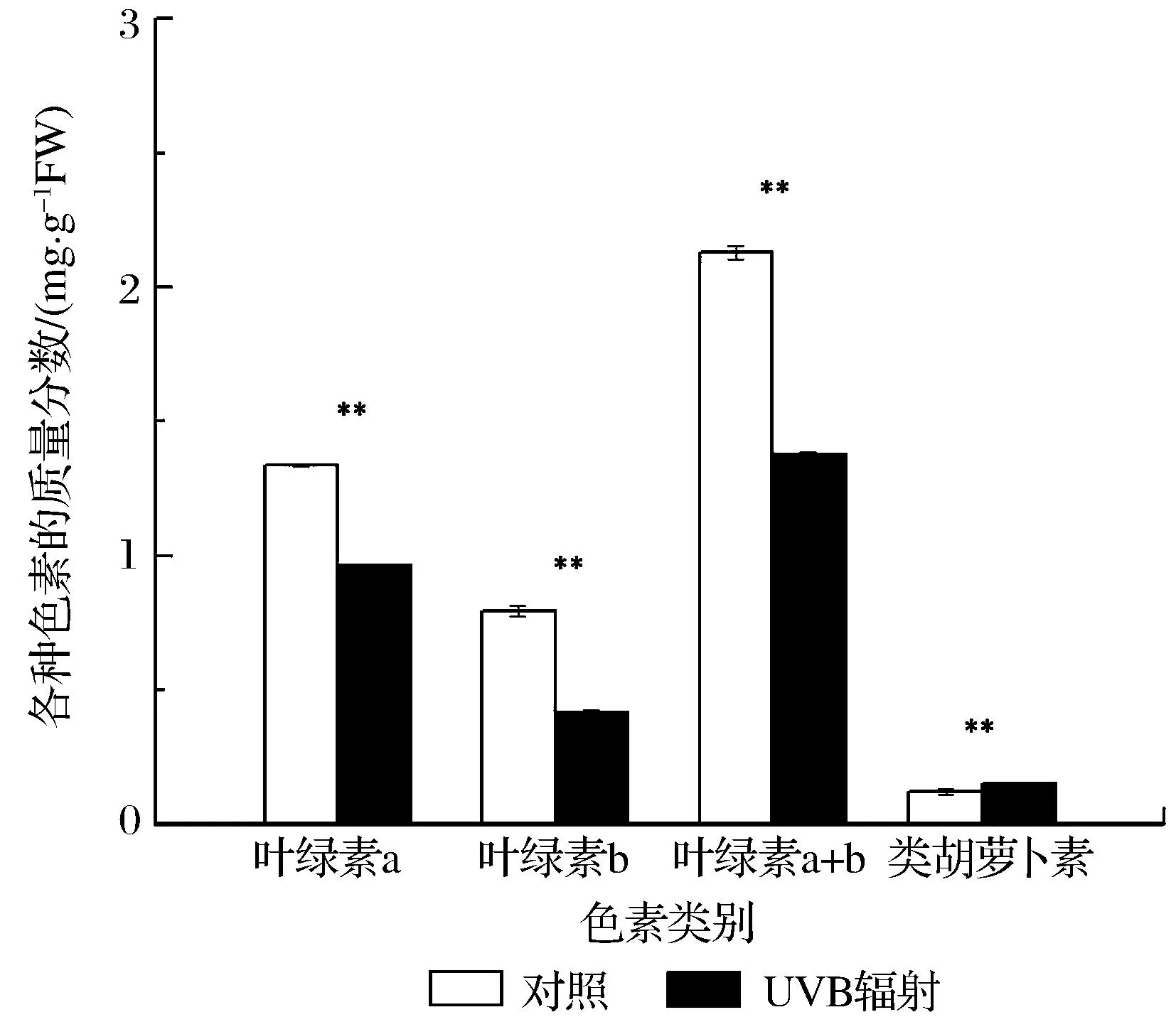
**表示差异极显著,显著水平为0.01图1 短期UVB辐照对抱茎风毛菊色素质量分数的影响Fig.1 The influence of short-term UVB irradiation on Saussurea chingiana pigment mass fraction
2.2UVB辐照对叶片OJIP特征的影响
(1)短期UVB辐照对叶片OJIP曲线的影响图2为短期UVB辐照对抱茎风毛菊OJIP曲线的影响。由图2可以看出抱茎风毛菊的叶绿素荧光诱导动力学曲线在处理前后均属于典型OJIP曲线,具有明显的O、J、I、P相。短期UVB辐照后,抱茎风毛菊的荧光信号显著低于处理前。抱茎风毛菊J、I、P相的荧光强度均低于处理前。此外,UVB辐照也影响了抱茎风毛菊到达P相的时间,UVB辐照处理前到达P相的时间要早于处理后。
(2) UVB辐照对OJIP曲线荧光参数的影响通过抱茎风毛菊叶片OJIP曲线荧光参数变化(见表2)可以看出,抱茎风毛菊在UVB辐照处理之前达到最大荧光所用的时间tFm约为165 ms,而在处理后tFm明显延长,约为222 ms,但不存在显著差异。4 h的UVB辐照胁迫显著降低了抱茎风毛菊的最大荧光Fm以及PSII最大光化学效率Fv/Fm(见表1)。UVB辐照同样也严重地损害了抱茎风毛菊PSII的潜在活性。光能利用参数PI在UVB辐照影响下显著降低。处理之前的抱茎风毛菊J相的相对可变荧光强度Vj要略低于处理之后。UVB辐照后,抱茎风毛菊的QA-还原的量Vj和QA还原的速率M0均增加,电子受体库Area也出现增大趋势,但不显著。叶片单位横截面积反应中心的数量RC/CS0、叶片单位横截面积电子传递的能量ET0/CS0、叶片单位横截面积捕获的能量TR0/CS0在处理前后均无显著差异。从能量分配来看,UVB辐照后抱茎风毛菊用于能量耗散的能量比例ΦD0极显著高于辐照前。捕获光能用于QA-以后的电子传递的能量比例Ψ0,吸收光能用于QA-以后的电子传递的能量比例ΦE0在处理前后差异不显著。
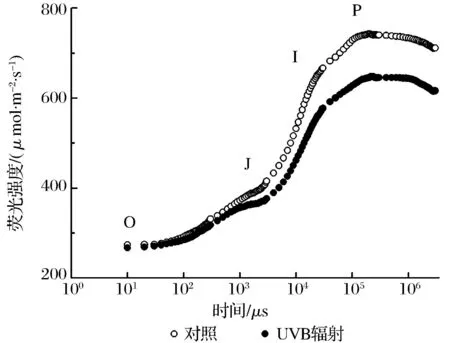
图2 短期UVB辐照对抱茎风毛菊OJIP曲线的影响Fig.2 The influence of short-term UVB irradiation on Saussurea chingiana OJIP curve

表2 抱茎风毛菊叶片OJIP曲线荧光参数
2.3UVB辐照对叶片光合蛋白表达量的影响
抱茎风毛菊叶片的PSII反应中心蛋白D1、D2在UVB辐照处理下均出现降解(见图3),与对照组相比,UVB处理4 h 后D1蛋白大约减少一半,而对D2蛋白的损害更严重,处理后是处理前的1/8;内周捕光色素蛋白CP43也发生明显降解,但外周捕光色素蛋白LHCII却出现增加超过3倍以上;UVB辐射胁迫也导致抱茎风毛菊的Cytb6f复合物以及ATP酶复合体蛋白出现不同程度的降解。

图3 短期UVB辐照对抱茎风毛菊叶片中光合蛋白表达量的影响Fig.3 Effects of short-term UVB radiation on photosynthetic proteins in leaves of Saussurea chingiana
3 结论
光合色素在植物光能吸收和传递过程中具有重要作用,叶片中光合色素质量分数的变化能够表征出植物光合能力的变化。类胡萝卜素在植物光合作用中发挥着辅助光能吸收和电子传递的重要作用,它能够吸收过多的光能,避免叶绿素发生光氧化,保护植物免于受到强辐射的伤害。UVB辐照后,抱茎风毛菊叶片中类胡萝卜素质量分数出现极显著增大,这表明短期UVB辐照促进了抱茎风毛菊叶片中类胡萝卜素的合成,从而对强辐射产生了一定的防护作用。叶绿素a/b比值可以反映叶绿体中类囊体的垛叠程度,短期UVB辐射后,抱茎风毛菊的叶绿素a/b比值较大,证明其叶片类囊体的垛叠结构较完整,这说明抱茎风毛菊对短期UVB辐射增强具有一定的抗性。抱茎风毛菊叶片经过UVB辐照处理后,其叶片中的叶绿素a、叶绿素b等质量分数均显著降低,说明UVB辐射的增加使叶绿体受到破坏,导致叶绿素的光降解,降低了对强光的吸收。
植物PSII对UVB辐射敏感,UVB辐射能够使PSII反应中心失活[20-22]。UVB增加会产生光抑制现象[23]。PSII的光化学效率(Fv/Fm)是度量光抑制程度的重要指标[24]。经过4 h的UVB辐照处理,抱茎风毛菊的最大荧光(Fm)和PSII的光化学效率(Fv/Fm)都是显著降低的,说明UVB辐照对PSII反应中心的光能转换效率产生了负作用,导致风毛菊产生光抑制。这与增补UVB 辐射对高山植物美丽风毛菊光合作用和光合色素的影响的研究结果基本一致[17]。光抑制的产生至少有两个机制,包括受体侧和供体侧的电子传递异常,分别表现为:QA的还原抑制了通过QA的电子传递;供体侧发生强氧化势的积累,导致电子传递失活[25]。PSII受体侧包括QA、QB和PQ库等。M0、Ψ0、ΦE0等参数能够反映PSII受体侧的变化。UVB辐照导致抱茎风毛菊用于QA-以后的电子传递的能量比例(Ψ0、ΦE0)下降,较多的光能用于QA的还原,使QA的还原速率(M0)和QA-还原的量(Vj)增加(见表1)。已有实验证明QA和QB活性能够影响J相、I相的荧光强度以及到达P相的时间[26]。抱茎风毛菊叶片的OJIP曲线显示,UVB辐照前后叶片J、I、P相的荧光强度差异显著(见图1),同时到达P相的时间也明显不同(见图2),说明UVB辐射处理前后抱茎风毛菊在QA和QB电子传递活性方面存在差异。由此推测,可能是因为UVB辐照抑制了抱茎风毛菊从QA-往下的电子传递,使PSII受体侧电子传递异常,从而产生光抑制。
PSII是UVB辐射主要损伤部位,尤其是反应中心的D1、D2蛋白,UVB辐射能使D1、D2蛋白发生降解。D1、D2蛋白直接参与PSII电子传递。D1蛋白比类囊体上的其他蛋白周转要快的多,使得PSII易受到光诱导破坏,产生光抑制,降低光合速率。经UVB辐照4 h后,抱茎风毛菊的D1、D2蛋白在处理前后均出现降解,进一步说明UVB辐照损害了PSII反应中心,产生光抑制。已有研究表明D1、D2蛋白的降解可能是引起电子传递能力减弱的直接原因[27,28]。CP43蛋白是PSII内周捕光色素复合体,LHCII是外周捕光色素蛋白复合体,都服务于PSII反应中心,参与光能的吸收和传递。UVB辐照后抱茎风毛菊的CP43蛋白出现降解现象,LHCII蛋白复合体却出现大幅度增加(见图2)。LHCII的增多可能是抱茎风毛菊应对增强的UVB辐照的一种应激反应,LHCII的增多会导致捕获过多的光能而造成光抑制。CP43蛋白的降解则会减少LHCII捕获的光能传递到PSII反应中心,降低捕获光能的能力。Cytb6f复合物主要是在PSII和PSI复合体间执行电子传递功能。ATP酶复合体在光合电子传递过程中具有重要作用,它能够利用质子浓度梯度及相应的电势差来合成ATP并将能量贮存在其中。UVB辐照后,抱茎风毛菊的Cytb6f复合物以及ATP酶复合体蛋白出现不同程度地降解,从而降低电子传递能力以及抑制H+的输送和ATP的合成,进一步影响到抱茎风毛菊的光能利用过程。
短期UVB辐照促进了抱茎风毛菊叶片中类胡萝卜素的合成,增大了叶绿素a/b比值,这在一定程度上缓解了UVB辐照对抱茎风毛菊的伤害,这可能与抱茎风毛菊种子来自高海拔环境有关,说明高海拔环境下的抱茎风毛菊由于长期适应较强的紫外辐射而形成了一套适应和保护机制。但另一方面,短期UVB辐照对抱茎风毛菊PSII反应中心蛋白(D1、D2)、内周捕光色素蛋白(CP43)、Cytb6f复合物和ATP酶复合体蛋白以及叶绿素荧光诱导动力学曲线等均产生了不同程度的负影响,说明UVB辐照仍然对抱茎风毛菊的光合作用具有显著的负作用,UVB辐射依然是限制高山植物生存的重要因素。
致谢:感谢中科院植物所张立新实验室为本实验提供光合抗体。
[1]Rousseaux M C,Flint S D,Searles P S,etal.Plant Responses to Current Solar Ultraviolet-B Radiation and to Supplemented Solar Ultraviolet-B Radiation Simulating Ozone Depletion:An Experimental Comparison[J].Photochemistry and Photobiology,2004,80(2):224-230.
[2]侯扶江,贲桂英,颜景义,等.田间增加紫外线(UV) 辐射对大豆幼苗生长和光合作用的影响[J].植物生态学报,1998,22(3):256-261.
[3]杨志敏,颜景义,郑有飞,等.紫外光辐射对不同条件下小麦叶片叶绿素降解作用的研究[J].西北植物学报,1995,15(4):288-293.
[4]马亚丽,常宗强,张芬梅,等.极端干旱区沙枣叶片气体交换特性及其对CO2浓度的响应[J].甘肃科学学报,2014,26(6):62-67.
[5]陈拓,安黎哲,冯虎元,等.UV-B辐射对蚕豆膜脂过氧化的影响及其机制[J].生态学报,2001,21(4):579-583.
[6]许彦平,姚晓红,蒲永义,等.天水日光温室光温生产潜力估算及区划研究[J].甘肃科学学报,2004,16(1):52-56.
[7]Tevini M,Iwanzik W,Thoma U.Some Effects of Enhanced UV-B Irradiation on the Growth and Composition of Plants[J].Planta,1981,153(4):388-394.
[8]李翠芬,曾结林,尹爱国.温度光照盐度对小球藻诱变株虾青素积累的调控[J].甘肃科学学报,2015,27(4):29-32.
[9]Van Rensen J S,Vredenberg W J,Rodrigues G C.Time Sequence of the Damage to the Acceptor and Donor Sides of Photosystem Ⅱ by UV-B Radiation as Evaluated by Chlorophyll a Fluorescence[J].Photosynthesis Research,2007,94(2-3):291-297.
[10]Fiscus E L,Philbeck R,Britt A B,etal.Growth of Arabidopsis Flavonoid Mutants under Solar Radiation and UV Filters[J].Environmental and Experimental Botany,1999,41(3):231-245.
[11]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999.
[12]聂晶,刁恩英,王桂秋,等.风毛菊提取物抗诱变效应的实验研究[J].中国中医药科技,1999,6(3):163-164.
[13]王桂秋,聂晶,刁恩英.风毛菊抗炎作用的实验研究[J].中国中医药科技,2000,7(1):39-40.
[14]王一峰,刘启茜,裴泽宇,等.青藏高原3种风毛菊属植物的繁殖分配与海拔高度的相关性[J].植物生态学报,2012,36(1):39-46.
[15]黄运平,尹祖棠.四种风毛菊属植物的核型研究[J].广西植物,1994,14(4):357-360.
[16]王一峰,巩红冬,高素芳,等.青藏高原高山植物东俄洛风毛菊和川西风毛菊的核型研究[J].西北师范大学学报:自然科学版,2006,42(4):71-73.
[17]师生波,尚艳霞,朱鹏锦,等.不同天气类型下UVB辐射对高山植物美丽风毛菊叶片PSII光化学效率的影响分析[J].植物生态学报,2011,35(7):741-750.
[18]师生波,尚艳霞,师瑞,等.高山植物美丽风毛菊PSII光化学效率和光合色素对短期增补UVB辐射的响应[J].植物生态学报,2012,36(5):420-430.
[19]Zhang L,Paakkarinen V,van Wijk K J,etal.Co-translational Assembly of the D1 Protein Into Photosystem Ⅱ[J].Journal of Biological Chemistry,1999,274(23):16 062-16 067.
[20]Basiouny F M,Van T K,Biggs R H.Some Morphological and Biochemical Characteristics of C3 and C4 Plants Irradiated with UVB[J].Physiologia Plantarum,1978,42(1):29-32.
[21]Teramura A H.Implications of Stratospheric Ozone Depletion Upon Plant Production[J].HortScience,1990,25(12):1 557-1 560.
[22]Okada M,Kitajima M,Buder W L.Inhibition of Photosystem Ⅰ and Photosystem Ⅱ in Chloroplasts by UV Radiation[J].Plant and Cell Physiology,1976,17(1):35-43.
[23]Asthana A,McCloud E S,Berenbaum M R,etal.Phototoxicity of Citrus Jambhiri to Fungi under Enhanced UV-B Radiation:Role of Furanocoumarins[J].Journal of Chemical Ecology,1993,19(12):2 813-2 830.
[24]许大全,张玉忠,张荣铣.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.
[25]巫继拓,沈允钢.菠菜叶绿体的光抑制部位[J].植物生理学报,1990,16(1):31-36.
[26]Schansker G,Tóth S Z,Kovács L,etal.Evidence for a Fluorescence Yield Change Driven by a Light-induced Conformational Change Within Photosystem Ⅱ During the Fast Chlorophyll a Fluorescence Rise[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,2011,1807(9):1 032-1 043.
[27]Masi A,Melis A.Morphological and Molecular Changes in the Unicellular Green Alga Dunaliella Salina Grown under Supplemental UV-B Radiation:Cell Characteristics and Photosystem Ⅱ Damage and Repair Properties[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,1997,1321(2):183-193.
[28]Critchley C,Russell A W.Photo Inhibition of Photosynthesis in Vivo:The Role of Protein Turnover in Photosystem Ⅱ[J].Physiologia Plantarum,1994,92(1):188-196.
The Influence of Short-term UVB Irradiation on SaussureaChingianaPhotosynthesis
Chang Zongqiang1,Qi Shuyun2
(1.Cold and Arid Regions Environmental and Engineering Research Institute,Chinese Academy of Sciences,Lanzhou 730000,China;2.Lanzhou Veterinary Research Institute,Chinese Academy of Agricultural Sciences,Lanzhou 730046,China)
TakesSaussureachingianaas the experimental material,and the it uses short-term wave Ultraviolet B(UVB) irradiation as the comparative experiments (CK:control group,natural atmosphere UVB intensity;UVB:UVB irradiance of 205 μw·cm-2,short-term irradiation time of 4 h),which has studied the changes of photosynthetic pigment content,chlorophyll fluorescence rapid induction kinetics curves(OJIP) and photosynthetic protein expression.The results showes that:UVB irradiation reduces the chlorophyll mass fraction ofSaussureachingiana,and increases the chlorophyll a/b ratio and carotenoid mass fraction;UVB irradiation has led the degradation of PSII reaction center protein(D1,D2),light-harvesting chlorophyll protein(CP43),Cytb6f compound and ATP enzyme compound protein,and the increase of expression quantity of the light harvesting pigment-protein (LHCII).UVB irradiation inhibits the downward electron transfer of QA-,increasing the heat dissipation energy,hindering the carbon assimilation process of photosynthesis,thus reducing the efficiency for solar energy utilization.Although the increase of chlorophyll a/b ratio and carotenoid content has eased the damage of UVB irradiation tp theSaussureachingiana,UVB irradiation still has a significant negative impact on photosynthesis.
Chlorophyll fluorescence;Photosynthetic pigments;Photosynthetic protein;Saussureachingiana;UVB
10.16468/j.cnki.issn1004-0366.2016.04.007.
2015-12-02;
2016-01-05.
国家自然科学基金项目(31370396);甘肃省自然科学基金项目(145RJZA052).
常宗强(1974-),男,甘肃会宁人,副研究员,研究方向为干旱区生态.E-mail:changzq@lzb.ac.cn.
Q945
A
1004-0366(2016)04-0028-06
引用格式:Chang Zongqiang,Qi Shuyun.The Influence of Short-term UVB Irradiation onSaussureaChingianaPhotosynthesis[J].Journal of Gansu Sciences,2016,28(4):28-33.[常宗强,祁淑云.短期UVB辐照对抱茎风毛菊光合作用的影响[J].甘肃科学学报,2016,28(4):28-33.]
