糖皮质激素对脑外伤患者血浆肿瘤坏死因子α及白细胞介素1β的调控作用
2016-08-31马宝林林吴用高丽丽
马宝林,林吴用Δ,高丽丽
(1.厦门大学附属第一医院 神经外科,福建 厦门 361022;2.福建中医药大学附属第二人民医院 神经内科,福建 福州 350108)
糖皮质激素对脑外伤患者血浆肿瘤坏死因子α及白细胞介素1β的调控作用
马宝林1,林吴用1Δ,高丽丽2
(1.厦门大学附属第一医院 神经外科,福建 厦门 361022;2.福建中医药大学附属第二人民医院 神经内科,福建 福州 350108)
目的研究糖皮质激素(glucocorticoid,GC)对脑外伤患者血浆肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白细胞介素1β(interleukin-1β,IL-1β)的调控作用,指导临床合理用药。方法随机选取2013年4月~2016年8月入住厦门大学附属第一医院神经外科的脑外伤患者120例,依随机表对照法随机分为激素组60例和非激素组60例,另外选择60例健康的体检者作为对照组。激素组给予常规剂量的地塞米松治疗1周。对照组不做任何处理。采用酶联免疫吸附法(ELISA)测定2组患者在治疗后第1、2、7、14天时血浆中TNF-α和IL-1β的含量。结果在第1、2天激素组的血浆中TNF-α和IL-1β的含量明显高于对照组(P<0.05),与非激素组差异无统计学意义。而在第7、14天明显低于非激素组(P<0.05),与对照组无明显差异。结论糖皮质激素对脑外伤患者TNF-α和IL-1β的调控具有明显的滞后性,损伤早期不能及时降低TNF-α和IL-1β的含量,在恢复期又使其降低,削弱了其对神经的保护作用,这可能会加剧患者的病情。
糖皮质激素;脑外伤;肿瘤坏死因子α;白细胞介素1β
脑外伤患者由于大脑局部或广泛性受损而造成不同程度的永久性功能障碍,其死亡率和致残率极高[1]。神经外科医生通过对大量患者的临床研究,找到了脑外伤的各种发病机制,发现细胞因子,尤其炎性细胞因子在患者受损后明显增加,参与脑部的局部炎症反应,损害大脑功能,这可能会加重病情,具有损害性作用[2-3]。随着神经免疫学的发展,研究发现炎性细胞因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白细胞介素1β(interleukin-1β,IL-1β)在炎症反应中起主导作用,它们的表达水平可以作为脑外伤后继发炎症的重要指标。因此,通过合理调控其表达对治疗脑外伤患者有重要的意义。糖皮质激素(glucocorticoid,GC)是由肾上腺皮质分泌的具有抑制免疫应答、抗炎、抗毒等作用的一类激素。在20世纪六七十年代有研究发现糖皮质激素能改善血脑屏障,活化钠-钾泵,修复并改善细胞膜的稳定性,减少脑脊液的生成,从而治疗脑水肿[4-5]。所以多数医师主张用糖皮质激素治疗脑外伤患者,但近年来多数临床实践表明糖皮质激素对此类患者的疗效甚微,甚至存在副作用,所以目前其不宜被用于常规治疗或长期使用。由于过度的炎症反应在脑外伤患者早期是有害的,轻度的炎症反应在恢复期有利于脑组织的修复[6-7]。糖皮质激素功能的合理发挥与否将直接影响脑外伤患者的恢复。本实验通过研究糖皮质激素对脑外伤患者损伤后不同时间点血浆中TNF-α和IL-1β的影响程度,来证明糖皮质激素是否能用于治疗脑外伤患者,指导临床合理用药,从而降低脑外伤患者因治疗不当而造成的死亡。
1 资料与方法
1.1 一般资料 选取2013年4月~2016年8月入厦门大学附属第一医院神经外科的符合诊断标准的脑外伤患者120例,依随机表对照法分为激素组60例和非激素组60例,激素组男38例,女22例,年龄在17~66岁,平均年龄(35.52±6.37)岁。非激素组男33例,女27例,年龄在16~61岁,平均年龄(35.46±5.13)岁。选择60例健康的体检者作为对照组,男30例,女30例,年龄在21~57岁,平均年龄(34.28±7.19)岁。2组患者及对照组在性别、年龄等差异不具有统计学意义,有可比性,且患者和体检者皆已签署知情同意书。
诊断及排除标准:患者昏迷指数(Glasgow coma scale,GCS)评分为3~8分,CT头颅平扫结果为颅内出血、脑挫裂伤或硬膜下血肿,近期无感染和其他器官的损伤。排除对本次研究药物过敏,或有糖尿病、心血管疾病和免疫系统疾病的患者。
1.2 方法
1.2.1 治疗方法:激素组以10 mg地塞米松(上海北杰集团关东药业有限公司,国药准字H22022648)连续静脉滴注治疗1周,其余用药2组患者大致相同。对照组不做任何处理。
1.2.2 标本检测:标本的采集和测定:在脑外伤患者受损后第1、2、7、14天时抽取其肘静脉血4 mL,经低温离心后分离出血浆置于-40 ℃的冰箱中保存留待检测。采用ELISA法由本院检验科严格检验样品的浓度,TNF-α和IL-1β试剂盒购自武汉博士德公司。
TNF-α测定程序:①准备工作:提前20 min从冰箱中取出试剂盒;将试剂管离心数分钟;配制1 000、500、250、125、62.5、31.3、15.6 pg/mL的TNF-α标准品;在使用前2 h内准备生物素标记抗人TNF-α抗体工作液;在使用前1h内准备ABC工作液;多次用至少0.4 mL的TBS洗涤缓冲液吸去酶标板内的液体。②实验步骤:取酶标板的一孔仅加入样品稀释液作为对照孔,然后将配制好的1 000、500、250、125、62.5、31.3、15.6 pg/mL TNF-α标准品各0.1 mL分别加入到另7个孔。最后将50 mL的样品稀释液和50 mL的样品依次加入到各孔,将酶标板加上盖,37 ℃环境下反应2 h;反应后甩去酶标板内液体,保证酶标板内没有残留液体;每孔依次加入0.1 mL的生物素标记抗人TNF-α抗体工作液,37 ℃下反应1 h;用PBS洗涤浸泡酶标板,甩去或吸取多余液体;每孔依次加入0.1 mL的ABC工作液,37 ℃下反应半小时;用PBS洗涤浸泡酶标板,甩去或吸取多余液体,保证没有残留液体;将0.1 mL的TMB显色液依次加入每个孔,在37 ℃条件下避光反应20 min;按每孔0.1 mL依次加入TMB终止液;用酶标仪检测A值,与零孔进行对照。
IL-1β的检测步骤同上。③结果评判:以A值为纵坐标,浓度作为横坐标绘制曲线;根据A值利用CurveExpert 1.3 软件计算样品的浓度值。

2 结果
2.1 各组血浆中TNF-α的含量比较 经统计学分析可知在第1、2天激素组血浆中TNF-α的含量明显高于对照组,差异具有统计学意义(P<0.05),而与非激素组差异无统计学意义。而在第7、14天明显低于非激素组,差异具有统计学意义(P<0.05),与对照组差异无统计学意义。见表1。
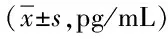
表1 各组血浆中TNF-α的含量比较Tab.1 Comparison of plasma TNF-α levels in each group (±s,pg/mL)
*P<0.05,与对照组比较,compared with control group;#P<0.05,与非激素组比较,compared with non-hormonal group
2.2 各组血浆中IL-1β的含量比较 在第1、2天激素组血浆中IL-1β的含量明显高于对照组,差异具有统计学意义(P<0.05),而与非激素组差异无统计学意义。而在第7、14天明显低于非激素组,差异具有统计学意义(P<0.05),与对照组差异无统计学意义。见表2。
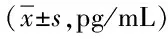
表2 各组血浆中IL-1β的含量比较Tab.2 Comparison of plasma IL-1β levels in each group(±s,pg/mL)
*P<0.05,与对照组比较,compared with control group;#P<0.05,与非激素组比较,compared with non-hormonal group
3 讨论
大量脑外伤患者的临床研究发现细胞因子尤其是炎性细胞因子在患者受损后会明显增加,参与脑部的局部炎症反应,损害大脑功能,具有损害性作用[8]。细胞因子(cytokines,CK)是能通过结合相应受体调节细胞生长、分化和效应及调控免疫应答的一类可溶性蛋白质,维护着个体细胞的完整性。随着神经免疫学的发展,研究发现炎性细胞因子TNF-α和IL-1β会在脑外伤患者损伤后大量表达,对患者造成继发性伤害[9-10]。小胶质细胞 (microglia)作为中枢神经系统(central nervous system,CNS)中最主要的一道免疫防线,不断地清除中枢神经系统中损坏的神经及感染性物质[11-12]。目前研究发现过多激活或失控的小胶质细胞是促炎因子的重要来源,如肿瘤坏死因子α,白细胞介素β。它们在受到刺激时会促进TNF-α和IL-1β等炎性细胞因子的表达,甚至超量生成。这些细胞因子一方面会引发脑外伤患者后继发炎症反应的可能,另一方面又有利于脑组织的修复[13-14]。本研究结果表明,与对照组相比,脑外伤患者7 d内血浆中TNF-α和IL-1β含量明显升高(P<0.05),患者早期由于血脑屏障受损,小胶质细胞等被激活后产生大量促炎因子TNF-α和IL-1β进入血液循环,会导致脑神经的死亡,从而引发脑外伤患者的后继发损伤。糖皮质激素虽能改善血脑屏障,同时具有抗炎的作用,但本研究结果表明,激素组血浆中TNF-α和IL-1β水平在7 d内并无明显下降,直到14 d时才降至正常水平(P<0.05)。同时非激素组血浆中TNF-α和IL-1β水平在14 d时依然高于对照组。可见糖皮质激素在脑外伤患者受损早期并不能有效地降低TNF-α和IL-1β的含量。大多医学者认为原因可能是:脑外伤患者受损后糖皮质激素受体GR的表达水平下降,在受损前2 d其功能状态也明显下降,外界输入的大量外源性GC不能与GR稳定结合从而无法发挥其抗炎作用。反而由于游离在血浆中GC具有一定副作用,会加重神经细胞受到额外的损伤[15-16]。而在患者受损后4 d左右GR的表达会上升,此时GC会与GR结合从而发挥抗炎作用。非激素组血浆中TNF-α和IL-1β含量在14 d后有所下降,但仍高于对照组和激素组。轻度炎症反应有利于脑组织的修复,激素组TNF-α和IL-1β含量影响患者的恢复。
综上所述,糖皮质激素对脑外伤患者血浆中TNF-α和IL-1β的调控具有明显的滞后性,损伤早期不能及时降低TNF-α和IL-1β的含量,在恢复期又使其降低,削弱了炎性细胞因子对神经的保护作用,这可能会加剧患者的病情[17]。由于炎性细胞因子TNF-α和IL-1β的双重作用,研制在合适时间点的抑制剂,将为未来治疗脑外伤患者提供合理有效的方向。
[1] 周染云, 孙静, 王国权,等.颅脑外伤患者住院期间康复护理的研究进展[J].解放军护理杂志, 2014,31(5):41-42.
[2] 史家欣, 李家树.糖皮质激素抗炎作用机制的研究进展[J].实用医学杂志, 2014(6):983-984.
[3] 何耀华, 翁习生, 邱贵兴.白细胞介素1β、肿瘤坏死因子α在膝关节原发性骨关节病发病中的作用[J].中华骨科杂志, 2014, 19(5):281-284.
[4] 侯晓东, 刘洪柏, 刘克敏.体外冲击波对兔膝骨关节炎软骨白细胞介素-1β及肿瘤坏死因子-α表达的影响[J].中国康复理论与实践, 2014,(2):121-124.
[5] Patel H, Platt R, Lozano JM, et al.Glucocorticoids for acute viral bronchiolitis in infants and young children[J].Jama, 2014, 311(1):87-88.
[6] Tomic-Canic M, Brem H, Samuels HH.De novo synthesis of glucocorticoids in the epidermis and its uses and applications: US, US 8802660 B2[P].2014, 371(2):119-129.
[7] Iannuzzi L.The Effect of Glucocorticoids on Joint Destruction in Rheumatoid Arthritis — NEJM[J].N Engl J Med, 2015, 9(2):488-492.
[8] NICE-SUGAR Study Investigators for the Australian and New Zealand Intensive Care Society Clinical Trials Group and the Canadian Critical Care Trials Group.Intensive versus conventional glucose control in critically ill patients with traumatic brain injury: long-term follow-up of a subgroup of patients from the NICE-SUGAR study.[J].Intensive Care Med, 2015, 41(6):1037-1047.
[9] Faul M, Coronado V.Chapter 1-Epidemiology of traumatic brain injury[J].Handbook of Clinical Neurology, 2015, 127:3-13.
[10] Iaccarino MA, Bhatnagar S, Zafonte R.Rehabilitation after traumatic brain injury.[J].Handb Clin Neurol, 2015, 127(55):411-422.
[11] Ni W, Zheng M, Xi G, et al.Role of lipocalin-2 in brain injury after intracerebral hemorrhage[J].J Cereb Blood Flow Metab, 2015,35(9):1454-1461.
[12] Johnson VJ, Vohr HW.Tumor Necrosis Factor-α[M].Springer Berlin Heidelberg, 2016.
[13] Nossent JC, Sagenjohnsen S, Bakland G.Tumor necrosis factor-α promoter -308/238 polymorphism association with less severe disease in ankylosing spondylitis is unrelated to serum TNF-α and does not predict TNF inhibitor response[J].J Rheumatol, 2014, 41(8):1675-1682.
[14] Park KH, Yoon YD, Kang MR, et al.Hypothemycin inhibits tumor necrosis factor-α production by tristetraprolin-dependent down-regulation of mRNA stability in lipopolysaccharide-stimulated macrophages[J].Int Immunopharmacol, 2015, 29(2):863-870.
[15] Wu G, Fan H, Huang Y, et al.Duhuo Jisheng Decoctioncontaining serum promotes proliferation of interleukin1βinduced chondrocytes through the p16cyclin D1/CDK4Rb pathway[J].Mol Med Rep, 2014, 10(5):2525-2534.
[16] Shen J, Arnett DK, Peacock JM, et al.Interleukin1β Genetic Polymorphisms Interact with Polyunsaturated Fatty Acids to Modulate Risk of the Metabolic Syndrome[J].J Nutr, 2013, 137(8):1846-1855.
[17] Zhong Y, Zhou LJ, Ren WJ, et al.Interleukin1β Induces Long-Term Potentiation of C-Fiber Evoked Field Potentials in Spinal dorsal Horn in Rats with Neuropathic Pain[J].Open Pain J, 2014, 2(1):18-23.
(编校:王俨俨)
Regulationofglucocorticoidsonplasmatumornecrosisfactor-αandinterleukin-1βinbraintrauma
MA Bao-lin1, LIN Wu-yong1Δ, GAO Li-li2
(1.Department of Neurosurgery, The First Affiliated Hospital of Xiamen University, Xiamen 361022, China; 2.Department of Neurology, The Second People’s Hospital Affiliated to Fujian University of Traditional Chinese Medicine, Fuzhou 350108, China)
ObjectiveTo study the regulation of glucocorticoid (GC) on plasma tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) in patients with brain trauma and guid rational drug use.Methods120 patients with brain trauma were randomly selected from April 2013 to August 2016 in our hospital, according to a random table were divided into hormone group and non-hormonal group, 60 cases of each group, another 60 healthy volunteers as control group.The hormone group
dexamethasone for one week, the control group with no treatment.The plasma TNF-α and IL-1β levels on 1st, 2nd, 7thand 14thdays were compared between two groups.ResultsOn the 1stand 2ndday, plasma TNF-α and IL-1β levels in hormone group were significantly higher than control group(P<0.05), while there was no significant difference compared with non-hormone group.On 7thand 14thdays, the TNF-α and IL-1β levels in hormone group were significantly lower than non-hormone group (P<0.05), while there was no significant difference compared with control group.ConclusionThe regulation of GC on TNF-α and IL-1β was hysteretic in traumatic brain injury patients, and can not reduce TNF-α and IL-1β content timely , but reduce their levels during the recovery period instead, reduce their protective effects of nerve, which could exacerbate the patient’s condition.
glucocorticoid; brain trauma; tumor necrosis factor-α; interleukin-1β
10.3969/j.issn.1005-1678.2016.10.010
福建省医学创新课题(2015-1-85)
马宝林,男,本科,主任医师,研究方向:颅脑损伤,E-mail:690334748@qq.com ;林吴用,通信作者,男,本科,主治医师,研究方向:颅脑损伤,E-mail:3197234871@qq.com。
R651;R741
A
