Ⅰ,Ⅱ期宫颈癌组织HIF-1α与COX-2蛋白共表达对预后的影响及机制*
2016-08-29罗爱华丰大利付娟李欣
罗爱华,丰大利,付娟,李欣
(三峡大学第二人民医院暨宜昌市第二人民医院 肿瘤放化疗科,湖北 三峡 443000)
Ⅰ,Ⅱ期宫颈癌组织HIF-1α与COX-2蛋白共表达对预后的影响及机制*
罗爱华,丰大利,付娟,李欣
(三峡大学第二人民医院暨宜昌市第二人民医院 肿瘤放化疗科,湖北 三峡 443000)
目的探讨Ⅰ,Ⅱ期宫颈癌组织中HIF-1α与COX-2蛋白的共表达对预后的影响及可能的机制。方法免疫组织化学法分析71例宫颈癌标本的HIF-1α和COX-2的共表达情况;RT-PCR法检测标本中HIF-1α mRNA和COX-2 mRNA的表达水平。χ2检验分析不同表达组患者1、2和3年存活率的差异;采用KM生存分析法了解不同表达组患者的存活时间的差异;采用相关分析了解蛋白及mRNA表达水平的相关性。结果HIF-1α和COX-2共表达组患者的3年存活率低于非共表达组(P<0.05);HIF-1α和COX-2共表达组患者的存活时间低于非共表达组(P<0.05);在Ⅱ期患者中,HIF-1α的蛋白水平与COX-2 mRNA的水平正相关(rs=0.594,P<0.05)。结论在Ⅰ,Ⅱ期宫颈癌中,HIF-1α和COX-2共表达组预后较差;HIF-1α蛋白可能正向调控COX-2 mRNA的表达。
宫颈癌;缺氧诱导因子1α;环氧合酶2;共表达;生存分析
缺氧是实体肿瘤形成的重要因素之一,在肿瘤形成时会造成正常血管压迫或阻塞导致缺氧环境加重,但在缺氧微环境下恶性肿瘤仍可不断生长、浸润甚至发生转移,说明肿瘤细胞对缺氧具有很强的适应能力。缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)是1992年SEMENZA与WANG在低氧的肝癌细胞株Hep3 B细胞的核提取物中发现的一种蛋白质,由两个亚基组成的异二聚体:HIF-1α和HIF-1β,都具有二聚化所需的碱性螺旋-环-螺旋(basic-helix-loop-helix,bHLH)和PAS(PERARNT-SIM)结构域[1]。缺氧诱导因子1α(HIF-1α)既是HIF-1活性的调节亚基又是活性亚基,是目前发现的唯一的一个特异性缺氧状态下发挥活性的转录因子。已在多种恶性肿瘤及癌前病变中检测到HIF-1α蛋白的过度表达,但正常组织及良性病变中则无表达。环氧合酶(Cyclooxygenase,COX,)是分解花生四烯酸(arachidonic acid,AA),生成各种内源性前列腺素(Prostaglandins,PGs)过程中重要的限速酶。目前,人们认为COX至少有3种形式:COX-1,COX-2,COX-3[2]。COX-2属于反应基因,在静止细胞中不易被检测到。COX-2呈诱导性表达,在大多数正常组织中表达极少,而当细胞接受各种刺激如细胞因子、生长因子、癌基因及促肿瘤剂的诱导后表达上调,参与炎症及肿瘤的发生[3-5]。包括结肠癌[6],肝癌[7-8],胰腺癌[9]在内的多种肿瘤组织均发现有COX-2的高表达,并与肿瘤的发生、发展及预后密切相关。本实验采用免疫组织化学及RT-PCR方法检测HIF-1α和COX-2的蛋白和mRNA表达水平。按蛋白表达情况分组,探讨HIF-1α和COX-2共表达及非共表达组的生存率及生存时间的差异。探讨HIF-1α蛋白水平和COX-2 mRNA水平的相关性,或COX-2蛋白水平和HIF-1αmRNA水平的相关性,明确HIF-1α和COX-2可能存在的调节关系。
1 资料与方法
1.1临床资料
选取2003年9月~2012年2月确诊并行手术治疗的71例宫颈癌标本。所有病例临床资料完整,患者年龄23~77岁,平均年龄46.3岁。所有患者术前均未行放化疗,术后病理类型均为鳞癌,分期为Ⅰb~Ⅱb期。术后行放疗或放化疗。
1.2HIF-1α和COX-2免疫组织化学检测
1.2.1实验方法及步骤固定后洗涤、脱水、透明浸蜡包埋,5μm切片,60度30 min脱蜡2次。水化后抗原修复、阻断、封闭。然后加一抗,HIF-1α多克隆抗体浓度为1∶400、COX-2多克隆抗体浓度为1∶150,上述一抗均购自Abcam公司。4℃过夜,再加HRP标记二抗40 min;DAB染色3~10 min,苏木精复染,显微镜下观察。
1.2.2免疫组织化学结果判定采用病理图像系统分析每张切片随机取3个高倍视野(10×20),HIF-1α按细胞核或细胞浆呈棕黄色染色为阳性;COX-2以细胞质内出现棕黄色颗粒为阳性。免疫组织化学染色指数为染色面积与染色强度的乘积。
1.3RT-PCR检测宫颈癌组织HIF-1αmRNA与COX-2 mRNA的表达情况
Trizol试剂盒提取总RNA,紫外分光光度计测定RNA纯度(A260/250>1.8)。取总RNA 5μg,按逆转录反应试剂说明完成cDNA的合成。PCR扩增条件:95℃预变性10 min,95℃、15 s、60℃、45 s循环40次。取2μl PCR产物经1.2%琼脂糖凝胶电泳鉴定。数据采用仪器自带软件分析,ABI Prism 7500 SDS Software。见表1。

表1 扩增引物序列表
1.4统计学方法
采用SPSS 22.0统计软件进行数据分析,计数资料用χ2检验,计量资料采用相关分析,生存分析采用Kaplan-Meier统计学分析及COX回归分析。
2 结果
2.1免疫组织化学结果
HIF-1α阳性表达的宫颈癌标本细胞成团分布,细胞质浓染,呈棕黄色染色,见图1。71例宫颈癌组织中41例HIF-1α阳性,阳性率57.8%。COX-2阳性表达的宫颈癌标本细胞成团分布,细胞质浓染,呈棕黄色染色,见图2。71例宫颈癌组织中53例COX-2阳性,阳性率74.6%。71例宫颈癌组织中HIF-1α与COX-2共表达33例,共表达率46.5%。
2.2HIF-1α和COX-2共表达对生存率的影响
根据HIF-1α和COX-2的表达情况分为4组:1组,HIF-1α 阴性,COX-2阴性组;2组,HIF-1α阴性,COX-2阳性组;3组,HIF-1α阳性,COX-2阴性组;4组,HIF-1α阳性,COX-2阳性组。各组的存活率见表2,经χ2检验各组3年存活率有显著性差异,P<0.05。经行×列χ2分割分析,HIF-1α和COX-2共表达组即4组的3年存活率显著低于另外3组,Pearsonχ2=7.289,P=0.007;而非共表达的3组间3年存活率差异无统计学意义。
2.3生存时间的影响因素
根据HIF-1α和COX-2的表达情况分为4组:1组,HIF-1α阴性,COX-2阴性组;2组,HIF-1α阴性,COX-2阳性组;3组,HIF-1α阳性,COX-2阴性组;4组,HIF-1α阳性,COX-2阳性组。以上4组K-M生存曲线见图3,Breslowχ2=9.845,P=0.02,提示按免疫组织化学不同分组的生存分布差异有统计学意义。按患者年龄分组,以45岁为划分标准,按年龄<45岁组与龄≥45岁组对生存生存时间的影响,做Kaplan-Meier统计学分析,Breslowχ2=0.027,P=0.870,提示不同年龄分组的生存分布差异无统计学意义。按患者临床分期进行Kaplan-Meier统计学分析,了解临床分期对患者生存时间的影响,Breslow χ2=8.482,P=0.014,提示不同临床分期的生存分布差异有统计学意义。采用COX回归模型分析影响患者生存分布的危险因素。多因素回归分析提示患者临床分期及HIF-1α和COX-2免疫组织化学表达情况分别是独立的预后因素,见表3。
2.4HIF-1α和COX-2 mRNA的表达情况
HIF-1αmRNA和COX-2 mRNA的扩增动力曲线见图4。COX-2 mRNA在宫颈癌组织中的表达水平与分期有关,Ⅱ期宫颈癌组织的表达水平显著高于Ⅰ期宫颈癌患者。
2.5HIF-1α蛋白水平和COX-2 mRNA表达的相关性
免疫组织化学指数反映蛋白的表达水平,mRNA含量反应了mRNA的表达水平。在Ⅱ期宫颈癌中,HIF-1α蛋白水平和COX-2 mRNA的表达水平呈显著正相关,r=0.594,P<0.05。而在Ⅰ期宫颈癌组织中两者相关性不明显。可能与Ⅱ期宫颈癌组织乏氧状况更明显有关。
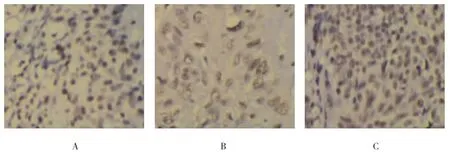
图1 HIF-1α阳性表达情况 (SP×200)
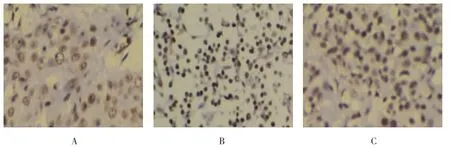
图2 COX-2阳性表达情况 (SP×200)
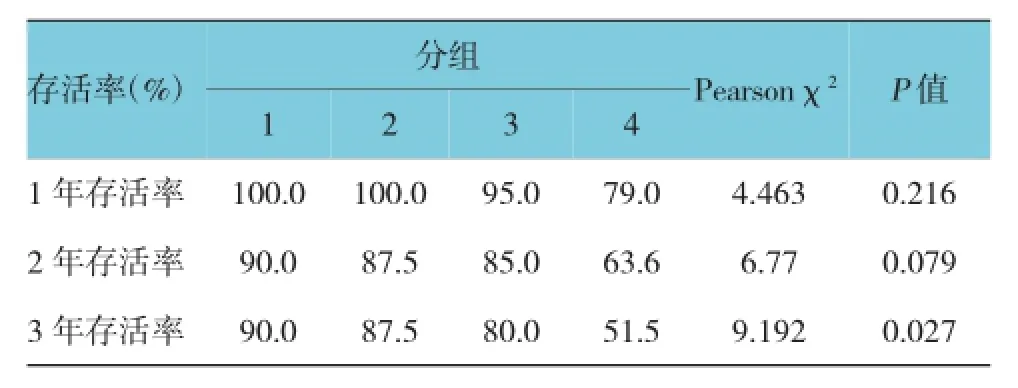
表2 各组存活率的比较
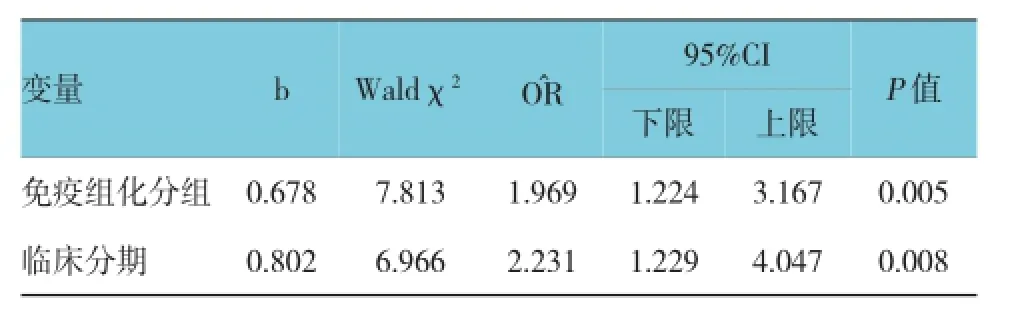
表3 COX模型筛选的危险因素及参数估计
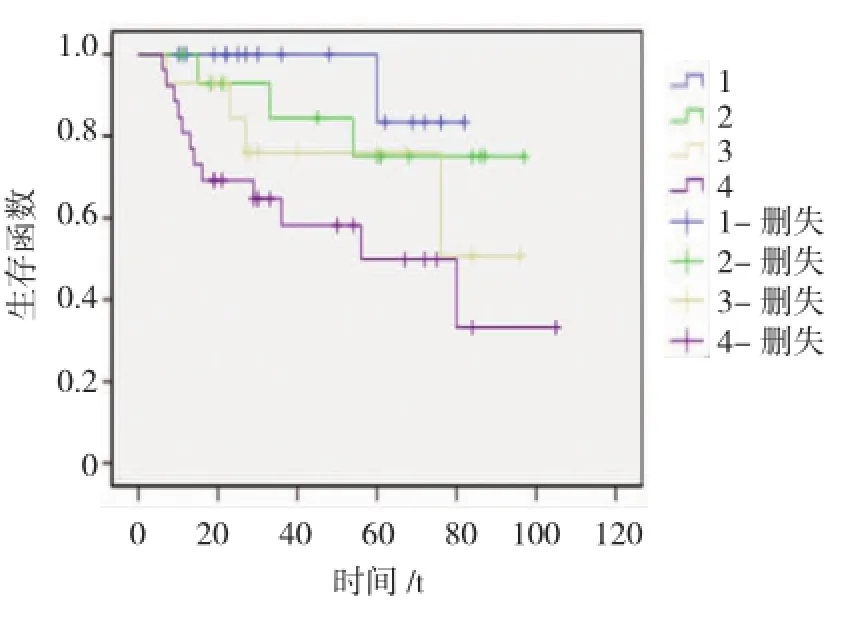
图3 不同免疫组织化学分组的Kapplan-meire生存曲线
图4 mRNA扩增动力曲线
3 讨论
恶性实体肿瘤由于增长迅速,经常会常出现缺氧的微环境,缺氧是恶性肿瘤治疗效果差,容易出现放化疗耐受性的常见原因之一。CHOI等[10]认为在肿瘤发生早期即可发生HIF-1的过度表达,并且HIF-1的过度表达与肿瘤血管形成、侵袭转移能力有关。正常氧分压下,细胞内HIF-1α不稳定,经泛素一蛋白酶体等途径迅速降解。缺氧时,胞质中HIF-1α稳定性增加,降解受阻,积聚增多并转移到核内,与核内的HIF-β结合成二聚体,形成有活性的HIF-1,继而与缺氧反应基因结合,激活转录过程,引起一系列的细胞对缺氧的反应[11]。迄今为止,确定的受HIF-1调控的缺氧反应基因有70多种[12]。该产物涉及参与肿瘤细胞的能量代谢、增殖、凋亡、转移、耐药及血管扩张、血管新生等多个方面。COX-2属于反应基因,在静止细胞中不易被检测到。COX-2在上皮组织癌(包括胃癌、直结肠癌、前列腺癌、肺癌、胰腺癌、乳腺癌、头颈部肿瘤等)中普遍存在过度表达现象,并影响患者的预后[13]。COX-2介导的生物学效应涉及肿瘤血管新生、细胞的增殖和凋亡、促进肿瘤细胞迁移,细胞黏附和肿瘤侵袭等。有资料显示HIF-1α,COX-2表达情况与患者预后有关。本实验资料显示,HIF-1α和COX-2共表达组的1年,2年,3年存活率均低于非共表达组;HIF-1 α和COX-2共表达组的存活时间显著低于非共表达组,并且HIF-1α和COX-2共表达可以作为一个独立的预后因素。两者共表达预后较差,可能与两者共同促进肿瘤的恶性行为有关。
对于HIF-1α和COX-2的关系,STASINOPOULOS等[14]认为COX-2可通过其催化产物PGE2激活HIF-1α活性以促进肿瘤血管生成。TAMMALI等[15]提出COX-2/PGE2/HIF-1α/VEGF途径可能是COX-2促进肿瘤血管生成的又一条途径。LIM等[16]通过研究发现,COX-2选择性抑制剂NS398通过COX-2/PGE2途径抑制HIF-1αmRNA的表达,减少HIF-1α的合成,从而抑制缺氧诱导的血管生成。JUNG等[17]的研究显示,HIF-1是关联炎症和癌变过程的一个重要转录因子,IL-1诱导活化NFKB/COX-2途径,上调HIF-1α蛋白的表达,并最终上调VEGF的表达,促进肿瘤血管生成。STASINOPOULOS等[14]发现PGE-2可以增强丝裂原活化激酶(MAPK)的活性,从而加速HIF-1α翻译转录和在核内的积聚。上述研究均表明,COX-2可调控HIF-1α蛋白的表达。但也有学者持不同意见,认为COX-2是HIF-1α下游的靶基因之一,受缺氧的诱导活化[18]。CSIKI等[19]的最新的研究通过对缺氧反应基因序列的比较,COX-2启动子缺失分析和定向诱变,证实在COX-2启动子内存在缺氧反应元件(hypoxia-responsive element,HRE),通过其与HIF-1α的结合,激活肺癌细胞中COX-2的表达。本组资料显示,HIF-1α和COX-2 mRNA的表达呈正相关(rs=0.594,P<0.05),因此可以推断,COX-2 mRNA的表达受HIF-1α水平的调控。HIF-1α可能通过与COX-2启动子内存在缺氧反应元件(HRE)结合,促进COX-2的转录。从而认为COX-2是HIF-1α下游的靶基因之一。HIF-1α蛋白可能正向调控COX-2 mRNA的表达。
[1]OGAWA,KAZUHIKO,CHIBA,et al.Clinical significance of hiflalpha expression in patients with esophageal cancer treated with concurrent chemoradiotherapy[J].Anticancer Research,2011,31(6): 2351-2359.
[2]STASINOPOULOS I,SHAH T,PENET M F,et al.COX-2 in cancer:Gordian knot or Achilles heel[J].Frontiers in Pharmacology,2013,4:1-7.
[3]PENG L,PENG Z,XIN L,et al.Micro ribonucleic acid(RNA)-101 inhibits cell proliferation and invasion of lung cancer by regulating cyclooxygenase-2[J].Thoracic Cancer,2015,6(6):778-784.
[4]YONG P,YAN J,LIN T,et al.Deletion of cyclooxygenase-2 inhibits K-ras-induced lung carcinogenesis[J].Oncotarget,2015,6(36):38816-38826.
[5]TOOMEY D P,MURPHY J F,CONLON K C.COX-2,VEGF and tumour angiogenesis[J].Surgeon Journal of the Royal Colleges of Surgeons of Edinburgh&Ireland,2009,7(7):174-180.
[6]WU Q B,SUN G P.Expression of COX-2 and HER-2 in colorectal cancer andtheir correlation[J].World Journal of Gastroenterology,2015,21(20):6206-6214.
[7]OU C,ZHENG H P,SU J J,et al.Effect of Ginkgo biloba extract on the expressions of Cox-2 and GST-Pi in rats with hep atocellular carcinoma risk[J].African Health Sciences,2014,14(1): 37-48.
[8]YANG Y,ZHU J,GOU H,et al.Clinical significance of Cox-2,survivin and Bcl-2 expression in hepatocellular carcinoma(HCC)[J]. Medical Oncology,2011,28(3):796-803.
[9]MA J X,SUN Y L,WANG Y Q,et al.Triptolide induces apoptosis and inhibits the growth and angiogenesis of human pancreatic cancer cells by downregulating COX-2 and VEGF[J].Oncology Research Featuring Preclinical&Clinical Cancer Therapeutics,2013,20(8):359-368.
[10]CHOI J Y,JANG Y S,MIN S Y,et al.Overexpression of MMP-9 andHIF-1alpha in breast cancer cells under hypoxic conditions[J].Journal of Breast Cancer,2011,14(2):88-95.
[11]SHEN R J,JIANG X Y,PU J W,et al.HIF-1 alpha and-2 alpha genes in a hypoxia-sensitive teleost species megalobrama amblycephala:cDNA cloning,expression and different responses to hypoxia.[J].Comparative Biochemistry&Physiology Part B Biochemistry&Molecular Biology,2010,157(3):273-280.
[12]MASOUD G N,WEI L.HIF-1α pathway:role,regulation and intervention for cancer therapy[J].Acta Pharmaceutica Sinica B,2012,3(12):53-54.
[13]JANA D,SARKAR D K,GANGULY S,et al.Role of cyclooxygenase 2(COX-2)in prognosis of breast cancer[J].Indian Journal of Surgical Oncology,2014,5(1):59-65.
[14]STASINOPOULOS I,O'BRIEN D Z.Inflammation,but not hypoxia,mediated HIF-1alpha activation depends on COX-2.[J]. Cancer Biology&Therapy,2009,8(1):31-35.
[15]TAMMALI R,SAXENA A,SRIVASTAVA S K,et al.Aldose reductase inhibition prevents hypoxia-induced increase in hypoxia-inducible factor-1alpha(HIF-1alpha)and vascular endothelialgrowthfactor(VEGF)byregulating26Sprotea some-mediated protein degradation in human colon cancer cells.[J]. Journal of Biological Chemistry,2011,286(27):24089-24100.
[16]LIM W,RARK C,SHIM M K,et al.Glucocorticoids suppress hypoxia-induced COX-2 and hypoxia inducible factor-1α expression through the induction of glucocorticoid-induced leucine zipper[J].BritishJournalofPharmacology,2014,171(3): 735-745.
[17]JUNG Y J,ISAACS J S,LEE S,et al.IL-1 beta-mediated up-regulation of HIF-1 alpha via an NF kappa B/COX-2 pathway identifies HIF-1 as a critical link between inflammation and oncogenesis[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2003,17(14):2115-2117.
[18]LEE J J,MITSUTERU N,SHINYA O,et al.Hypoxia activates the cyclooxygenase-2-prostaglandin E synthase axis[J].Carcinogenesis,2010,31(3):427-34.
[19]CSIKI I,YANAGISAWA K,HARUKI N,et al.Thioredoxin-1 modulatestranscriptionofcyclooxygenase-2viahypoxia-inducible factor-1 in non-small cell lung cancer[J].Cancer Research,2006,66(1):143-150.
(张蕾编辑)
Influence of the coexpression of HIF-1α and COX-2 on prognosis of patients with cervical cancer in stageⅠand stageⅡand possible functional mechanism*
Ai-hua Luo,Da-li Feng,Juan Fu,Xin Li
(Department of Chemo-irradiation Oncology,Yichang Second People's Hospital,Yichang,Hubei 443000,China)
Objective To investigate the influence of the coexpression ofHIF-1αandCOX-2on the prognosis of patients with cervical cancer in stageⅠ and stageⅡ and the possible functional mechanism.Methods The coexpressions ofHIF-1αandCOX-2were detected in 71 cases with cervical cancer by immunohistochemical.The levels ofHIF-1αmRNA andCOX-2mRNA were detected by RT-PCR.Chi-squared test was used to analyze the differences of survival rate from one year to three year in different groups;KM survival analysis was used for the survival time in different groups;correlation analysis was used to analyze the correlation between protein and mRNA level.Results The survival rate of three year in the group of coexpression ofHIF-1αandCOX-2was significantly lower than that in the non-coexpression group(P<0.05).The survival time in the group of coexpression ofHIF-1α andCOX-2was significantly shorter than that in the non-coexpression group(P<0.05).There was a positive correlation between theHIF-1αprotein level and theCOX-2mRNA level in the patients with cervical cancer in stageⅡ(rs=0.594,P<0.05).Conclusions The prognosis is poorer in the group of coexpression ofHIF-1αand COX-2of patients with cervical cancer in stageⅠ and stageⅡ than the non-coexpression group.TheHIF-1αprotein may upregulate the level ofCOX-2mRNA.
cervical cancer;HIF-1α;COX-2;coexpression;survival analysis
R737.33
A
10.3969/j.issn.1005-8982.2016.16.014
1005-8982(2016)16-0067-05
2016-04-14
宜昌市医疗卫生科研项目(No:A14301-31)[通信作者]李欣,E-mail:lixinyc5189@163.com
