核黄素抑制大鼠缺血性脑损伤
2016-08-29阮名花邹赢锌储智勇
阮名花,邹赢锌,栾 洁,储智勇
(1.江西中医药大学,江西 南昌 330004;2.海军医学研究所,上海 200433)
核黄素抑制大鼠缺血性脑损伤
阮名花1,邹赢锌2,栾洁2,储智勇2
(1.江西中医药大学,江西 南昌330004;2.海军医学研究所,上海200433)
doi:10.3969/j.issn.1001-1978.2016.08.017
目的探讨核黄素对缺血性脑损伤的保护作用及其机制。方法在体实验,采用SD ♂大鼠,随机分为对照组、模型组和核黄素组。核黄素组大鼠腹腔注射核黄素1 mg·kg-1,连续7 d后,模型组和核黄素组大鼠用线栓法制作大脑中动脉栓死(middle cerebral artery occlusion,MCAO)模型。术后24 h,用2,3,5-氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)检测脑梗死面积、称重法检测脑水肿状况、电镜观察缺血处脑皮层超微结构变化。离体实验采用原代培养的大鼠脑皮层神经元制备氧糖剥夺(oxygen and glycose deprivation,OGD)模型。用噻唑蓝[3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide,MTT]法检测OGD后神经元活力、电镜观察神经元超微结构变化。大鼠经MCAO模型24 h后,对脑组织中的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的酶活力进行测定。结果核黄素明显减少MCAO引起的脑梗死面积(P<0.01)、抑制脑水肿(P<0.01)、抑制亚细胞结构损伤;核黄素明显保护神经元OGD后的细胞活力(P<0.01)和亚细胞结构。核黄素明显提高铜锌SOD(Cu-ZnSOD,SOD1)、GSH-Px和CAT的酶活力(P<0.01);而对锰SOD(Mn-SOD,SOD2)的酶活力无影响。结论核黄素对大鼠缺血性脑损伤具有保护作用,其作用机制包括保护缺血时脑组织的抗氧化酶活力。
核黄素;大鼠;缺血性脑损伤;大脑中动脉栓死;氧糖剥夺模型;神经元;抗氧化酶
核黄素是人体必需的维生素之一,人体不能合成,只能从外界获取。近年来研究发现核黄素与人类癌症、心脑血管病、糖尿病等多种疾病密切相关。研究显示,人脑卒中后处于核黄素缺乏的状态[1]。核黄素激酶功能低下与脑卒中发生密切相关[2]。但文献中关于核黄素与缺血性脑损伤的关系局限于核黄素参与叶酸[3]、同型半胱氨酸[4]等的代谢,进而间接抑制缺血性脑损伤;我们前期报道了核黄素抑制缺血后神经细胞凋亡,进而抑制缺血性脑损伤[5]。本研究旨在研究核黄素对缺血性脑损伤的保护作用及其抗氧化应激机制。
1 材料
1.1实验动物清洁级SD大鼠,体质量180~200 g,购买于上海西普尔-必凯实验动物有限公司,动物许可证号:SCXK(沪)2013-0016。大鼠自由摄食摄水,饲养于温度为22℃、相对湿度70%、8 ∶00~20 ∶00照明的环境中。
1.2仪器大脑中动脉栓死(middle cerebral artery occlusion,MCAO)模型硅胶栓线(北京沙东生物制药有限公司),TB-214型电子天平(北京赛多利斯仪器系统有限公司),三气培养箱(Thermo scientific),酶标仪(Thermo scientific),T6型新世纪紫外-可见分光光度计(北京普析通用仪器有限责任公司),透射电子显微镜(日本日立公司),SW-CJ-IBH超净台(苏净集团安泰公司)。
1.3试剂核黄素(Sigma,货号R9504);DMEM培养液(Hyclone);2,3,5-氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)(国药集团化学试剂有限公司);噻唑蓝[3-(4,5-dimethylthiazol-2yl)-2,5-diphenyltetrazolium bromide,MTT](国药集团化学试剂有限公司);特制不含核黄素DMEM培养液(Gibco公司定制);多聚赖氨酸(Sigma公司);L-谷氨酰胺(Gibco公司);B27神经元生长因子(Gibco公司);Neurobasal(Gibco公司);超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxide,GSH-Px)试剂盒、蛋白测定试剂盒,均购买于南京建成生物有限公司。
2 方法
2.1分组与给药在体实验,选取体质量180~200 g的SD大鼠,随机分成3组:对照组、模型组、核黄素组。核黄素组大鼠每天腹腔注射核黄素1 mg·kg-11次,连续7 d。离体实验以原代培养至7~10 d的神经元为研究对象,将神经元随机分为对照组、模型组、核黄素各剂量组(0.85、3.1、12.6、300.6 nmol·L-1)。核黄素剂量的设计理由如下[5]:① 0.85 nmol·L-1,代表严重缺乏核黄素的人体血浆中核黄素浓度;② 3.1 nmol·L-1,代表中度缺乏核黄素的人体血浆中核黄素浓度;③ 12.6 nmol·L-1,代表正常人体血浆中核黄素浓度;④ 300.6 nmol·L-1,代表补充核黄素后的人体血浆中核黄素浓度。
2.2MCAO模型制备大鼠用10%水合氯醛溶液腹腔注射麻醉(3 mL·kg-1体质量)。固定消毒,剃掉喉颈部被毛,沿颈部正中线切口,钝性分离皮下组织,沿大鼠左侧找到胸锁乳突肌肌腱,找到颈内动脉鞘,分离动脉鞘,可见光滑的颈总动脉,向头端可见颈外动脉、颈内动脉,结扎颈外动脉近头端、颈总动脉近心端,在颈总动脉开小口,将栓线从颈总动脉插入颈内动脉直到大脑前动脉处,以造成大脑中动脉处局部缺血,模拟人脑卒中病理状态。将颈内动脉、颈外动脉和颈总动脉结扎缝合伤口。大鼠醒后再次给药,24 h后进行神经功能缺失体征评分以判断手术模型是否成功。
2.3脑组织2,3,5-氯化三苯基四氮唑(TTC)染色SD大鼠24只,分组和给药同“2.1”,每组8只。MCAO手术24 h后大鼠麻醉、断头取脑,保持大脑的完整性。将脑组织进行每片2 mm冠状切片,共6片。将切片置于预先配制好的浓度为2% TTC染色液中,避光放入37℃恒温孵育30 min。4%多聚甲醛固定1 h。TTC染色后,正常脑组织呈玫瑰红色,梗死脑组织未被染色而呈白色。脑切片充分染色后取出排列整齐,拍照保存。TTC与正常组织中的脱氢酶反应而显现红色,缺血组织内因脱氢酶活性下降而不产生变化。用Image J 1.4图像分析系统计算梗死面积及全脑总面积。梗死面积百分比以所占脑片总面积的百分率(%)表示。
2.4脑水肿测定选取SD大鼠27只,分组和给药同“2.1”,每组9只。MCAO模型制备24 h后取大鼠手术侧半脑组织,去除延髓、小脑后称重。
2.5脑皮层超微结构观察SD大鼠9只,分组和给药同“2.1”,每组3只。MCAO手术24 h后取大鼠梗死侧脑中动脉附近皮层,以4%多聚甲醛4℃固定过夜;用磷酸缓冲液漂洗3次,每次5~10 min;用1%锇酸固定1.5 h;再次漂洗3次;分别用30%、50%、70%、85%、95%、100%乙醇脱水封片,每步5~10 min;用丙酮加环氧树脂包埋;加热聚合;超薄切片;柠檬酸进行双重染色;最后用超微电镜观察拍照。
2.6原代神经元培养细胞培养板用0.1 g·L-1多聚赖氨酸包被过夜。剖取孕期为16~19 d的胎鼠大脑皮层,仔细剥除脑膜和血管;剥离的皮层组织转入新鲜预冷的高糖DMEM中漂洗2次;用眼科剪尽量剪碎;将组织块转移到含有37℃预热的10 mL 0.125%胰蛋白酶的锥形瓶中,置于37℃的CO2培养箱消化10~15 min;加入10% FBS终止消化;1 500 r·min-1离心3 min,弃上清;加入接种培养基[DMEM+20% FBS+1%青链霉素混合液(100×)],轻轻吹打,200目筛网过滤;调整细胞密度为1×109·L-1种板,记为原代接种d 0;种板后24 h更换神经元生长培养基[Neurobasal+2% B27+25 μmol·L-1L-谷氨酰胺+1%青链霉素混合液(100×)];每3 d更换1次新鲜培养基;d 7~10,可以进行实验处理。
2.7氧糖剥夺(OGD)模型制备神经元细胞用PBS清洗2次;加入高糖Krebs溶解的相应药物,37℃的5% CO2恒温孵育箱作用2 h;取出细胞PBS清洗2次;加入无糖Krebs液溶解的相应药物,放入37℃通以94% N2、5% CO2、1% O2的混合气体的三气培养箱,稳定15 min后开始计时,持续作用2 h,模拟神经元缺糖缺氧状态。模型结束后立即进行相关实验处理和测定,以免细胞氧复吸。
2.8细胞活力检测采用MTT比色法。在待测的96孔神经元细胞培养液中加入5 g·L-1的MTT溶液20 μL;混匀后,于37℃恒温孵育4 h;吸除培养液,每孔加入150 μL的DMSO;震荡溶解后于490 nm处测定吸光值。以模型组吸光值为1.0计。
2.9离体神经元超微结构观察神经元细胞用PBS清洗2次;胰酶消化收集细胞;1 500 r·min-1离心3 min,吸弃上清,把细胞团块转移至EP管内,以4%多聚甲醛4°C固定过夜;用磷酸缓冲液漂洗3次,每次5~10 min;用1%锇酸固定1.5 h;再次漂洗3次;分别用30%、50%、70%、85%、95%、100%乙醇脱水封片,每步5~10 min;用丙酮加环氧树脂包埋;加热聚合;超薄切片;柠檬酸进行双重染色;最后用超微电镜观察拍照。
2.10抗氧化酶活性测定取MCAO大鼠缺血侧脑组织按1 ∶9(g·mL-1)的比例加入生理盐水在冰浴下匀浆,4℃、2 500 r·min-1离心20 min,取上清。采用南京建成生物有限公司的试剂盒按说明书操作,通过公式计算出待测样品中的SOD、CAT、GSH-Px的活力。
3 结果
3.1核黄素抑制MCAO后大鼠脑梗死由Fig 1可见,大鼠MCAO术后24 h,模型组大鼠脑梗死明显;而核黄素组大鼠的脑梗死面积相比模型组明显减小(P<0.01),提示核黄素抑制MCAO引起的大鼠脑梗死。
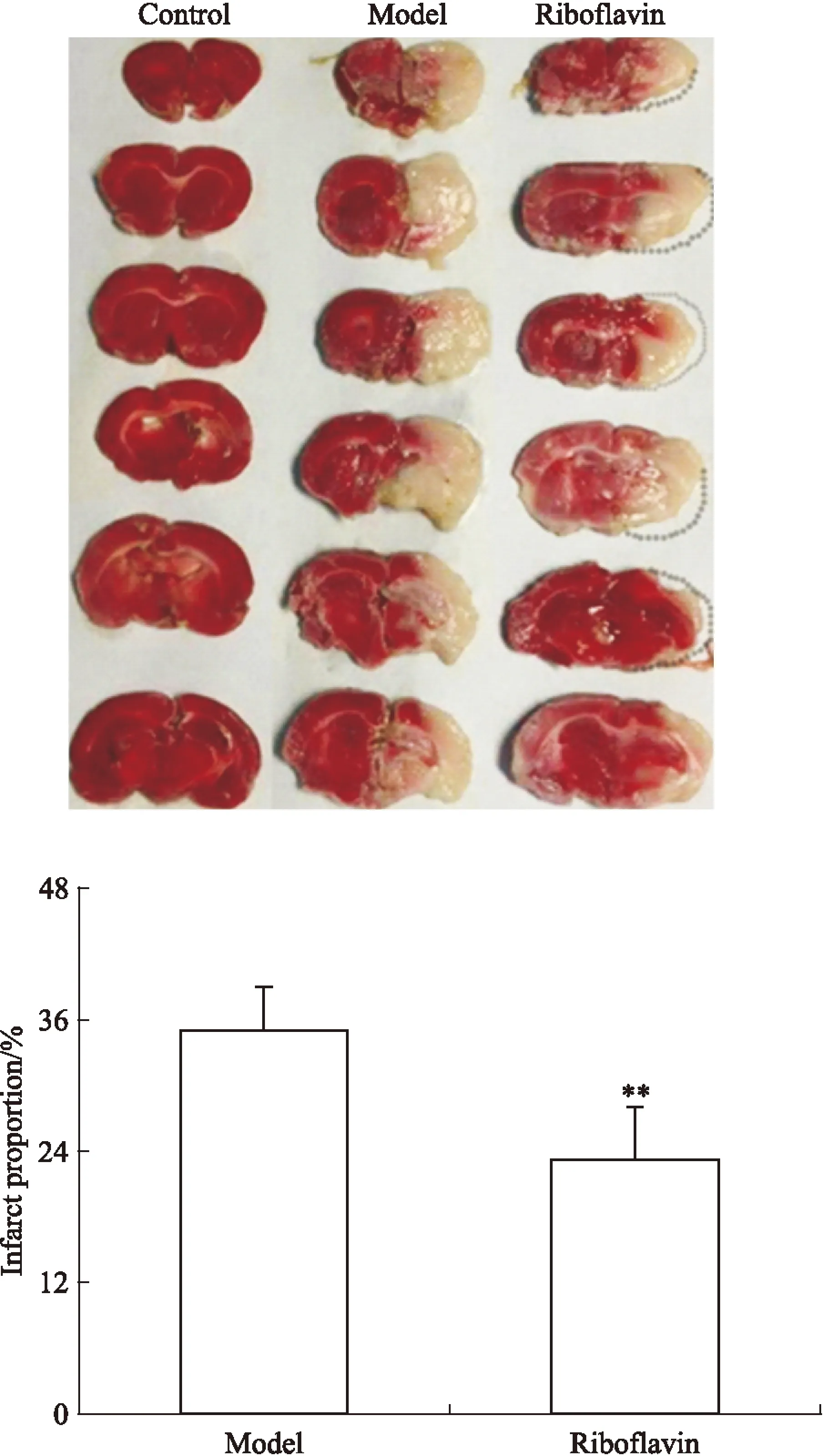
Fig 1 Riboflavin inhibited cerebral infarction in rats induced by MCAO(n=8)
**P<0.01vsmodel
3.2核黄素抑制MCAO后大鼠脑水肿由Fig 2可见,大鼠MCAO术后24 h,与对照组相比,模型组大鼠梗死侧脑组织重量明显升高,提示水肿严重(P<0.01);而核黄素组大鼠的梗死侧脑组织重量相比模型组明显降低(P<0.01),提示核黄素明显抑制MCAO引起的大鼠脑水肿。
3.3核黄素抑制MCAO后大鼠脑皮层超微结构损伤由Fig 3可见,对照组大鼠脑皮层的突触泡正常,细胞核染色质均匀分布,线粒体轮廓清晰;而模型组则胞质严重脱落,核染色质聚集,突触泡扩大明显,整个细胞以及细胞核都呈现收缩状态;核黄素组损伤有明显改善,细胞器丰富,线粒体轮廓清楚无肿胀,突触泡正常,核染色质分布均匀,提示核黄素对MCAO引起的大鼠脑皮层亚细胞结构损伤具有明显的抑制作用。
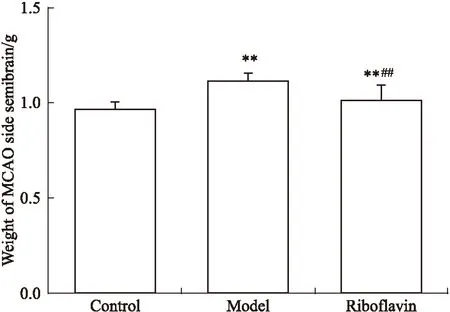
Fig 2 Riboflavin inhibited brain edema in rats induced by MCAO(n=9)
**P<0.01vscontrol;##P<0.01vsmodel
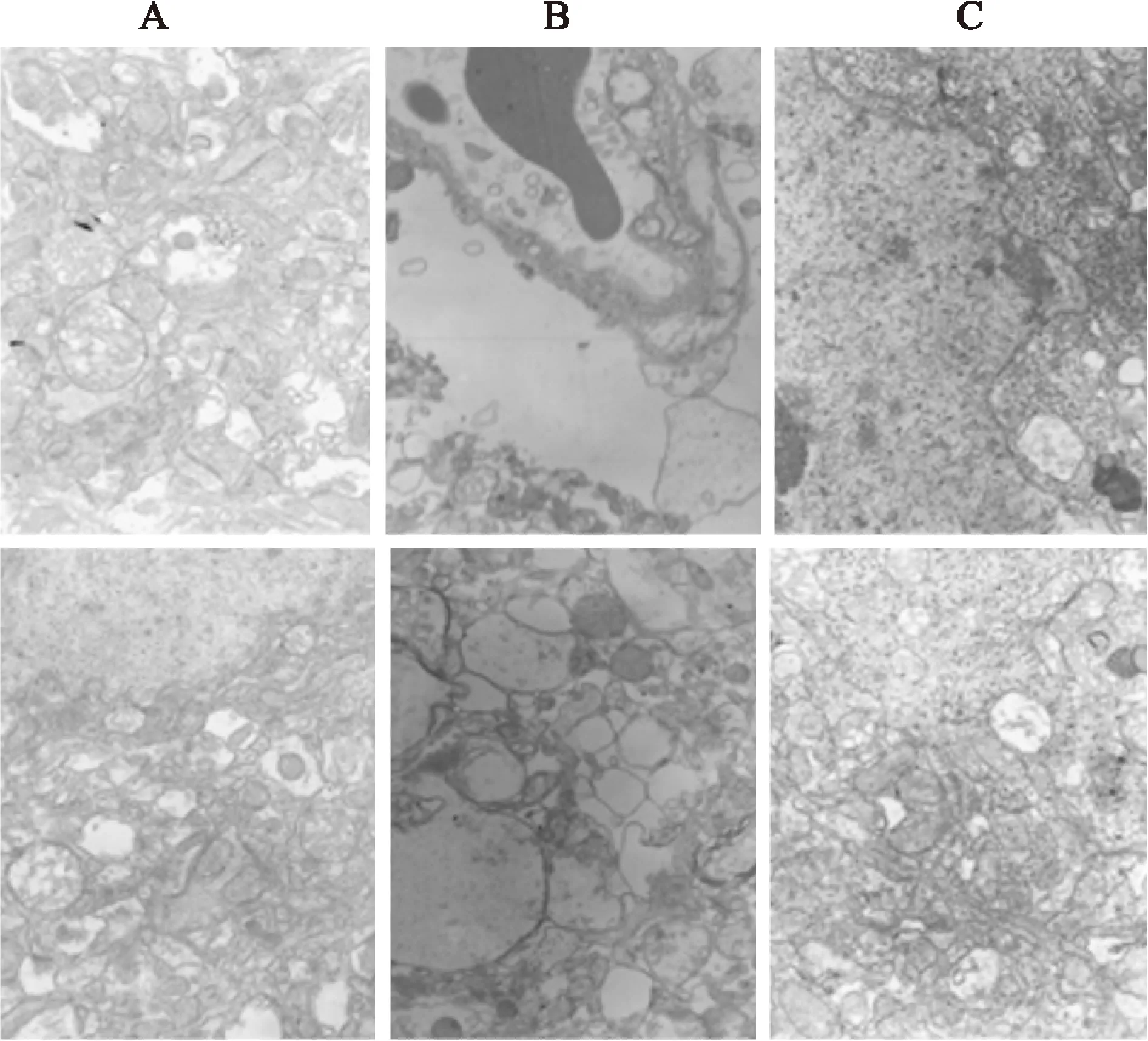
Fig 3 Riboflavin inhibited ultrastructural injury in rats induced by MCAO(10 000×)
A:Control;B:Model;C:Riboflavin
3.4核黄素抑制OGD诱导的神经元细胞活力下降由Fig 4可见,与OGD模型组相比,核黄素组的神经元活力均明显提高,差异具有统计学意义(P<0.01)。3.1 nmol·L-1核黄素组与0.85 nmol·L-1核黄素组相比,神经元活力提高明显;3.1、12.6、300.6 nmol·L-1核黄素对神经元活力的保护作用接近最高值,不再有明显的上升趋势。
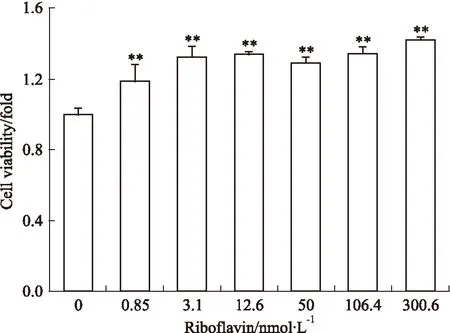
Fig 4 Riboflavin inhibited cell viability decreasing in neurons induced by OGD(n=8)**P<0.01 vs control
3.5核黄素抑制OGD诱导的神经元超微结构损伤由Fig 5可见,对照组神经元核大而圆,核染色质分布均匀,细胞结构丰富;模型组细胞量减少,凋亡趋势明显,核染色质边集化,突触泡扩张,染色质裂解,胞质内线粒体空泡化,细胞呈皱缩状;核黄素给药后细胞状态比模型组好,核轮廓清楚,染色质分布均匀,胞质中突触泡轻度扩张。此离体实验结果再次表明核黄素对缺血性神经元具有保护作用。
3.6核黄素保护MCAO后大鼠脑抗氧化酶活性由Fig 6可见,与对照组相比,模型组大鼠脑组织中SOD、铜锌SOD(Cu-ZnSOD,SOD1)、CAT、GSH-Px活力值明显降低(P<0.01),提示缺血性脑损伤后抗氧化酶的活力明显下降;与模型组相比,核黄素组脑组织中SOD、SOD1、CAT、GSH-Px活力明显升高(P<0.01),提示核黄素对缺血后脑组织中抗氧化酶活力具有明显的保护作用;而锰SOD(Mn-SOD,SOD2)的活力在各组间差异未见显著性。
4 讨论
核黄素在机体中有递氢作用,是机体一些重要的氧化还原酶的辅酶,参与组织的呼吸过程。已发现160多种含有核黄素的酶,它们多参与体内生物氧化、呼吸链代谢等。美国《心脏病杂志》曾报道:补充B族维生素尤其是核黄素,会减低脑卒中、心肌梗死等疾病的发病率[6]。但是尚没有文献报道核黄素与缺血性脑损伤的直接关系。
为了观察核黄素对缺血性脑损伤是否有保护作用,我们通过在体和离体两方面进行了实验研究。在体实验选用大鼠MCAO模型[7],结果发现核黄素明显抑制MCAO引起的脑梗死面积、脑水肿、亚细胞结构损伤;离体实验选用原代培养神经元OGD模型,结果发现核黄素明显保护神经元OGD后的细胞活力和亚细胞结构。这些结果从在体和离体两方面证明了核黄素对缺血性脑损伤具有明显的抑制作用。
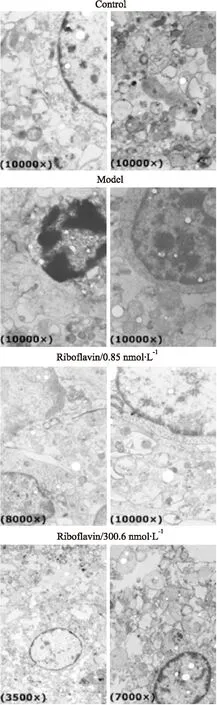
Fig 5 Riboflavin inhibited subcellular structure injury in neurons induced by OGD
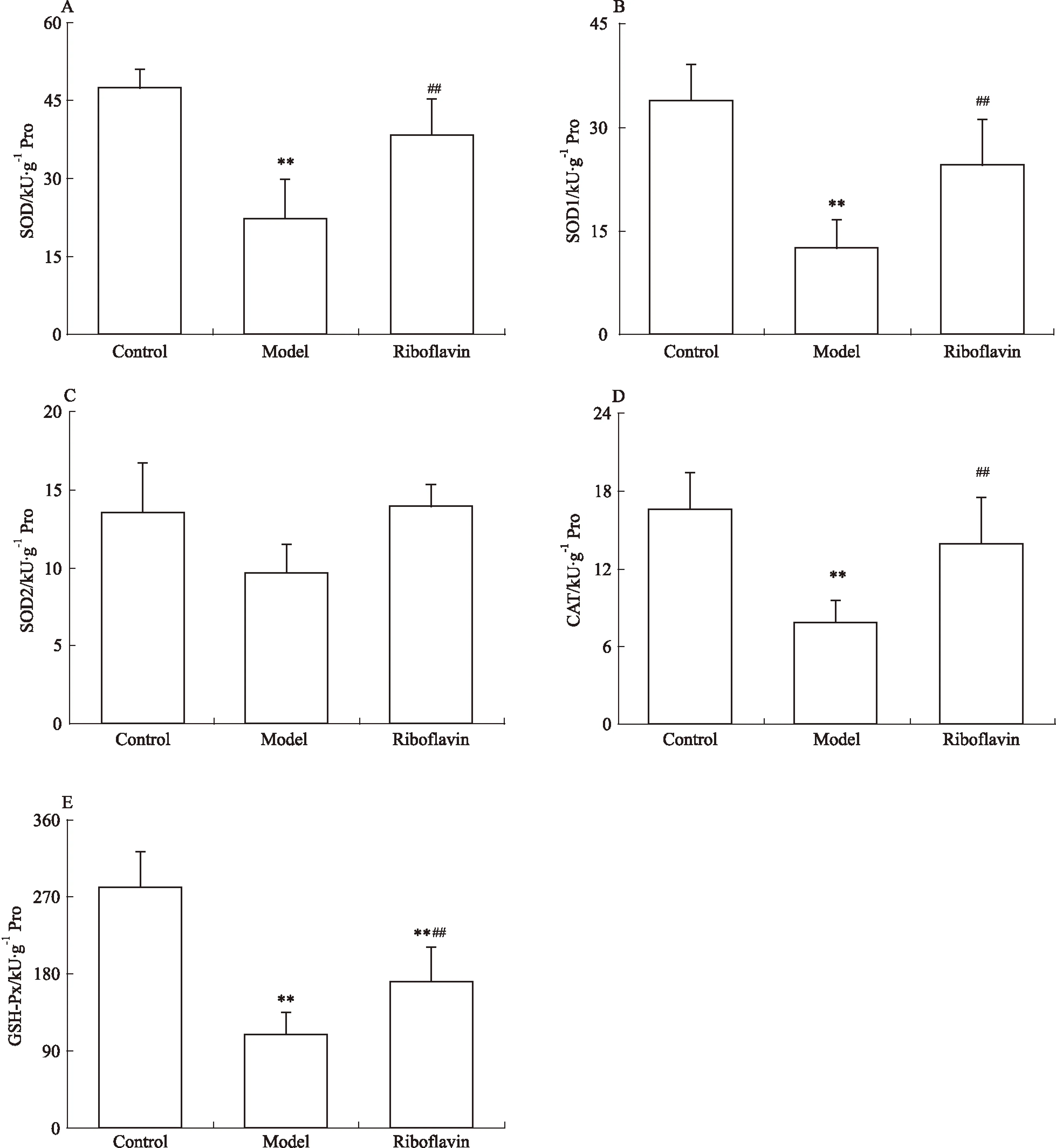
Fig 6Riboflavin protected anti-oxidant enzyme activity in rats after MCAO(n=6).
**P<0.01vscontrol;##P<0.01vsmodel
氧化应激被学术界广泛认为是缺血性脑损伤的机制之一[8],加之核黄素在体内主要参与氧化还原反应,那么核黄素对缺血性脑损伤的保护作用是否也有抗氧化应激的机制参与?氧化应激是体内自由基增多引起的,进而导致细胞结构和功能病变,最终导致细胞出现凋亡甚至坏死[9]。自由基是细胞正常代谢的中间产物。SOD、CAT、GSH-Px属于体内天然的抗氧化酶促防御系统[10]。SOD能清除超氧阴离子自由基[11],CAT能清除过氧化氢[12],GSH-Px能清除细胞质中的H2O2阻断脂质过氧化连锁反应[13]。我们通过对大鼠MCAO后脑组织中的酶活力进行检测发现,核黄素明显提高SOD1、GSH-Px和CAT的酶活力,提示核黄素对MCAO诱导的大鼠脑组织抗氧化酶活力下降具有明显的抑制作用。
此外,报道显示核黄素有良好的抗凝作用,对心脑血管疾病的防治作用优于阿司匹林[14];加之,核黄素无明显毒副作用[15],这些都为核黄素应用于缺血性脑损伤的防治提供了可行性。
总之,本课题研究通过在体和离体实验证明了核黄素对缺血性脑损伤的保护作用,这种保护作用的机制包括保护缺血后脑组织中的抗氧化酶SOD、GSH-Px和CAT的酶活性。基于此研究的核黄素抗缺血性脑损伤效应,提示核黄素在代谢中的角色及其缺乏与公共健康的关系值得深度探索。
(致谢:本实验在上海海军医学研究所防护医学研究室完成。感谢储智勇博士,邹赢锌博士,栾洁博士的帮助和指导。)
[1]Gariballa S,Ullegaddi R. Riboflavin status in acute ischemic stroke[J].EurJClinNutr, 2007, 61(10):1237-40.
[2]Betz A L,Ren X D,Ennis S R,Hultquist D E.Riboflavin reduces edema in focal cerebral ischemia[J].ActaNeurochirSuppl(Wien),1994,60:314-7.
[3]Ward M, Wilson C P, Strain J J, et al. B-vitamins, methylenetetrahydrofolate reductase(MTHFR) and hypertension[J].IntJVitamNutrRes, 2011, 81(4):240-4.
[4]Abdollahi A, Omranipour R. Is increase of homecysteine, anti-cardiolipin, anti-phospholipid antibodies associated with breast tumors[J].ActaMedIran,2015, 53(11):681-5.
[5]Zou Y X, Zhang X H, Su F Y, et al. Importance of riboflavin kinase in the pathogenesis of stroke[J].CNSNeurosciTher, 2012, 18(10):834-40.
[6]Shite J, Qin F, Mao W, et al.Antioxidant vitamins attenuate oxidative stress and cardiac dysfunction in tachycardia-induced cardiomyopathy[J].JAmCollCardiol,2001, 38(6):1734-40.
[7]葛建彬,顾锦华,李梅,等. 银杏内酯A对小鼠脑缺血/再灌注损伤的保护作用及其抑制NF-κB信号通路下调p53、Caspase-3表达的机制[J]. 中国药理学通报, 2012, 28(8):1105-10.
[7]Ge J B, Gu J H, Li M, et al. Neuroprotective effects of Ginkgo lide A on a mouse model of transient focal cerebral ischemia associated with inhibition of NF-κB signaling pathway and down regulation of the levels of P53 and Caspase-3[J].ChinPharmacolBull, 2012, 28(8):1105-10.
[8]Dong X,Zheng L,Lu S, Yang Y. Neuroprotective effects of pretreatment of ginsenoside Rb1 on severe cerebral ischemia-induced injuries in aged mice:involvement of anti-oxidant signaling[J].GeriatrGerontolInt,2015,Dec29.doi:10.1111/ggi.12699.
[9]Gong G,Xiang L,Yuan L, et al.Protective effect of glycyrrhizin,a direct HMGB1 inhibitor,on focal cerebral ischemia/reperfusion-induced inflammation,oxidative stress,and apoptosis in rats[J].PLoSOne,2014,9(3):e89450.
[10]Albuguergue R V, Malcher N S, Amado L L, et al.Invitroprotective effect and antioxidant mechanism of resveratrol induced by dapsone hydroxylamine in human cells[J].PLoSOne,2015,10(8):e0134768.
[11]Zhang S,Cao Y,Xie L, et al. Effect of superoxide dismutaseentrapped liposomes and protein transduction domain superoxide dismutase on human umbilical vein endothelial cells[J].MolMedRep, 2014, 9(4):1427-33.
[12]Tabassum R,Vaibhav K,Shrivastava P,et al. Perillyl alcohol improves functional and histological outcomes against ischemia-reperfusion injury by attenuation of oxidative stress and repression of COX-2, NOS-2 and NF-κB in middle cerebral artery occlusion rats[J].EurJPharmacol, 2015, 747:190-9.
[13]Hazini A, Cemek M, Ildak ⅰ, et al. Investigation of ischemia modified albumin, oxidant and antioxidant markers in acute myocardial infarction[J].PostepyKardiolInterwencyjnej, 2015, 11(4):298-303.
[14]Fiqueiredo J C,Levine A J,Grau M V, et al.Vitamins B2,B6,and B12 and risk of new colorectal adenomas in a randomized trial of aspirin use and folic acid supplementation[J].CancerEpidemiolBiomarkersPrev,2008,17(8):2136-45.
[15]Mack C,Hulquist D E,Shlafer M. Mycocardial flavin reductase and riboflavin:a potential role in decreasing reoxygenation injury[J].BiochemBiophysCommum,1995,212(1):35-40.
Riboflavin inhibited ischemia brain damage in rats
RUAN Ming-hua1,ZOU Ying-xin2,LUAN Jie2, CHU Zhi-yong2
(1.JiangxiUniversityofTraditionalChineseMedicine,Nanchang330004,China;2.NavalMedicalResearchInstitute,Shanghai200433,China)
AimTo investigate the protective effect of riboflavin on ischemia brain damage and the mechanism.MethodsTheinvivoexperiments were processed in male SD rats. Rats were randomly arranged into control group,model group and riboflavin group.The rats in riboflavin group were intraperitoneally injected riboflavin at the dose of 1 mg·kg-1for seven consecutive days.Then the rats in model and riboflavin groups were carried out middle cerebral artery occlusion(MCAO) operation.After 24 h, all rats were sacrificed and the brain tissue was dissected to observe the infarct area, the edema and the ultrastructure damage. The brain tissue was dyed by triphenyl tetrazolium chloride. The brain edema was observed by the weight of ischemia-side semi-brain. The ultrastructure was observed by electron microscope.Theinvitroexperiments were processed in primary culture neurons by exposed to oxygen and glycose deprivation(OGD).The viability of neurons was assayed by MTT method. The enzyme activity of superoxide dismutase(SOD), catalase (CAT) and glutathione peroxidase (GSH-Px) was assayed to explore the mechanism.ResultsRiboflavin significantly decreased the infarct area(P<0.01), inhibited the brain edema(P<0.01) and inhibited the ultrastructure damage in rats after MCAO;riboflavin protected the viability(P<0.01)and the ultrastructure of neurons exposed to OGD. The enzyme activity of antioxidant SOD1(P<0.01),CAT(P<0.01) and GSH-Px(P<0.01) was protected by riboflavin in MCAO model.No difference was found in the activity of SOD2. ConclusionRiboflavin inhibits ischemia brain damage, and the protection of the activity of antioxidants is involved in the mechanism.
riboflavin; rat;ischemia brain damage;middle cerebral artery occlusion;oxygen and glycose deprivation;neurons;antioxidase
2016-04-01,
2016-05-09
国家自然科学基金资助项目(No 81402922)
阮名花(1990-),女,硕士生,研究方向:药理学,E-mail:416978642@qq.com;
储智勇(1969-),男,博士,副研究员,研究方向:药理学,通讯作者,E-mail:zhiyongchuleader@163.com
A
1001-1978(2016)08-1115-07
R-332;R322.81;R346.32;R743.310.22;R977.22
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.034.html