褪黑素对人卵裂期胚胎发育的影响及机制研究
2016-08-27胡晓东熊风万才云李观贵黄丽施彭月婷孙青鲍忠剑曾勇
胡晓东,熊风,万才云,李观贵,黄丽施,彭月婷,孙青,鲍忠剑,曾勇
(深圳中山泌尿外科医院生殖中心,深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所,深圳 518045)
·实验研究·
褪黑素对人卵裂期胚胎发育的影响及机制研究
胡晓东,熊风,万才云,李观贵,黄丽施,彭月婷,孙青,鲍忠剑,曾勇*
(深圳中山泌尿外科医院生殖中心,深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所,深圳518045)
目的探讨褪黑素对人第3天(D3)卵裂期胚胎发育成囊胚的影响及其作用机制。方法收集2012年10月至2014年10月在本中心行IVF-ET助孕治疗患者捐赠的D3玻璃化冷冻胚胎,复苏后存活率100%且未发生卵裂球溶解的胚胎纳入研究(n=143),随机分为褪黑素组(培养液中加入1×10-7mol/L褪黑素,n=71)和对照组(不添加褪黑素,n=72)。两组胚胎均放于37℃、5%CO2培养箱中培养72 h,统计囊胚及优质囊胚形成率;采用鲁米诺化学发光法检测培养液中总活性氧(ROS)水平;实时荧光定量PCR法分析抗氧化酶类基因CAT、GPx、SOD1、SOD2及凋亡相关基因Bax、Bcl-2的表达。结果褪黑素组的囊胚形成率(42.25%)显著高于对照组(26.38%)(P<0.05),优质囊胚形成率(30.00%)略高于对照组(26.32%),但无显著性差异(P>0.05)。培养72 h后两组胚胎培养液中的ROS水平比较(513.33 vs. 556.67 RLUs)无显著性差异(P>0.05)。褪黑素处理后,胚胎内过氧化氢酶基因CAT的相对表达量(1.68±0.43)较对照组(1.00±0.03)显著上调(P<0.05),其他基因包括Bax、Bcl-2、SOD1、SOD2、GPx的表达则没有显著性差异(P>0.05)。结论褪黑素能够促进人卵裂期胚胎继续发育形成囊胚,其机制可能与上调胚胎中过氧化氢酶基因CAT的表达有关。
褪黑素;人卵裂期胚胎;囊胚;过氧化氢酶
【Abstract】
Objective: To investigate the effect of melatonin on development of human cleavage-stage embryos to blastocyst in vitro.
Methods: The vitrified Day 3 embryos donated by couples undergone IVF treatment in our center from October 2012 to October 2014 were collected. The embryos which blastomere did not dissolved after warming were included in this study (n=143) and randomly divided into two groups according to the embryos were cultures with/without melatonin: the melatonin group (n=71) and the control group (n=72). The warmed embryos in both groups were cultured in the same incubator for 72 hours at 37℃,5% CO2concentration. The formation rates of blastocyst and high-grade blastocyst were compared between the two groups. Chemiluminescence assay was adopted to quantify the ROS levels in culture media. Gene expression of antioxidant enzymesCAT,GPx,SOD1 andSOD2,and apoptosis related genesBcl-2 andBaxin the embryos were analyzed by real-time fluorescent quantitative PCR.
Results: The blastocyst formation rate of melatonin group(42.25%)was significantly increased compared to the control group(26.38%)(P<0.05),while the high-grade blastocyst formation rate was slightly increased but no statistic difference(30.00% vs. 26.32%)(P>0.05). The ROS levels in the culture media after 72 hours culture were comparable between the two groups(513.33 vs. 556.67 RLUs)(P>0.05). The mRNA level ofCATwas significantly increased in the melatonin group compared with the control group [(1.68±0.43)vs.(1.00±0.03)] (P<0.05),but no significant difference was found in the mRNA level ofGPx,SOD1,SOD2,Bcl-2 andBax(P>0.05).
Conclusions: Melatonin can promote human Day 3 cleavage-stage embryos develop to blastocyst. The mechanism could be associated with up-regulating expression of catalase gene by melatonin.
(JReprodMed2016,25(8):719-724)
胚胎发育发生在有氧环境中,因自身代谢会产生一定量的总活性氧(ROS)。ROS积累能够导致细胞膜脂质过氧化、损伤DNA、基因表达异常,造成毒性作用,ROS引起的氧化损伤可导致胚胎发育阻滞[1]。体内条件下,卵泡液与输卵管液及其上皮含有大量酶类以及非酶类抗氧化剂,以保护胚胎免受氧化损伤。这些抗氧化剂包括非酶性抗氧化物如褪黑素,维生素A、C、E,丙酮酸盐,谷胱甘肽,(亚)牛磺酸,半胱胺等,以及自身的酶性抗氧化剂如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、过氧化物氧化还原酶(PRDX)等[2]。然而,体外胚胎培养条件下则失去这些保护机制[3],目前一般采用三气培养箱的低氧环境来减少ROS的产生。虽然也有添加L-肉碱[4]、维生素E[5]等抗氧化剂促进胚胎发育的研究,但是作用并不明显,仍然缺乏一种非常有效的生理性抗氧化保护剂。
褪黑素(化学名称为N-乙酰-5-甲氧基色胺)是哺乳动物和人的松果体分泌的一类吲哚类激素,在包括生殖系统的多个器官和组织中都有分布,是一个生理安全性自由基清除剂和抗氧化剂[6]。已有研究表明,在胚胎培养液中添加褪黑素能够促进包括小鼠[7]、绵羊[8]、牛[9]和猪[10]等哺乳动物早期胚胎的发育,促进囊胚的形成。然而褪黑素对人类胚胎发育及囊胚形成的影响却未见报道。本研究以人第3天(D3)卵裂期冷冻复苏胚胎为材料,研究褪黑素对人类胚胎囊胚发育的影响,并初步探讨褪黑素作用于人卵裂期胚胎的可能机制。
材料与方法
一、研究对象
收集2012年10月至2014年10月在我院生殖中心行体外受精-胚胎移植(IVF-ET)患者自愿放弃并捐赠用于科研的D3胚胎。所有胚胎均是按照Quinns’s Advantage®玻璃化冷冻试剂盒(SAGE,美国)说明书行玻璃化冷冻的胚胎。根据其配套的玻璃化解冻试剂盒解冻所有胚胎,复苏1 h后进行复苏存活率评估及形态学评级。其中,复苏存活率为100%且所有卵裂球均未发生溶解的胚胎纳入本次研究。本研究经本院伦理委员会讨论通过。
二、主要试剂与仪器
Quinns’s Advantage®胚胎培养液、Quinns’s Advantage®玻璃化冷冻与解冻试剂盒(SAGE,美国);褪黑素、二甲基亚砜(DMSO)、鲁米诺(5-氨基-2,3-二氢-1,4-二氮杂萘二酮)(Sigma,美国);实时荧光定量PCR试剂盒Power SYBR Green Cells-to-CT(Life Technologies Corporation,美国);PCR所用引物由上海生工公司合成;Synergy H1TM全功能酶标仪(Biotek,美国);ABI 7500实时荧光定量PCR仪(Applied Biosystems,美国)。
三、分组及培养方式
根据Scott采用的胚胎形态学分级标准[11]对复苏后的胚胎进行评级,3级以上胚胎纳入本次研究(n=143),在保证两组间的胚胎评级没有显著性差异的前提下,随机分为两组,褪黑素组(n=71)和对照组(n=72)。根据前期预实验基础和相关文献经验[12-13],褪黑素组囊胚培养液中加入1×10-7mol/L褪黑素,对照组则不添加褪黑素。胚胎培养方式均采用Quinns’s Advantage®囊胚培养液进行微滴单个培养,微滴大小40 μl。两组胚胎均放置于37℃、5% CO2培养箱中培养72 h,观察并统计囊胚形成情况。根据Gardner & Schoolcraft标准[14]对囊胚进行质量评估。
四、培养液ROS检测
囊胚培养液中的ROS含量采用鲁米诺化学发光法检测。体外培养胚胎72 h的培养液作为检测组,检测无胚胎培养、置于培养箱相同条件下72 h培养液中的ROS水平作为背景值。10 μl培养液中加入0.5 μl浓度为5 mmol/L的鲁米诺,采用Synergy H1TM全功能酶标仪37℃条件下进行检测,参照之前文献[15]采用的方法,每个样品测量15 min,读取化学发光值,最终培养液中的ROS含量用相对光单位(RLUs)表示。每个样品测两个复孔。
五、荧光定量PCR
采用SYBR Green试剂盒定量分析两组胚胎中抗氧化酶类基因的表达情况,如铜锌超氧化物歧化酶基因(SOD1)、锰超氧化物歧化酶基因(SOD2)、谷胱甘肽过氧化物酶基因(GPx)、过氧化氢酶基因(CAT),及凋亡相关基因,如抗凋亡的B淋巴细胞瘤-2基因(Bcl-2)、促凋亡的Bcl-2相关X蛋白基因(Bax)。GPx、CAT、SOD1、SOD2、Bax和Bcl-2基因的引物序列见表1。具体流程参照试剂盒说明书,分别收集培养72 h的褪黑素组和对照组所有胚胎,PBS溶液清洗2次后加入裂解液稀释100倍的DNase I,提取RNA。加入20×RT酶混合液,2×SYBR RT缓冲液,在37℃ 60 min,95℃ 1 min条件下逆转录成cDNA。取1 μl cDNA模板,5 μl 2×SYBR Green PCR酶混合物,0.2 μl引物,ddH2O补至10 μl体系。利用ABI 7500实时荧光定量PCR仪进行扩增。扩增条件为:95℃预变性10 min,95℃ 15 s,60℃ 1 min,40个循环。选择β-actin作为内参基因,计算目标基因相对mRNA表达量。每个基因重复3次实验。

表1 实时荧光定量PCR引物
六、统计学分析

结 果
一、褪黑素对人卵裂期胚胎继续培养形成囊胚的影响
褪黑素组和对照组的复苏后胚胎质量比较无显著性差异(P>0.05)(表2)。两组胚胎在相同条件下培养72 h,观察囊胚形成数量及质量,结果显示,褪黑素组胚胎发育为囊胚的比例显著高于对照组胚胎(42.25% vs. 26.38%,P<0.05)。褪黑素组优质囊胚的形成率有所提高,但是二者比较无显著性差异(30.00% vs. 26.32%,P>0.05)(表3)。

表2 两组复苏胚胎的质量比较 [n(%)]

表3 两组囊胚形成情况比较 [n(%)]
注:与对照组比较,*P<0.05
二、培养液中ROS水平检测
采用鲁米诺化学发光法检测培养液中的ROS含量,结果显示褪黑素组囊胚培养液中的ROS水平与对照组相当(513.33 vs. 556.67 RLUs),无显著性差异(P>0.05)(图1)。
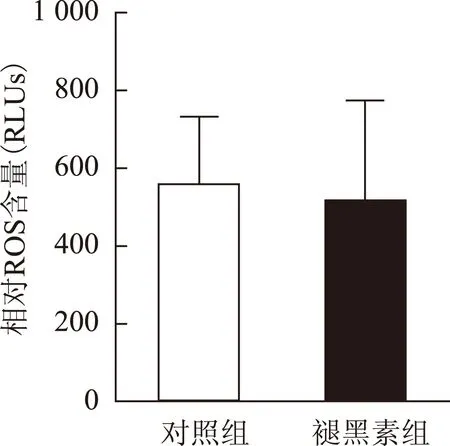
图1 两组囊胚培养液中ROS水平比较
三、Bcl-2、Bax、CAT、GPx、SOD1和SOD2基因表达的定量分析
实时荧光定量PCR结果显示,褪黑素组胚胎中CAT基因mRNA的相对表达量(1.68±0.43)较对照组(1.00±0.03)显著升高(P<0.05),其它基因的表达两组间比较无显著性差异(P>0.05)(图2)。

注:与对照组比较,*P<0.05图2 荧光定量PCR检测Bcl-2,Bax,CAT,GPx,SOD1和SOD2的相对表达量
讨 论
目前,辅助生殖技术是治疗不孕不育症最为有效的方法。经过30多年的发展,大家开始认识到传统卵裂期胚胎的移植存在种植率不高、移植胚胎数多、多胎现象严重等问题[16],有学者开始尝试从卵裂期胚胎移植向囊胚移植甚至单囊胚移植过渡,认为在提高临床妊娠率的同时,显著降低多胎妊娠风险[17],囊胚培养与移植可能是未来辅助生殖技术的发展趋势[18]。这就对囊胚培养技术提出了极大的挑战。虽然目前有研究尝试对培养液及培养条件等进行优化,但囊胚形成率仍不高,若全部进行囊胚培养,仍有约10%的患者无囊胚形成而无可用胚胎[19]。因此,为了更有效、更安全地实施辅助生殖技术,提高囊胚形成率十分关键。本研究将褪黑素作为抗氧化保护剂添加到培养液中,结果显示褪黑素显著提高了人类卵裂期胚胎的囊胚形成率,提示其可能用于改善目前体外培养条件下囊胚形成不高、无囊胚形成发生率较高的现况。
褪黑素是人及其它哺乳动物体内合成的一类生理性激素,已有报道其作为活性氧清除剂应用于动物胚胎的研究中。在小鼠模型中,褪黑素能够诱导2细胞期冷冻复苏胚胎内源性谷胱甘肽的表达以及降低活性氧水平,提高囊胚形成率及胚胎质量[20]。褪黑素的添加也能提高绵羊冷冻复苏胚胎发育成囊胚的细胞数与孵出率[21]。我们的研究结果较为类似,在人D3冷冻复苏胚胎囊胚培养液中添加1×10-7mol/L褪黑素,显著提高了囊胚形成率,提示褪黑素可能参与人卵裂期胚胎囊胚发育过程,并起到促进作用。然而,添加褪黑素后,虽然形成囊胚的质量有提高趋势,但与对照组比较并没有显著性差异,这与之前报道的褪黑素提高动物胚胎形成囊胚的质量[20]不同。分析其原因,一方面可能是由于样本量的局限性;另一方面,本研究中,只在D3胚胎向后继续培养的囊胚培养液中添加褪黑素,与胚胎体外发育早期就添加褪黑素的相比,对胚胎发育的影响可能存在一定的差异。此外,动物胚胎的质量评估体系主要是根据囊胚细胞数来评估囊胚质量;而对于人类胚胎而言,根据Gardner & Schoolcraft标准,需要综合考虑囊胚腔直径、扩张程度、内细胞团的紧密程度及内细胞团和滋养层的细胞数,是一个综合性的质量评估[14]。两种不同的质量评估体系可能也是导致人和动物胚胎形成囊胚质量差异性的原因。另外,本研究中所用的褪黑素作用浓度为1×10-7mol/L,这主要是基于我们前期的浓度梯度摸索实验(0 mol/L、1×10-9mol/L、1×10-7mol/L和1×10-5mol/L)及相关文献经验[12-13],证实1×10-7mol/L的使用浓度可以获得满意的受精率与优胚率,加之有文献报道高浓度的褪黑素反而会抑制细胞分裂从而不利于胚胎的发育[22],但1×10-7mol/L是不是褪黑素的最佳作用浓度尚有待进一步研究验证。
胚胎的玻璃化冷冻及解冻操作可能会破坏胚胎自身的抗氧化保护机制[23],因此体外培养过程中可能需要体外添加抗氧化保护剂。由于人类胚胎的特殊性,本研究选择了冷冻复苏的胚胎研究褪黑素对人类胚胎发育的影响,并不能很直接地反应人类新鲜胚胎发育的情况。Choi等[24]的研究表明,在培养液中添加1×10-10mol/L褪黑素能显著提高猪新鲜胚胎的囊胚形成率;亦有研究证实褪黑素有利于新鲜鼠胚的囊胚发育[20]。上述研究提示,褪黑素可能对冷冻胚胎和新鲜胚胎的发育均有积极作用,有可能仅在最适作用浓度上存在区别。
褪黑素发挥抗氧化作用的具体机制包含两条途径:(1)不依赖受体途径:褪黑素有高的亲脂性,能够自由进出细胞膜性结构,与ROS分子直接结合并进行清除,而且褪黑素与ROS反应的代谢产物还具有活性氧清除功能[6]。(2)依赖受体途径:褪黑素与细胞膜上的褪黑素受体结合,向细胞内传递抗氧化信号,通过级联放大效应激活细胞内的抗氧化酶类(SOD、GPx、CAT、PRDX等)的表达从而发挥抗氧化的保护功能[25]。通过两种途径,最终有效减少ROS的含量,从而促进动物胚胎的发育[26]。
培养液是体外培养中胚胎的生长环境,培养液中的营养物质及胚胎的代谢产物,对胚胎的生长发育都十分关键。其中,胚胎自身代谢产生及外环境释放的ROS物质都可能严重阻滞胚胎发育[27]。因此,本研究采用鲁米诺化学发光法检测了体外培养72 h后培养液中的总ROS水平。但出乎意外的是,褪黑素组与对照组培养液中的ROS含量比较并没有显著性差异,提示褪黑素的添加并不能有效去除培养液中的ROS,也就是说褪黑素可能是通过胚胎细胞膜上的褪黑素受体,向细胞内传递氧化应激信号,从而提高对ROS的耐受,促进囊胚形成。因此,本研究分析了褪黑素处理72 h后,胚胎中Bcl-2、Bax、CAT、GPx、SOD1和SOD2基因表达的情况。结果显示CAT基因表达显著上调,这与已有文献[28]报道一致;其他基因(Bcl-2、Bax、GPx、SOD1和SOD2)的表达两组间比较则没有显著性差异。而之前有文献报道,褪黑素能显著促进牛胚胎中抗氧化酶基因GPx、SOD1和抗凋亡基因Bcl-2的表达,抑制促凋亡基因Bax的表达,降低细胞内的ROS含量和细胞凋亡[29];对于猪体细胞核移植胚胎,褪黑素能通过上调Bcl-2和下调Bax的基因表达促进囊胚的形成[30];而在小鼠胚胎中,褪黑素上调表达SOD和Bcl-2基因,减少细胞内的ROS产生和抑制细胞凋亡,并不影响GPx和Bax等基因的表达[7]。如果不考虑褪黑素添加时间对基因表达的影响,这种差异可能是由于物种间的差异性造成的,即对于不同物种的胚胎,在体外发育过程中,褪黑素调控的下游基因可能并不相同。
综上所述,本研究尝试将褪黑素添加到人的胚胎培养液中,揭示了褪黑素对人卵裂期胚胎生长发育的促进作用。褪黑素的添加并不能直接改善胚胎培养液中的ROS水平,其可能机制与通过上调胚胎内CAT基因的表达,从而提高胚胎的抗氧化能力有关。但是,本研究并没有对胚胎内CAT蛋白表达情况及细胞内的ROS含量进行检测。因此,对于褪黑素究竟是如何影响CAT的表达水平以及如何通过上调CAT的表达来影响人类胚胎的发育,还需要更加深入的研究。
[1]粱琳,陈秀娟. 观察体外受精中卵泡液的抗氧化能力及其对卵母细胞质量和胚胎发育的影响[J]. 生殖医学杂志,2015,24: 532-537.
[2]胡德宝,张宝修,张也,等. 氧化应激与胚胎的氧化还原调节[J]. 畜牧兽医学报,2014,45: 1038-1043.
[3]Fujii J,Iuchi Y,Okada F. Fundamental roles of reactive oxygen species and protective mechanisms in the female reproductive system[J]. Reprod Biol Endocrinol,2005,3: 43.
[4]Abdelrazik H,Sharma R,Mahfouz R,et al. L-Carnitine decreases DNA damage and improves the in vitro blastocyst development rate in mouse embryos[J]. Fertil Steril,2009,91: 589-596.
[5]周瑞年,李瑞文. 添加抗氧化物维生素E对人类胚胎体外发育的影响[J]. 实用妇产科杂志,2010,26: 936-938.
[6]Zavodnik IB,Domanski AV,Lapshina EA,et al. Melatonin directly scavenges free radicals generated in red blood cells and a cell-free system: chemiluminescence measurements and theoretical calculations[J]. Life Sci,2006,79: 391-400.
[7]Wang F,Tian X,Zhang L,et al. Melatonin promotes the in vitro development of pronuclear embryos and increases the efficiency of blastocyst implantation in murine[J]. J Pineal Res,2013,55: 267-274.
[8]Berlinguer F,Leoni GG,Succu S,et al. Exogenous melatonin positively influences follicular dynamics,oocyte developmental competence and blastocyst output in a goat model[J]. J Pineal Res,2009,46: 383-391.
[9]Cebrian-Serrano A,Salvador I,Raga E,et al. Beneficial effect of melatonin on blastocyst in vitro production from heat-stressed bovine oocytes[J]. Reprod Domest Anim,2013,48: 738-746.
[10]Shi JM,Tian XZ,Zhou GB,et al. Melatonin exists in porcine follicular fluid and improves in vitro maturation and parthenogenetic development of porcine oocytes[J]. J Pineal Res,2009,47: 318-323.
[11]Scott L,Alvero R,Leondires M,et al. The morphology of human pronuclear embryos is positively related to blastocyst development and implantation[J]. Hum Reprod,2000,15: 2394-2403.
[12]Wang F,Tian X,Zhou Y,et al. Melatonin improves the quality of in vitro produced (IVP) bovine embryos: implications for blastocyst development,cryotolerance,and modifications of relevant gene expression[J/OL]. PLoS One,2014,9: e93641.
[13]Vandaele L,Van Soom A. Intrinsic factors affecting apoptosis in bovine in vitro produced embryos[J]. Verh K Acad Geneeskd Belg,2011,73: 79-104.
[14]Gardner DK,Lane M,Stevens J,et al. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer[J]. Fertil Steril,2000,73: 1155-1158.
[15]Lee TH,Lee MS,Liu CH,et al. The association between microenvironmental reactive oxygen species and embryo development in assisted reproduction technology cycles[J]. Reprod Sci,2012,19: 725-732.
[16]Blake DA,Farquhar CM,Johnson N,et al. Cleavage stage versus blastocyst stage embryo transfer in assisted conception[J]. Cochrane Database Syst Rev,2007,(4): CD002118.
[17]Pribenszky C,Mátyás S,Kovács P,et al. Pregnancy achieved by transfer of a single blastocyst selected by time-lapse monitoring[J/OL]. Reprod Biomed Online,2010,21: 533-536.
[18]薛侠,张四林,施文浩,等. 不同授精方式的选择性单囊胚移植的妊娠结局分析[J]. 生殖医学杂志,2014,23: 760-762.
[19]高梦莹,李永刚,马艳萍,等. 囊胚培养与囊胚移植的临床应用[J]. 生殖与避孕,2011,31: 765-768.
[20]Gao C,Han HB,Tian XZ,et al. Melatonin promotes embryonic development and reduces reactive oxygen species in vitrified mouse 2-cell embryos[J]. J Pineal Res,2012,52: 305-311.
[21]Succu S,Pasciu V,Manca ME,et al. Dose-dependent effect of melatonin on postwarming development of vitrified ovine embryos[J]. Theriogenology,2014,81: 1058-1066.
[23]Somfai T,Ozawa M,Noguchi J,et al. Developmental competence of in vitro-fertilized porcine oocytes after in vitro maturation and solid surface vitrification: effect of cryopreservation on oocyte antioxidative system and cell cycle stage[J]. Cryobiology,2007,55: 115-126.
[24]Choi J,Park SM,Lee E,et al. Anti-apoptotic effect of melatonin on preimplantation development of porcine parthenogenetic embryos[J]. Mol Reprod Dev,2008,75: 1127-1135.
[25]Lanoix D,Lacasse AA,Reiter RJ,et al. Melatonin: the smart killer: the human trophoblast as a model[J]. Mol Cell Endocrinol,2012,348: 1-11.
[26]Kang JT,Koo OJ,Kwon DK,et al. Effects of melatonin on in vitro maturation of porcine oocyte and expression of melatonin receptor RNA in cumulus and granulosa cells[J]. J Pineal Res,2009,46: 22-28.
[27]Cseh S,Corselli J,Nehlsen-Cannarella SL,et al. The effect of quick-freezing in ethylene glycol on morphological survival and in vitro development of mouse embryos frozen at different preimplantation stages[J]. Theriogenology,1997,48: 43-50.
[28]Fischer TW,Kleszczyński K,Hardkop LH,et al. Melatonin enhances antioxidative enzyme gene expression (CAT,GPx,SOD),prevents their UVR-induced depletion,and protects against the formation of DNA damage (8-hydroxy-2’-deoxyguanosine) in ex vivo human skin[J]. J Pineal Res,2013,54: 303-312.
[29]Su J,Wang Y,Xing X,et al. Melatonin significantly improves the developmental competence of bovine somatic cell nuclear transfer embryos[J]. J Pineal Res,2015,59: 455-468.
[30]Pang YW,An L,Wang P,et al. Treatment of porcine donor cells and reconstructed embryos with the antioxidant melatonin enhances cloning efficiency[J]. J Pineal Res,2013,54: 389-397.
[编辑:肖晓辉]
Effect of melatonin on development of human cleavage-stage embryos in vitro
HU Xiao-dong,XIONG Feng,WAN Cai-yun,LI Guan-gui,HUANG Li-shi,PENG Yue-ting,SUN Qing,BAO Zhong-jian,ZENG Yong*
FertilityCenter,ShenzhenZhongshanUrologyHospital,ShenzhenKeyLaboratoryofReproductiveImmunologyforPeri-implantation,ShenzhenZhongshanInstituteforReproductionandGenetics,Shenzhen518045
Melatonin;Human cleavage-stage embryos;Blastocyst;Catalase
2015-12-29;
2016-02-02
深圳市基础研究项目(JCYJ20150402165325174);深圳市科技计划项目(201202200);广东省医学科研基金项目(A2014658)
胡晓东,女,广东人,本科,副主任医师,妇产科学专业.(*
,Email:szsz01@sina.com)
DOI:10.3969/j.issn.1004-3845.2016.08.010
