Cu2+对污泥微生物活性影响的恢复性研究
2016-08-27荣宏伟李权斌张朝升王连杰董明
荣宏伟,李权斌,张朝升,王连杰,董明
(1.广州大学土木工程学院,广东广州510006;2.青岛市旅游规划建筑设计研究院,山东青岛266001;3.中冶焦耐工程技术有限公司,辽宁大连116085)
Cu2+对污泥微生物活性影响的恢复性研究
荣宏伟1,李权斌1,张朝升1,王连杰2,董明3
(1.广州大学土木工程学院,广东广州510006;2.青岛市旅游规划建筑设计研究院,山东青岛266001;3.中冶焦耐工程技术有限公司,辽宁大连116085)
通过人工投加Cu2+对驯化污泥进行破坏性实验,观察了Cu2+对活性污泥氨氮、COD降解及其碘硝基四氮唑脱氢酶(INT-ETS)活性、比氧摄取速率(SOUR)、氨摄取速率(AUR)的影响。当加入1~10mg/LCu2+时,受到影响的微生物系统和活性污泥可在后期的培养驯化中恢复其相关功能,指标可恢复至未投加Cu2+时的水平;当Cu2+质量浓度达到25mg/L时,系统受到较为严重的破坏,无法自我修复。
活性污泥;Cu2+;污泥微生物活性;恢复周期
活性污泥法由于低价高效而被广泛应用于城市污水处理厂,由于微生物是污水处理工艺中污染物的重要分解者,重金属对活性污泥微生物的毒性研究一直备受关注〔1-3〕。铜是城市污水中四大常见的有害重金属之一,其主要来源于城市生活污水和某些工业废水〔4-6〕。重金属离子的毒效应影响会使多种微生物受到抑制,最终导致整个污水处理体系的微生物种类锐减,处理效果减弱,处理效率下降甚至系统失效等严重后果〔7-10〕。
微量(μg/L级)的重金属(如铜、锌、铁、镍和钴)是生物酶活性的辅助因子,是微生物生长必需元素;然而,当大多数生物体内重金属离子浓度达到了一定量(mg/L级)的水平时便会中毒〔11〕。重金属可以影响甚至破坏微生物酶的结构和活性〔12-14〕,但是某些微生物可以通过自身生物解毒功能对重金属毒性产生抗性并在后期驯化培养中恢复自身活性及相关功能。根据当前的代谢适应假说,在驯化时被重金属离子破坏了的酶被新合成酶取代或者失活的通道被新的途径取代〔15〕。
笔者采用循序渐进的培养驯化方式,通过研究活性污泥在某一浓度重金属Cu2+作用条件下生物活性的变化情况,对重金属Cu2+对微生物活性影响的恢复功能做进一步研究,以期为重金属废水处理研究提供参考。
1 试验材料和方法
1.1材料
实验污泥:取自广州市沥滘污水处理厂二沉池,采用人工配制的污水进行驯化和培养,使其出水的各项指标达到《城镇污水处理厂污染物排放标准》(GB 18918—2002)中的一级A标准。
实验污水:采用模拟城市生活污水,由自来水、啤酒、NH4Cl、KH2PO4、NaHCO3及少量CaCl2、MgSO4、FeSO4配制而成。其水质:COD 280~300mg/L、NH4+-N 25~30mg/L、pH 7.0~7.5、NO3--N 0.1~2.0mg/L、NO2--N 0~1.1mg/L、TP 6.5~7.5mg/L。
0.2%INT溶液:取2 g碘硝基四氮唑(INT)溶于少量蒸馏水中,完全溶解后,将其稀释定容至1 L,贮存于棕色试剂瓶中,并置于暗处。
Tris-HCl缓冲液(pH=8.4):准确称取6.037 g三羟甲基氨基甲烷(Tris)溶于20mL、1mol/L的HCl中,完全溶解后,将其稀释定容至1 L。
1.0mg/L INT标准溶液:称取0.050 g INT,溶于50mL去离子水中,存于棕色容量瓶中,该溶液即为1.0mg/L INT标准溶液。
1.2分析项目及方法
1.2.1常规水质分析项目及方法
试验期间对各项水质指标和系统控制指标进行了定时定量分析,CODCr、MLSS、NH4+-N、SV、重金属Cu2+均采用国家发布的标准方法〔16〕,采用WTW测定仪及相应探头在线监测反应器内DO和pH。
1.2.2碘硝基四氮唑脱氢酶(INT-ETS)活性检测方法
取0.6mL污泥混合液,置于15mL离心管中,向其中加入4mL的Tris-HCI缓冲液、2mL的0.2% INT溶液。迅速将制备好的样品放入温度为(37± 1)℃的水浴振荡器内振荡培养0.5 h,振荡结束后,向样品中加入2mL的37%甲醛以终止酶的反应。将该样品放入离心机离心5min(离心机转速调节至4 000 r/min,下同),小心弃去离心管中的上清液,并加入10mL的丙酮,搅拌混合均匀后,将其放入温度为(37±1)℃的水浴振荡器内振荡萃取0.5 h(暗处操作)。待样品萃取完毕,将样品放入离心机中离心5min,将上清液和沉淀污泥彻底分离。用分光光度计在485 nm处读取萃取液的吸光度,按式(1)计算INT-ETS活性(以TSS计,下同)。
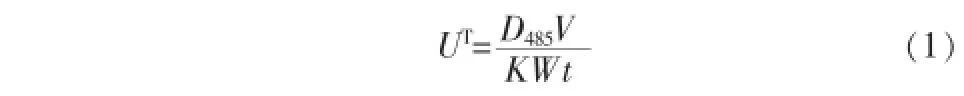
式中:UT——INT-ETS活性,mg/(g·h);
D485——上清液在波长485 nm处的吸光度;
V——萃取剂(丙酮)体积,mL;
K——标准曲线斜率,本试验取0.003 9;
W——污泥干重,g;
t——培养时间,h。
1.2.3比氧摄取速率(SOUR)检测方法
采用溶解氧电极测定活性污泥的SOUR。将活性污泥样品置于锥形瓶中,充分曝气使样品中溶解氧浓度达到饱和状态,然后插入溶解氧电极,记录溶解氧随时间的变化情况。测试过程中,利用磁力搅拌器对污泥样品进行搅拌混合,并注意保持锥形瓶良好的气密性。待溶解氧测定完成后,将锥形瓶内的活性污泥样品全部取出并测定其污泥浓度。利用溶解氧-时间曲线的直线部分和污泥浓度计算活性污泥的SOUR,见式(2)。

式中:UO——活性污泥的比氧摄取速率,mg/(g·h);
ΔDO——溶解氧的减少量,mg/L;
X——混合液悬浮固体质量浓度,g/L;
t——测试时间,h。
1.2.4氨摄取速率(AUR)检测方法
采用氨电极在线测定氨氮浓度变化情况,通过氨氮-时间曲线的直线部分以及测定的污泥浓度值计算活性污泥的AUR,见式(3)。

式中:A——活性污泥的氨摄取速率,mg/(g·h);
ΔNH4+-N——NH4+-N减少的质量浓度,mg/L;
X——混合液悬浮固体质量浓度,g/L;
t——测试时间,h。
1.3实验方案
采用稳定运行的SBR反应器进行实验。反应器内用啤酒配制的人工污水将其污泥质量浓度稀释至4 000mg/L左右,向SBR反应器内加入Cu2+溶液,使反应器内Cu2+质量浓度分别达到1.0、5.0、10.0、25.0 mg/L。将其曝气搅拌运行,溶解氧浓度控制在3~4 mg/L,pH控制在7.0~7.5。反应器运行5 h后停止运行,取0.6mL污泥混合液进行INT-ETS活性检测。沉淀15 min,沉淀结束后,取出上清液,测量其NH4+-N、COD。同时,从反应器中取出污泥混合液置于250mL的锥形瓶内并进行充分曝气,当污泥混合液溶解氧达到饱和状态时插入溶解氧电极,保证锥形瓶具有良好气密性的条件下在线检测溶解氧浓度并记录相关数据。测量结束后,除去锥形瓶内上清液,将活性污泥倒回SBR反应器内进行后续实验。
2 实验结果与讨论
2.1 1mg/LCu2+对微生物活性的影响
1mg/LCu2+对微生物活性的影响见图1。
当反应器内加入1mg/L的Cu2+后,COD、NH4+-N去除率在前2个周期内呈直线下降趋势,第2个周期结束后两参数降至最低,分别从初始的95.85%、89.28%降低至87.35%、65.68%;随后,NH4+-N、COD去除率逐渐上升,在第7个周期结束后,COD、NH4+-N去除率分别恢复至96.75%、90.12%,与未投加Cu2+时的去除效果类似。
当反应器内加入1mg/L的Cu2+后,污泥INT-ETS活性在前3个周期内呈下降趋势,第3个周期结束后降至最低,从初始的439.30mg/(g·h)降低至254.53mg/(g·h)。随后,污泥INT-ETS活性逐渐上升,在第12个周期结束后,污泥INT-ETS活性恢复至未投加Cu2+时的水平。
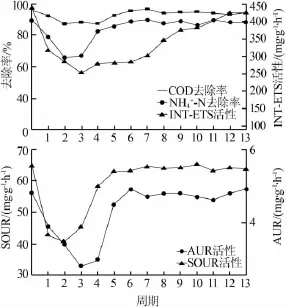
图1 1mg/LCu2+对微生物活性的影响
当反应器内加入1mg/L的Cu2+后,污泥SOUR活性和AUR活性呈下降趋势,分别在第2个和第3个周期结束后降至最低,并分别从初始的64.62、4.8mg/(g·h)降低至40.68、2.81mg/(g·h);随后,污泥SOUR活性和AUR活性逐渐上升,分别在第7个、第8个周期结束后,两活性恢复至未投加Cu2+时的水平。
上述结果表明,当受到1mg/LCu2+影响时,微生物系统及活性污泥可在后期的培养驯化中恢复其相关活性,即微生物系统有一定的自我修复功能。
2.2 5mg/LCu2+对微生物活性的影响
5mg/LCu2+对微生物活性的影响见图2。
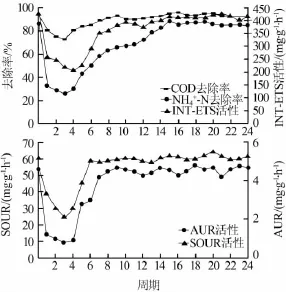
图2 5mg/LCu2+对微生物活性的影响
当反应器内加入5mg/L的Cu2+后,COD、NH4+-N去除率在前4个周期内呈直线下降趋势,第4个周期结束后两参数降至最低,分别从初始的94.35%、85.68%降低至80.45%、30.22%;随后,COD、NH4+-N去除率逐渐上升,分别在第9个和第14个周期结束后恢复至初始去除效果。
当反应器内加入5mg/L的Cu2+后,污泥INTETS活性在前4个周期内呈下降趋势,第4个周期结束后降至最低,从初始的425.68mg/(g·h)降低至206.75mg/(g·h)。随后,污泥INT-ETS活性逐渐上升,在第10个周期结束后,污泥INT-ETS活性恢复至未投加Cu2+时的水平。
当反应器内加入5mg/L的Cu2+后,污泥SOUR活性和AUR活性呈下降趋势,在第3个周期结束后降至最低,分别从初始的60.54、4.6mg/(g·h)降低至24.63、0.8mg/(g·h);随后,污泥SOUR活性和AUR活性逐渐上升,分别在第6个、第9个周期结束后,两活性恢复至未投加Cu2+时的水平。
上述结果表明,当受到5mg/LCu2+影响时,微生物系统及活性污泥可在后期的培养驯化中恢复其相关活性,即微生物系统有一定的自我修复功能。
2.3 10mg/LCu2+对微生物活性的影响
10mg/LCu2+对微生物活性的影响见图3。
当反应器内加入10mg/L的Cu2+后,COD、NH4+-N去除率在前2个周期内呈直线下降趋势,第2个周期结束后两参数降至最低,分别从初始的93.45%、89.28%降低至65.85%、15.46%;随后,COD、NH4+-N去除率逐渐上升,分别在第22个和第28个周期结束后恢复至初始去除效果。
当反应器内加入10mg/L的Cu2+后,污泥INTETS活性在前3个周期内呈下降趋势,第3个周期结束降至最低,从初始的420.74mg/(g·h)降低至182.08mg/(g·h)。随后,污泥INT-ETS活性逐渐上升,在第14个周期结束后,污泥INT-ETS活性恢复至未投加Cu2+时的水平。
当反应器内加入10mg/L的Cu2+后,污泥SOUR活性和AUR活性呈下降趋势,分别在第3个、第2个周期结束后降至最低,并分别从初始的58.96、4.5 mg/(g·h)降低至15.65、0.6 mg/(g·h);随后,污泥SOUR活性和AUR活性逐渐上升,分别在第12个、第17个周期结束后,两活性恢复至未投加Cu2+时的水平。
上述结果表明,当受到10mg/LCu2+影响时,微生物系统及活性污泥可在后期的培养驯化中恢复其相关活性,即微生物系统有一定的自我修复功能。
2.4 25mg/LCu2+对微生物活性的影响
25mg/LCu2+对微生物活性的影响见图4。

图4 25mg/LCu2+对微生物活性的影响
当反应器内加入25mg/L的Cu2+后,COD、NH4+-N去除率在前9个周期内呈下降趋势,第9个周期结束后两参数降至最低,分别从初始的92.05%、88.56%降低至38.45%、5.45%;随后,COD、NH4+-N去除率有上升趋势,但幅度较小。从第40周期开始COD、NH4+-N去除率始终在某一数值范围内浮动。这说明较高浓度的Cu2+对微生物系统造成严重的破坏,这种破坏具有一定的延续性,利用微生物自身修复功能很难使其恢复至未受破坏之前的状态。
当反应器内加入25mg/L的Cu2+后,污泥INTETS活性在前7个周期内呈下降趋势,并且反应较为明显,第1个周期结束后就已经下降至110.62 mg/(g·h)。第7个周期结束后降至最低,从初始的415.25mg/(g·h)降低至108.82mg/(g·h)。随后,污泥INT-ETS活性逐渐上升,在第20个周期结束后,污泥INT-ETS活性恢复至380.54mg/(g·h)左右,低于未投加Cu2+时的水平。说明25mg/LCu2+对活性污泥结构造成一定程度的破坏,其活性在后期的培养驯化中虽然有恢复,但很难达到未受破坏前的水平,这也能够说明微生物系统自我修复功能是在一定的破坏范围内有效。
当反应器内加入25mg/L的Cu2+后,污泥SOUR活性和AUR活性在前9个周期内呈下降趋势,并且反应较为明显,第1个周期结束后就已经分别下降至20.02、0.9mg/(g·h)。第9个周期结束后降至最低,随后,污泥SOUR活性和AUR活性有所恢复,但幅度较缓,并且最终低于未投加Cu2+时的水平。
上述结果表明,25mg/LCu2+对活性污泥结构造成一定程度的破坏,其活性在后期的培养驯化中虽然有恢复,但很难达到未受破坏前的水平,这也能够说明微生物系统自我修复功能是在一定的破坏范围内有效。
3 结论
微生物系统遭到重金属Cu2+破坏时,具有一定的自我修复能力,但这种能力只在一定的破坏范围内才有效。当生物处理系统中加入的Cu2+质量浓度为1~10mg/L时,受到影响的微生物系统和活性污泥可在后期的培养驯化中恢复其相关功能,系统的COD、NH4+-N去除率以及活性污泥的INT-ETS活性、SOUR活性、AUR活性均能够恢复至未投加Cu2+时的水平,但加入的Cu2+浓度越高,生物处理系统自我修复所需要的时间也越长;当加入的Cu2+质量浓度达到25mg/L时,微生物系统受到较为严重的破坏,相关指标无法在后期的驯化中恢复至未受破坏前的水平。
[1]王伟,徐艳,侯昭牧,等.Ni2+对活性污泥活性及群落多样性的影响[J].环境工程学报,2014,8(1):138-143.
[2]荣宏伟,李健中,张可方.铜对活性污泥微生物活性影响研究[J].环境工程学报,2010,4(8):1709-1713.
[3]李娟英,赵庆祥,王静,等.重金属对活性污泥微生物毒性的比较研究[J].环境污染与防治,2009,31(11):17-20.
[4]Wong L,Henry JG.Decontaminatingbiologicalsludge foragriculture use[J].WaterScience and Technology,1984,17:575-586.
[5]Stankovic V,Božic D,GorgievskiM,etal.Heavymetal ionsadsorption from minewaters by sawdust[J].Chemical Industry and Chemical EngineeringQuarterly,2009,15(4):237-249.
[6]高朝勇,刘钟骏,周鹏.电镀行业环境问题分析与污染整治对策[J].低碳世界,2013(5):206-207.
[7]Li Jia,Liu Xiang,Liu Yan,etal.The effectof continuousexposureof copper on the properties and extracellular polymeric substances(EPS)of bulking activated sludge[J].Environmental Science and Pollution Research International,2011,18(9):1567-1573.
[8]谢丹瑜,康得军,唐虹,等.城市污水中重金属对活性污泥系统的影响与对策[J].环境工程,2015,33(5):59-63.
[9]You SJ,TsaiYP,HuangRY.Effectofheavymetalson nitrification performance in different activated sludge processes[J].Journal of HazardousMaterials,2009,165(1/2/3):987-994.
[10]Cheng Li,LiXiaochen,Jiang Ruixue,etal.Effectsof Cr(Ⅵ)on the performance and kineticsof theactivated sludge process[J].Bioresource Technology,2011,102(2):797-804.
[11]Yunus PM,Fikret K.Copper(Ⅱ)ion toxicity in activated sludge processes as function of operating parameters[J].Enzyme and MicrobialTechnology,2007,40(5):1228-1233.
[12]Nehrenheim E,Waara S,Johansson W L.Metal retention on pine bark and blast furnace slag-on-site experiment for treatmentof low strength landfill leachate[J].Bioresource Technology,2008,99(5):998-1005.
[13]Lin Yuemei,Yang Xuefu,Liu Yu.Kinetic responses of activated sludgemicroorganisms to individual and joint copper and zinc[J]. Journal of Environmental Science and Health,2003,38(2):353-360.
[14]Stasinakis A S,Mamais D,Thomaidis N S,etal.Effectof chromium(Ⅵ)on bacterialkineticsofheterotrophic biomassofactivated sludge[J].WaterResearch,2002,36(13):3341-3349.
[15]Amann R I,LudwigW,Schleifer K H.Phylogenetic identification and in situ detection of individualmicrobial cells without cultivation[J].MicrobiologicalReviews,1995,59(1),143-169.
[16]国家环保总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:53-74.
—————
Studies on the recovery of the influences of Cu2+on sludgem icrobialactivity
Rong Hongwei1,LiQuanbin1,Zhang Chaosheng1,Wang Lianjie2,Dong Ming3
(1.Schoolof CivilEngineering,Guangzhou University,Guangzhou 510006,China;2.Qingdao Instituteof Tourism Planning&Architecture Design,Qingdao 266001,China;3.ACRECoking&Refractory Engineering Consulting Corporation,Dalian 116085,China)
Through destructive testson sludge acclimation by adding Cu2+artificially,the influencesof Cu2+on activated sludge ammonia nitrogen,COD degradation and its INT-ETS activity,SOUR and AUR are observed.When 1-10mg/LofCu2+isadded,theaffectedmicrobialsystemsand activated sludge can recover their related functions in the latter cultivation and acclimation,and the indexes can be recovered to the level before Cu2+wasadded.When the mass concentration of Cu2+reaches 25mg/L,the system is damaged rather seriously,being unable to do self-repairment.
activated sludge;Cu2+;microbialactivity ofsludge;recovery cycle
X703
A
1005-829X(2016)07-0034-05
国家自然科学基金资助项目(51278133,21477027);广东省科技计划项目(2014A020216049);广州市教育系统创新团队资助项目(13C01)
荣宏伟(1973—),教授,博士。电话:13570706055,E-mail:rhwcn@139.com。
2016-03-02(修改稿)
