氟原子对苯并二噻吩类共轭聚合物光伏性能的影响
2016-08-25王迅昶周文佩夏养君
王迅昶,周文佩,汪 锋,夏养君
(1 武汉工程大学绿色化工过程教育部重点实验室,湖北 武汉 430073;2 兰州交通大学光电技术与智能控制教育部重点实验室,甘肃 兰州 730070)
氟原子对苯并二噻吩类共轭聚合物光伏性能的影响
王迅昶1,周文佩1,汪锋1,夏养君2
(1 武汉工程大学绿色化工过程教育部重点实验室,湖北武汉430073;2 兰州交通大学光电技术与智能控制教育部重点实验室,甘肃兰州730070)
设计合成了两种D-A型共轭聚合物给体材料PBDT-BT,PBDT-FBT,研究了引入氟原子后,双直链噻吩修饰的苯并二噻吩共轭聚合物的热力学,光学,电学性质与光伏性能的变化。以聚合物/PC71BM作为活性层材料,研究了不同比例的给体受体对有机太阳能电池光伏性能的影响。两种聚合物热力学分解温度均超过了400 ℃,同时表现出不错的吸光能力。较低的HOMO能级使得PBDT-BT与PBDT-FBT的开路电压均超过了0.85 eV,通过器件结构ITO/PEDOT:PSS/Active Layer/Ca/Al,优化得到的光伏性能分别为2.42%与3.55%。
苯并二噻吩;氟化;共轭聚合物;光电转化效率
随着经济的快速发展,社会对于能源的依赖程度越来越大,特别是石油天然气这些不可再生能源。为了开发利用清洁无污染的太阳能,人们越来越重视对聚合物太阳能电池的研究开发。由于聚合物给体材料的结构多样,设计灵活,并且对电池的光电转换效率影响极大,活性层给体材料便成了科学家们主要的研究对象[1-2]。苯并二噻吩(BDT)结构是一个非常优异的给体单元,广泛用于构建D-A型共轭聚合物。苯并二噻吩的大平面共轭结构有利于聚合物的π-π堆积。基于苯并二噻吩的共轭聚合物一般都具有较高的迁移率与较好的稳定性[3-5]。
Yang等[5]报道了一系列基于BDT结构的共轭聚合物,他们在研究太阳能电池结构和性能的关系中做出了很大的贡献。Hou等合成并研究了BDT的侧链取代对聚合物性能的影响,尤以噻吩烷基链取代的BDT(BDT-T)为主要研究对象,用于构建新型的共轭聚合物[6-9],大量高效的共轭聚合物被用于光伏器件的构建。Chen等报道的PTB7-Th,通过把2-(2-乙基己基)噻吩结构引入BDT的4,8位,器件表现出非常优异的光伏性能。Hou等又通过把硫原子插入到BDT-T单元上,构建了全新的共轭聚合物单元,提高了聚合物的电压和电流[10]。烷基链的选择在聚合物半导体材料的设计中已经成为一个非常重要的因素,它可以平衡分子间的相互堆积,调整聚合物的溶解性和结晶度以获得最大的器件光伏性能[11-13]。在聚合物的骨架上烷基链的大小和位置都会很大程度上影响聚合物的光伏性能[14-15]。引入氟原子也是提高聚合物光伏性能常用的手段之一,由于其很强的缺电子特性,通常能有效降低聚合物的HOMO能级,从而提高聚合物的开路电压[16-18]。
本文中,我们以双侧链噻吩修饰的BDT衍生物,2,6-双(三甲基锡)-4,8-双(2,3-二辛基噻吩-5-基)-苯[1,2-b:4,5-b′]并二噻吩(M1)作为给电子结构单元,并将具有强缺电子单元的苯并噻二唑(BT)与二氟苯并噻二唑(FBT)引入了聚合物的主链骨架中,合成了两种聚合物PBDT-BT与PBDT-FBT。系统的研究了在引入氟原子后,对此类聚合物热学,光学,电学和光伏性能的影响。
1 实 验
2,6-双(三甲基锡)-4,8-双(2,3-二辛基噻吩-5-基)-苯[1,2-b:4,5-b′]并二噻吩(M1),BT,FBT的合成路线分别按文献所得[19-21]。单体M1,聚合物PBDT-BT与 PBDT-FBT的合成路线如图式1所示,本文章仅对合成M1的最后一步反应过程进行阐述,聚合物的制备条件为等物质量的三甲基锡单体与二溴物质在三(二亚苄基丙酮)二钯(Pa2(dba)3)和三(3-甲氧基苯基)膦(P(oTol)3)的催化下,进行Still-coupling偶联反应。

图1 单体M1和聚合物的合成路线
(1)2,6-双(三甲基锡)-4,8-双(2,3-二辛基噻吩-5-基)-苯[1,2-b:4,5-b′]并二噻吩(M1)的合成
称取4,8-双(2,3-二辛基噻吩-5-基)-苯[1,2-b:4,5-b′]并二噻吩(2.0 g,1.9 mmol)于250 mL三口烧瓶中,氩气保护下,加入80 mL无水THF,在-10 ℃下逐滴加入正丁基锂(4.3 mL,1.6 M),保持-10 ℃反应3 h。将氯化三甲基锡(1.5 g,7.6 mmol)溶解于10 mL无水正己烷中,-10 ℃下一次性加入反应液反应1 h,后继续在室温避光条件下反应12 h。加入少量水淬灭反应,石油醚萃取,水洗,无水硫酸钠干燥,旋干溶剂得到黄色固体,柱层析分离提纯(氧化铝;洗脱剂/石油醚),异丙醇重结晶2次后,得1.47 g淡黄色针状晶体(产率62%)。
1H NMR (400 MHz,CDCl3) δ (ppm):7.72 (s, 2H), 7.23 (s, 2H), 2.73~2.87 (t, 4H), 2.56~2.63 (t, 4H), 1.57~1.80 (m, 8H), 1.17~1.50 (m, 40H), 0.80~0.99 (t, 12H), 0.28~0.52 (t, 18H)。Anal. calcd. for C56H90S4Sn2: C 59.58, H 8.03, S 11.36; found: C 59.64, H 7.98, S 11.39。
(2)聚合物PBDT-BT的制备
将M1(213.4 mg,0.2 mmol)和苯并噻二唑(58.8 mg,0.2 mmol),用6 mL精制脱气的甲苯和0.8 mL的DMF溶解,抽真空5 min后加入Pd(dba)2(2 mg)和P(oTol)3(4 mg),继续抽真空20 min。在氩气保护下反应回流48 h后,分别用10 mg反应物M1和2-溴噻吩封端,各反应4 h。冷却至室温后,用200 mL的甲醇沉淀,抽滤,分别用乙醇、丙酮、正己烷进行索氏抽提。以甲苯为洗脱剂柱层析分离提纯后,再次用150 mL甲醇沉淀,真空干燥后得到139.0 mg黑色固体。(产率78.7%) Anal. calcd. for C58H78N2S3: C 77.45, H 8.74, N 3.11, S 10.69; found: C 77.95, H 8.69, N 3.23, S 10.13。 Mn=21.6 kg/mol, PDI=1.86。
(3)聚合物PBDT-FBT的制备
聚合物PBDT-FBT的制备方法同PBDT-FBT。聚合后得到151.3 mg黑色固体(产率82.3%)。 Anal. calcd. for C58H76F2N2S3: C 74.47, H 8.19, N 2.99, S 10.28; found: C 74.52, H 8.09, N 3.01, S 10.33。Mn=19.6 kg/mol, PDI=1.78。
2 结果与讨论
2.1聚合物的热稳定性
聚合物的热稳定性由热失重分析仪(TGA)进行表征,TGA的升温速率设为10 ℃/min。如图2所示,聚合物PBDT-BT与PBDT-FBT的热失重5%温度(Td)分别为412 ℃和414 ℃,说明高温对该材料的结构影响很小,聚合物结构中氟原子的引入并未对聚合物的热稳定性产生影响。在聚合物的器件制作,特别在退火时,聚合物的Td在400 ℃以上能保证聚合物的结构不容易发生变化。良好的热稳定性是聚合物广阔应用前景的保障,此类聚合物很适用于聚合物太阳能电池器件的制备。

图2 聚合物的TGA分析曲线
2.2聚合物的光学性质
聚合物PBDT-BT和PBDT-FBT在三氯甲烷溶液和固体薄膜中的紫外-可见吸收光谱分别如图3所示。三氯甲烷溶液中,聚合物PBDT-BT的最大吸收峰分别出现在337 nm、417 nm和652 nm;聚合物PBDT-FBT的最大吸收峰分别出现在335 nm、413 nm、466 nm和644 nm。固体薄膜中,聚合物PBDT-BT的最大吸收峰分别出现在341 nm、425 nm和675 nm;聚合物PBDT-FBT的最大吸收峰分别出现在339 nm、414 nm、472 nm和654 nm。与溶液状态下相对比,PBDT-BT和PBDT-FBT在固体薄膜状态下分别有21 nm和10 nm的红移。光谱的红移显示出聚合物在薄膜状态下发生了聚集,这表明它的分子间相互作用较强,有利于分子间的排列,可能对相应器件中的电荷传输起到促进作用,能在一定程度上提高聚合物的空穴迁移率[22-23]。但氟原子的引入对紫外吸收的变化并不明显,吸收可见光的范围略微变窄,表明氟原子并不能减小此类聚合物的光学带隙。通过图b得到两个聚合物的吸收带边,可以算出其光学带隙(具体结果见表1)。


图3 聚合物在三氯甲烷溶液(a)和在固体薄膜(b)的紫外吸收光谱
2.3聚合物的电化学性质

表1 聚合物的光学和电化学参数Table 1 Optical and Electrochemical Data of the Copolymers

图4 聚合物的循环伏安曲线图
循环伏安法常用于测定有机半导体材料电化学性能、确定材料最低未占轨道能级(LUMO)和最高占有轨道能级(HOMO)。通过测定各聚合物的起始氧化电位(EOX),从而确定聚合物的HOMO能级,通过光学能带隙并且利用公式:ELUMO=EHOMO+Eg,计算出聚合物的LUMO能级。在进行定标时,二茂铁的电位在0.18 eV (已知二茂铁的确定能级为-4.8 eV)。从而聚合物的HOMO能级可以用公式:EHOMO=-(EOX+4.62)(eV)计算[24-25]。聚合物的循环伏安曲线见图4,可得聚合物 PBDT-BT与PBDT-FBT的起始氧化电位分别为0.88 eV, 0.94 eV。各聚合物的HOMO,LUMO能级见表1,PBDT-FBT相比PBDT-BT的HOMO能级降低了0.06 eV,表明氟原子的引入能降低此类聚合物的HOMO能级。较低的HOMO能级是获得较大的开路的电压的可靠保障。聚合物的LUMO能级与PC71BM的LUMO能级的势能差也超过了0.3 eV,保证了聚合物与PC71BM共混做成器件后激子的分离。
2.4聚合物的光伏性能
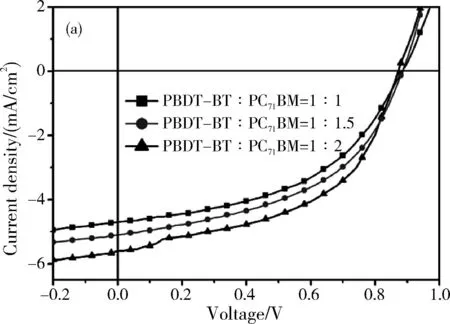



图5 聚合物与PC71BM在1:1,1:1.5和1:2比例下的优化的光伏性能参数
在聚合物太阳能电池光伏性能的表征中,我们选择PC71BM作为受体材料,用正置器件结构进行性能测试。器件的性能均在标准太阳光AM 1.5 G(100 mW/cm2)的模拟器照射下进行测试。正置器件的实验条件为:聚合物材料分别与PC71BM共混,分别配制成质量比为1:1,1:1.5,1:2的三种比列的溶液,溶剂为氯苯(CB),添加3%的DIO,浓度为9 mg/mL,用作活性层。器件结构如下:ITO/PEDOT:PSS/Active Layer/Ca/Al。其中,ITO玻璃使用前用清洗液、去离子水、丙酮、异丙醇清洗并干燥备用,然后用O2等离子清洗ITO玻璃12 min;PEDOT:PSS在4000 rpm/min的条件下旋涂成膜(30 nm),在空气中分别以不退火和160 ℃退火30 min进行优化;Ca和Al在真空度低于2×10-4Pa的条件下分别蒸镀8 nm和100 nm;活性层(Active Layer)在干燥的,充满N2的手套箱内制备。两聚合物正置器件的J-V曲线和EQE曲线如图5所示。

表2 聚合物太阳能电池的光伏性能数据Table 2 Photovoltaic performances of polymer solar cells
由表2看出,此类聚合物有相对较高的开路电压,PBDT-BT和PBDT-FBT开路电压均已超过0.85 eV,此结果与两聚合物较低的HOMO能级相符合,虽然氟原子的引入未能提高聚合物的开路电压,但聚合物的短路电流却有明显的提高,可能在引入氟原子后,聚合物与PC71BM的相分离效果更好,退火操作后PBDT-FBT的表面形貌比PBDT-BT更好,形成的聚合物/PC71BM互穿网络更利于载流子的迁移。虽然PBDT-FBT的HOMO能级比PBDT-BT略低,但并没有获得更高的开路电压,这可能是因为BDT单元4,8位噻吩的两条较长的烷基链影响了聚合物π-π堆积。PBDT-BT作为器件活性层给体材料的最高效率在PBDT:PC71BM=1:2下得到,Jsc=5.6 mA·cm-2,Voc=0.87 eV,FF=49.84%,PCE=2.42。PBDT-FBT作为器件活性层给体材料的最高效率则在PBDT-FBT:PC71BM=1:1时获得,Jsc=8.13 mA·cm-2,Voc=0.88 eV,FF=49.60%,PCE=3.55。
图5(c)与图5(d)分别表示出了聚合物PBDT-BT/PC71BM器件与PBDT-FBT/PC71BM器件的外量子效率(EQE)。EQE曲线与聚合物Jsc的大小有着很好的匹配度。在PBDT-FBT与PC71BM的三种不同共混比例下,EQE值变化不大,最高可以达到40%,且400~700 nm下的EQE值均超过了30%,从而短路电流在各条件下的变化较小。而PBDT-BT与PC71BM在不同共混比例下的EQE值变化较明显,在400~700 nm下有15%至30%的变化幅度,从而相对短路电流的变化也更为明显。从图5(c)和图5(d)可明显看出,引入氟原子后外量子效率有较为显著的增大,即双侧链噻吩取代BDT衍生物所制备的聚合物可以通过引入氟原子来提高短路电流。
3 结 论
通过still-coupling偶联反应,合成了两种基于双侧链噻吩修饰的苯并二噻吩共轭聚合物,并比较了含氟与不含氟原子聚合物的物理,化学,光伏性能的差异。此类聚合物在引入氟原子后紫外吸收变化不大,光学带隙略有增加。虽然HOMO能级有一定的降低,但聚合物的开路电压并未提高。短路电流显著增大,可能与PBDT-FBT的表面形貌比PBDT-BT更好有关,形成的聚合物/PC71BM互穿网络更利于载流子的迁移。PBDT-BT与 PBDT-FBT作为活性层给体材料,PC71BM作为受体材料制备的聚合物器件的最高效率分别为2.42%与3.55%
[1]Thompson B C, Frechet J M. Polymer-fullerene composite solar cells [J]. Angew. Chem. Int. Ed., 2008, 47(1):58-77.
[2]Günes S, Neugebauer H, Sariciftci N S. Conjugated polymer-based organic solar cells [J]. Chem. Rev., 2007, 107(4):1324-1338.
[3]Zhang Y, Hau S K, Yip H-L, et al. Efficient polymer solar cells based on the copolymers of benzodithiophene and thienopyrroledione [J]. Chem. Mater., 2010, 22(9):2696-2698.
[4]Ye L, Zhang S, Huo L, et al. Molecular design toward highly efficient photovoltaic polymers based on two-dimensional conjugated benzodithiophene [J]. Acc. Chem. Res., 2014, 47(5):1595-1603.
[5]Pan H, Li Y, Wu Y, et al. Low-temperature, solution-processed, high-mobility polymer semiconductors for thin-film transistors [J]. J. Am. Chem. Soc., 2007, 129(14):4112-4113.
[6]Hou J, Park M-H, Zhang S, et al. Bandgap and molecular energy level control of conjugated polymer photovoltaic materials based on benzo [1, 2-b: 4, 5-b′] dithiophene [J]. Macromolecules, 2008, 41(16):6012-6018.
[7]Huang Y, Guo X, Liu F, et al. Improving the Ordering and Photovoltaic Properties by Extending π-Conjugated Area of Electron-Donating Units in Polymers with D-A Structure [J]. Adv. Mater., 2012, 24(25):3383-3389.
[8]Zhang S, Uddin M A, Zhao W, et al. Optimization of side chains in alkylthiothiophene-substituted benzo [1, 2-b: 4, 5-b′] dithiophene-based photovoltaic polymers [J]. Polymer Chemistry, 2015, 6(14):2752-2760.
[9]袁延华, 同军锋. 基于苯并二噻吩不同侧链共聚物的合成及光伏性能[J]. 广州化工, 2015, 43(9):5-9.
[10]Cui C, Wong W-Y, Li Y. Improvement of open-circuit voltage and photovoltaic properties of 2D-conjugated polymers by alkylthio substitution [J]. Energy Environ. Sci., 2014, 7(7):2276-2284.
[11]Mei J, Bao Z. Side chain engineering in solution-processable conjugated polymers [J]. Chem. Mater., 2013, 26(1):604-615.
[12]Chen M S, Lee O P, Niskala J R, et al. Enhanced solid-state order and field-effect hole mobility through control of nanoscale polymer aggregation [J]. J. Am. Chem. Soc., 2013, 135(51):19229-19236.
[13]Zhang F, Hu Y, Schuettfort T, et al. Critical role of alkyl chain branching of organic semiconductors in enabling solution-processed n-channel organic thin-film transistors with mobility of up to 3.50 cm2V-1s-1[J]. J. Am. Chem. Soc., 2013, 135(6):2338-2349.
[14]Meager I, Ashraf R S, Mollinger S, et al. Photocurrent enhancement from diketopyrrolopyrrole polymer solar cells through alkyl-chain branching point manipulation [J]. J. Am. Chem. Soc., 2013, 135(31):11537-11540.
[15]Yang L, Tumbleston J R, Zhou H, et al. Disentangling the impact of side chains and fluorine substituents of conjugated donor polymers on the performance of photovoltaic blends [J]. Energy Environ. Sci., 2013, 6(1):316-326.
[16]Umeda N, Ueno T, Pohlmeyer C, et al. A photocleavable rapamycin conjugate for spatiotemporal control of small GTPase activity [J]. J. Am. Chem. Soc., 2010, 133(1):12-14.
[17]Zhou H, Yang L, Stuart A C, et al. Development of fluorinated benzothiadiazole as a structural unit for a polymer solar cell of 7% efficiency [J]. Angew. Chem., 2011, 123(13):3051-3054.
[18]Zhang M, Guo X, Zhang S, et al. Synergistic effect of fluorination on molecular energy level modulation in highly efficient photovoltaic polymers [J]. Adv. Mater., 2014, 26(7):1118-1123.
[19]Wang M, Hu X, Liu P, et al. Donor-acceptor conjugated polymer based on naphtho [1, 2-c: 5, 6-c] bis [1, 2, 5] thiadiazole for high-performance polymer solar cells [J]. J. Am. Chem. Soc., 2011, 133(25):9638-9641.
[20]Edelmann M J, Raimundo J-M, Utesch N F, et al. Dramatically enhanced fluorescence of heteroaromatic chromophores upon insertion as spacers into oligo (triacetylene) s [J]. Helv. Chim. Acta, 2002, 85(7):2195-2213.
[21]Zhang Y, Chien S-C, Chen K-S, et al. Increased open circuit voltage in fluorinated benzothiadiazole-based alternating conjugated polymers [J]. Chem. Commun., 2011, 47(39):11026-11028.
[22]Yang M, Peng B, Liu B, et al. Synthesis and photovoltaic properties of copolymers from Benzodithiophene and Thiazole [J]. J. Phys. Chem. C., 2010, 114(41):17989-17994.
[23]Zhang M, Guo X, Li Y. Synthesis and characterization of a copolymer based on thiazolothiazole and dithienosilole for polymer solar cells [J]. Adv. Eng. Mater., 2011, 1(4):557-560.
[24]Hendriks K H, Li W, Wienk M M, et al. Small-bandgap semiconducting polymers with high near-infrared photoresponse [J]. J. Am. Chem. Soc., 2014, 136(34):12130-12136.
[25]Pommerehne J, Vestweber H, Guss W, et al. Efficient two layer leds on a polymer blend basis [J]. Adv. Mater., 1995, 7(6):551-554.
Effect of Fluorination on Performance of Benzodithiophene-based Conjugated Polymers
WANG Xun-chang1, ZHOU Wen-pei1, WANG Feng1, XIA Yang-jun2
(1 Key Laboratory for Green Chemical Engineering and Process of Ministry of Education,WuhanInstituteofTechnology,HubeiWuhan430073;2KeyLaboratoryofOpto-technologyandIntelligentControlofMinistryofEducation,LanzhouJiaotongUniversity,GansuLanzhou730070,China)
Two donor-acceptor (D-A) types of conjugated polymers were synthesized through palladium-catalyzed stille polymerization. The change of thermodynamic, optical, optoelectronic and photovaltic properties was investigated when incorporating the fluorine atom into the dialkythio-substituted BDT-based polymers. With the polymer/PC71BM as active layer, the ratio of donor/acceptor was studied how to influence the performances of polymer solar cells. The resulting polymers exhibited excellent thermal stability with decomposition temperature up to 400 ℃ and a broad absorption spectrum. The low HOMO energy level leaded to a high Voc over 0.85 eV. PBDT-BT and PBDT-FBT based on an device configuration of ITO/PEDOT:PSS/Active Layer/Ca/Al showed good photovoltaic performances with power conversion efficiency of 2.42% and 3.55% respectively.
benzodithiophene; fluorination; conjugated polymers; power conversion efficieny
王迅昶(1989-),男,硕士,主要从事光电材料的合成与研究。
汪锋,男,教授,主要研究方向:高分子功能材料的合成与应用。
TK519
A
1001-9677(2016)014-0091-05
