基于核磁共振的代谢组学技术在脑梗死中的研究进展
2016-08-25夏能志杨运俊温州医科大学附属第一医院放射科浙江温州325000
阮 磊 夏能志 杨运俊温州医科大学附属第一医院放射科,浙江温州 325000
基于核磁共振的代谢组学技术在脑梗死中的研究进展
阮磊夏能志杨运俊▲
温州医科大学附属第一医院放射科,浙江温州325000
脑梗死是缺血性脑血管病的严重表现形式,其致残、致死及复发率均较高。近年来随着神经影像技术的不断发展,脑梗死的影像学研究正由传统的大体形态学向功能、分子水平转变。基于核磁共振的代谢组学技术在脑梗死中的逐渐应用,使得人们对脑梗死的研究深入到细胞代谢水平,对于理解脑梗死的病理生理变化、诊断、预后和疗效的判断均有重要意义。因此,本文基于核磁共振的代谢组学技术在脑梗死研究方面的进展进行综述。
代谢组学;脑梗死;细胞代谢;核磁共振
[Abstract]Cerebral infarction is a serious form of ischemic cerebrovascular disease and has high disability,mortality and recurrence rate.With the development of neuroimaging techniques in recent years,the imaging study of cerebral infarction is changing from the tradition general morphology to the function and molecular levels.The gradual application of nuclear magnetic resonance(NMR)-based Metabonomics on cerebral infarction makes the study of cerebral infarction deeper into the level of cell metabolism,and has great significance in understanding the pathophysiology,diagnosis,prognosis and curative effect of cerebral infarction.Therefore,this article reviewed the progress of NMR-based Metabonomics on cerebral infarction research.
[Key words]Metabonomics;Cerebral infarction;Cell metabolism;Nuclear magnetic resonance(NMR)
代谢组学(Metabonomics)是指通过定性定量分析生物体系受刺激或扰动后其代谢产物的变化,叙述机体在内外环境变化后代谢过程的动态反应规律,从而研究生物体系代谢途径的一种技术,是继基因组学、转录组学和蛋白质组学之后发展起来的一门新兴组学[1,2]。Nicholson等[1,3]于 1999年首次提出“Metabonomics”的概念,认为代谢组学能检测、识别和量化整个生物系统而不是单个细胞的代谢变化,并利用NMR在疾病诊断、药物筛选等方面做了大量的研究工作。随后,Fiehn等[4]根据研究的对象和目的不同,将对生物体系的代谢产物分析分为4个层次:①代谢物靶标分析;②代谢轮廓分析;③代谢组学分析;④代谢物指纹分析。代谢组学研究的对象大多是相对分子质量为1000以下的小分子代谢物,其在生物医学的主要分析技术包括核磁共振(Nuclear magnetic resonance,NMR)、气相色谱-质谱法(GC-MS)和液相色谱-质谱法(LC-MS)。随着代谢组学技术的不断发展,代谢组学中生物标志物的研究受到广泛关注,而基于NMR的代谢组学技术是代谢组学普遍采用的方法[5,6]。
研究表明,我国约有700万脑卒中患者,且发生率正以每年8.7%的速度上升,每年用于治疗脑卒中的费用高达数百亿元人民币,给患者家庭和社会造成沉重的负担[7-9]。其中缺血性脑卒中约占60%~80%,而脑梗死是其严重表现形式[10]。缺血脑组织的损伤机制非常复杂,涉及病理生理、生化、细胞信号转导等多种改变,近年来随着神经影像技术的不断发展,脑梗死的影像学研究正由传统的大体形态学向功能、分子水平转变。因此了解缺血脑的组织分子代谢水平的变化规律,对于辅助临床诊断及判断疾病预后和治疗效果均有非常重要的意义。
1 基于NMR的代谢组学技术
基于NMR的代谢组学技术主要是利用高磁场中原子核对射频辐射的吸收光谱鉴定体液中化合物结构,通过检测一系列样品的NMR谱图,再结合模式识别方法,对生物体的体液和组织进行系统测量和分析,对完整的生物体中随时间改变的代谢物进行动态跟踪检测、定性定量,然后将这些代谢信息与病理生理过程中的生物学事件关联起来,可以判断出生物体的病理生理状态,并有可能找出与之相关的生物标志物[1,3]。经过几十年的发展,NMR已成为测定分子结构最有效的工具之一,其可以测定多种核素,如1H、2H、13C、17O、19F、14N、15N、31P、23Na、39K等,其中最常用的核素是1H、13C和31P[11,12]。由于NMR所需样本用量小、无需分离技术,基于NMR的代谢组学技术已广泛用于药物毒理性评定、生物信息学研究、代谢性疾病、肿瘤学等的检测[13]。近年来,随着代谢物波谱数据库的建立和完善,样品中代谢物的鉴定将变得更加容易。
基于NMR的代谢组学研究中采集得到的是多维的、大量的数据,数据处理一般遵循以下步骤[14]:①NMR谱图采集,并校正基线和相位;②谱图预处理,包括归一化、分段积分和尺度标准化处理;③采用模式识别方法进行聚类分析和生物标志物的识别。主成分分析经过SIMCA软件处理后,可以得到得分图和载荷图两种分布图。从得分图上可观察样品的离散、聚集程度,还能反映样品随时间的动态变化过程。样品分布点越集中,说明这些样品中所含有的变量/分子的组成和浓度越接近,反之则差异越大。在载荷图中,变量分布与得分图中的样品分布和位置相对应,表示所检测的变量(如NMR中的化学位移)分布情况。然而载荷图只能粗略寻找差异化合物,若要确定化合物之间差异的显著性,则须借助相应的统计分析方法。
2 缺血脑组织的代谢物变化
脑梗死发生时会出现脑代谢障碍,造成线粒体有氧代谢中断、ATP生成减少,从而导致葡萄糖通过无氧酵解产生乳酸(Lactate,Lac)供能,而另一种能量储存方式的磷酸肌酸亦分解成肌酸(Creatine,Cr)供能[15]。此外,N-乙酰基天冬氨酸(N-acetyl aspartate,NAA)、胆碱(Choline,Cho)、谷氨酸(Glutamate,Glu)、谷氨酰胺(Glutamine,Gln)、γ-氨基丁酸 (Gamma-Amino-Butyric Acid,GABA)、丙氨酸 (Alanine,Ala)、甘氨酸(Glycine,Gly)、天冬氨酸(Aspartate,Asp)、肌醇(myo-Inositol,m-Ins)、琥珀酸(Succinate,Suc)、牛磺酸(Taurine,Tau)等脑内代谢物均会发生相应变化。通过在体或离体NMR分析脑梗死后代谢物的变化,对研究脑梗死的发病和预后具有重要的医学价值和社会价值。
2.1NAA
NAA主要存在于成熟的神经元胞体和轴突内,在神经元线粒体或内质网内由天门冬氨酸和乙酰辅酶A合成,是脑内含量仅次于Glu的氨基酸衍生物,通常位于谱图的2.02 ppm处,是正常人脑MRS中的最高峰。这种高峰信号还包含一小部分其他乙酰混合物信号,比如N-乙酰天门冬氨酰谷氨酸(NAAG)、N-乙酰神经氨酸。NAA反映神经元的密度和活性状态,可能与神经元的渗透压调节、轴突-胶质细胞间信号传递有关[16,17]。在急性脑梗死患者中,NAA含量降低常被认为是缺血后脑损伤的标志,其降低的水平反映了缺血脑组织损伤的严重程度,即降低的程度越大表明丢失的神经元越多[18]。多数研究表明,脑梗死患者梗死核心NAA于超急性期出现轻度下降,急性期显著下降,慢性期下降达最低水平,标志着脑神经元出现了不可逆性损伤[19]。急性期NAA的降低可能是由于NAA的合成减少和分解增加所致。有临床试验表明,NAA下降率为0.67 μg/(kg·h),高于正常成人脑中NAA的合成速率0.55 μg/(kg·h)[20]。同时,由于NAA的合成是ATP依赖性的,能量的缺乏会使NAA持续降低。Munoz等[21]对51例急性脑缺血患者进行1H-MRS检查发现,缺血区和缺血周围组织的NAA进行性下降,表明神经损伤从缺血发生后到2周甚至更长时间可持续存在。Lei等[22]对缺血30 min后再灌注小鼠的研究发现,缺血侧纹状体的NAA含量在缺血后3 h显著降低,且缺血24 h仍然显著减少。
有研究显示,NAA与梗死面积及临床预后相关,一般大面积梗死患者NAA降低程度较小面积梗死者更严重,而NAA的恢复或升高可能预示好的预后[23,24]。Brulatout等[25]利用在体NMR对全脑缺血30 min后再灌注大鼠的研究发现,NAA先呈显著降低,恢复灌注后再逐渐恢复。NAA降低程度通常较Cho和Cr更大,可能是因为脑梗死区神经元较胶质细胞对缺血更敏感,当神经元功能受损时,胶质细胞结构尚完整[26]。
2.2Lac
Lac是无氧糖酵解的产物,被认为是脑梗死开始阶段最敏感的标志物[6,27]。当谱图中出现Lac峰时,常提示脑组织存在缺血、缺氧,脑细胞有氧代谢障碍而无氧糖酵解加强。脑缺血刚发作时Lac含量最高,其反映存活神经元的代谢紊乱而非神经元的坏死情况[24]。脑缺血后Lac含量的升高可分为两个阶段:第一个阶段是脑组织缺血缺氧后的无氧酵解,第二个阶段于再灌注后1 h开始增加并可持续到再灌注72 h。后者Lac含量的升高可能是由于胶质细胞Lac代谢的增加所致[28]。脑梗死后Lac可从急性期到慢性期持续升高,可作为慢性脑缺血的标记。Lac的持续升高可能是因为Lac随梗死区细胞的溶解而缓慢扩散,或由缺血半暗带神经元及渗入的炎性细胞产生。Lac的升高程度与缺血程度和血液中葡萄糖浓度有关。有研究表明,低血糖能阻止大鼠脑缺血再灌注导致的乳酸增加,可能是低血糖能减少缺血后代谢的负担,而且低血糖对缺血后游离脂肪酸和兴奋性氨基酸水平的影响较小[29]。Lac在缺血数天后会被清除,而其持续升高也可能源于其合成和清除的失衡[30]。然而,这种持续性升高并非绝对的。Gideon等[31]利用MRS对脑梗死患者的长期随访发现,Lac可以在脑缺血后1~4周降低,而在7~15个月的慢性期又重新出现。
急性期Lac含量升高和NAA水平降低可反映梗死核心的形成。Henriksen等[32]研究急性期Lac和相对脑血流量的关系发现,两者成反向关系,且Lac在缺血区分布不均,梗死核心Lac比梗死周围区含量高。研究表明,NAA与Lac的综合分析对于区别梗死核心与脑缺血半暗带有重要的价值,NAA显著降低、Lac明显升高的区域可能为不可逆损伤区,而Lac显著升高、NAA正常或轻度下降的区域可能为脑缺血半暗带[33]。
2.3Cho和Cr
既往临床研究常以Cho和Cr作为参照物,来计算NAA和Lac的相对浓度,其认为脑梗死患者Cho和Cr的浓度不会发生显著变化[34,35]。但近年来国内外多数研究表明,Cho和Cr在脑梗死时并不是恒定不变的,不同脑梗死时期其浓度不同。有研究发现,Cr在脑梗死后3个月持续降低,而Cho在脑梗死后2周明显降低,随后逐渐上升至正常水平[36]。Cho主要存在于细胞膜,是细胞膜和鞘磷脂的标志物。谱图上Cho峰由磷酸胆碱、甘油磷酸胆碱、游离胆碱构成,其峰值高低取决于膜磷脂和神经递质乙酰胆碱的浓度。Cho浓度升高表明细胞膜合成增加或细胞数量增加,降低则表明细胞膜的破坏[37]。
谱图上的Cr峰由肌酸和磷酸肌酸共同构成,其存在于神经元和胶质细胞中,是细胞内磷酸转运系统和能量缓冲系统的标志物[38]。作为一种能量储备形式,Cr在ATP不足时参与机体供能,对于维持细胞能量代谢起着重要作用。Cr在缺血24 h后开始降低,可持续降低到缺血后96 h[18],提示超急性期由于脑缺血而出现明显的能量代谢障碍,从而导致高能磷酸代谢物减少,说明神经元对缺血的反应非常敏感。研究表明,脑梗死超急性期Cr开始显著下降,随着梗死时间延长,急性期至亚急性期Cr逐步降低,至慢性期降到较低水平。脑梗死患者Cr与NAA下降趋势基本保持一致,但Cr下降程度不及NAA明显[39]。有研究表明,NAA/Cr和Cho/Cr可反映缺血性脑白质损伤患者的认知功能障碍情况,重度认知障碍患者NAA/Cr和Cho/Cr降低,而对轻中度认知障碍患者,NAA/Cr降低而Cho/Cr明显增加[40]。
2.4Glu、Gln和GABA
Glu、Asp是兴奋性氨基酸,对神经元有兴奋作用,然而其浓度过高则可产生神经毒性作用;GABA和Gly是抑制性氨基酸,能抑制神经兴奋,在一定程度上可抵消兴奋性神经毒性作用[41,42]。通常情况下,机体中兴奋性氨基酸和抑制性氨基酸处于一个动态平衡之中[43]。有研究表明,神经元和神经胶质细胞间存在Gln-Glu-GABA循环,即神经元释放至胞外的Glu可被神经胶质细胞吸收,在谷氨酰胺合成酶的作用下转化成Gln,然后神经胶质细胞中的Gln被转运至神经元中被谷氨酰胺酶水解成Glu,此外在GABA能神经元中,Glu在谷氨酸脱羧酶的作用下形成GABA。Glu虽然是脑内最重要的兴奋性神经递质,但是体内合成的谷氨酸却不能通过血脑屏幕,所以只能通过Gln-Glu途径产生的Glu才能作为神经递质发挥作用。
在缺血条件下Glu含量急剧升高,致使神经元上非N-甲基-D-天冬氨酸(NMDA)受体活化、钠离子通道开放,造成大量钠离子内流,引起细胞肿胀[44]。同时过量的Glu还可活化NMDA受体,促使钙通道开放,钙离子大量内流造成钙超载,神经细胞严重受损,甚至死亡。脑内谷氨酸兴奋性神经毒性是脑缺血性损伤的主要因素,而且缺血改变了星形胶质细胞与神经元间Gln-Glu循环,梗死核心的胶质细胞由于缺氧而不能将细胞外积累的Glu转化为Gln,抑制了星形胶质细胞对Glu的吸收,导致Glu浓度进一步升高[45]。有实验研究表明,Glu在缺血后2 h含量达到最高,MRS联合ADC、DWI可通过定量分析代谢物的浓度评估超急性期脑缺血发作时间[46]。
2.5其他
m-Ins普遍存在于胶质细胞中,对维持细胞内外环境渗透压的稳定起重要作用,是胶质细胞功能受损的敏感标志物[6]。Tau也主要存在于胶质细胞中,是一种重要的抑制性神经递质,有保护和调节神经的作用,可以促进神经元增殖和分化[42]。Suc是三羧酸循环中的重要物质,同时参与Glu-GABA-Suc代谢旁路,即除了参与能量代谢循环外,还参与Glu及GABA的平衡[47]。Ala是体内非必需氨基酸,存在诸多代谢途径,在酶的催化下可转变为丙酮酸参与糖酵解,且与Glu互为可逆反应。
脑缺血可导致三羧酸循环、糖酵解、氨基酸、磷脂和核苷酸代谢等代谢变化,基于NMR的代谢组学技术已成为分析脑缺血代谢物变化的有力检查手段。通过1H-MRS检测脑缺血各阶段的代谢标记物的变化对脑梗死的诊断、治疗和预后具有重要的指导意义。
[1]Nicholson JK,Connelly J,Lindon JC,et al.Metabonomics:A platform for studying drug toxicity and gene function[J]. Nat Rev Drug Discov,2002,1(2):153-161.
[2]Collins FS,Green ED,Guttmacher AE,et al.A vision for the future of genomics research[J].Nature,2003,422(6934):835-847.
[3]Nicholson JK,Lindon JC,Holmes E.'Metabonomics':Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J].Xenobiotica,1999,29(11):1181-1189.
[4]Fiehn O.Combining genomics,metabolome analysis,and biochemical modelling to understand metabolic networks[J]. Comp Funct Genomics,2001,2(3):155-168.
[5]Liu K,Ye XJ,Hu WY,et al.Neurochemical changes in the rat occipital cortex and hippocampus after repetitive and profound hypoglycemia during the neonatal period:An ex vivo 1H magnetic resonance spectroscopy study[J].Mol Neurobiol,2013,48(3):729-736.
[6]Li S,Huang M,Wang X,et al.Retinal metabolic changes in an experimental model of optic nerve transection by ex vivo 1H magnetic resonance spectroscopy[J].Neurochem Res,2011,36(12):2427-2433.
[7]WHO.The top 10 causes of death.World Health Organization[R].2008.
[8]卫生部心血管防治中心.中国心血管病报告2010[R].中国百科全书出版社,2011.
[9]WHO.Lobal burden of disease 2002:Deaths by age,sex and cause for the year 2002[R].World Health Organization,2003.
[10]Zhang LF,Yang J,Hong Z,et al.Proportion of different subtypes of stroke in China[J].Stroke,2003,34(9):2091-2096.
[11]陈文学,邓风,岳勇.核磁共振技术在生物组织中的应用[J].波谱学杂志,2004,21(1):127-139.
[12]Senn T,Hazen SL,Tang WH.Translating metabolomics to cardiovascular biomarkers[J].Prog Cardiovasc Dis,2012,55(1):70-76.
[13]Emwas AHM,Salek RM,Griffin JL,et al.NMR-based metabolomics in human disease diagnosis applications limitations and recommendations[J].Metabolomics,2013,9(5):1048-1072.
[14]Xu J,Zhang J,Cai S,et al.Metabonomics studies of intact hepatic and renal cortical tissues from diabetic db/ db mice using high-resolution magic-angle spinning 1H NMR spectroscopy[J].Anal Bioanal Chem,2009,393(6-7):1657-1668.
[15]李华钢,章军建,姜健等.通过1H磁共振波谱和经颅多普勒超声观察急性脑梗死患者早期代谢物及血流动力学的变化[J].中华物理医学与康复杂志,2003,25 (11):684-688.
[16]Long PM,Moffett JR,Namboodiri AM,et al.N-acetylaspartate(NAA)and N-acetylaspartylglutamate(NAAG)promote growth and inhibit differentiation of glioma stem-like cells[J].J Biol Chem,2013,288(36):26188-26200.
[17]Moffett JR,Ross B,Arun P,et al.N-Acetylaspartate in the CNS:From neurodiagnostics to neurobiology[J].Prog Neurobiol,2007,81(2):89-131.
[18]Igarashi H,Kwee IL,Nakada T,et al.1H magnetic resonance spectroscopic imaging of permanent focal cerebral ischemia in rat:Longitudinal metabolic changes in is chemic core and rim[J].Brain Res,2001,907(1-2):208-221.
[19]Hacke W,Kaste M,Fieschi C,et al.Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemispheric stroke.The European Cooperative A-cute Stroke Study(ECASS)[J].JAMA,1995,274(13):1017-1025.
[20]Ariyannur PS,Moffett JR,Manickam P,et al.Methamphetamine-induced neuronal protein NAT8L is the NAA biosynthetic enzyme:Implications for specialized acetyl coenzyme A metabolism in the CNS[J].Brain Res,2010,8:1-13.
[21]Munoz MS,Cvoro V,Chappell FM,et al.Changes in NAA and lactate following ischemic stroke:A serial MR spec troscopic imaging study[J].Neurology,2008,71(24):1993-1999.
[22]Lei H,Berthet C,Hirt L,et al.Evolution of the neurochemical profile after transient focal cerebral ischemia in the mouse brain[J].J Cereb Blood Flow Metab,2009,29 (4):811-819.
[23]蔺俊斌,廖维靖.N-乙酰天冬氨酸与缺血性卒中的研究进展[J].中国脑血管病杂志,2011,8(9):501-504.
[24]Lemesle M,Walker P,Guy F,et al.Multi-variate analysis predicts clinical outcome 30 days after middle cerebral artery infarction[J].Acta Neurol Scand,2000,102(1):11-17.
[25]Brulatout S,Meric P,Loubinoux I,et al.A one-dimensional(proton and phosphorus)and two-dimensional (proton)in vivo NMR spectroscopic study of reversible global cerebral ischemia[J].J Neurochem,1996,66(6):2491-2499.
[26]王丽红,陈清威,穆耀强.1H-磁共振波谱在脑梗死进展中的应用研究[J].中国医药导刊,2007,9(5):375-378.
[27]Zhang X,Liu H,Wu J,et al.Metabonomic alterations in hippocampus,temporal and prefrontal cortex with age in rats[J].Neurochem Int,2009,54(8):481-487.
[28]Bivard A,Krishnamurthy V,Stanwell P,et al.Spectroscopy of reperfused tissue after stroke reveals heightened metabolism in patients with good clinical outcomes[J].J Cereb Blood Flow Metab,2014,34(12):1944-1950.
[29]Sappey-Marinier D,Chileuitt L,Weiner MW,et al.Hypoglycemia prevents increase in lactic acidosis during reperfusion after temporary cerebral ischemia in rats[J]. NMR Biomed,1995,8(4):171-178.
[30]Graham GD,Blamire AM,Howseman AM,et al.Proton magnetic resonance spectroscopy of cerebral lactate and other metabolites in stroke patients[J].Stroke,1992,23(3):333-340.
[31]Gideon P,Sperling B,Arlien-Soborg P,et al.Long-term follow-up of cerebral infarction patients with proton magnetic resonance spectroscopy[J].Stroke,1994,25(5):967-973.
[32]Henriksen O,Gideon P,Sperling B,et al.Cerebral lactate production and blood flow in acute stroke[J].J Magn Reson Imaging,1992,2(5):511-517.
[33]钟高贤,朱文珍,王伟,等.磁共振DWI、PWI和MRS量化评定超早期脑梗死缺血半暗带[J].放射学实践,2006,21(6):541-545.
[34]Parsons MW,Li T,Barber PA,et al.Combined 1H MR spectroscopy and diffusion-weighted MRI improves the prediction of stroke outcome[J].Neurology,2000,55(4):498-505.
[35]Kim GE,Lee JH,Cho YP,et al.Metabolic changes in the ischemic penumbra after carotid endarterectomy in stroke patients by localized in vivo proton magnetic resonance spectroscopy(1H-MRS)[J].Cardiovasc Surg,2001,9(4):345-355.
[36]Munoz MS,Cvoro V,Armitage PA,et al.Choline and creatine are not reliable denominators for calculating metabolite ratios in acute ischemic stroke[J].Stroke,2008,39(9):2467-2469.
[37]Castillo M,Kwock L,Mukherji SK.Clinical applications of proton MR spectroscopy[J].AJNR,1996,17(1):1-15.
[38]陈若伟,郑文斌.氢质子磁共振波谱定量分析在脑梗死中的应用[J].医学综述,2008,14(2):316-318.
[39]Lanfermann H,Kugel H,Heindel W,et al.Metabolic changes in acute and subacute cerebral infarctions:find ings at proton MR spectroscopic imaging[J].Radiology,1995,196(1):203-210.
[40]Xing Y,Fang F,Zhang X,et al.Proton magnetic resonance spectroscopy and cognitive impairment in patients with ischemic white matter lesions[J].J Res Med Sci,2013,18(12):1061-1066.
[41]Cecil KM,Jones BV.Magnetic resonance spectroscopy of the pediatric brain[J].Top Magn Reson Imaging,2001,12 (6):435-452.
[42]Ying W,Garnier P,Swanson RA.NAD+repletion prevents PARP-1-induced glycolytic blockade and cell death in cultured mouse astrocytes[J].Biochem Biophys Res Commun,2003,308(4):809-813.
[43]Peng H,Li YF,Sun SG.Effects of Ginkgo biloba extract on acute cerebral ischemia in rats analyzed by magnetic resonance spectroscopy[J].Acta Pharmacol Sin,2003,24 (5):467-471.
[44]Suh SW,Hamby AM,Swanson RA.Hypoglycemia,brain energetics,and hypoglycemic neuronal death[J].Glia,2007,55(12):1280-1286.
[45]Pascual JM,Carceller F,Roda JM,et al.Glutamate,glutamine,and GABA as substrates for the neuronal and glial compartments after focal cerebral ischemia in rats[J]. Stroke,1998,29(5):1048-1056.
[46]Yan G,Dai ZZ,Xuan YH,et al.Early metabolic changes following ischemia onset in rats:An in vivo diffusionweighted imaging and 1H-magnetic resonance spec troscopy study at 7.0 T[J].Mol Med Rep,2015,11(6):4109-4114.
[47]Yogeeswari P,Sriram D,Vaigundaragavendran J.The GABA shunt:An attractive and potential therapeutic target in the treatment of epileptic disorders[J].Curr Drug Metab,2005,6(2):127-139.
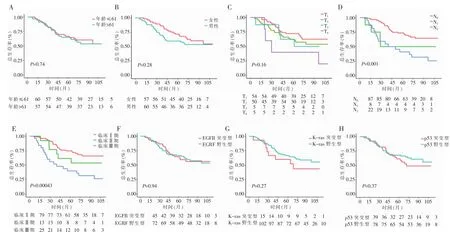
图1 基本特征生存率差异(见内文第5页)
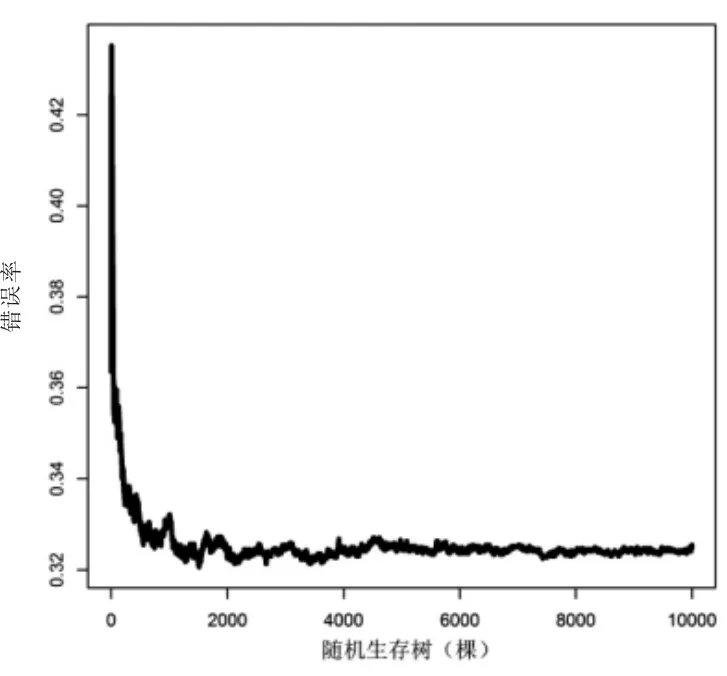
图2 RSF迭代过程(见内文第5页)
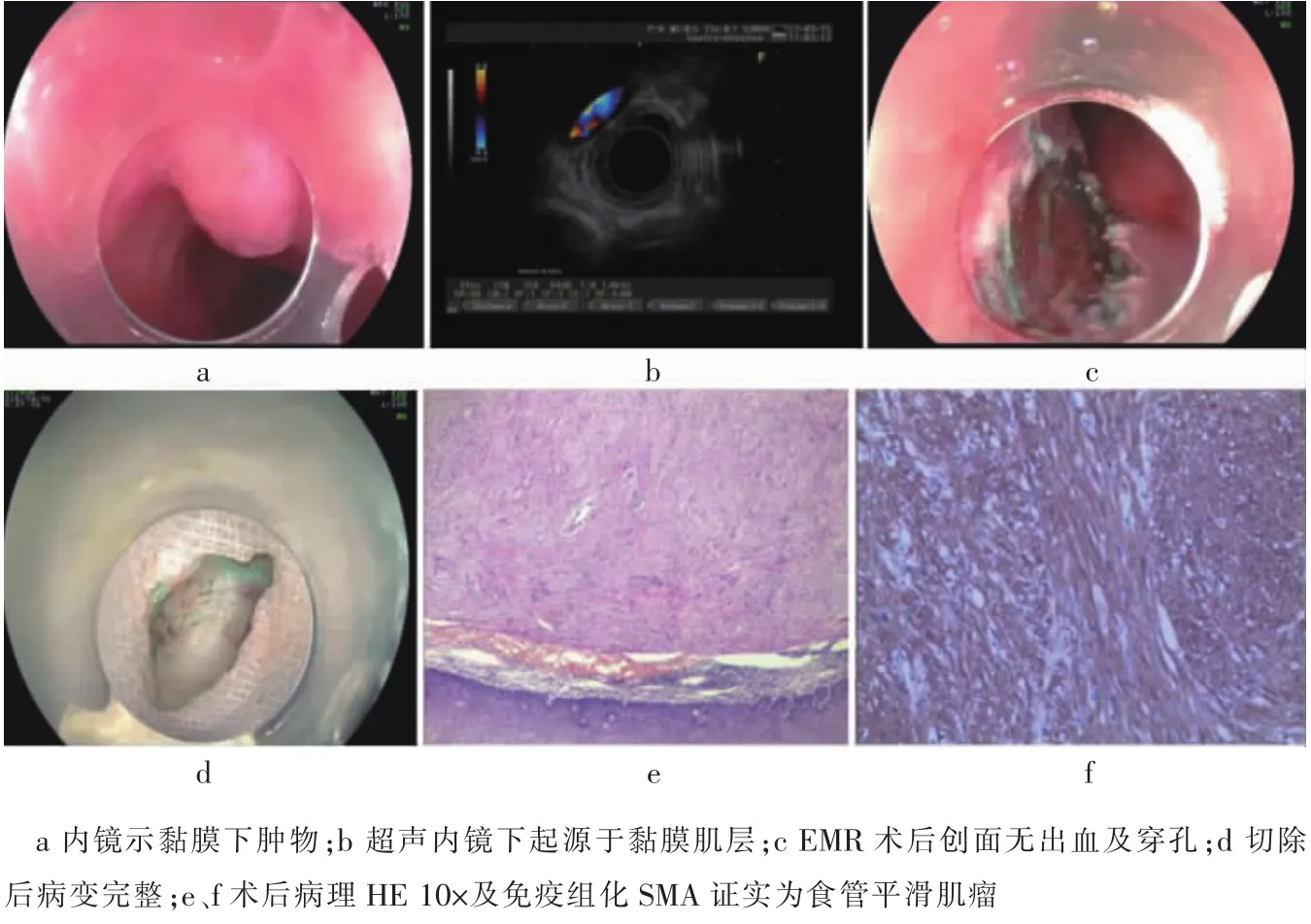
图4 EVS指导下EMR切除食管黏膜肌层平滑肌瘤
(见内文第76页)
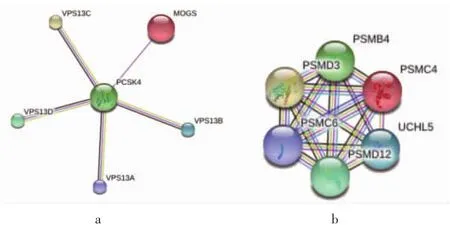
图3 基因调控关系
(见内文第5页)
Advancement of NMR-based Metabonomics on cerebral infarction research
RUAN LeiXIA NengzhiYANG Yunjun
Department of Radiology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou325000,China
图5 牵拉性视网膜脱离(见内文第108页)
图6 病理膜上可见造影剂通过(见内文第108页)
R445.2;R743.33
A
1673-9701(2016)17-0164-05
浙江省温州市科技计划项目(Y20140731);浙江省温州市科技计划项目(Y20150087);浙江省医药卫生科研项目(2014KYA134);浙江省自然科学基金(LY15H220001)▲
(2016-03-12)
