过氧化尿素对桃幼树淹水胁迫的缓解效果研究
2016-08-24肖元松彭福田束怀瑞沈光业王娜娜罗静静赵永飞
肖元松, 彭福田, 束怀瑞, 沈光业, 王娜娜, 罗静静, 赵永飞
(山东农业大学园艺科学与工程学院,山东农业大学作物生物学国家重点实验室,山东泰安 271018)
过氧化尿素对桃幼树淹水胁迫的缓解效果研究
肖元松, 彭福田*, 束怀瑞, 沈光业, 王娜娜, 罗静静, 赵永飞
(山东农业大学园艺科学与工程学院,山东农业大学作物生物学国家重点实验室,山东泰安 271018)
【目的】研究过氧化尿素对淹水胁迫下桃幼树生理特性和光合荧光参数的影响,旨在探明施用过氧化尿素对淹水胁迫下桃幼树胁迫伤害的缓解作用,为人为减轻或克服涝害对桃树的伤害提供有意义的参考。【方法】 以1年生春美/毛桃[Prunus persica (Carr.)Franch.]嫁接苗为试材进行了盆栽试验。首先进行了淹水处理,观察树苗的生长状况; 然后进行使用过氧化尿素肥料盆栽试验。试验共设4个处理,袋控过氧化尿素处理(T1),撒施过氧化尿素处理(T2),撒施普通尿素处理(T3),不施氮肥对照(CK)。肥料全部基施后进行淹水处理,于处理0、1、3、5、7天测定了过氧化尿素在土壤中的氧气释放特征,树苗叶片气体交换参数和地上部生理生化指标,第5天测定了叶绿素荧光参数。【结果】施用过氧化尿素可提高土表水体溶氧量,处理后7天内,袋控过氧化尿素处理水体溶氧量始终维持较高水平。淹水胁迫下,施用过氧化尿素处理桃幼树叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)下降幅度显著低于对照。处理5天后,施用过氧化尿素处理桃幼树叶片光合性能指标(PIABS),最大光化学效率(Fv/Fm),单位面积有活性反应中心的数量(RC/Cso)均高于对照,单位面积的热耗散(DIo/Cso)低于对照,差异显著; 施用过氧化尿素处理(T1和T2)桃幼树叶片的Chla、Chlb和Chl(a+b)分别比对照提高了10.72%、10.86%、10.87和5.71%、4.78%、5.57%,差异显著。施用过氧化尿素处理大大提高淹水胁迫下桃幼树叶片抗氧化酶(SOD、POD和CAT)活性,减少叶片MDA含量的增加幅度。淹水胁迫下施用过氧化尿素处理桃幼树根系活力、根系脯氨酸(Pro)含量高于对照,根系相对膜透性(RMP)和乙醇脱氢酶(ADH)活性低于对照,差异显著。【结论】施用过氧化尿素可提高土表水体溶氧量,提高淹水胁迫下桃幼树叶片抗氧化酶活性,增强植株抗逆性,有效缓解淹水胁迫对树体的伤害作用。
过氧化尿素; 桃幼树; 淹水胁迫; 缓解效果
随着全球气候异常,局部地区暴雨、洪涝灾害频繁发生,淹水胁迫成为植物遭受的主要非生物胁迫之一[1]。长期淹水造成低氧或缺氧等次生胁迫,植物细胞电子传递受阻,活性氧大量积累,细胞膜结构和功能受到破坏,甚至会出现植株大量死亡[2-3]。低氧胁迫下,根系积累大量乙醇、乳酸等有毒物质,根系代谢紊乱,有氧呼吸受到抑制,能量供应缺乏,影响对养分的吸收[4-5]。淹水造成根系氧气供应的减少,会引起植物叶片气孔关闭,气孔导度减小,进而造成叶片净光合速率、光化学量子效率降低[6],同时叶片中总叶绿素和叶绿素a含量下降,导致植株生长和总生物量的减少[7]。
大量降雨,不当灌溉或排水不良等因素常常造成果园积水内涝,土壤处于淹水状态,对果树造成淹水胁迫。桃树为浅根性果树,根系呼吸强度高,对氧气的需求量大,耐涝性较差。淹水条件下土壤中气体被迫排出,容易造成土壤中氧气不足[8-9],若排水不良,不仅会影响树体生长发育、产量和品质的提高,严重的甚至死树。因此,研究通过技术措施减轻湿涝灾害对桃树的伤害具有重要理论和生产应用价值。
有关低氧胁迫的研究多集中在植株对淹水胁迫的适应机理及胁迫响应特性等方面[5,10-11],如何缓解或克服涝害对桃树胁迫伤害的研究尚不多见。研究发现过氧化尿素与水反应可以缓慢放出氧气,提高土表水层溶氧量[12],施加过氧化尿素可以提高土壤溶液中的活性氧含量[13],为根系呼吸提供所需的氧气。为此,本研究以1年生盆栽春美/毛桃[Prunus persica (Carr.)Franch.]嫁接苗为试材,以过氧化尿素为外源氧气供体,研究过氧化尿素在水中氧气释放特性及过氧化尿素对淹水胁迫下桃幼树生理特性和光合荧光参数的影响,旨在探明施用过氧化尿素对淹水胁迫下桃幼树胁迫伤害的缓解作用,为人为减轻或克服涝害对桃树的伤害提供有意义的参考。
1 材料与方法
1.1试验材料与设计

于2013年7、8月份,进行淹水预备试验,观察淹水胁迫下桃幼树生长状况。于2014年7月进行施用过氧化尿素试验,设4个处理:T1, 袋控过氧化尿素处理;T2, 撒施过氧化尿素处理;T3, 撒施普通尿素处理;CK, 不施过氧化尿素和普通尿素为对照。具体处理为:T1, 在盆内挖深7cm的环状沟,将4包袋控过氧化尿素(3.75g/袋)均匀埋入后覆土;T2,在盆内挖深7cm的环状沟,将等量的过氧化尿素(15.00g)均匀地撒施在环状沟内,覆土;T3,在盆内挖深7cm的环状沟,将等氮量的普通尿素(9.78g)均匀地撒施在环状沟内,覆土;CK为保证不同处理间对盆内土壤扰动状况一致,对照处理同样挖深7cm的环状沟后将土回填(各处理距土表7cm处均已见有根系分布)。上述工作完成后将4个处理的盆栽苗分别放入注有水的4个长3m,宽2m,深0.5m的水池内。每处理15盆,每盆1株,3次重复。T1和T2处理所施用的过氧化尿素含氮量与T3处理尿素含氮量相同。并进行重复试验测定相关指标。
所用过氧化尿素为河北三洁化工有限公司生产,含N30%,活性氧16.5%。尿素为市售,含N46%。根据每公斤干土中加入200mg纯氮计算出过氧化尿素的用量,为消除各处理间氮素对试验结果造成的影响,施用等氮量的尿素。
1.1.2 室内过氧化尿素氧气释放特性试验为验证过氧化尿素在水中释放氧气的特性,进行室内过氧化尿素氧气释放特性试验(苗木种植情况及试验土壤情况同1.1.1)。 试验设3个处理:T1,埋入4包袋控过氧化尿素(3.75g/袋);T2,撒施过氧化尿素(15克);CK,不施过氧化尿素为对照。各处理方法同1.1.1。每处理10盆,单株重复。施入过氧化尿素后向盆钵内注水,并始终保持水面距盆内土表5cm左右。
1.2测定项目和方法
1.2.1 土表水层溶解氧含量测定于处理的第0、1、3、5和7天进行,采用便携式溶解氧测定仪测定土表水层中溶解氧含量。每处理重复3次,结果取其平均值。

1.2.3 叶绿素荧光参数的测定于淹水处理第5d进行,采用连续激发式荧光仪(HandyPEA,Hansatech,英国)测定快速叶绿素荧光诱导曲线。每处理重复5次,结果取其平均值。
1.2.4 生理指标的测定于淹水处理的第1、3、5天进行,测定叶片超氧化物歧化酶(SOD),过氧化物酶(POD),过氧化氢酶(CAT)活性和MDA含量。于淹水处理第5d时测定不同处理叶片叶绿素含量,以及根系活力,根系脯氨酸含量和根系相对膜透性。每处理各随机选取3株进行取样,重复3次,结果取其平均值。SOD活性按照陈贻竹等[14]的方法,以每分钟抑制氮蓝四唑(NBT)光还原50%为1个酶活力单位(U),酶的活性以U/(g·min),FW表示;POD活性按Omran的方法[15],以每分钟减少0.01个A值所需的酶量为1个活性单位(U),以U/(g·min),FW表示;CAT活性采用Kar等[16]的方法,酶的活性计算同POD活性;MDA含量采用硫代巴比妥酸法[17],以μmol/g,FW表示。
叶绿素含量[17]、根系活力[18]、相对膜透性(RMP)[19]、脯氨酸(Pro)含量[19]和乙醇脱氢酶活性[20]采用常规方法测定。
1.3数据处理
试验数据采用Excel进行图表绘制,采用DPS软件对数据进行方差分析及最小显著差异性检验(Duncan’s新复极差法, P<0.05)。
㉕Jeffrey A.Parness,“Old - fashioned Pregnancy,Newly - fashioned Paternity”,Syracuse Law Review,57(53),2003,p.69.
2 结果与分析
2.1施用过氧化尿素对水体溶氧量的影响
施用过氧化尿素后盆内土表水体中的溶氧量呈现先升高后降低的趋势(图1)。溶氧量最大值出现在处理后第1天,可观察到水体中有气泡冒出,以T2处理最高,T1和T2处理分别较对照提高了0.82 倍和1.25倍。处理第3天后,水体溶氧量开始逐渐下降,T2处理下降幅度最大;T1处理水体溶氧量始终高于其它处理。处理7天内,袋控过氧化尿素处理水体溶氧量始终维持较高水平。T1处理袋控过氧化尿素处理能够缓慢稳定地释放氧气,水体溶氧量始终保持较高水平。
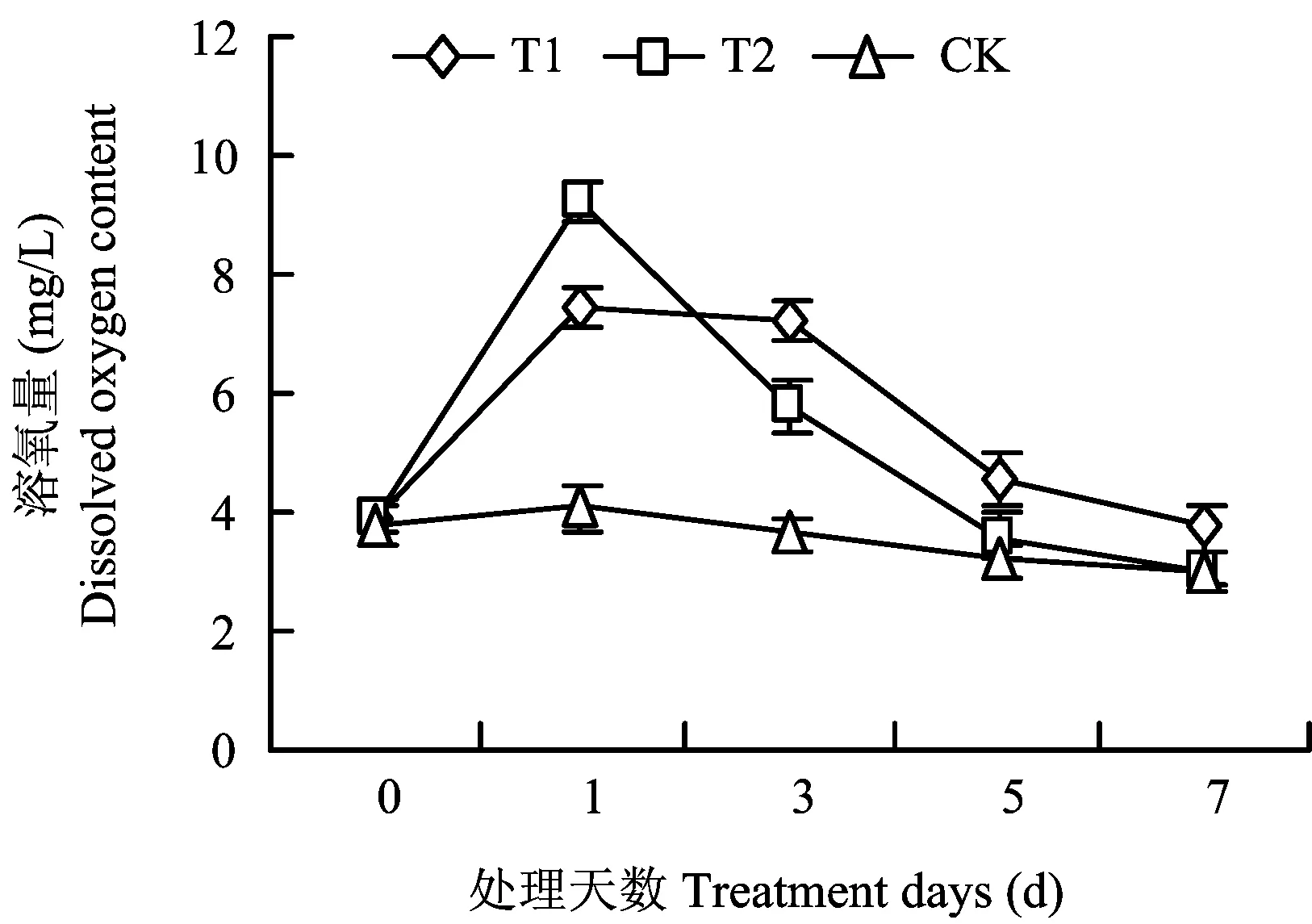
图1 添加过氧化尿素水体的溶氧量Fig.1 Water dissolved oxygen content after addition of urea peroxide
2.2过氧化尿素对淹水胁迫下桃幼树叶片气体交换参数的影响
桃幼树在淹水胁迫过程中,叶片净光合速率表现出逐渐降低的趋势(图2A)。淹水第1天后净光合速率即表现出下降趋势,表明桃幼树叶片光合作用对淹水胁迫非常敏感。淹水第5天叶片净光合速率已降至较低水平。淹水过程中,T1和T2处理叶片净光合速率始终显著高于T3和CK处理。T1、T2、T3和CK处理淹水第5天叶片净光合速率较淹水处理开始当天降幅分别为93.04%、95.38%、97.28%和97.40%。表明施用过氧化尿素处理可有效缓解淹水胁迫对桃幼树叶片光合作用的抑制。气孔导度影响叶片光合速率,胞间二氧化碳浓度及蒸腾速率。由图2B、2C和2D看出,淹水胁迫下各处理桃幼树叶片气孔导度,胞间CO2浓度和蒸腾速率均表现出淹水第1天升高,之后逐渐降低的趋势。但施用过氧化尿素处理(T1处理)在第1,3,5天桃幼树叶片气孔导度和蒸腾速率均显著高于对照。
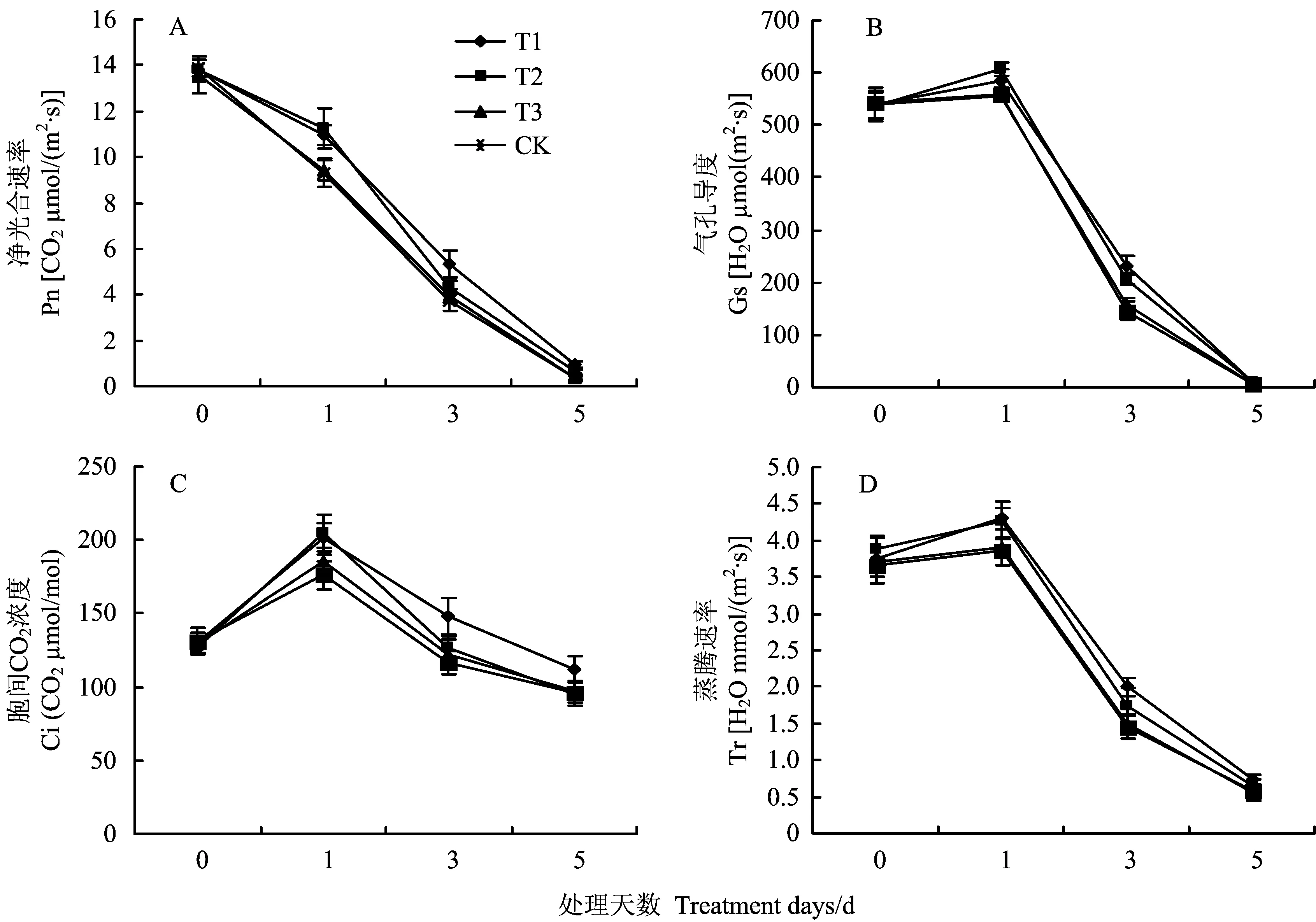
图2 淹水处理不同时间添加过氧化尿素对桃幼树叶片Pn、Gs、Ci和Tr的影响Fig.2 Effects of urea peroxide on Pn, Gs, Ci and Tr in peach trees leaves under different days of waterlogging stress
2.3过氧化尿素对淹水胁迫下桃幼树叶片荧光参数的影响
PIABS是反映叶片光合性能的重要指标。Fv/Fm表示暗适应下最大光化学量子产量,其大小反映了PSII反应中心内原初光能的转换效率,是反映光抑制程度的良好指标。RC/Cso是单位面积有活性反应中心的数量;DIo/Cso是单位面积的热耗散。由表1可以看出,淹水胁迫下外源氧气供体过氧化尿素处理桃幼树叶片PIABS、Fv/Fm和RC/Cso显著高于对照; 而DIo/Cso显著低于对照。T1和T2处理桃幼树叶片PIABS较对照提高了24.35%和16.52%。表明,施用过氧化尿素后,桃幼树光合机构受损伤程度明显小于对照。桃幼树叶片Fv/Fm较对照提高了7.04%和4.23%。说明施用过氧化尿素处理桃幼树叶片光抑制程度减轻。桃幼树叶片RC/Cso较对照提高了11.22%和7.83%。桃幼树叶片DIo/Cso较对照降低了18.53%和9.31%。T3与对照之间无显著差异。可见施用过氧化尿素处理桃幼树叶片光合电子效率高于对照。
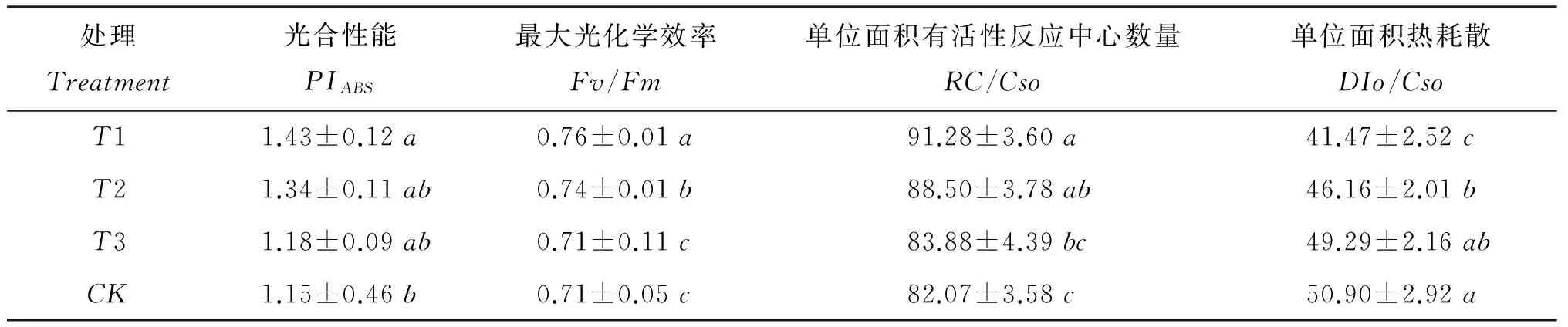
表1 淹水胁迫下施用过氧化尿素桃幼树叶片荧光参数
注(Note): 同列数值后不同小写字母表示处理间在 0.05 水平上差异显著Valuesfollowedbydifferentlettersinacolumnaresignificantlydifferentatthe0.05level.
2.4过氧化尿素对淹水胁迫下桃幼树叶片叶绿素含量的影响
2.5过氧化尿素对淹水胁迫下桃幼树叶片抗氧化酶活性和MDA含量的影响
由图4看出,随着处理天数的增加,不同处理的叶片保护酶(SOD、POD和CAT酶)活性呈现先升高后降低的趋势。表明在淹水胁迫开始阶段,植株通过提高叶片保护酶活性以适应外界环境胁迫,但随着胁迫时间的增加,叶片保护酶活性开始降低。淹水胁迫第1天,叶片CAT活性和SOD活性均以T2处理最高,第3天和第5天叶片CAT酶活性,POD酶活性和SOD酶活性均以T1处理最高。由图4A可以看出,淹水处理后第1、3、5天,T1处理叶片CAT活性分别比对照高5.85%、15.87和11.53%,差异显著;T2处理叶片CAT活性分别比对照高7.57%、7.57和0.73%。T3处理和对照间无显著差异。由图4B可以看出,淹水处理后第1、3、5天,T1处理叶片POD活性显著高于对照,分别比对照高11.81%、22.61%和37.16%;T2处理叶片POD活性分别比对照高9.98%、13.08%和17.64%。T3处理和对照间无显著差异。图4C为外源氧气对淹水胁迫下桃幼树叶片SOD活性的影响。结果表明,淹水处理后第1、3、5天,T1处理叶片SOD活性显著高于对照,分别比对照高39.84%、60.95%和71.53%;T2处理叶片POD活性分别比对照高67.29%、38.40%和34.80%。T3处理和对照间无显著差异。由图4D看出,随着淹水处理天数的增加,各处理桃树叶片MDA含量呈现逐渐增加的趋势,且以对照MDA含量最高。外源供氧处理叶片MDA含量显著低于对照,T3处理和对照间无显著差异。可见外源供氧可在一定程度上缓解淹水胁迫下桃幼树叶片MDA含量的增加幅度; 并通过提高叶片抗氧化酶活性增强植株抗逆性,减小逆境胁迫对植株的破坏作用。
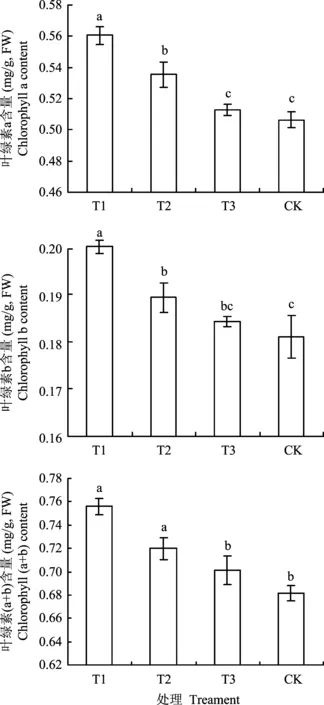
图3 淹水胁迫下施用过氧化尿素桃幼树叶片叶绿素含量Fig.3 Chlorophyll content in leaves of peach trees affected by urea peroxide under flooding stress
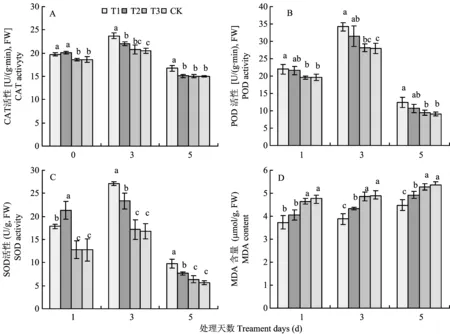
图4 过氧化尿素对淹水胁迫下桃幼树叶片抗氧化酶活性和MDA含量的影响Fig.4 Effects of urea peroxide on SOD, POD, CAT activities and MDA content in young peach trees leaves under flooding stress
[注(Note): 柱上不同字母表示处理间差异达5%显著水平Differentlettersabovethebarsatthesamedaymeansignificantamongtreatmentsat5%level.]
2.6过氧化尿素对淹水胁迫下桃幼树根系生理特性的影响
由表2可知,淹水胁迫下外源供氧处理桃幼树根系活力显著高于对照。其中T1和T2处理桃幼树根系活力分别为对照的1.17倍和1.10倍。脯氨酸是一种植物细胞内重要的渗透调节物质,植株可通过增加脯氨酸含量以抵御逆境胁迫,其含量高低可在一定程度上反映植株的抗逆性。在淹水处理后,T1和T2处理根系脯氨酸含量分别较对照提高了21.56%和16.37%,差异显著。说明T1和T2处理在淹水胁迫下植株受伤害程度会低于对照。淹水处理后,根系相对膜透性以对照最高,分别为T1和T2处理的1.11倍和1.05倍,T3与对照无显著差异; 根系乙醇脱氢酶活性以对照最高,分别为T1和T2处理的1.11倍和1.05倍,T3与对照差异不显著。表明T1和T2处理桃幼树根系受伤害程度最轻。
3 讨论与结论
过氧化尿素能够在水中缓慢释放出氧气,并且在分解过程无污染物,是一种较为理想的根际给氧化学肥料,已在美国和日本水稻增氧生产中得到广泛应用[13]。Bryce等[21]研究发现,对土表水层中施用一定量的过氧化尿素后,显著提高了西红柿根际的溶解氧。本试验结果表明,施用过氧化尿素后水体溶氧量显著高于对照,这与赵锋等[13]的研究结果一致。在试验过程中发现袋控过氧化尿素处理土表水中不断有气泡冒出。撒施过氧化尿素后第1天,水体溶氧量迅速增加,随着时间的推移,溶氧量下降幅度较大。撒施处理过氧化尿素与水迅速反应,放出大量氧气,使水体溶氧量在短时间内达到最大值; 前期过氧化尿素的大量消耗导致后期氧气释放明显减少。施用袋控过氧化尿素处理,能够在较长时间内保持较高溶氧量。袋控肥和撒施实质上均为增加水体中溶氧量,为淹水胁迫下植株提供氧气,袋控过氧化尿素可在一定程度上控制过氧化尿素与水的反应速度,延长淹水条件下水体氧含量的维持。本试验是在室内进行的模拟淹水试验,有关在大田条件下施用过氧化尿素氧气释放特性及其适宜用量还需进一步研究。

表2 过氧化尿素对淹水胁迫下桃幼树根系生理特性的影响
注(Note): 同列数值后不同小写字母表示处理间在 0.05 水平上差异显著Valuesfollowedbydifferentlettersinacolumnsignificantlydifferentatthe0.05level.
氧气是植物根系呼吸所必需的,淹水条件下最先受到影响的是植物根系,根际缺氧抑制根系有氧呼吸,破坏根系正常的生理功能,严重时导致根系凋亡。长期淹水导致土壤中空气被排出,造成根区缺氧环境,抑制作物根系有氧呼吸,影响根系活力。植物组织受到逆境伤害时,膜的功能受损或结构破坏而使其透性增大,细胞内各种水溶性物质包括电解质将有不同程度的外渗,将植物组织浸入无离子水中,水的电导度将因电解质的外渗而加大,伤害愈重,外渗愈多,电导度的增加也愈大[22]。研究表明,淹水胁迫下植物细胞内脯氨酸含量呈指数增长,以此来维持细胞的膨压,保护酶和膜系统免受伤害[23]。脯氨酸作为一种渗透调节物质可在一定程度上缓解淹水对细胞膜的伤害作用。本研究发现,淹水条件下施用过氧化尿素处理,桃幼树根系活力和根系脯氨酸含量显著高于对照,根系相对膜透性显著低于对照。这可能是因为过氧化尿素分解产生的氧气为根系呼吸提供所需的氧气,减轻了淹水胁迫对根系细胞结构的损伤,保证了根系正常生理功能,维持相对较高的生理活性。但其生理机制有待进一步研究。
植物体内存在SOD、POD、CAT等抗氧化酶,它们可以清除活性氧,避免细胞遭受伤害[24-25]。淹水会使植物抗氧化酶活性发生不同程度变化[26-27]。如何采取一定措施提高逆境胁迫下植物体内抗氧化酶活性对于植株增强抵御逆境胁迫能力至关重要。研究表明,短时间淹水胁迫,玉米叶片SOD、CAT等抗氧化酶活性升高[24],绿豆细胞中SOD、CAT在淹水初期均有不同程度的升高,以清除细胞中累积的自由基[26]。本试验结果表明,淹水条件下,桃幼树叶片SOD、POD、CAT酶活性表现出先升高后降低的趋势。淹水初期抗氧化酶活性的提高是植株对逆境胁迫的一种适应和保护机制,随淹水时间的增加抗氧化酶活性降低。对淹水条件下桃幼树根系施用过氧化尿素后,叶片SOD、POD、CAT酶活性均显著高于对照。这可能是因为施用过氧化尿素后保证桃幼树根系有氧呼吸作用的正常进行,为植株各种生理代谢提供能量,增强了抗氧化酶活性。并减少无氧呼吸产生的有毒物质对植株的伤害,可在一定程度上维持稳定的细胞结构,进而提高叶片抗氧化酶活性,减轻淹水胁迫下活性氧积累对植株的伤害。MDA是膜脂过氧化的最终产物,通常将其作为脂质过氧化指标,用于表明细胞膜脂过氧化程度和植物对逆境胁迫反应的强弱[1]。研究表明,淹水条件下水稻叶片中MDA含量明显增加[28]。本试验结果发现,淹水条件下,桃幼树叶片MDA含量逐渐升高,外源供氧处理叶片MDA含量始终低于对照,降低了MDA含量增高幅度。表明,施用过氧化尿素可降低桃幼树叶片细胞膜脂过氧化程度。缺氧环境中,植物根系有氧呼吸受到抑制,乙醇发酵的无氧呼吸增强,乙醇脱氢酶活性增大。本试验结果表明,施用过氧化尿素处理根系乙醇脱氢酶活性显著低于对照。施用尿素处理与对照无显著差异。表明,施用过氧化尿素处理桃幼树根系无氧呼吸强度较低。可见,淹水过程中,通过对根系补充氧气可提高桃幼树抗氧化酶活性,对增强植株耐涝性具有积极作用。
叶绿素是植物叶片光合作用的物质基础,其含量的高低能反映植物的生长状况和叶片光合能力[29]。有研究发现,淹水使植株生长受抑制,叶绿素含量降低[7],初期净光合速率急剧下降[26]。本试验中观察到,在淹水过程中桃幼树叶片逐渐发黄,有叶片脱落的现象,表明淹水胁迫破坏了桃树叶片结构,叶片开始脱落。试验结果表明,处理5天后,施用过氧化尿素处理(T1和T2处理)桃幼树叶片的Chla、Chlb和Chl(a+b)显著高于对照。施用过氧化尿素能够维持叶片功能,延缓淹水胁迫造成的叶片黄化脱落。本研究从光合性能方面对外源供氧效果进行了研究,结果表明,淹水处理1天后,桃幼树光合速率明显降低,至淹水第5天净光合速率已降至较低水平。但施用过氧化尿素处理后桃幼树净光合速率,气孔导度,蒸腾速率均显著高于对照。叶绿素荧光参数反映了植物叶片光合性能和受胁迫程度。PIABS是反映植物光合综合性能的一个参数,荧光参数Fv/Fm代表PSⅡ的原初光能转化效率[30]。施用过氧化尿素处理(T1,T2)桃幼树叶片光合性能指标(PIABS),最大光化学效率Fv/Fm,单位面积有活性反应中心的数量RC/Cso均显著高于对照; 单位面积的热耗散DIo/Cso显著低于对照。这可能是因为施用过氧化尿素处理后有效缓解了低氧胁迫对桃幼树叶片光合机构的损伤,PSⅡ反应中心数目及捕获光能水平高于对照,进而在不同程度上提高了叶片光合能力。另外,施用过氧化尿素处理减轻了光抑制程度,提高光合电子传递效率,过剩光能降低,导致单位面积热耗散降低。但其具体机制还有待进一步研究。
在试验过程中发现,施用袋控过氧化尿素处理桃幼树叶片黄化落叶量明显少于其它处理和对照。淹水5天后,将各处理植株移出水池,一周后调查发现,施用袋控过氧化尿素处理桃幼树植株存活率为66.67%,显著高于对照的33.33%。可见,淹水条件下外源氧气可在一定程度上缓解淹水胁迫对桃幼树叶片细胞的破坏作用,降低淹水对光合机构活性中心的损伤,施用尿素处理对淹水胁迫的缓解效果甚微。在桃树栽培管理中,特别是一些多雨地区,涝害现象时有发生。因此,可在大量降雨之后或降雨之前及时施用过氧化尿素,以缓解淹水对树体的伤害作用,保证树体正常生长,有效减轻因涝害引起的死树现象。
综上所述,施用过氧化尿素可提高土表水体溶氧量,袋控过氧化尿素处理根区土壤可在一定时间内维持较高的氧气含量。与对照相比,在淹水胁迫下施用过氧化尿素提高了桃幼树叶片叶绿素含量,光合作用以及抗氧化酶活性,降低了叶片MDA含量提高幅度。可见,外源氧气供体过氧化尿素可有效缓解淹水胁迫对树体的伤害作用。
[1]潘澜, 薛立. 植物淹水胁迫的生理学机制研究进展[J]. 生态学杂志, 2012,31(10): 2662-2672.
PanL,XueL.Plantphysiologicalmechanismsinadaptingtowaterloggingstress:Areview[J].ChineseJournalofEcology, 2012, 31(10): 2662-2672.
[2]VantoaiTT,BollesCS.Postanoxicinjuryinsoybean(Glycine max)seedlings[J].PlantPhysiology, 1991, 97: 588-592.
[3]IrfanM,HayatS,HayatQ, et al.Physiologicalandbiochemicalchangesinplantsunderwaterlogging[J].Protoplasma, 2010, 241(1-4): 3-17.
[4]GuoSR,KazuyoshiN,ShojiT.Arolefornitratereductaseinthehightoleranceofcucumberseedlingstoroot-zonehypoxia[J].JournaloftheJapaneseSocietyforHorticulturalScience, 1998, 67(4): 613-618.
[5]MorardP,LacosteL,SilvestreJ.Effectofoxygendeficiencyonuptakeofwaterandmineralnutrientsbytomatoplantsinsoillessculture[J].JournalofPlantNutrition, 2000, 23(8): 1063-1078.
[6]CarvalhoLC,AmancioS.Antioxidantdefencesysteminplantletstransferredfrominvitrotoexvitro:effectsofincreasinglightintensityandCO2concentration[J].PlantScience, 2002, 162: 33-40.
[7]EdwardsAL,LeeDW,RichardsJH.Responsestoafiuctuatingenvironment:effectofwaterdepthongrowthandbiomassallocationinEleocharis cellulosaTorr.(Cyperaceae)[J].CanadianJournalofBotany, 2003, 81: 964-975.
[8]VartapetianBB,JacksonMB.Plantadaptationstoanaerobicstress[J].AnnalsofBotany, 1997, 79(Suppl.A): 13-20.
[9]JacksonMB,ArmstrongW.Formationofaerenchymaandtheprocessesofplantventilationinrelationtosoilfloodingandsubmergence[J].PlantBiology, 1999, 1: 274-287.
[10]ChristiansonJA,LiewellynDJ,DennisES,WilsonLW.Globalgeneexpressionresponsestowaterlogginginrootsandleavesofcotton(Gossypium hirsutumL.)[J].PlantCellPhysiology, 2010,51(1): 21-37.
[11]AbikoT,KotulaL,ShionoK, et al.EnhancedformationofaerenchymaandinductionofabarriertoradialoxygenlossinadventitiousrootsofZea nicaraguensiscontributetoitswaterloggingtoleranceascomparedwithmaize(Zea maysssp. mays)[J].Plant,CellandEnvironment, 2012, 35(9): 1618-1630.
[12]PezeshkiSR.Spartinapatenstorhizophereoxygendeficiency.ActaEcology, 1996, 17 (5): 365-378.
[13]赵锋, 王丹英, 徐春梅, 等. 水稻对过氧化尿素用量的响应特征[J]. 中国稻米, 2012, 16(1): 4-8.
ZhaoF,WangDY,XuCM, et al.Responsecharacteristicsofricetoureaperoxide[J].ChinaRice, 2012, 16(1): 4-8.
[14]陈贻竹,B帕特森. 低温对植物叶片中超氧物歧化酶、过氧化物酶和过氧化氢水平的影响[J]. 植物生理学报, 1988, 14: 323-328.
ChenYZ,PattersonBD.Theeffectofchillingtemperatureonthelevelofsuperoxidedismutase,catalaseandhydrogenperoxideinsomeplantleaves[J].ActaPhytophysiologicaSinica, 1988, 14: 323-328.
[15]OmranRG.Peroxidelevelsandtheactivitiesofcatalase,peroxidase,andindoleaceticacidoxidaseduringandafterchillingcucumberseedlings[J].PlantPhysiology, 1980, 65(2): 407-408.
[16]KarM,MishraD.Catalase,peroxidase,andpolyphenoloxidaseactivitiesduringriceleafsenescence[J].PlantPhysiology, 1976, 57(2): 315-319.
[17]赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社. 2002.
ZhaoSJ,ShiGA,DongXC.Techniquesofplantphysiologicalexperimental[M].Beijing:ChineseAgriculturalScienceandTechnologyPress. 2002.
[18]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社. 2000.
ZouQ.Guideofplantphysiologicalexperiments[M].Beijing:ChinaAgriculturePress. 2000.
[19]高俊凤. 植物生理学试验技术[M]. 西安: 世界图书出版社, 2000.
GaoJF.Techniquesofplantphysiologicalexperiment[M].Xi’an:WorldPublishingCompany, 2000.
[20]WatersI,MorrellS,GreenwayH,ColmerTD.EffectsofanoxiaonwheatseedlingsⅡ.InfluenceofO2supplypriortoanoxiaontolerancetoanoxia,alcoholicfermentationandsugarlevels[J].JournalofExperimentBotany, 1991, 42(244): 1437-1447.
[21]BryceJH,FochtDD,StolzyLH.Soilaerationandplantgrowthresponsetoureaperoxidefertilization[J].SoilScience, 1982, 134: 111-116.
[22]阮成江,谢庆良. 土壤水分对沙棘成活率及抗逆生理特性的影响[J]. 应用与环境生物学报, 2002, 8(4): 341-345.
RuanCJ,XieQL.EffectofsoilmoistureonsurvivalrateofHippophaerhamnoidesL.anditsstress-resistancephysiologicalcharacteristics[J].ChineseJournalofAppliedEnvironmentalBiology, 2002, 8(4): 341-345.
[23]汪贵斌,曹福亮,郭起荣. 淹水对银杏生长及生理的影响[J].江西农业大学学报, 1998, 20( 2): 237-241.
WangGB,CaoFL,GuoQR.EffectsofartificialfloodingongrowthandphysiologyofGinkgo Biloba [J].ActaAgriculturaeUniversitatisJiangxiensis, 1998, 20(2): 237-241.
[24]BlokhinaOB,VirolainenE,FagerstedtKV, et al.Antioxidantstatusofanoxia-tolerantandintolerantplantspeciesunderanoxiaandreaction[J].PlantPhysiology, 2000, 109: 396-403.
[25]柯德森,孙谷畴,王爱国. 低温诱导绿豆黄化幼苗乙烯产生过程中活性氧的作用[J]. 植物生理与分子生物学学报, 2003, 29 (2): 127-132.
KeDS,SunGC,WangAG.Theroleofactiveoxygeninchillinginducedethyleneproductioninetiolatedmungbeanseedings[J].JournalofPhysiologyandMolecularBiology, 2003, 29 (2): 127-132.
[26]AhmedS,NawataE,HosokawaM, et al.Alterationsinphotosynthesisandsomeantioxidantenzymaticactivitiesofmungbeansubjectedtowaterlogging[J].PlantScience, 2002, 163(1): 117-123.
[27]YordanovaRY,ChristovKN,PopovaLP.Antioxidativeenzymesinlarleyplantssubjectedtosoilflooding[J].EnvironmentalandExperimentalBotany, 2004,51(2): 93-101.
[28]UshimaruT,OgawaK,IshidaN, et al.Changesinorganellesuperoxidedismutaseisoenzymesduringairadaptationofsubmergedriceseedlings:Differentialbehaviorofisoenzymesinplastidsandmitochondoria[J].Planta, 1995,196: 606-613.
[29]NievaFJJ,CastilloJM,LuqueCJ.EcophysiologyoftidalandnontidalpopulationoftheinvadingcordgrassSpattinadensiflora:seasonalanddiurnalpatternsinaMediterraneanclimate[J].Estuarine,CoastalandShelfScience, 2005, 57: 919-928.
[30]DemmigB,BjorkmanO.ComparisonoftheeffectofexcessivelightonchlorophyllfluorescenceandphotonyieldofO2evolutioninleavesofhigherplants[J].Planta, 1987, 171(2): 171-184.
Alleviationofureaperoxidetowaterloggingdamageinyoungpeachtrees
XIAOYuan-song,PENGFu-tian*,SHUHuai-rui,SHENGuang-ye,WANGNa-na,LUOJing-jing,ZHAOYong-fei
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong)
【Objectives】Theeffectofureaperoxideonthephysiologicalcharacteristicsandphotosyntheticfluorescenceparameterswasevaluatedinyoungpeachtreesexposedtowaterloggingstresstoprovideusefulinformationforbetterpeachproduction.【Methods】Potexperimentswereconductedwithone-year-oldpeachtrees, ‘Chunmei’astestmaterials.Firstlyapotexperimentwasconductedtodeterminetheresponseofpeachtreestowaterloggingstress;thenanotherpottrialwasconductedtostudytheeffectofureaperoxideapplication.Fourtreatmentsweredesigned:ureaperoxidepackedinsideabagandburiedinto7cmdeeparoundtheplants(T1);ureaperoxidebroadcastedintosoil(T2),commonureabasalapplied(T3)andnoNappliedascontrol(CK).Inthe0, 1, 3, 5and7thdayofwaterloggingtreatment,theoxygenreleasecharactersofureaperoxideinsoil,theleafgasexchangeparametersofpeachtrees,andthephysicalandbiochemicalindexinleafandrootweredetermined;Inthe5thday,thechlorophyllfluorescenceparametersweremeasured.【Results】Thesoilsurfacewaterdissolvedoxygenconcentrationincreasedaftertheapplicationofureaperoxide.Thewaterdissolvedoxygenconcentrationalwaysmaintainedatahighlevelunderthebagcontrolureaperoxidetreatmentwithin7daysaftertreatment.Theapplicationofureaperoxidesignificantlyreducedthedecreaseamplitudeofnetphotosyntheticrate(Pn)ofyoungpeachtreesleaf,stomatalconductance(Gs)andtranspirationrate(Tr).Fivedaysaftertreatment,theyoungpeachtreesleafperformanceindex(PIABS),maximalphotochemicalefficiency(Fv/Fm),thenumbersofactivereactioncenterperunitarea(RC/Cso)weresignificantlyhigherthancontrol,andtheincreaseampltitudeoftheheatdissipationperunitarea(DIo/Cso)wassignificantlylowerthancontrolunderwaterloggingstress.ThevaluesofChla,ChlbandChl(a+b)ofyoungpeachtreesleafweresignificantlyincreasedby10.72%、10.86%、10.87and5.71%、4.78%、5.57%,respectively,underapplicationofureaperoxidetreatments(T1andT2)thanthecontrol.Applicationofureaperoxideenhancedtheactivitiesofantioxidantenzyme(superoxidedismutase,peroxidaseandcatalase)inyoungpeachtreesleavesandalleviatedtheincreaseampltitudeofMDAinyoungpeachtreesleaves.Therootactivity,rootproline(Pro)contentweresignificantlyhigherthancontrol,andtherootrelativeplasmamembranepermeabilityandalcoholdehydrogenaseactivityweresignificantlylowerthancontrolunderapplicationofureaperoxidetreatments. 【Conclusions】Ourstudyindicatesthatapplicationofureaperoxidecanalleviatetheinfluenceofwaterloggingstressinyoungpeachtreesbyincreasingthesoilsurfacewaterdissolvedoxygenconcentration,enhancingtheactivitiesofantioxidantenzyme.
ureaperoxide;youngpeachtrees;waterloggingstress;alleviationeffect
2014-10-16接受日期: 2015-03-01网络出版日期: 2015-07-24
国家现代农业产业技术体系项目(CARS-31-3-03); 山东省高校优秀科研创新团队计划项目资助。
肖元松(1986—),男,山东平原人,博士研究生,主要从事果树生理生态研究。E-mail:yuansongx2013@163.com
E-mail:pft@sdau.edu.cn
S662.1;S606+.2
A
1008-505X(2016)02-0502-09
