钙处理对葡萄柚果实细胞壁物质代谢及其相关基因表达的影响
2016-08-24史正军王连春吴海波刘惠民
邓 佳, 史正军*, 王连春, 吴海波, 刘惠民
( 1西南山地森林资源保育与利用省部共建教育部重点实验室,西南林业大学,昆明 650224;2西南林业大学林学院,昆明 650224)
钙处理对葡萄柚果实细胞壁物质代谢及其相关基因表达的影响
邓 佳1, 史正军1*, 王连春2, 吴海波2, 刘惠民1
( 1西南山地森林资源保育与利用省部共建教育部重点实验室,西南林业大学,昆明 650224;2西南林业大学林学院,昆明 650224)
【目的】研究采前、采后钙处理对葡萄柚果实细胞壁组分、细胞壁降解酶活性变化及其相关基因表达的影响,可为了解钙与果实细胞壁物质代谢之间的关系,揭示钙对果实软化的作用机理,为调控葡萄柚果实膳食纤维含量,提高果实质地品质提供理论依据。【方法】试验于2011年2月至11月在云南省玉溪市葡萄柚果园进行,供试品种为‘里约红’葡萄柚,该品种于2005年嫁接于当地砧木,株行距为3m×3m。试验由采前和采后钙处理两部分组成。采前钙处理在幼果初期、幼果末期、膨大初期、膨大末期、转色期,叶面喷施2%CaCl2; 采后钙处理在果实成熟采后浸于2%CaCl2溶液5min, 室温贮藏。之后每15天取样一次,每次取10个果实,测定葡萄柚果肉细胞壁组分、细胞壁降解酶活性及其基因表达量。【结果】随葡萄柚果实后熟软化,紧密结合型果胶(共价结合型果胶)解聚为松散结合型果胶(水溶性果胶、离子结合型果胶),紧密结合型半纤维素(24%KOH可溶性半纤维素)解聚使其含量下降,而松散结合型半纤维素含量增加(4%KOH可溶性半纤维素)。果实PG、PME、Cx、α-L-Af和β-Gal酶活性及其基因表达量均随果实软化呈不同程度增加。PME活性在果实采收后表现出较高含量,而PG活性在果实贮藏前期急剧增加,其酶基因的表达量与酶活性变化趋势基本一致。Cx、α-L-Af和β-Gal活性在贮藏中、后期上升较快,相关酶基因的表达量亦明显增加。钙处理显著地降低果实细胞壁降解酶活性和基因表达水平,其中采后钙处理对α-L-Af和β-Gal活性和基因表达在贮藏中、后期的调控作用较显著,酶活性和基因表达均维持在较低水平。【结论】外源钙处理降低细胞壁降解酶活性及其基因表达,抑制了细胞壁物质的解聚,采后钙处理对细胞壁物质代谢的调控效果优于采前钙处理。外源钙处理抑制了细胞壁降解酶基因表达水平,降低了细胞壁降解酶活性,减缓了果胶、半纤维素的解聚,从而达到调控果实膳食纤维含量、维持果实质地品质、延长果实货架期寿命的目的。
葡萄柚; 钙处理; 细胞壁物质; 细胞降解酶; 基因表达
葡萄柚(Citrus paradisiMacf.)属芸香科柑桔属植物,葡萄柚果实柔软多汁,采后贮藏过程中因质地软化易受到霉菌感染引发蒂腐病、绿霉病等生理性病害,缩短贮运寿命,降低其商品价值[1]。果胶-纤维素-半纤维素总体结构的破坏和果胶、纤维素等细胞壁物质解聚是果实软化的开端。多聚半乳糖醛酸酶(PG)、果胶甲酯酶(PME)、纤维素酶(Cx)和糖苷酶等细胞壁降解酶是果实成熟和软化过程中影响细胞壁结构的重要酶,研究细胞壁降解酶在果实软化过程中的作用机理,对提高果实质地品质,调控果实膳食纤维含量具有重要意义。
钙与果实的贮藏质地品质密切相关,它是细胞壁结构的必要物质。在采前或采后用钙制剂进行处理,能明显降低细胞壁降解酶作用,维持细胞壁结构与功能的稳定,有效防止果实硬度下降,提高果实抗病性,防止生理病害,延长果实贮藏寿命和货架期[1]。本试验以‘里约红’葡萄柚果实为试材,利用生理生化和分子生物学方法,研究采前、采后钙处理对葡萄柚果实细胞壁组分、细胞壁降解酶活性变化及其相关基因表达的影响,以期了解钙元素与果实细胞壁物质代谢之间的关系,揭示钙对果实软化的作用机理,为调控葡萄柚果实膳食纤维含量,提高果实质地品质提供理论依据。
1 材料与方法
1.1供试材料与方法
试验于2011年2月至2011年11月在云南省玉溪市嘎洒镇金土地公司葡萄柚果园进行,供试品种为‘里约红’葡萄柚,该品种于2005年嫁接于当地砧木,株行距为3m×3m。

采后处理(post-Ca): 随机选取无病、虫、伤和成熟度一致的果实进行处理。常温下将果实置于浓度为2%CaCl2溶液浸泡5分钟,通风室温晾干[3]。

对照处理(control): 除不喷施钙或在2%CaCl2中浸泡,其余同上述处理。
1.2指标及测定方法
1.2.1 果实失重率称重测定,每组处理测定5个果实。果实失重率(%)=[(贮前果实质量-贮藏后果实质量)/贮前果实质量]×100。
1.2.2 果肉硬度GY-B型硬度计测定,探头直径3.5mm。随机取3个果实,在每个果实赤道面位置去皮对称四侧测定,取平均值,单位N。
1.2.3 果实细胞壁物质的提取、分离及含量测定细胞壁物质的提取和分离参考Redgwell等及Rose等[4-5]的方法并略加改进,分别提取乙醇不溶物(alcoholinsolubleresidue,AIR)、水溶性果胶(WSP)、离子结合型果胶(ESP)、共价结合型果胶(SCSP)、4%KOH可溶性半纤维素(4KSF)和24%KOH可溶性半纤维素(24KSF)。果胶含量用咔唑法测定,半纤维素用蒽酮法测定,每样重复3次,取其平均值。
1.2.4 细胞壁降解酶的提取及活性酶液制备参照Lohani等[6]和Deng等[7]的方法并略加改进。取果肉1.0g,样品放于冷冻过的研钵内,加入10mLTris-HCl溶液(50mmol/L,pH7.0),冰浴上研磨匀浆,4℃离心,取上清液用于酶提取液以测定酶活性。
果胶甲酯酶(PME)活性测定采用NaOH滴定法[8]、多聚半乳糖醛酸酶(PG)和纤维素酶(Cx)活性测定采用DNS比色法[6]、β-半乳糖苷酶(β-Gal)和α-L-阿拉伯呋喃糖苷酶(α-L-Af)活性测定采用比色法[10-11]。以上各种细胞壁酶活性的测定均重复3 次,取其平均值。
1.2.5 酶基因表达的实时荧光定量PCR检测采用Trizol法提取总RNA,使用AMVFirstStrandcDNASynthesisKit试剂盒(购自上海生工公司)合成cDNA第一链。采用Primer5软件进行qRT-PCR引物设计,看家基因18S用作目的基因荧光定量PCR内参。
引物PG上游5′-GAACCTTAGGGTGGTCAACAG-3′; 下游5′-GACTTCAACACGAGATGC-3′。PME上游5′-CAGAACCGACCCTAACCAGAG-3′; 下游5′-AAGGAACGTCTTAACGGAGCT-3′。Cx上游5′-TATCTTAGTCGGAGCCATCGTC-3′; 下游5′-TATACGTAGCCGGTTCTGAGTGA-3′。β-Gal上游5′-GTTATGTGCAAACAAGACGACG-3′; 下游5′-GCCGGTCTAGTAGGAACAGCA-3′。α-L-Af上游5′-CGGTTTTTCAGATTTCCAGGT-3′; 下游5′-TCACCAAAGTGTCCAGGTCTC-3′。18S上游5′-GTAGTCCATGCCGTAAACGAT-3′; 下游5′-CGAATTAAACCACATGCTCCA-3′。
采用ABI7500荧光定量PCR仪和ABISybrGreenPCRMasterMix(2X)试剂盒进行qRT-PCR检测。20μL反应体系包括: 1μL模板(cDNA)、2μL特异引物、10μLSybrGreenPCRMasterMix,ddH2O补齐20μL,反应程序为95℃反应2min,然后95℃ 10s,60℃ 40s,40个循环。qRT-PCR的数据分析采用2-ΔΔCT方法,每个处理样品设置3次重复。
1.3数据处理
应用SPSS软件进行差异显著性分析(P < 0.05)、相关性分析,用SigmaPlot软件作图。
2 结果与分析
2.1葡萄柚果实采后失重率、硬度的变化
图1A显示,钙处理对葡萄柚果实失重率的调控表现出明显抑制作用,贮藏结束时,采前、采后钙处理果实失重率明显低于对照。由图1B可知,贮藏过程中葡萄柚果肉硬度持续下降,贮藏前期(第15天),2种钙处理果实硬度都略高于对照,但与对照差异不显著。贮藏结束时,采后浸钙处理果实硬度显著高于其他处理。贮藏期间,采后浸钙处理对硬度、失重率的调控优于采前钙处理。
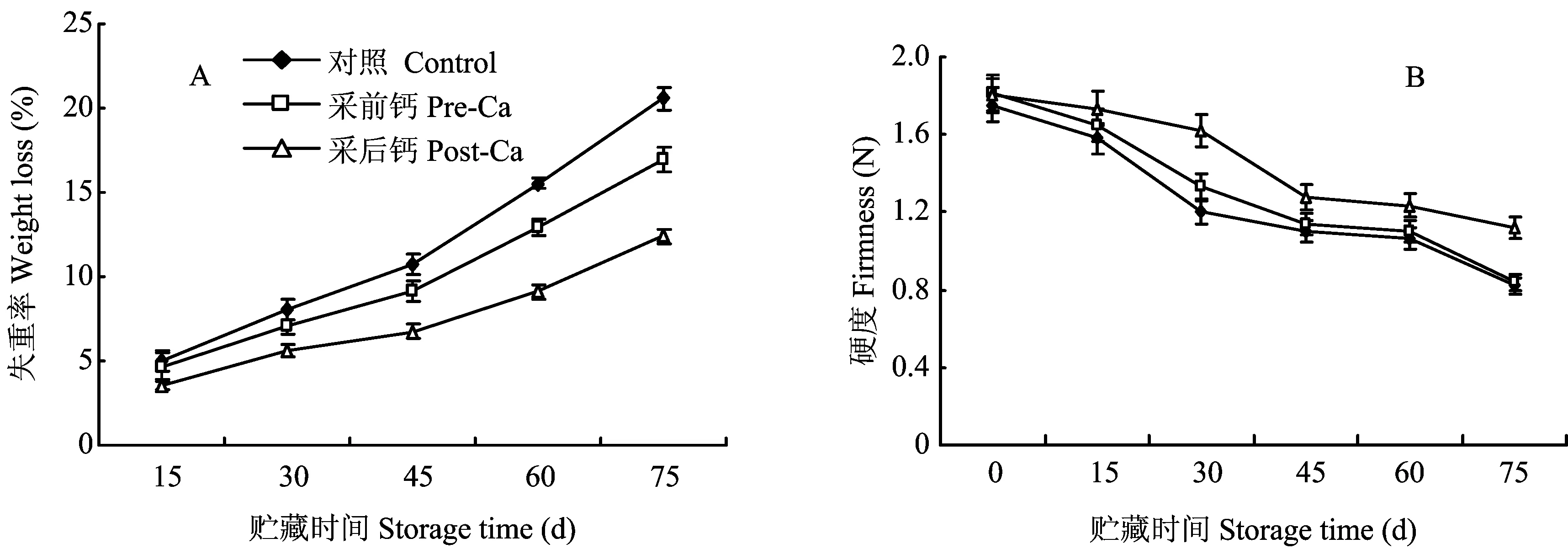
图1 不同钙处理葡萄柚果实失重率、硬度变化Fig.1 Fruit weight loss and firmness of grapefruit under different calcium treatments
2.2葡萄柚果实采后细胞壁物质含量的变化
2.2.1 果实乙醇不溶物含量变化果实乙醇不溶物含量可间接衡量果实细胞壁物质降解程度。乙醇不溶物含量越少,说明细胞壁物质降解越多,果实软化越快。钙处理明显抑制了乙醇不溶物含量的下降(图2A),贮藏后期采后钙处理果实乙醇不溶物含量仍保持较高水平。
2.2.2 果实水溶性果胶(WSP)含量变化从图2B看出,贮藏过程中葡萄柚果实WSP含量呈明显持续上升趋势,与果实硬度变化呈极显著负相关(r=-0.900**)。钙处理明显抑制果实WSP含量上升。其中,采后钙处理抑制贮藏后期WSP含量增加,其含量与硬度呈负相关(r=-0.839**),而采前钙处理果实WSP含量变化趋势与对照相似,但其含量极显著低于其它2种处理, 与硬度变化呈极显著负相关(r=-0.836**)。
2.2.3 果实离子型果胶(ESP)含量变化果实ESP含量变化趋势与WSP含量变化趋势相似,随果实硬度下降呈上升趋势(图2C)。采后果实ESP含量急剧增加,其含量与硬度呈极显著负相关关系(r=-0.780**),而钙处理显著地抑制了果实ESP含量增加,第30天后与对照差异达极显著水平(P<0.01),两种钙处理ESP含量变化与果实硬度的下降呈极显著负相关关系(r=-0.812**, r=-0.774**)。

图2 不同钙处理葡萄柚果实细胞壁物质变化Fig.2 Variation of cell wall components in grapefruit fruit under different calcium treatments
2.2.4 果实共价结合型果胶(SCSP)含量变化图2D显示,贮藏期间葡萄柚果实SCSP变化情况与WSP、ESP相反,随果实软化总体呈降低趋势,与硬度呈极显著正相关关系(r=0.785**)。采前钙处理果实SCSP含量变化与对照变化趋势相同,虽抑制SCSP含量降低,但与对照差异不显著,其含量与硬度的相关性为极显著正相关(r=0.851**),而采后钙处理使果实SCSP含量在整个贮藏期间维持在较高水平,与硬度变化显著相关(r=0.566*),极显著(P<0.01)高于其他2组处理。
2.2.5 果实半纤维素(4KSF、24KSF)含量变化由图2E可知,葡萄柚果实贮藏期间4KSF含量呈持续缓慢上升趋势,与硬度下降呈极显著负相关关系(r=-0.948**)。采前钙处理果实4KSF含量变化趋势与对照相似,略低于对照,与硬度也呈极显著负相关关系(r=-0.798**); 采后钙处理4KSF含量在贮藏过程中相对稳定,极显著(P<0.01)低于其他2组处理,与硬度的相关系数为-0.163。从图2F可以看出,果实细胞壁组分24KSF含量在贮藏过程中持续减少,与硬度呈显著正相关(r=0.777*)。采前钙处理果实24KSF含量与对照变化趋势相同,其含量略高于对照但差异不显著; 采后钙处理24KSF含量极显著(P<0.01)高于其他2组处理。采前、采后钙处理果实24KSF含量与硬度呈显著正相关(r=0.608*和r=0.537*)2.3葡萄柚果实采后细胞壁降解酶活性变化及其基因表达

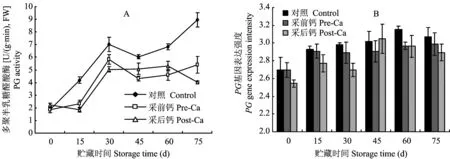
图3 不同钙处理葡萄柚果实PG酶活性变化及其基因表达Fig.3 Grapefruit fruit PG activity and its gene expression under different calcium treatments
2.3.2PME酶活性变化及其基因表达图4A表明,采后葡萄柚果实PME活性维持在较高水平,随贮藏时间延长呈下降趋势,与硬度变化呈显著正相关(r=0.586*)。采前钙处理抑制了PME活性的升高,但与对照差异较小。采后钙处理极显著抑制贮藏初期PME活性,贮藏期间保持相对平稳水平,与硬度的相关性不显著(r=0.321)。PME基因表达量也保持较高水平(图4B),其含量变化波动不大。采前、采后钙处理分别明显抑制了贮藏后期、前期果实PME基因的表达水平。
2.3.3Cx酶活性变化及其基因表达图5A显示,葡萄柚果实Cx酶随果实软化其活性不断上升,与硬度变化呈显著负相关(r=-0.813**)。采前钙处理极显著抑制贮藏后期酶活性,采后钙处理酶活性始终维持在较低水平,两种处理Cx分别与硬度的相关性不显著(r=-0.384,r=-0.292)。贮藏期间,Cx基因的表达量持续增加(图5B),与其酶活性变化趋势相一致。2种钙处理均有效抑制了贮藏期间Cx基因的表达,其中采后钙处理控制效果优于采前钙处理。

图4 不同钙处理对葡萄柚果实PME酶活性变化及其基因表达Fig.4 Grapefruit fruit PME activity and its gene expression under different calcium treatments

图5 不同钙处理葡萄柚果实Cx酶活性变化及其基因表达Fig.5 Grapefruit fruit Cx activity and its gene expression under different calcium treatments

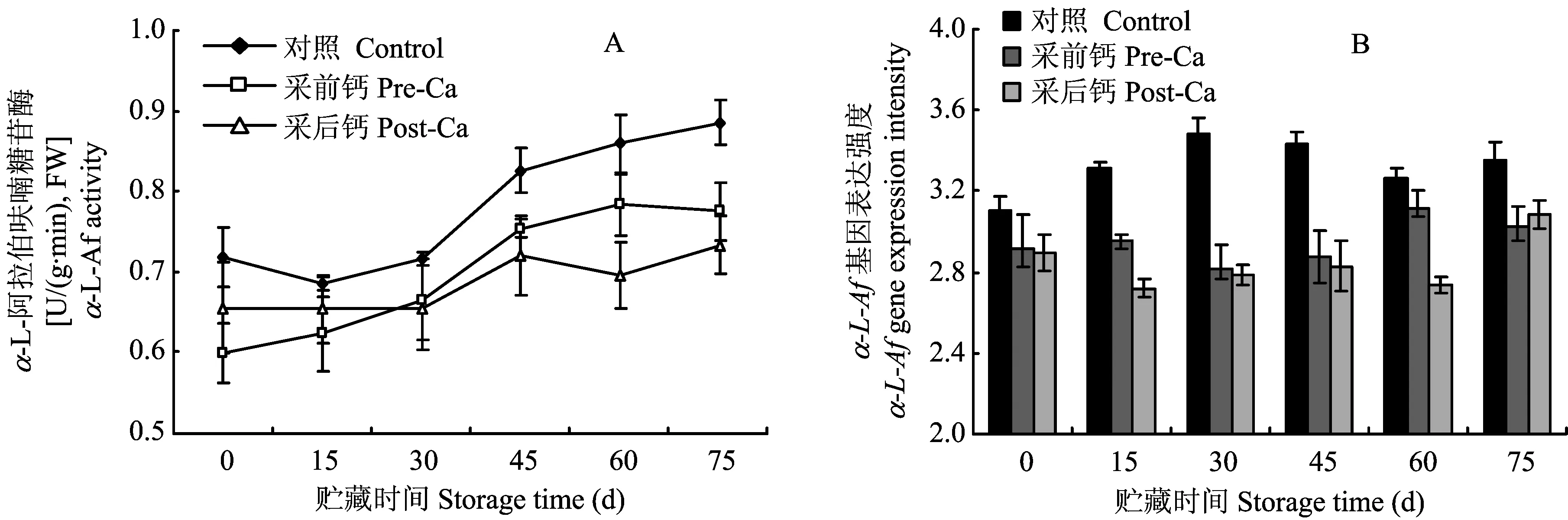
图6 不同钙处理葡萄柚果实α-L-Af酶活性变化及其基因表达Fig.6 α-L-Af activity and its gene expression in grapefruit fruit under different calcium treatments
2.3.5β-Gal酶活性变化及其基因表达从图7A看出,果实β-Gal酶与α-L-Af酶活性呈相似的变化规律,随贮藏时间延长逐渐增强,与果实硬度呈极显著的负相关关系(r=-0.741**)。采前钙处理显著降低β-Gal活性,但未改变其变化趋势。采后钙处理极显著抑制了贮藏末期β-Gal活性,其与硬度的相关性不显著(r=-0.246)。相应地,采后随着果实后熟软化β-Gal基因的表达量不断增加(图7B),贮藏中期急剧增加。采前钙处理对β-Gal调控作用不明显。采后钙处理几乎完全抑制β-Gal基因表达量的增加。

图7 不同钙处理葡萄柚果实β-Gal酶活性变化及其基因表达Fig.7 Grapefruit fruit β-Gal activity and its gene expression under different calcium treatments
3 讨论
果实成熟软化衰老过程中,细胞壁结构会发生很大的变化,使果实质地发生改变。Knee和Bartele指出,果实细胞壁分子骨架是由纤维素的原纤维和半纤维素一起构成,分散的果胶物质通过多聚半乳糖醛酸、阿拉伯聚糖和半乳糖连接到纤维素-半纤维素复合体上,并与之交叉联接,从而构成果胶-纤维素-半纤维素(P-C-H)总体结构[12]。细胞壁的结构物质果胶、半纤维素和纤维素等大分子多糖的解聚,均会对果实的质地产生显著的影响。本研究结果表明,葡萄柚果实采收时质地较硬,细胞壁乙醇不溶物含量较高,果胶物质以难溶的共价结合态果胶(SCSP)为主,贮藏期间随后熟软化,果实硬度下降,乙醇不溶物含量降低,共价结合态果胶解聚为易溶的水溶性果胶(WSP)和离子型果胶(ESP); 同时,果实细胞壁物质中高含量的难溶态半纤维素(24KSF)也解聚为易溶态半纤维素(4KSF)。细胞壁组分与硬度相关性分析结果表明,细胞壁物质中WSP、ESP和4KSF与硬度达极显著负相关,SCSP和24KSF分别与硬度呈极显著、显著正相关。这个结果与Brummell等[11]研究结论相一致,在果实成熟软化过程中,硬度下降一般伴随着果实难溶性果胶、半纤维素物质含量的降低,易溶性果胶含量增加。
钙是构成细胞壁的重要元素,外源钙处理能维持采后果实细胞壁结构稳定性,不同的钙处理方法对细胞壁降解的抑制效果有一定影响[13]。本研究结果表明,钙处理能减少AIR的损失,抑制WSP、ESP和4KSF含量上升,并使SCSP、24KSF含量保持在较高水平,表明钙处理能明显抑制贮藏过程中细胞壁物质解聚。此外,本研究还发现采后钙处理的紧密结合型多糖(SCSP、24KSF)含量高于采前钙处理含量,表明采后钙处理对细胞壁物质解聚的调控效果优于采前钙处理。目前关于Ca2+对果实细胞壁影响的解释普遍认为,Ca2+与细胞壁中果胶相结合形成Ca-果胶交联聚合物,这种广泛的交联有利于果胶聚合物的集聚,形成细胞壁网络,增加机械强度,同时减小细胞壁透性,限制了果实内引起果肉软化的酶或真菌病原体产生的导致果肉腐烂的酶通过,抑制中层胶物质降解,保持较完整的微纤丝结构,从而能有效地维持果实质地品质[14]。
大多数研究认为,果实质地软化伴随膳食纤维含量降低的主要原因是由细胞壁降解酶促进细胞壁物质的解聚,导致细胞壁超微结构的破坏,改变细胞壁结构的完整稳定性,从而影响果实硬度[15]。因此,细胞代谢过程中细胞壁降解酶起着非常重要的作用。本研究中发现,贮藏期葡萄柚果实细胞壁降解酶PG、PME、Cx、α-L-Af和β-Gal活性均不同程度地增加,相关基因表达水平也呈现出不同程度的上升趋势。PME活性在采收后表现出较高含量,而PG活性在贮藏前期急剧增加,其基因的表达量与酶活性变化趋势基本一致。Cx、α-L-Af和β-Gal活性则呈增加趋势,贮藏中、后期上升较快,相关酶基因的表达量亦明显增加,但与酶活性变化趋势并不一致。由此认为,PME可能是启动葡萄柚果实衰老软化的重要酶,PG在葡萄柚软化初期起明显促进作用,糖苷酶(α-L-Af、β-Gal)实质性地参与了葡萄柚果实软化进程,并在果实软化中、后期具有重要促进作用。本研究中,PME、α-L-Af酶活性变化与其基因表达量变化不完全一致,Amnuaysin、Wei等对香蕉、苹果的研究中也发现PME、α-L-Af基因的表达量变化与酶的活性变化并不完全一致[16,10],可能是酶的活性既取决于基因的表达量,还取决于基因翻译后的修饰调控[17]。此外,本研究还发现,钙处理显著地降低果实细胞壁降解酶活性和基因表达水平,其中采后钙处理对α-L-Af和β-Gal活性和基因表达在贮藏中、后期的调控作用较显著,酶活性和基因表达均维持在较低水平。大量研究表明,外源钙处理能显著降低细胞壁降解酶活性,生长期钙处理的白凤桃贮藏阶段果实PE、Cx活性维持在较低水平[13],Ortiz对苹果进行采前、采后浸钙处理试验,结果发现钙处理能够抑制α-L-Af和β-Gal的活性,降低果胶溶解,保持中胶层结构完整性,进而有效保持果实硬度[18-19]。Siddiqui和Bangerth研究表明,细胞壁降解酶活性下降可能是通过钙影响细胞内pH值从而间接影响酶活性或提高果胶聚合度(钙起交联作用),也可能是阻止外界水解酶的进入,减少酶与底物的接触,从而防止中胶层解体,增加细胞壁机械强度,维持细胞壁结构的完整、稳定性[20]。
4 结论
细胞壁降解酶参与葡萄柚果实衰老软化进程,PME可能是启动葡萄柚果实衰老软化的重要酶,PG和糖苷酶(α-L-Af、β-Gal)分别在果实软化初期和中后期可能起着更为重要的促进作用。采后钙处理显著抑制细胞壁物质解聚,并且对糖苷酶(α-L-Af、β-Gal)活性及其基因表达具有更显著的调控作用。
钙处理抑制了细胞壁降解酶基因表达水平,降低了细胞壁降解酶活性,减缓了果胶、半纤维素的解聚,维持细胞壁结构的完整性, 因而外源钙处理较好地维持了贮藏期间果实硬度。
[1]邓佳, 刘惠民, 张南新, 等. 采后钙及热处理对葡萄柚果实贮藏期细胞壁物质代谢的影响[J]. 北方园艺, 2013,(2): 123-129.
DengJ,LiuHM,ZhangNX, et al.Effectofcalciumandhottreatmentsoncellwallmetabolismduringgrapefruit(Citrus paradiseMacf.)postharveststorage[J].NorthernHorticulture, 2013(2): 123-129.
[2]董涛, 夏仁学, 黄仁华, 等. 甜橙果实膳食纤维与PG、Cx活性的研究[J]. 园艺学报, 2007,34(5): 1287-1292.
DongT,XiaRX,HuangRH, et al.TherelationshipbetweentheactivityofPGandCxwithdietaryfiberinsweetorangefruit[J].ActaHotriculturaeSinica, 2007, 34(5): 1287-1292.
[3]ChardonnetCO,CharronCS,SamsCE,ConwayWS.Chemicalchangesinthecorticaltissueandcellwallsofcalcium-infiltrated‘GoldenDeliciuous’applesduringstorage[J].PostharvestBiologyandTechnology, 2003, 28(1): 97-111.
[4]RedgwellRJ,CurtiD,Gehin-DelvalC.Physicochemicalpropertiesofcellwallmaterialsfromapple,kiwifruitandtomato[J].EuropeanFoodResearchandTechnology, 2008, 227(2): 607-618.
[5]RoseJKC,HadfieldKA,LabavitchJM,BennettAB.Temporalsequenceofcellwalldisassemblyinrapidlyripeningmelonfruit[J].PlantPhysiology, 1998, 117(2): 345-361.
[6]LohaniS,TrivediPK,NathP.Changesinactivitiesofcellwallhydrolasesduringethylene-inducedripeninginbanana:effectof1-MCP,ABAandIAA[J].PostharvestBiologyandTechnology, 2004, 31(2): 119-126.
[7]DengY,WuY,LiTF, et al.Studiesofpostharvestberryabscissionof‘Kyoho’tablegrapesduringcoldstorageandhighoxygenatmospheres[J].PostharvestBiologyandTechnology, 2007, 43(1): 95-101.
[8]LinTP,LiuCC,ChenSW,WangWYP.PurificationandcharacterizationofpectinmethylesterasefromFicusawkeotsangMakinoachenes[J].PlantPhysiology, 1989, 91(4): 1445-1453.
[9]DongT,XiaR,WangM, et al.Changesindietaryfibre,polygalacturonase,cellulaseofnavelorange[Citrus sinensis(L.)Osbeck‘CaraCara’]fruitsunderdifferentstorageconditions[J].ScientiaHorticulturae, 2008, 116(4): 414-420.
[10]WeiJM,MaFW,ShiSG, et al.Changesandpostharvestregulationofactivityandgeneexpressionofenzymesrelatedtocellwalldegradationinripeningapplefruit[J].PostharvestBiologyandTechnology, 2010, 56(2): 147-154.
[11]BrummellDA,CinVD,CrisostoCH,LabavitchJM.Cellwallmetabolismduringmaturation,ripeningandsenescenceofpeachfruit[J].JournalofExperimentalBotany, 2004, 55(405): 2029-2039.
[12]KneeM,BartleyIM.Compositionandmetabolismofcellwallpolysaccharidesinripeningfruits[A].FriendJC,RhodesMJ.Recentadvancesinthebiochemistryoffruitandvegetables[M].NewYork:AcademicPress, 1981.
[13]梁庆沙, 张东亚, 李芳, 等. 钙处理对白凤桃果实冰温贮藏后细胞壁代谢物质的影响[J]. 果树学报, 2009, 26(5): 714-718.
LiangQS,ZhangDY,LiF, et al.Effectsofcalciumtreatmentonmetaboliteofcellwallofbaifengpeachfruitstoredaticepoint[J].JournalofFruitScience, 2009, 26(5): 714-718.
[14]DixonB,SagarGR,ShorrocksVM.EffectofcalciumandboronontheincidenceoftreeandstoragepitinapplesofthecultivarEgremontRusset[J].JournalofHorticulturalScience, 1973, 48(4): 403-411.
[15]FischerRL,BennettAB.Roleofcellwallhydrolasesinfruitripening[J].AnnualReviewofPlantPhysiologyandPlantMolecularBiology, 1991,(42): 675-703.
[16]AmnuaysinN,JonesML,SeraypheapK.Changesinactivitiesandgeneexpressionofenzymesassociatedwithcellwallmodificationinpeelsofhotwatertreatedbananas[J].ScientiaHorticulturae, 2012, 142: 98-104.
[17]梁国庆, 孙静文, 周卫, 王秀斌. 钙对苹果果实超氧化物歧化酶、过氧化氢酶活性及其基因表达的影响[J]. 植物营养与肥料学报, 2011, 17(2): 438-444.
LiangGQ,SunJW,ZhouW,WangXB.Effectsofcalciumonactivitiesandgeneexpressionsofsuperoxidedismutaseandcatalaseinapple(Malus punilaMill.)fruits[J].PlantNutritionandFertilizerScience, 2011, 17(2): 438-444.
[18]OrtizA,GraellJ,LaraI.Cellwall-modifyingenzymesandfirmnesslossinripening‘GoldenReinders’apples:AcomparisonbetweencalciumdipsandULOstorage[J].FoodChemistry, 2011, 128(4): 1072-1079.
[19]OrtizA,GraellJ,LaraI.Preharvestcalciumapplicationsinhibitsomecellwall-modifyingenzymeactivitiesanddelaycellwalldisassemblyatcommercialharvestof‘FujiKiku-8’apples[J].PostharvestBiologyandTechnology, 2011, 62(2): 161-167.
[20]SiddiquiS,BangerthF.Studiesoncellwallmediatedchangesduringstorageofcalcium-infiltratedapples[J].ActaHorticulturae, 1992, 326: 105-114.
Effectsofcalciumtreatmentsoncellwallmaterialmetabolismandrelatedenzymeactivitiesandgeneexpressioningrapefruit(CitrusparadisiMacf.)
DENGJia1,SHIZheng-jun1*,WANGLian-chun2,WUHai-bo2,LIUHui-min1
(1 Key Laboratory for Forest Resources Conservation and Use in the Southwest Mountains of China, Ministry of Education, Southwest Forestry University, Kunming 650224, China; 2 College of Forestry, Southwest Forestry University, Kunming 650224, China)
【Objectives】StudyontheeffectofCatreatmentonthecellwallcomponents,thevariationsofcellwalldegradingenzymeactivitiesandtheexpressionofrelevantgeneswillhelptounderstandtherelationshipbetweentheCaandmetabolismofcellwallmaterials,explorethemechanismsofCatofruitsoftening,andprovidebasefortheimprovementoffruitbenchingtime. 【Methods】AfieldexperimentwascarriedoutingrapefruitorchardinYuxiCity,YunnanProvincein2012.Grapefruitcultivar‘Riored’wasusedastestedcrop.Therootstockofthecultivarwasgraftedin2005onalocalcultivarindensityof3m×3m.TheCatreatmentswerecomposedoftwoparts:duringfruitgrowingandafterharvest.Growingtreatmentwasfoliarspraying2%CaCl2solutionatveryyoungfruit,endofyoungfruit,earlyfruitexpansion,endoffruitexpansionandcolordevelopingstage.Afterharvesttreatment:theharvestedfruitsweresoakedin2%CaCl2solutionfor5min,thenstoredatroomtemperature.Fruitsamplesweretakenevery15daysandeachtimewith10fruitsduringthestorageforthemeasurementofrelativeitems.【Results】Thetightlyboundpectins(covalentboundpectin)weredissembledintolooselyboundpectins(watersolublepectin,ionboundpectin)withgrapefruitfruitripening.Thecontentsoftightlyboundhemicelluloses(24%KOH-solublefraction)decreasedwhilelooselyboundhemicelluloses(4%KOH-solublefraction)increased.Theactivityandtheexpressionofcellwallenzymesgenesincreasedasfruitsoftened.PMEexpressedhighlevelsafterharvest.ThelevelofPGactivityincreasedintheearlystageofstoragewhilePGexpressionchangedsimilartoenzymetendency.TheactivitiesofCx,α-L-Afandβ-Galacceleratedinthemiddleandlaterstageofstoragerespectively,andtheirexpressionwereobviouslyenhancedduringstorage.Calciumtreatmenthadsignificantlyinhibitedcellwallenzymeactivitiesandgeneexpression.Calciumtreatmentdramaticallyregulatedtheactivityofα-L-Af,β-Galactivityinmiddlestageofstorageandlaterstage,respectively.Theenzymeactivities,geneexpressionsofα-L-Afandβ-Galhadnoticeablylowerlevelsincalciumtreatments. 【Conclusions】Calciumtreatmentscouldreducetheactivitiesofwall-degradingenzymes,theexpressionofrelevantgenes,andinhibitthedissemblingofwallmaterials.Therefore,calciumtreatmentiseffectiveinmaintainingfruittexturequalityandprolongingthebenchingperiod.
grapefruit;calcium;cellwallmaterial;cellwalldegradingenzyme;geneexpression
2014-07-17接受日期: 2015-03-16网络出版日期: 2015-05-20
教育部重点实验室科研基金项目(KLESWFU-1405); 国家林业局项目([2010]47); 高校引进人才科研基金启动项目(111406)资助。作者简介: 邓佳(1983—),女,云南昆明人,博士,讲师,主要从事果树栽培与利用研究。E-mail:dengjia1983@163.com
E-mail:shizhengjun1979@163.com
S666.3;S606+.2
A
1008-505X(2016)02-0450-09
