五爪金龙、南美蟛蜞菊入侵对土壤化学和微生物学性质的影响
2016-08-24全国明毛丹鹃章家恩谢俊芳
全国明, 毛丹鹃, 章家恩*, 谢俊芳, 秦 钟
(1 广州城市职业学院城市建设工程系,广州 510405; 2 华南农业大学热带亚热带生态研究所,农业部华南热带农业环境重点实验室,广东省高等学校农业生态与农村环境重点实验室,广州 510642)
五爪金龙、南美蟛蜞菊入侵对土壤化学和微生物学性质的影响
全国明1,2, 毛丹鹃2, 章家恩2*, 谢俊芳2, 秦 钟2
(1 广州城市职业学院城市建设工程系,广州 510405; 2 华南农业大学热带亚热带生态研究所,农业部华南热带农业环境重点实验室,广东省高等学校农业生态与农村环境重点实验室,广州 510642)

五爪金龙; 南美蟛蜞菊; 土壤化学; 土壤微生物群落
五爪金龙(Ipomoea cairica)是旋花科番薯属的多年生草质藤本,原产北美洲,因具有较高的观赏价值常被用作垂直绿化材料在许多地区引种和栽培,后逸为野生,不断在林缘、果园、茶园、路旁与公共园林等生境中繁殖扩散,现已入侵我国广东、广西、海南、云南、福建等省区[1]。五爪金龙的攀爬与分枝能力强,在野外能够通过缠绕、覆盖等方式影响其他植物的生长发育,逐渐成为严重危害农林业生产及自然生态系统的恶性杂草。在华南地区,其危害仅次于有“植物杀手”之称的薇甘菊(Mikania micrantha)[2]。南美蟛蜞菊(Wedelia trilobata)又名三裂叶蟛蜞菊,为菊科蟛蜞菊属的多年生草质匍匐植物,原产中、南美洲, 20世纪80年代香港将其作为地被绿化植物引进栽培,后迅速在我国华南地区蔓延扩散[3]。南美蟛蜞菊的生态适应性强,生长速度快,植株生产力高,入侵后极易形成单优植物群落成片生长,对当地的生物多样性造成极大威胁,已被列为世界上危害最严重的100种外来入侵生物之一[4]。
在入侵生物学的研究领域中,外来种的入侵机制一直是入侵生态学者的关注焦点。前人的研究表明,五爪金龙、南美蟛蜞菊快速的营养生长与克隆繁殖能力[1,3]、较低的叶片建成成本[5]、较高的光合速率[6]以及较强的化感作用[7-8]是其成功入侵的生物学基础。同时,五爪金龙较高的光合氮利用效率、比叶面积[9]与耐盐、耐草食动物(昆虫)啃食的特征[10],以及南美蟛蜞菊较高的表型可塑性、局域适应能力[11]和抵御高温[12]、强光辐射[13]的性能在其入侵过程中也发挥了重要作用。但迄今为止,针对这两种外来植物入侵机制的研究主要集中在地上部的植株生理部分,对地下部土壤生态系统的变化所开展的工作尚少见报道[14-15]。对于外来种而言,当其扩散到新的栖息地后,能够在适宜的环境条件下大量繁殖蔓延,通过生长竞争取代土著植物,改变入侵地的植物群落结构,进而导致土壤生物多样性与生态系统发生变化[16-17]。入侵地土壤性质的变化很可能有利于外来植物在与土著植物的竞争中占据优势,从而促进外来种自身的入侵扩散。如千屈菜(Lythrum salicaria)入侵湿地宽叶香蒲(Typha latifolia)群落后,显著提高了土壤的有机质含量和氮矿化速率,氮素的供应更加充足[18]。外来植物葱芥(Alliaria petiolata)能够增加入侵地土壤的pH和氮、磷、钙等养分的有效性,加快养分循环过程,以创造更好的土壤环境条件,促进入侵[19]。但外来植物的入侵暴发亦可能造成土壤养分的迅速下降,如入侵北美大草原的外来种冰草(Agropyron cristatum)显著降低了土壤总碳、全氮和速效氮含量[20]。
本研究以土著植物类芦(Nayraudia reynaudiana)为对照,采用野外样地试验法研究五爪金龙、南美蟛蜞菊入侵对土壤养分、土壤微生物量、土壤酶活性以及土壤微生物群落代谢活性、碳源利用特征和功能多样性的影响,探讨入侵地土壤生态环境变化对两种外来植物入侵的响应规律。提出以下假设: 1)两种外来植物入侵能够提高土壤养分水平; 2)两种外来植物入侵能够增强土壤生化反应强度,促进土壤养分循环; 3)两种外来植物入侵能够提高土壤微生物群落的代谢活性与功能多样性。
1 材料与方法
1.1试验地概况

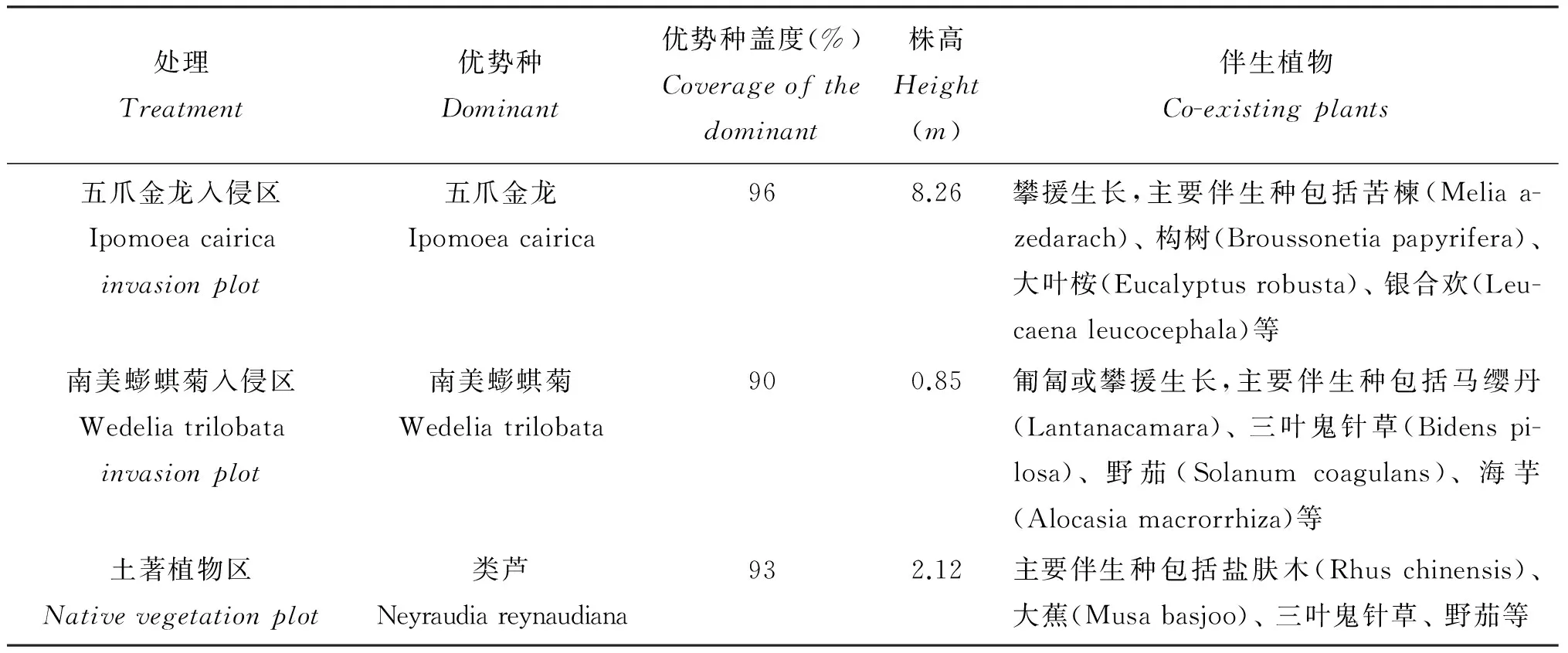
表1 不同入侵区的植物群落特征
1.2土样采集
2010年1月分别在上述3类样地随机设立4个重复小样方(2m×2m),先清除样方内地面的枯枝、石块等杂物,然后按S形采用5点法采集0—10cm表层土。3类样地的土壤样品均在目标植物根系周围采集。每个小样方所采集的土壤混合均匀后用四分法取适量土样运回实验室。其中一部分土样于室内自然风干,除去动植物残体,研磨过1mm筛,用于土壤养分、土壤酶活性的分析测定; 另一部分样品暂时冷藏于-18 ℃冰箱,1周内取出置25 ℃培养5d后测定土壤微生物量碳、氮、磷与微生物功能多样性。
1.3测定项目与方法
1.3.1 土壤养分的测定土壤有机碳采用重铬酸钾容量法(外加热法); 全氮采用凯氏定氮法; 全磷采用NaOH熔融—钼锑抗比色法; 全钾采用NaOH熔融—火焰光度法; 速效氮采用碱解扩散法; 速效磷采用0.05mol/LHCl-0.025mol/LH2SO4浸提—钼锑抗比色法; 速效钾采用NH4OAc浸提—火焰光度法测定[21]。
1.3.2土壤酶活性的测定脲酶采用苯酚-次氯酸钠比色法[22],脲酶活性以24h后1g土壤生成的NH3-N的微克数表示; 蛋白酶采用茚三酮比色法[23],蛋白酶活性以24h后1g土壤生成的NH3-N的毫克数表示; 蔗糖酶、纤维素酶采用3,5-二硝基水杨酸比色法[22-23],其中蔗糖酶活性以24h后1g土壤生成的葡萄糖毫克数表示,纤维素酶活性以72h后1g土壤生成的葡萄糖毫克数表示; 过氧化氢酶采用高锰酸钾滴定法[23],酶活性以20min后1g土壤消耗的0.02mol/L高锰酸钾的毫升数表示。
1.3.3 土壤微生物量碳、氮、磷的测定土壤微生物量的测定参照吴金水等[24]的方法。试验土样经过前处理、氯仿薰蒸后,分别采用K2Cr2O7-H2SO4氧化法、凯氏定氮法测定微生物量碳与微生物量氮,浸提剂为0.5mol/LK2SO4; 采用钼锑抗显色法测定土壤微生物量磷,浸提剂为0.5mol/LNaHCO3。
1.3.4 土壤微生物功能多样性的测定参照姚槐应等[22]的方法并作改进,在200mL三角瓶中加入100mL0.85%NaCl溶液,高压灭菌后备用(121 ℃, 20min)。称取相当于10g烘干土的新鲜土壤,倒入已冷却的无菌NaCl溶液中,封口,振荡20min(25 ℃, 160r/min),悬浮液静置澄清后在超净工作台上用0.85%NaCl溶液按10 倍稀释法制成10-3浓度的土壤稀释液,用微量移液器将稀释液接种到BIOLOGECO微平板中,25 ℃培育,每隔24h用酶标仪在590nm处测定各孔吸光值。
1.4数据处理
BIOLOGECO微平板的总体颜色变化用平均孔颜色变化率(averagewellcolordevelopment,AWCD)表示。AWCD=Σ(Ci-R)/n,式中,Ci为各反应孔在590nm下的吸光值; R为对照孔的吸光值; n为培养基的碳源数量。BIOLOGECO微平板的碳源数为31,Ci-R≤0的孔在计算中记为0[25],当AWCD达到0.75时能观测到大部分微孔中微生物群落的反应,本研究中最接近该值的培养时间为72h,因此选择该培养时间的数据进行土壤微生物群落碳源利用特征以及功能多样性的差异分析[26-27]。其中土壤微生物群落的碳源利用特征采用主成分(PCA)分析法,而功能多样性指数则采用下列公式计算﹕
1)Shannon-Wiener指数[28]H′= -ΣPilnPi
式中,Pi = (Ci-R)/Σ(Ci-R),表示第i反应孔的相对吸光值与整块BIOLOGECO微平板所有反应孔相对吸光值总和的比值。
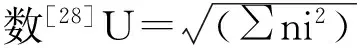
式中, ni = Ci-R,表示第i反应孔的相对吸光值。
3)Simpson优势度指数[29]Ds =1-ΣPi2。
4)Pielou均匀度指数[28]E =H′/lnS
S为丰富度指数(Richness),指被微生物群落利用的基质数量。若微孔的相对吸光值≥0.2,则认为是阳性值并计入微生物群落的丰富度,即此类微孔的总和[30]。
所有试验数据均用MicrosoftExcel进行处理,通过SPSS17.0进行方差分析(One-wayANOVA),并采用Duncan新复极差法进行多重比较。分析结果采用Origin8.0作图。
2 结果与分析
2.1土壤养分

表2五爪金龙、南美蟛蜞菊入侵区与土著植物区的土壤养分
Table2SoilnutrientsofIpomoeacairicainvasionplot,Wedeliatrilobatainvasionplotandnativevegetationplot
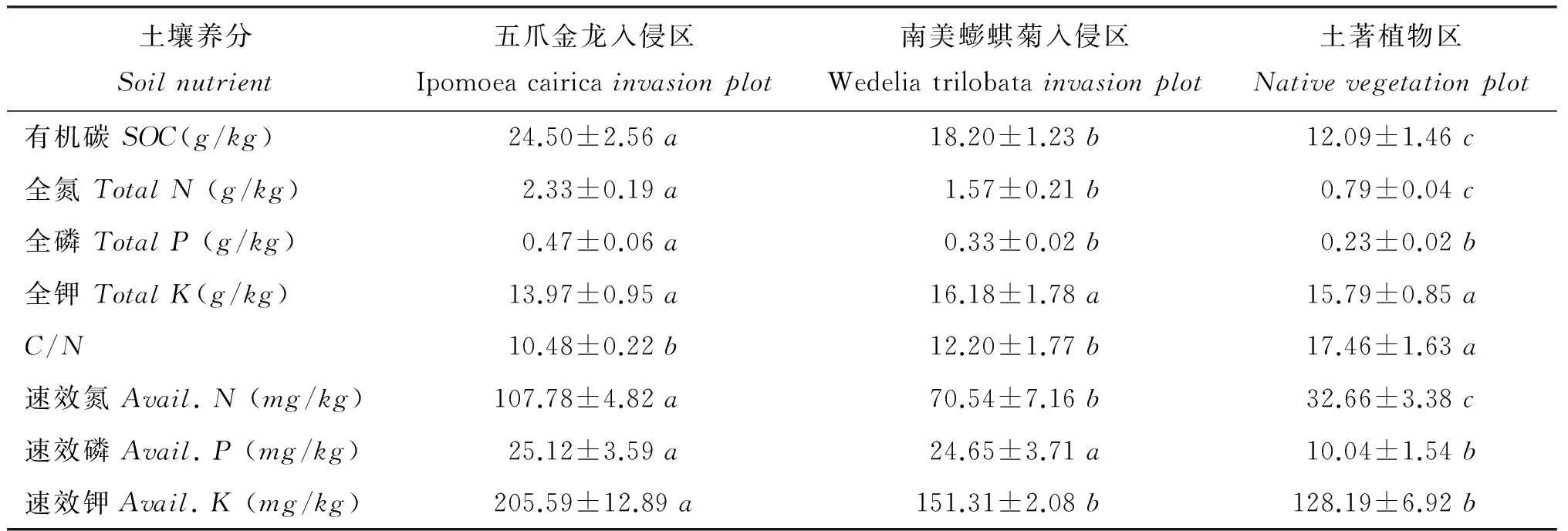
土壤养分Soilnutrient五爪金龙入侵区Ipomoeacairicainvasionplot南美蟛蜞菊入侵区Wedeliatrilobatainvasionplot土著植物区Nativevegetationplot有机碳SOC(g/kg)24.50±2.56a18.20±1.23b12.09±1.46c全氮TotalN(g/kg)2.33±0.19a1.57±0.21b0.79±0.04c全磷TotalP(g/kg)0.47±0.06a0.33±0.02b0.23±0.02b全钾TotalK(g/kg)13.97±0.95a16.18±1.78a15.79±0.85aC/N10.48±0.22b12.20±1.77b17.46±1.63a速效氮Avail.N(mg/kg)107.78±4.82a70.54±7.16b32.66±3.38c速效磷Avail.P(mg/kg)25.12±3.59a24.65±3.71a10.04±1.54b速效钾Avail.K(mg/kg)205.59±12.89a151.31±2.08b128.19±6.92b
注(Note): 同行数据后不同字母表示不同处理之间的差异达5%显著水平Valuesfollowedbydifferentlettersinthesamerowaresignificantamongdifferentplotsatthe5%level.
2.2土壤微生物量


表3 五爪金龙、南美蟛蜞菊入侵区与土著植物区的土壤微生物量
注(Note):SMBC—Soilmicrobialbiomasscarbon;SMBN—Soilmicrobialbiomassnitrogen;SMBP—Soilmicrobialbiomassphosphorus.Cmic—土壤微生物碳SoilmicrobialbiomassC;Corg—土壤有机碳SoilorganicC;Nmic—土壤微生物氮SoilmicrobialbiomassN;Nt—土壤全氮SoiltotalN;Pmic—土壤微生物磷SoilmicrobialbiomassP;Pt—土壤全磷SoiltotalP. 同行数据后不同字母表示不同处理间的差异达5%显著水平Valuesfollowedbydifferentlettersinthesamerowaresignificantamongdifferentplotsatthe5%level.
2.3土壤酶活性
南美蟛蜞菊入侵区的脲酶、蛋白酶活性最高,其含量分别比土著植物区增加70.35%和21.51%,差异显著; 五爪金龙入侵区的脲酶、蛋白酶活性次之,但亦显著高于土著植物区(表4)。与土著植物区相比,五爪金龙、南美蟛蜞菊入侵区的蔗糖酶活性分别增加322.58%和157.14%,差异显著。纤维素酶活性的变化与蛋白酶类似,南美蟛蜞菊入侵区的含量最高,土著植物区的含量最低; 与土著植物区相比,两个入侵区的增幅均在2倍以上,差异显著。过氧化氢酶活性在各处理间的差异均不显著。从表4还可看出,两种入侵植物对土壤脲酶、蔗糖酶活性的影响程度不同,其中五爪金龙对蔗糖酶的活化能力更强,而南美蟛蜞菊则对脲酶活性的提升更显著。
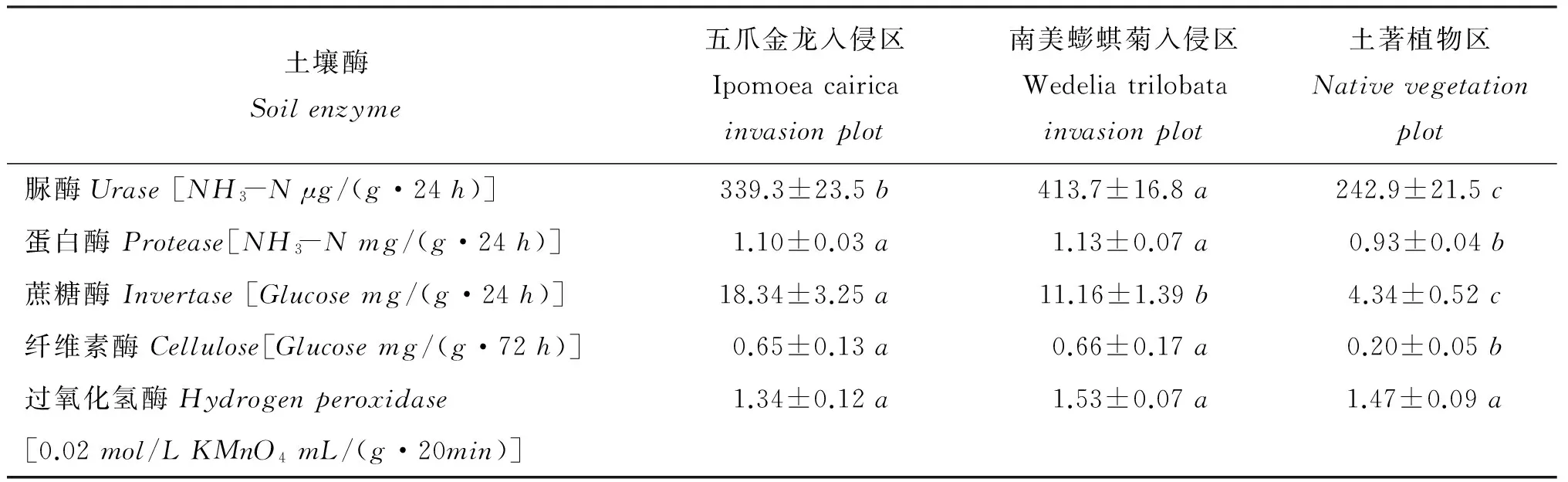
表4 五爪金龙、南美蟛蜞菊入侵区与土著植物区的土壤酶活性
注(Note): 同行数据后不同字母表示不同处理间的差异达5%显著水平Valuesfollowedbydifferentlettersinthesamerowaresignificantamongdifferentplotsatthe5%level.
2.4土壤微生物碳代谢指纹



图1 不同入侵区土壤微生物群落碳源利用的平均孔颜色变化率 Fig.1 Average well color development (AWCD) of carbon substrate utilization for soil microbial community under different invasion plots
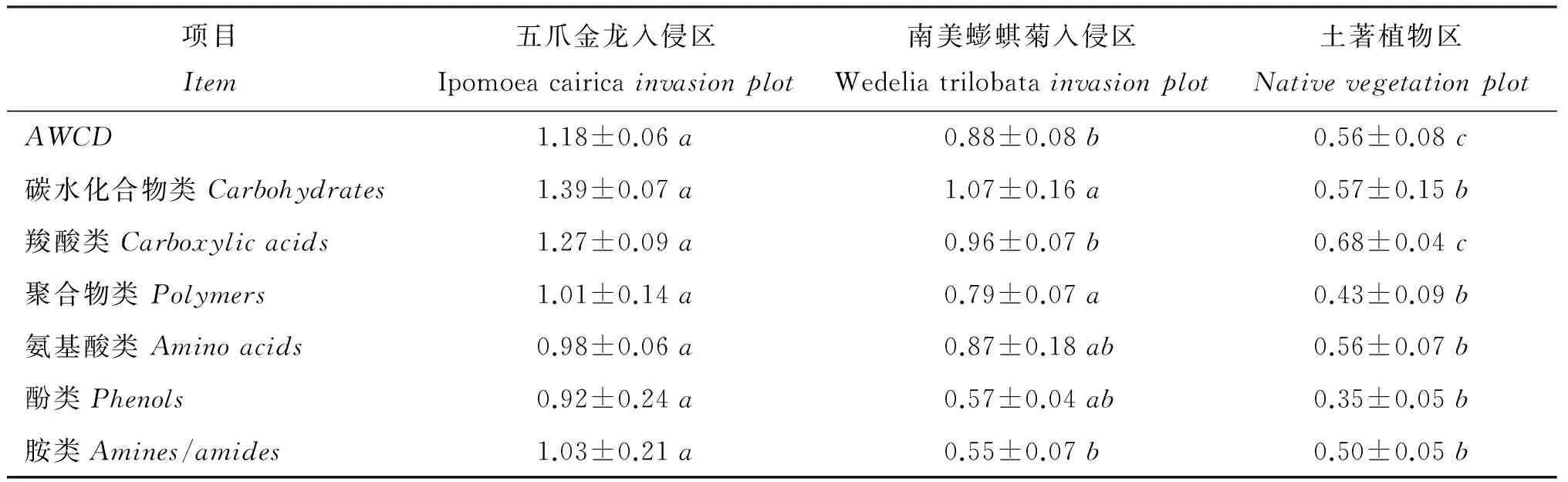
项目Item五爪金龙入侵区Ipomoeacairicainvasionplot南美蟛蜞菊入侵区Wedeliatrilobatainvasionplot土著植物区NativevegetationplotAWCD1.18±0.06a0.88±0.08b0.56±0.08c碳水化合物类Carbohydrates1.39±0.07a1.07±0.16a0.57±0.15b羧酸类Carboxylicacids1.27±0.09a0.96±0.07b0.68±0.04c聚合物类Polymers1.01±0.14a0.79±0.07a0.43±0.09b氨基酸类Aminoacids0.98±0.06a0.87±0.18ab0.56±0.07b酚类Phenols0.92±0.24a0.57±0.04ab0.35±0.05b胺类Amines/amides1.03±0.21a0.55±0.07b0.50±0.05b
注(Note):AWCD—平均孔颜色变化率Averagewellcolordevelopment. 表中数据为培养至72h的结果Datainthetableweredeterminedaftertheincubationof72h. 同行数据后不同字母表示不同处理区之间的差异达5%显著水平Valuesfollowedbydifferentlettersinthesamerowaresignificantamongdifferentplotsatthe5%level.
主成分分析结果(图2)显示,不同处理区对微生物利用碳源的分异情况差异显著,第1主成分(PC1)聚集了60.61%的数据变异,第2主成分(PC2)聚集了11.28%的数据变异,两主成分基本能反映土壤微生物群落碳源利用的主要信息。五爪金龙、南美蟛蜞菊两个入侵区在PC1轴主要沿正值方向分布,在PC2轴则各分布在正、负值方向; 而土著植物区无论在PC1轴、PC2轴均分布在负值方向。表明两种外来植物入侵能够改变土壤微生物群落的碳源利用格局。
在BIOLOGECO微平板的31种碳源中,PC1与5种碳水化合物类(i-赤藓糖醇、D-甘露醇、N-乙酰-D-葡糖胺、D-纤维二糖、D,L-α-甘油磷酸)、3种氨基酸类(L-天冬酰胺、L-苯丙氨酸、甘氨酰-L-谷氨酸), 3种聚合物类(吐温80、α-环糊精、糖原), 2种羧酸类(γ-羟丁酸、D-苹果酸), 1种酚类(4-羟基苯甲酸)以及1种胺类碳源(苯乙胺)呈现较高的相关性(RPC1>0.80),表明PC1主要受碳水化合物类、氨基酸类与聚合物类碳源的影响; 而PC2则与3种碳水化合物类(β-甲基-D-葡萄糖苷、D-半乳糖酸γ-内酯、α-D-乳糖), 2种羧酸类(丙酮酸甲酯、D-半乳糖醛酸)以及1种氨基酸类碳源(L-精氨酸)的相关程度较高(RPC2>0.40),显示其主要受碳水化合物类与羧酸类碳源的制约(表6)。
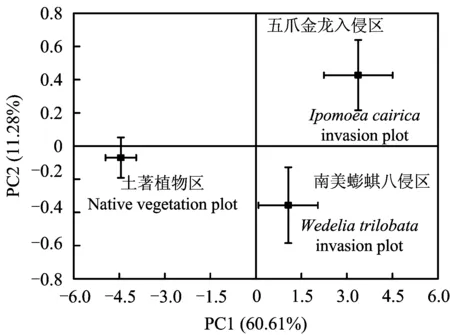
图2 不同入侵区土壤微生物群落碳源利用的主成分(PC1、PC2)分类图Fig.2 PCA-ordination biplot (PC1, PC2) of carbon substrate utilization for soil microbial community under different invasion plots
[注(Note): 图中数据为培养至72h的结果Datainthefigureweredeterminedaftertheincubationof72h.PC1、PC2分别代表主成分1和主成分2PC1andPC2indicateprincipalcomponent1andprincipalcomponent2respectively.PC1、PC2括号内的数值表示相应主成分特征值的方差贡献率Valuesinparenthesesindicatethepercentagesoftotalvariationaccountedforbyeachprincipalcomponentaxis.]
两种外来植物入侵能够对土壤微生物群落的功能多样性产生重要影响(表7)。与土著植物区相比,五爪金龙、南美蟛蜞菊显著提高了入侵地土壤微生物群落的Shannon-Wiener指数(H′)、McIntosh指数(U)、丰富度指数(S)和Simpson优势度指数(Ds),但两个入侵区之间的差异较小。Pielou均匀度指数(E),3个处理间的差异不明显。
3 讨论
3.1五爪金龙、南美蟛蜞菊入侵对土壤养分、土壤微生物量与土壤酶活性的影响
植物通过调节生境土壤养分动态进而影响其他植物的生长、繁殖,是物种竞争替代的重要驱动机制之一。随着对地下生态系统认识的不断深入,外来种入侵与土壤生态系统过程变化的相互关系,即“入侵植物—土壤系统”的反馈作用越来越受到研究者的关注[32-33]。大量研究表明,入侵植物能够对入侵地土壤的理化性质与系统功能产生直接和间接的影响,导致入侵地的土壤结构、土壤养分库与养分循环过程发生改变,并且这种改变与外来植物的入侵力密切相关[34-36]。如正在云南、四川等西南山地急剧扩散的紫茎泽兰(Ageratina adenophora)能够增加土壤有机碳、全氮以及铵态氮、硝态氮、速效磷等速效养分的含量,明显改善土壤肥力[37]。外来杂草银胶菊(Parthenium hysterophorus)入侵尼泊尔草地亦造成入侵区土壤有机质、全氮、速效磷、速效钾等养分含量大幅上升[38]。外来植物假高粱(Sorghum halepense)入侵美国草原后显著促进了土壤镁、锌、铁、锰等矿质元素的有效化,提高了土壤中相应阳离子的浓度[39]。而在我国东南沿海湿地大肆入侵的互花米草(Spartina alterniflora)导致入侵地土壤碳库、氮库和硫库的明显上升[40-41]。本研究结果显示,五爪金龙、南美蟛蜞菊入侵可显著提高土壤有机碳、全氮、速效氮、速效磷的含量,降低土壤C/N比,但对土壤全钾含量的影响不明显。这说明两种外来植物能够改善入侵地的土壤环境条件,提高土壤肥力水平和增加养分的有效供应,进而支持本研究的第1个假说。
土壤微生物量是土壤中体积小于5×103μm3的生物总量,它是土壤中最活跃的肥力因子之一,参与土壤有机质的分解、腐殖质的形成和土壤养分的循环转化过程,是土壤生态系统肥力的重要生物学指标[24]。而土壤酶主要来源于土壤微生物的代谢过程和土壤中植物、动物的活体分泌或残体分解,能够参与土壤的许多重要生物化学过程和物质循环,其中脲酶、蛋白酶与氮素转化有关,蔗糖酶、纤维素酶与有机碳的循环相关,过氧化氢酶则催化分解土壤中累积的过氧化氢,减轻过氧化氢对植物的毒害作用[22-23]。本研究发现,五爪金龙、南美蟛蜞菊入侵显著增加土壤微生物量碳、氮、磷含量以及土壤脲酶、蛋白酶、蔗糖酶和纤维素酶的活性,但对过氧化氢酶的影响不明显,支持本文的第2个假设。相似的研究结果也在其他的外来植物中发现,如长期入侵葡萄牙滨海沙丘地区的长叶相思(Acacia longifolia)显著增加土壤微生物量碳含量[42]; 入侵我国南亚热带河岸地带的外来杂草马缨丹明显提高土壤微生物量氮、磷含量[43]; 而入侵新西兰南岛的绿毛山柳菊(Hieracium pilosella)和入侵我国华东地区的加拿大一枝黄花(Solidago canadensis)均能够使土壤微生物量碳、氮、磷含量显著提高[44-45]。在土壤酶活性的变化方面,相关研究表明,南美干旱区的入侵灌木大叶落地生根(Kalanchoe daigremontiana)促进了土壤脲酶活性的明显上升[46]; 外来植物柔枝莠竹(Microstegium vimineum)入侵区的土壤纤维素酶、多酚氧化酶和氨基肽酶活性亦显著增强[47]; 而在我国华南地区快速蔓延的薇甘菊则能大幅提高土壤蔗糖酶、蛋白酶、β-萄糖苷酶和磷酸酶活性[48]。可见,五爪金龙、南美蟛蜞菊与大多数研究报道的外来植物类似,能够提高入侵区的土壤生物活性和土壤生化反应强度,这对加快土壤的养分循环与物质转化具有重要的促进作用。

表6 土壤微生物群落碳源利用与前两个主成分(PC1、PC2)的相关性
注(Note): RPC1、RPC2为各个碳源在主成分1、主成分2的因子载荷值 RPC1andRPC2valuesrefertotheeigenvectorloadingfactorforeachsubstrate. 表中只列出因子载荷值RPC1>0.80和RPC2>0.40的碳源种类Onlysubstrateswithfactorloadings>0.80, >0.40inPC1andPC2respectivelyarepresented.CH、CA、AA、PL、AM、PH分别代表碳水化合物类、羧酸类、氨基酸类、聚合物类、胺类和酚类CH,CA,AA,PL,AMandPHindicatecarbohydrates,carboxylicacids,aminoacids,polymers,amines/amidesandphenolsrespectively.
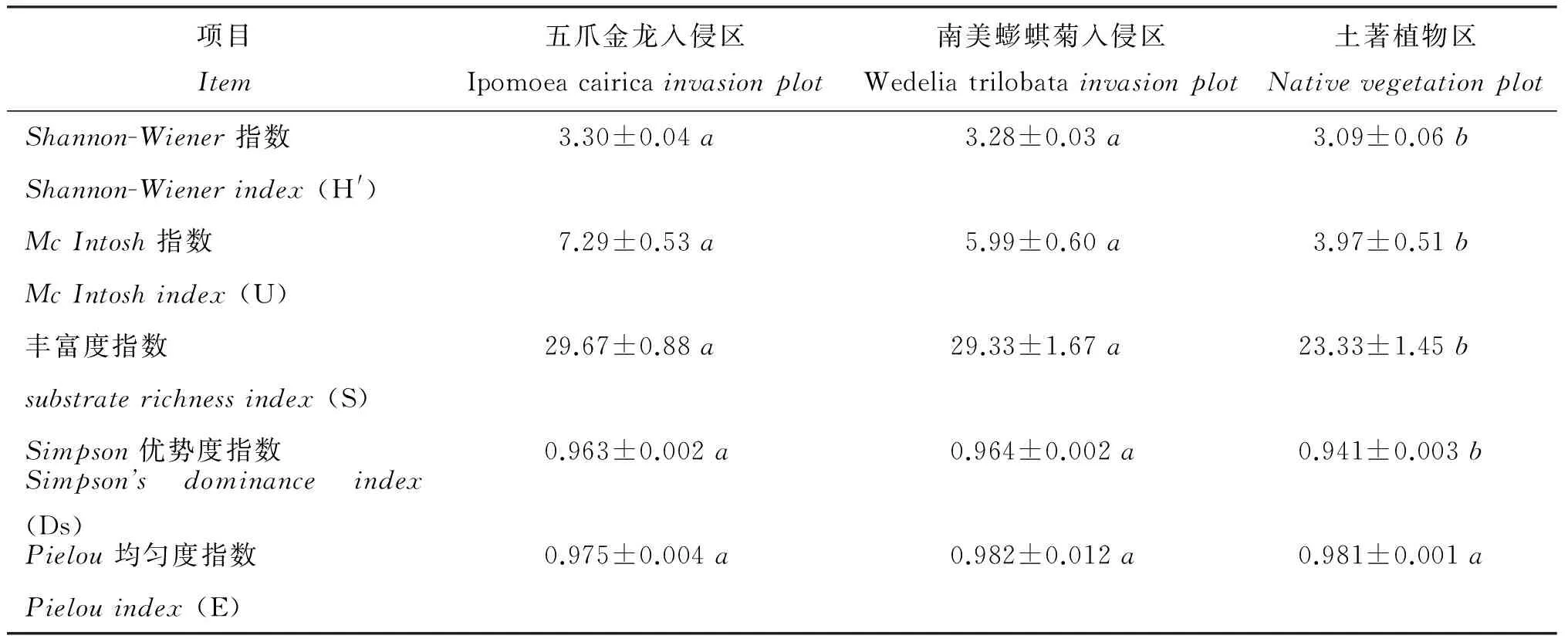
表7 五爪金龙、南美蟛蜞菊入侵区与土著植物区土壤微生物群落碳源利用的功能多样性指数
注(Note): 同行数据后不同字母表示不同处理区之间的差异达5%显著水平Valuesfollowedbydifferentlettersinthesamerowaresignificantamongdifferentplotsatthe5%level.
3.2五爪金龙、南美蟛蜞菊入侵对土壤微生物碳代谢指纹的影响
土壤微生物是土壤生态系统中极其重要的生物因子之一,它直接参与凋落物的分解、根系养分的吸收与土壤肥力的转化过程,进而对植物的生长、竞争和生态系统功能的稳定产生重要影响。许多外来植物能够通过改变土壤微生物群落的结构组成、区系数量与生理功能,破坏土著植物与土壤微生物群落在长期演化过程中所形成的平衡共生关系,干扰土著种的资源获取、生长繁殖与种群更新,从而使自身在入侵竞争中获得更大优势[34,37]。本试验虽没有直接测定入侵区土壤微生物群落的成分与各生理种群的变化,但利用BIOLOG微平板技术对其碳源利用特征以及功能多样性的研究结果表明,五爪金龙、南美蟛蜞菊入侵能够显著提高土壤微生物群落的代谢活性、碳源利用率和功能多样性指数,改变土壤微生物群落的碳源利用格局,进而支持本文的第3个假设。这也与盐生草(Halogeton glomeratus)、皱果苋(Amaranthus viridis)、马缨丹等外来植物的研究结果类似[43,49-50]。Qin等[51]进一步指出,与外来植物豚草(Ambrosia artemisiifolia)的重度入侵区相比,土壤微生物学性质的变化对豚草轻度入侵的响应更灵敏,轻度入侵区土壤微生物群落的AWCD、碳源利用效率(尤其是碳水化合物类、胺类碳源)均显著上升。五爪金龙、南美蟛蜞菊两种外来植物对土壤微生物群落代谢活性、土壤碳源利用效率以及功能多样性的提高能够推动入侵区土壤的生物化学反应进程,从而改善土壤养分和土壤环境状况。
一般而言,外来植物对土壤生态系统过程的改变主要与其异常的营养吸收策略、净初级生产力、凋落物输入的数量、质量与分解速率以及释放的次生化合物如叶片挥发物、根系分泌物等密切相关[19,34,40]。本研究中,五爪金龙、南美蟛蜞菊显著改善土壤微环境的原因可能包括:
1)两个外来种全年均可进行营养生长,光合能力强,生长速度快,比土著植物具有更高的净初级生产力,能在短时间内积累更多的植株生物量[2-3]。同时,这两种外来植物在野外主要以单优群落的形式生长,其蔓性攀爬的特点使群落内的其他植物因光照不足、光合作用受阻而枯竭; 尤其是五爪金龙,其在树冠顶部所形成的致密覆盖层能够导致林下层植物(包括乔木、灌木、草本植物等)成片死亡。这些枯死的植物残体以及自身在发育中所形成的枯落物使进入系统的凋落物数量大幅增加,虽然目前有关五爪金龙、南美蟛蜞菊凋落物质量的研究尚无报道,但对其他一些外来种的研究表明,与土著植物相比,外来植物的凋落物分解速率更快,并可以促进土著植物凋落物的分解和养分释放[19]。这些数量巨大的凋落物将直接促进土壤有机碳含量的显著上升,并有利于土壤氮、磷养分的固定,提高土壤肥力水平[43]。因此,两种入侵植物群落内凋落物的数量、分解状态可能是促进土壤养分库与养分供应量增加的重要原因。
2)两种外来植物尤其是南美蟛蜞菊的根系发达,不定根、侧根的发生量大[3]; 并且与土壤接触的地上部匍匐植株茎节在适宜的条件下能够萌发克隆分枝并长成新的植株,不断拓展种群的侵占面积并形成更庞大的根系系统。植物生长过程中大量的光合同化产物能够通过根区以根系分泌物的形式进入地下生态系统并成为土壤微生物的能量来源,有利于提高土壤微生物群落的代谢活性和生理功能[52]。同时,丰富的土壤有机质可促进土壤碳源的利用率提高[53],五爪金龙、南美蟛蜞菊入侵区较高的土壤有机碳含量也有助于提高土壤微生物群落对各类碳源的利用效率。另外,两种外来植物所形成的大面积致密覆盖层,能够改变群落内的局部小气候环境。根据野外观察,与周围环境相比,五爪金龙、南美蟛蜞菊群落内的太阳辐射强度大幅下降,地表土壤的温度降低、湿度上升。这将有效避免华南地区夏季频发的极端高温、高强度太阳辐射所导致的不良影响,形成有利于土壤微生物群落增长、繁殖的适宜小生境; 并且也能够有效缓解暴雨对地面的冲刷力度,减少土壤养分的流失。
3)两个外来种入侵形成的单优群落改变地面植物的种类构成[6,14],同时通过残体腐解、茎叶淋溶、根系分泌等途径向土壤释放各种化感物质[7-8],进而调控土壤微生物群落的结构与功能。Si等[54]研究证实南美蟛蜞菊入侵明显改变土壤微生物群落的结构组成,土壤真菌以及硝化细菌、亚硝化单胞菌的丰富度显著增加。五爪金龙亦显著提高入侵地土壤自生固氮菌、氨氧化细菌与真菌的数量[55]。自生固氮菌能够固定大气氮素,使气态氮转变为植物可利用的氮形态,从而有效增加土壤氮素的积累。氨氧化细菌、硝化细菌、亚硝化单胞菌等功能微生物与土壤的氮素转化密切相关,其数量上升将有利于土壤养分的活化,进而促进氮素循环,形成有利于自身入侵蔓延的土壤养分环境[54,56]。土壤真菌群落在植物入侵中亦承担着重要功能,其数量增加一方面有利于固定更多的碳、氮、磷素,提高土壤微生物量碳、氮、磷含量,增加土壤的活性养分库; 二是部分土壤真菌与外来植物根系共生形成丛枝菌根真菌,能够有效增强外来植物的养分吸收能力和促进入侵[57]。因此,两种外来植物通过改变入侵地土壤微生物群落尤其是土壤真菌群落的结构、数量,活化土壤养分,进而提高系统内的养分供应水平和加快入侵进程。
由上可见,五爪金龙、南美蟛蜞菊入侵能够明显改善土壤的微生物环境,加快营养循环与物质转化过程,从而促进土壤有效养分的释放与肥力供应,这可能是两种外来植物成功入侵的机制之一,即通过较强地改善入侵地土壤尤其是贫瘠土壤的养分水平,从而快速、高效地获取生长、繁殖所需的各种物质资源,增强自身的竞争能力,抑制土著植物的生长,促进入侵。
4 结论
采用野外样方研究法探讨了五爪金龙、南美蟛蜞菊入侵对土壤化学与微生物学性质的影响,结果显示,与土著植物相比,两种外来植物入侵显著提高了土壤有机碳、全氮、速效氮、有效磷的含量,降低土壤C/N比,但对土壤全钾含量的影响不明显。同时,显著增加了入侵区土壤微生物量碳、氮、磷含量以及土壤脲酶、蛋白酶、蔗糖酶和纤维素酶的活性,对土壤过氧化氢酶的影响较小。另外,两种外来植物入侵区的土壤微生物群落代谢活性、碳源利用率和功能多样性指数亦显著上升。这说明五爪金龙、南美蟛蜞菊两个外来种入侵能够改善入侵区域的土壤营养环境条件,加快土壤的物质转化与养分循环进程,提高土壤中可直接利用的养分水平,从而创造有利于自身生长、竞争的微生境,加快入侵扩散。
[1]胡玉佳, 王永繁. 两种草质藤本杂草营养生长与生殖生长研究[J]. 中山大学学报(自然科学版), 2001, 40(1): 93-96.
HuYJ,WangYF.Astudyonthevegetationandreproductionoftwoweedyherbaceousvines[J].ActaScientiarumNaturaliumUniversitatisSunyatseni, 2001, 40(1): 93-96.
[2]廖宜英, 林金哲, 郑灿钟. 农林业入侵杂草五爪金龙生活史特性研究[J]. 江西农业学报, 2006, 18(6): 112-115.
LiaoYY,LinJZ,ZhengCZ.ObservationonlifehistorycharacteristicsofinvasiveweedIpomoea cairicainagricultureandforestry[J].ActaAgriculturaeJiangxi, 2006, 18(6): 112-115.
[3]吴彦琼, 胡玉佳, 廖富林. 从引进到潜在入侵的植物—南美蟛蜞菊[J]. 广西植物, 2005, 25(5): 413-418.
WuYQ,HuYJ,LiaoFL. Wedelia trilobata—Aspeciesfromintroducedtopotentialinvasive[J].Guihaia, 2005, 25(5): 413-418.
[4]LoweS,BrowneM,BoudjelasS, et al. 100oftheworld’sworstinvasivealienspecies:aselectionfromtheglobalinvasivespeciesdatabase[R].NewZealand:TheInvasiveSpeciesSpecialistGroup, 2000.
[5]宋莉英, 彭长连, 彭少麟. 华南地区3种入侵植物与本地植物叶片建成成本的比较[J]. 生物多样性, 2009, 17(4): 378-384.
SongLY,PengCL,PengSL.ComparisonofleafconstructioncostsbetweenthreeinvasivespeciesandthreenativespeciesinSouthChina[J].BiodiversityScience, 2009, 17(4): 378-384.
[6]吴彦琼, 胡玉佳. 外来植物南美蟛蜞菊、裂叶牵牛和五爪金龙的光合特性研究[J]. 生态学报, 2004, 24(10): 2334-2339.
WuYQ,HuYJ.ResearchesonphotosyntheticcharacteristicsofexoticplantsWedelia trilobata, Pharbitis nilandIpomoea cairica[J].ActaEcologicaSinica, 2004, 24(10): 2334-2339.
[7]刘伟, 侯任昭, 叶蕙, 等. 五爪金龙的化感作用[J]. 华南农业大学学报, 1997, 18(2): 119-120, 122.
LiuW,HouRZ,YeH, et al.StudyontheallelopathyofIpomoea cairica[J].JournalofSouthChinaAgriculturalUniversity, 1997, 18(2): 119-120, 122.
[8]吴易, 司春灿, 孙见凡, 等. 南美蟛蜞菊根系分泌物中2种化学物质的化感潜力[J]. 西北农业学报, 2014, 23(10): 170-178.
WuY,SiCC,SunJF, et al.AllelopathiceffectsoftwochemicalsinWedelia trilobatarootexudates[J].ActaAgriculturaeBoreali-occidentalisSinica, 2014, 23(10): 170-178.
[9]ShenXY,PengSL,ChenBM, et al.Dohigherresourcecaptureabilityandutilizationefficiencyfacilitatethesuccessfulinvasionofnativeplants? [J].BiologicalInvasions, 2011, 13: 869-881.
[10]LiuG,HuangQQ,LinZG, et al.HightolerancetosalinityandherbivorystressesmayexplaintheexpansionofIpomoea cairicatosaltmarshes[J].PLoSOne, 2012, 7(11):e48829.
[11]SiCC,DaiZC,LinY, et al.LocaladaptationandphenotypicplasticitybothoccurredinWedelia trilobatainvasionacrossatropicalisland[J].BiologicalInvasions, 2014, 16: 2323-2337.
[12]宋莉英, 孙兰兰, 张强, 等. 高温对入侵种三裂叶蟛蜞菊叶片PSII功能和光能分配的影响[J]. 植物生理学通讯, 2009, 45(5): 464-468.
SongLY,SunLL,ZhangQ, et al.EffectsofhightemperatureonthePSIIfunctionsandabsorbedlightallocationinleavesofinvasiveWedelia trilobata[J].PlantPhysiologyCommunications, 2009, 45(5): 464-468.
[13]宋莉英, 孙兰兰, 舒展, 等. 夏季高光下入侵植物三裂叶蟛蜞菊叶片变红的生理功能[J]. 生物多样性, 2009, 17(2): 188-194.
SongLY,SunLL,ShuZ, et al.PhysiologicalfunctionsoftheredleavesofWedelia trilobatainducedbyhighirradianceinsummer[J].BiodiversityScience, 2009, 17(2): 188-194.
[14]朱慧, 吴双桃. 杂草五爪金龙对入侵地植物群落和土壤肥力的影响[J]. 生态与农村环境学报, 2012, 28(5): 505-510.
ZhuH,WuST.ImpactsofinvasionofIpomoea cairicaonplantcommunityandsoilfertility[J].JournalofEcologyandRuralEnvironment, 2012, 28(5): 505-510.
[15]柯展鸿, 邱佩霞, 胡东雄, 等. 三裂叶蟛蜞菊入侵对土壤酶活性和理化性质的影响[J]. 生态环境学报, 2013, 22(3): 432-436.
KeZH,QiuPX,HuDX, et al.EffectsofWedelia trilobatainvasiononsoilenzymeactivitiesandphysical-chemicalproperties[J].EcologyandEnvironmentalSciences, 2013, 22(3): 432-436.
[16]DomènechR,VilàM,GestiJ, et al.NeighbourhoodassociationofCortaderia selloanainvasion,soilpropertiesandplantcommunitystructureinmediterraneancoastalgrasslands[J].ActaOecologica, 2006, 29: 171-177.
[17]MartinMR,TippingPW,SickmanJO.Invasionbyanexotictreealtersaboveandbelowgroundecosystemcomponents[J].BiologicalInvasions, 2009, 11: 1883-1894.
[18]FickbohmSS,ZhuWX.Exoticpurpleloosestrifeinvasionofnativecattailfreshwaterwetlands:Effectsonorganicmatterdistributionandsoilnitrogencycling[J].AppliedSoilEcology, 2006, 32: 123-131.
[19]RodgersVL,WolfeBE,WerdenLK, et al.TheinvasivespeciesAlliaria petiolata (garlicmustard)increasessoilnutrientavailabilityinnorthernhardwood-coniferforests[J].Oecologia, 2008, 157: 459-471.
[20]ChristianJM,WilsonSD.Long-termecosystemimpactsofanintroducedgrassinthenorthernGreatPlains[J].Ecology, 1999, 80(7): 2397-2407.
[21]鲍士旦. 土壤农化分析(第三版)[M]. 北京: 农业出版社, 2000.
BaoSD.Soilandagriculturalchemistryanalysis(3rdedition) [M].Beijing:ChinaAgriculturePress, 2000.
[22]姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术[M]. 北京: 科学出版社, 2006.
YaoHY,HuangCY.Soilmicrobialecologyanditsexperimentaltechnology[M].Beijing:SciencePress, 2006.
[23]关松荫. 土壤酶及其研究方法[M]. 北京: 农业出版社, 1986.
GuanSY.Soilenzymesanditsresearchmethods[M].Beijing:AgriculturePress, 1986.
[24]吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006.
WuJS,LinQM,HuangQY, et al.Assaymethodofsoilmicrobialbiomassanditsapplication[M].Beijing:ChinaMeteorologicalPress, 2006.
[25]GarlandJL.AnalyticalapproachestothecharacterizationofsamplesofmicrobialcommunitiesusingpatternsofpotentialCsourceutilization[J].SoilBiologyandBiochemistry, 1996, 28: 213-221.
[26]GarlandJL.Analysisandinterpretationofcommunity-levelphysiologicalprofilesinmicrobialecology[J].FEMSMicrobiologyEcology, 1997, 24: 289-300.[27]StefanowiczA.Thebiologplatestechniqueasatoolinecologicalstudiesofmicrobialcommunities[J].PolishJournalofEnvironmentalStudies, 2006, 15(5): 669-676.
[28]王强, 戴九兰, 吴大千, 等. 微生物生态研究中基于BIOLOG方法的数据分析[J]. 生态学报, 2010, 30(3): 817-823.
WangQ,DaiJL,WuDQ, et al.StatisticalanalysisofdatafromBIOLOGmethodinthestudyofmicrobialecology[J].ActaEcologicaSinica, 2010, 30(3): 817-823.
[29]胡婵娟, 傅伯杰, 刘国华, 等. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性[J]. 生态学报, 2009, 29(2): 727-733.
HuCJ,FuBJ,LiuGH, et al.SoilmicrobialfunctionalanddiversityundertypicalartificialwoodlandsinthehillyareaoftheLoessPlateau[J].ActaEcologicaSinica, 2009, 29(2): 727-733.
[30]RatcliffAW,BusseMD,ShestakCJ.Changesinmicrobialcommunitystructurefollowingherbicide(glyphosate)additionstoforestsoils[J].AppliedSoilEcology, 2006, 34: 114-124.
[31]InsamH.Anewsetofsubstratesproposedforcommunitycharacterizationinenvironmentalsamples[A].InsamH,RanggerA(eds).Microbialcommunities:Functionalversusstructuralapproaches[M].BerlinHeidelberg:Springer, 1997. 259-260.
[32]KulmatiskiA,BeardKH,StevensJR, et al.Plant-soilfeedbacks:ameta-analyticalreview[J].EcologyLetters, 2008, 11: 980-992.
[33]SudingKN,HarpoleWS,FukamiT, et al.Consequencesofplant-soilfeedbacksininvasion[J].JournalofEcology, 2013, 101: 298-308.
[34]WeidenhamerJD,CallawayRM.Directandindirecteffectsofinvasiveplantsonsoilchemistryandecosystemfunction[J].JournalofChemicalEcology, 2010, 36: 59-69.
[35]vanderPuttenWH,BardgettRD,BeverJD, et al.Plant-soilfeedbacks:thepast,thepresentandfuturechallenges[J].JournalofEcology, 2013, 101: 265-276.
[36]JandováK,KlinerováT,MüllerováJ, et al.Long-termimpactofHeracleum mantegazzianuminvasiononsoilchemicalandbiologicalcharacteristics[J].SoilBiologyandBiochemistry, 2014, 68: 270-278.
[37]NiuHB,LiuWX,WanFH, et al.Aninvasiveaster(Ageratinaadenophora)invadesanddominatesforestunderstoriesinChina:alteredsoilmicrobialcommunitiesfacilitatetheinvaderandinhibitnatives[J].PlantandSoil, 2007, 294: 73-85.
[38]TimsinaB,ShresthaBB,RokayaMB, et al.ImpactofParthenium hysterophorusL.invasiononplantspeciescompositionandsoilpropertiesofgrasslandcommunitiesinNepal[J].Flora, 2011, 206: 233-240.
[39]RoutME,ChrzanowskiTH.TheinvasiveSorghum halepenseharborsendophyticN2-fixingbacteriaandalterssoilbiogeochemistry[J].PlantandSoil, 2009, 315: 163-172.
[40]LiaoCZ,LuoYQ,JiangLF, et al.InvasionofSpartinaalternifloraenhancedecosystemcarbonandnitrogenstocksintheYangtzeEstuary,China[J].Ecosystems, 2007, 10: 1351-1361.
[41]ZhouCF,AnSQ,DengZF, et al.SulfurstoragechangedbyexoticSpartina alternifloraincoastalsaltmarshesofChina[J].EcologicalEngineering, 2009, 35: 536-543.
[42]MarchanteE,KjøllerA,StruweS, et al.InvasiveAcacia longifoliainducechangesinthemicrobialcatabolicdiversityofsanddunes[J].SoilBiologyandBiochemistry, 2008, 40: 2563-2568.
[43]FanL,ChenY,YuanJG, et al.TheeffectofLantana camaraLinn.invasiononsoilchemicalandmicrobiologicalpropertiesandplantbiomassaccumulationinsouthernChina[J].Geoderma, 2010, 154: 370-378.
[44]SaggarS,McIntoshPD,HedleyCB, et al.Changesinsoilmicrobialbiomass,metabolicquotient,andorganicmatterturnoverunderHieracium (H. pilosellaL.) [J].BiologyandFertilityofSoils, 1999, 30: 232-238.
[45]ZhangCB,WangJ,QianBY, et al.EffectsoftheinvaderSolidago canadensisonsoilproperties[J].AppliedSoilEcology, 2009, 43: 163-169.
[46]ChacónN,HeanaH,FloresS, et al.Chemical,physical,andbiochemicalsoilpropertiesandplantrootsasaffectedbynativeandexoticplantsinNeotropicalaridzones[J].BiologyandFertilityofSoils, 2009, 45: 321-328.
[47]KourtevaPS,EhrenfeldaJG,HäggblomM.Experimentalanalysisoftheeffectofexoticandnativeplantspeciesonthestructureandfunctionofsoilmicrobialcommunities[J].SoilBiologyandBiochemistry, 2003, 35: 895-905.
[48]LiWH,ZhangCB,JiangHB, et al.Changesinsoilmicrobialcommunityassociatedwithinvasionoftheexoticweed, Mikania micranthaHBK[J].PlantandSoil, 2006, 281: 309-324.
[49]DudaJJ,FreemanDC,EmlenJM, et al.Differencesinnativesoilecologyassociatedwithinvasionoftheexoticannualchenopod, Halogeton glomeratus[J].BiologyandFertilityofSoils, 2003, 38: 72-77.
[50]SanonA,BéguiristainT,CébronA, et al.Changesinsoildiversityandglobalactivitiesfollowinginvasionsoftheexoticinvasiveplant, Amaranthus viridisL.,decreasethegrowthofnativesahelianAcaciaspecies[J].FEMSMicrobiologyEcology, 2009, 70: 118-131.
[51]QinZ,XieJF,QuanGM, et al.ImpactsoftheinvasiveannualherbAmbrosia artemisiifoliaL.onsoilmicrobialcarbonsourceutilizationandenzymaticactivities[J].EuropeanJournalofSoilBiology, 2014, 60: 58-66.
[52]JacinthePA,BillsJS,TedescoLP.Size,activityandcatabolicdiversityofthesoilmicrobialbiomassinawetlandcomplexinvadedbyreedcanarygrass[J].PlantandSoil, 2010, 329: 227-238.
[53]GomezE,FerrerasL,ToresaniS.Soilbacterialfunctionaldiversityasinfluencedbyorganicamendmentapplication[J].BioresourceTechnology, 2006, 97: 1484-1489.
[54]SiCC,LiuXY,WangCY, et al.Differentdegreesofplantinvasionsignificantlyaffecttherichnessofthesoilfungalcommunity[J].PLoSONE, 2013, 8(12):e85490.
[55]朱慧, 马瑞君, 吴双桃, 等. 杂草五爪金龙对其入侵地土壤酶活性与微生物群落的影响[J]. 韩山师范学院学报, 2012, 33(3): 34-39.
ZhuH,MaRJ,WuST, et al.ImpactsofinvasiveweedIpomoea cairicaonthesoilenzymeactivitiyandmicrobialcommunity[J].JournalofHanshanNormalUniversity, 2012, 33(3): 34-39.
[56]HawkesCV,WrenIF,HermanDJ, et al.Plantinvasionaltersnitrogencyclingbymodifyingthesoilnitrifyingcommunity[J].EcologyLetters, 2005, 8: 976-985.
[57]柏艳芳, 郭绍霞, 李敏. 入侵植物与丛枝菌根真菌的相互作用[J]. 应用生态学报, 2011, 22(9): 2457-2463.
BaiYF,GuoSX,LiM.Interactionsbetweeninvasiveplantsandarbuscularmycorrhizalfungi:Areview[J].ChineseJournalofAppliedEcology, 2011, 22(9): 2457-2463.
ImpactsofIpomoeacairicaandWedeliatrilobatainvasiononsoilchemicalandmicrobiologicalcharacteristics
QUANGuo-ming1,2,MAODan-juan2,ZHANGJia-en2*,XIEJun-fang2,QINZhong2
(1 Department of Urban Construction Engineering, Guangzhou City Polytechnic, Guangzhou 510405, China;2 Institute of Tropical and Subtropical Ecology, South China Agricultural University/Key Laboratory of Agro-Environment in the Tropics, Ministry of Agriculture/Key Laboratory of Agroecology and Rural Environment of Guangdong Regular Higher Education Institutions, Guangzhou 510642, China)
【Objectives】Ipomoea cairicaandWedelia trilobata,thetwogeneralexoticplants,haveinvadedsuccessfullyinsouthernChinaandcausedlotsofseriousdamagestonativeecosystem.Inordertoexploreimpactsofthetwoweedsinvasiononsoilecosystemandprovidescientificbasisfortheirinvasionmechanisminfields,thechangesofsoilchemicalandmicrobiologicalproperties,includingsoilnutrient,soilmicrobialbiomass,soilenzymeandmetabolicactivity,carbonsubstrateutilizationandfunctiondiversityofsoilmicrobialcommunityinI. cairicainvadedcommunity, W. trilobatainvadedcommunityandNeyraudia reynaudiananativecommunitywereinvestigatedbyusingfieldplotmethods. 【Methods】Threesamplingsiteswereselected,includingI. cairicainvadedsite, W. trilobatainvadedsiteandN. reynaudiananativesiteintheHuolushanForestParkofGuangzhoucityinJanuary2010.Therewerefourreplicatespersamplingsite(eachreplicateplotwas4m2).Soilsampleswerecollected,andsoilnutrient,soilenzymeactivity,soilmicrobialbiomassandfunctiondiversityofsoilmicrobialcommunityweredetermined. 【Results】 1)Comparedwiththenativeplantplot,thecontentsofsoilorganiccarbon,totalnitrogen,totalphosphorus,availablenitrogen,availablephosphorusandavailablepotassiumintheI. cairicaplot(increasedrangeis60.38%-230.01%)andthecontentsofsoilorganiccarbon,totalnitrogen,availablenitrogenandavailablephosphorusintheW. trilobataplot(increasedrangeis50.54%-145.52%)aresignificantlyincreased,whilethesoilC/Nratiosaresignificantlydecreased,andtherearenosignificantdifferencesinthecontentsoftotalpotassiumamongthethreeplots. 2)Thetwoexoticplantscouldsignificantlyincreasesoilmicrobialbiomassoftheinvadedplots.Thecontentsofsoilmicrobialbiomasscarbon,nitrogenandphosphorusoftheI. cairicaplotandtheW. trilobataplotare105.00%-152.15%and61.51%-138.27%higherthanthoseinthenativeplantplotrespectively,whiletherearenosignificantdifferencesinthecontentsofsoilmicrobialbiomassbetweenthetwoinvadedplots.Theratioofsoilmicrobialbiomasscarbontosoilorganiccarbon(Cmic/Corg)intheW. trilobataplotissignificantlyhigherthanthatinthenativeplantplot,buttheratiosofsoilmicrobialbiomassnitrogentototalsoilnitrogen(Nmic/Nt)andsoilmicrobialbiomassphosphorustototalsoilphosphorus(Pmic/Pt)amongthethreeplotsareinthesamelevels. 3)Thetwoexoticplantsinvasioncouldsignificantlyincreasetheactivitiesofsoilurase,protease,invertaseandcelluloseenzymes.Theactivitiesofsoilurase,proteaseandcelluloseenzymesoftheW. trilobataplotarethehighestinallthesamplingplots,andare70.35%, 21.51%and227.86%higherthanthoseofthenativeplantplotrespectively.TheactivitiesofsoilinvertaseoftheI. cairicaplotandtheW. trilobataplotare322.58%and157.14%higherthanthatofthenativeplantplotrespectively,whiletheactivitiesofhydrogenperoxidasearealmostthesameamongthethreeplotsandnosignificantdifferencesarefound. 4)Thetwoexoticplantscouldsignificantlyincreasethemetabolicactivitiesofsoilmicrobialcommunityoftheinvadedplots.Theaveragewellcolordevelopment(AWCD)ofalltreatmentsexhibitsanorderofI. cairicaplot> W. trilobataplot>nativeplantplotduringthewholeincubatingperiod.TheAWCDvaluesofthreesamplingplotsincubatedat72hoursare1.18, 0.88and0.56respectively,andthedifferencesaresignificant.Comparedtothenativeplantplot, I. cairicainvasioncouldsignificantlyimprovesixcarbonsubstrateutilizationofsoilmicrobialcommunity,withtheincreasedrangesreachupto75.00%-162.86%. W. trilobatainvasionalsosignificantlyincreasestheutilizationsofcarbohydrates,carboxylicacidsandpolymers,withtheincreasedratesof87.72%, 41.18%and83.72%respectively.Therearesomedifferencesintheutilizationsofdifferentcarbonsubstratesbetweenthetwoinvasiveplants,andthecarboxylicacidsandamines/amidesutilizationsofsoilfromtheI. cairicaplotaresignificantlygreaterthanthoseintheW. trilobataplot.Theprincipalcomponentsanalysis(PCI)revealsthat71.89%ofthevariationofcarbonsubstrateutilizationdataofsoilmicrobialcommunityindifferentinvasionplotscouldbeexplainedbythefirstandsecondcomponents(PC1andPC2).Carbohydrates,aminoacidsandpolymersarehighlycorrelatedwithPC1,whilePC2ismainlyaffectedbycarbohydratesandcarboxylicacids.Thetwoexoticplantscouldsignificantlyinfluencethefunctiondiversityofsoilmicrobialcommunity.TheindexesofShannon-Wiener(H′),McIntosh(U),substraterichness(S)andSimpson′sdominance(Ds)ofsoilmicrobialcommunityinthetwoinvadedplotsaresignificantlyhigherthanthoseinthenativeplantplot,butthedifferencesbetweenthetwoinvadedplotsarenotsignificant.ThePielouindexes(E)alsohavenotsignificantdifferencesamongallthethreetreatments. 【Conclusions】Thetwoexoticplants, I. cairicaandW. trilobata,canamelioratesoilnutritionenvironmentintheinvadedareas,enhancesupplylevelofsoilnutrients,andhencecreateafavorablemicrohabitatwhichcanbenefittheirgrowthandcompetitivenessandfacilitatetheirinvasioninfields.
Ipomoea cairica; Wedelia trilobata;soilchemistry;soilmicrobialcommunity
2014-09-12接受日期: 2015-05-12网络出版日期: 2015-07-17
国家自然科学基金(U1131006); 国家星火计划项目(2013GA780108); 教育部博士点基金项目(200805640012,20124404110009); 广东省高等学校高层次人才项目[粤财教(2013)246号]; 广州市属高校科研计划项目(2012A136); 广州市青少年科技教育项目(14B024-05)资助。
全国明(1975—), 男, 广东廉江人, 博士, 副教授,主要从事农业生态学、入侵生态学方面的研究。E-mail:gzbyqgm@126.com
E-mail:jeanzh@scau.edu.cn
Q143;Q16;Q948
A
1008-505X(2016)02-0437-13
