探针药物法评价黄草乌酒对大鼠肝脏CYP1A2、CYP3A1和CYP2E1的影响
2016-08-23任国印王晶晶张瑞林聂胜洁李继印李树华
任国印,王晶晶,张瑞林,聂胜洁,李继印,李树华
探针药物法评价黄草乌酒对大鼠肝脏CYP1A2、CYP3A1和CYP2E1的影响
任国印1,王晶晶2,张瑞林1,聂胜洁1,李继印1,李树华1
目的 探讨黄草乌酒对大鼠CYP450亚型(CYP1A2、CYP3A1、CYP2E1)的代谢活性的影响。方法 采用Cocktail探针法(咖啡因、咪达唑仑和氯唑沙宗),利用超高效液相色谱—串联质谱(UPLC-MS/MS)测定黄草乌酒对大鼠CYP450亚型活性影响。将大鼠随机分为5组,分别为空白对照组、白酒组、单草乌组、低草乌酒组和高草乌酒组,各组动物连续灌胃给药14 d,于第15 d腹腔注射Cocktail探针药液,并于腹腔注射探针药液前后不同时间点断尾采血。使用UPLC-MS/MS测定各探针药物的血药浓度,评价CYP450亚型的代谢活性。结果 氯唑沙宗的半衰期(T1/2)均低于空白对照组(P<0.05),表明酒精、黄草乌和黄草乌酒对CYP2E1均有明显的诱导作用。与空白对照组相比,酒精对CYP1A2和CYP3A1的诱导不明显。与白酒组相比,黄草乌酒对CYP3A1和CYP2E1的诱导以及对CYP1A2的抑制作用均无显著性差异。结论 黄草乌与酒精合用后可诱导CYP2E1的活性,发生药物间相互作用,增加黄草乌对大鼠的肝毒性。
黄草乌;酒精;Cocktail探针药物;CYP450;UPLC-MS/MS
黄草乌为毛茛科乌头属植物,主要分布在滇中及滇西部地区[1]。黄草乌的主要活性成分为滇乌碱、粗茎乌头碱甲、丽乌碱等[2],其中的主要毒性或活性成分多为双酯型二萜生物碱。黄草乌的块根味麻,具有镇痛、抗风湿、抗癫痫、抗肿瘤、提高免疫力等多种药理作用[3]。云南草乌植物资源丰富,常被制成泡酒治疗风湿性关节炎及其他疑难杂症,但由于缺乏黄草乌酒的中毒机制及体内代谢的研究资料,用药不当引起的中毒案(事)件日益增多。
CYP450是存在于人体肝细胞内质网的一类同工酶,广泛参与内源性和外源性化合物的代谢,介导药物间的相互作用[4-5]。CYP1A2占人体肝脏P450的13%,大多数化学物质和毒物均由其代谢[6],咖啡因可以作为CYP1A2的底物和抑制剂。而CYP3A4在人体肝脏和小肠表达较高,占肝脏P450的30%,大鼠与人体CYP3A4对应的是CYP3A1,参与50%以上的临床药物的代谢[7],咪达唑仑为CYP3A1/2的底物和抑制剂。CYP2E1虽然占肝脏P450的7%,却是许多小分子有机化合物及药物的代谢酶[8],如乙醇、对乙酰氨基酚等,氯唑沙宗为CYP2E1的特异性底物。因此,研究黄草乌酒对CYP450的影响,对研究黄草乌酒中毒机制,指导临床用药和法医学鉴定均具有实际意义。本研究采用Cocktail探针药物法评价黄草乌酒对大鼠肝脏CYP1A2、CYP3A1、CYP2E1活性的影响。
1 材料与方法
1.1 药品与试剂 黄草乌,产自云南楚雄州南华县,取样时间为2014年10月23日,鉴定人为云南中医学院杨跃文副教授,标本存放于昆明医科大学法医学院毒物化学系。咖啡因 (caffeine,CAF)、咪达唑仑 (midazolam,MDZ)、氯唑沙宗 (chlorzoxazone,CLZ) 标准品(中国药品食品检定研究院,纯度均≥98.9%)。52°红星二锅头(北京红星股份有限公司),甲醇和乙腈(色谱纯,美国SIGMA公司),甲酸等试剂均为分析纯,屈臣氏去离子水。
1.2 仪器 Agilent1290型超高效液相色谱仪(美国Agilent公司)和ABI SCIEX 4000Q TRAP 串联质谱仪(美国AB SCIEX公司)。
1.3 实验动物 雄性SD大鼠30只,体质量(280±10) g,购自湖南斯莱克景达实验动物有限公司。每笼5只群养,自由摄食饮水,室温20~24 ℃,湿度40%~60%。动物在新饲养环境适应1周后进行实验。
1.4 药物制备
1.4.1 黄草乌乙醇浸泡液的制备 取黄草乌块根20 g,粉碎后用无水乙醇浸泡17 d,得到72 mL浸泡液,经UPLC-MS/MS法测定,滇乌碱、粗茎乌头碱甲、塔拉萨敏的含量分别为0.575 mg·g-1、0.730 mg·g-1、1.405 mg·g-1。浸泡液经气相色谱/质谱联用法分析,未检出敌敌畏、敌百虫、乐果和甲胺磷等农药残留(当地常用农药),经扫描电镜/能谱仪分析,砷、铅、汞的含量均低于1 μg·g-1。
1.4.2 灌胃液的制备 空白对照组灌胃液:珍茗纯净水;白酒组灌胃液:52°红星二锅头;单草乌组灌胃液:取1.4.1中草乌酒2.0 mL,氮气吹干,用少量稀盐酸溶解,氢氧化钠调PH 7后,纯净水溶解定容至6.0 mL;低草乌酒组灌胃液:取1.4.1中草乌酒1.0 mL,氮气吹干后,用6.0 mL红星二锅头溶解;高草乌酒组灌胃液:取1.4.1中草乌酒3.0 mL,氮气吹干后,用6.0 mL红星二锅头溶解。
1.4.3 Cocktail 探针药物的制备 准确称取探针药物咖啡因、咪达唑仑各200 mg,氯唑沙宗400 mg于100 mL容量瓶中,用无水乙醇定容至100 mL,混匀后得到3种混合探针药物(咖啡因2 mg·mL-1,咪达唑仑2 mg·mL-1,氯唑沙宗4 mg·mL-1)置4 ℃冰箱保存、备用。按大鼠体质量(咖啡因10 mg·kg-1,咪达唑仑10 mg·kg-1,氯唑沙宗20 mg·kg-1)量取适量的探针药液,自然挥干后,以0.1 mL吐温-20拌匀,再以3 mL灭菌生理盐水充分溶解后,腹腔注射至大鼠体内。
1.5 动物实验 将健康雄性SD大鼠30只,随机分为5组,每组6只。分别为空白对照组、白酒组、单草乌组、低草乌酒组和高草乌酒组,每组动物按照1.4.2对应给灌胃液0.6 mL,共14 d;第15天,按照1.4.3腹腔注射混合探针药物,分别在给药前(0 min)和给药后5 min、15 min、30 min、1 h、1.5 h、2 h、3 h、4 h、5 h、6 h、8 h、12 h、24 h、48 h、72 h断尾取血,肝素抗凝。
1.6 样品处理 取5~20 μL大鼠全血于EP管中,加入适量甲醇沉淀蛋白(振荡3 min,15 000 r·min-1离心3 min)后进样分析。
1.7 检测条件 液相条件:ACQUITY UPLC®BEH C18色谱柱(2.1 mm×50 mm×1.7 μm);流动相:A为乙腈,B为0.1%甲酸水溶液。洗脱梯度:0~0.8 min,流动相A为1%;0.8~2.5 min,流动相A由1%升到99%;2.5~3.5 min,流动相A为99%;3.5~3.6 min,流动相A由99%降到1%;3.6~6 min,流动相A为到1%。进样体积:5 μL,流速:0.3 mL·min-1,保留时间7 min,柱温40 ℃。质谱条件:电喷雾离子源分别采用正离子(electrosprary positive ionization,ESI+)和负离子扫描(electrosprary negative ionization,ESI-),多反应监测模式(multiple reaction monitoring,MRM),三重四极杆检测器。3种CYP450探针药物定量离子对的质谱参数详见表1。

表1 3种CYP450探针药物的质谱参数
注:DP/V:锥孔电压;EP/V:入口电压;CE/V:碰撞电压;CXP/V:碰撞室出口电压。

2 结果
2.1 检测方法验证 UPLC-MS/MS检测不同时间点大鼠全血中3种探针药物的浓度,采用与标准品保留时间和两对离子对比较进行探针药物的定性分析,外标标准曲线法进行探针药物的定量分析。咖啡因的线性范围为5~100 ng·mL-1(检出限为0.3 ng·mL-1,定量限为1.0 ng·mL-1);咪达唑仑的线性范围为1~100 ng·mL-1(检出限为0.01 ng·mL-1,定量限为0.05 ng·mL-1);氯唑沙宗的线性范围为1~100 ng·mL-1(检出限为0.05 ng·mL-1,定量限为0.1 ng·mL-1)。3种探针药物的日内、日间精密度(n=6)均小于10%,准确度均在98%~101%之间。
2.2 5组大鼠的药代动力学实验结果 用DAS 2.0计算药代动力学参数,见表2。结果显示:与空白对照组比较,白酒组咖啡因和咪达唑仑的T1/2缩短不明显,氯唑沙宗的T1/2明显缩短(P<0.05),表明白酒对CYP1A2和CYP3A1无明显诱导作用,但对CYP2E1的活性有明显诱导作用。单草乌组、低草乌酒组和高草乌酒组中咖啡因的T1/2延长差异无统计学意义(P>0.05),表明黄草乌及黄草乌酒对CYP1A2的活性抑制不明显。单草乌组、低草乌酒组和高草乌酒组中咪达唑仑的T1/2均缩短,但仅低草乌酒组咪达唑仑的T1/2差异有统计学意义(P<0.05),表明黄草乌及黄草乌酒对CYP3A1的活性无明显诱导作用。单草乌组、低草乌酒组和高草乌酒组中氯唑沙宗的T1/2较空白对照组明显缩短50%(P<0.05),表明黄草乌和黄草乌酒对CYP2E1的活性均有诱导作用。此外,高草乌酒组咪达唑仑的药峰浓度降低,药峰时间延长,药—时曲线下面积降低(P<0.05)。
与白酒组比较,单草乌组、低草乌酒组和高草乌酒组中咖啡因的T1/2延长不明显;单草乌组、低草乌酒组和高草乌酒组中咪达唑仑的T1/2缩短,但仅低草乌酒组有统计学差异(P<0.05),表明黄草乌酒对CYP3A1的诱导作用主要由乙醇引起。单草乌组、低草乌酒组和高草乌酒组中氯唑沙宗的T1/2缩短无显著性差异。综合分析发现,黄草乌与白酒合用后对CYP2E1和CYP3A1的诱导,以及对CYP1A2的抑制效应均强于白酒。
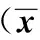
表2 各组探针药物的主要药代动力学参数±s,n=6)
(续表)

探针药物组别Cmax/μg·mL-1Tmax/h-1T1/2/hAUC(0~24)/μg·h·mL-1AUMC(0~24)/μg·h·mL-1MRTPO/h咪达唑仑A0.52±0.100.33±0.132.97±1.550.91±0.201.28±0.251.41±0.07B0.67±0.240.50±0.00①1.84±0.031.21±0.19①2.45±0.671.93±0.35C0.61±0.390.25±0.001.64±0.091.53±0.962.09±1.411.37±1.60D0.60±0.020.46±0.00①1.42±0.26②0.93±0.07②1.33±0.131.44±0.17E0.24±0.09①②1.00±0.291.85±0.390.63±0.15①②1.06±0.16②1.72±0.14氯唑沙宗A10.57±1.590.25±0.004.37±1.9411.02±1.9611.54±4.891.05±0.45B12.58±2.850.50±0.00①2.50±0.78①17.52±5.87①21.95±8.50①1.23±0.11C17.47±1.78①0.25±0.002.14±0.35①13.85±1.60①11.15±1.410.81±0.01D11.10±1.420.25±0.00②1.78±0.56①12.71±0.7712.51±2.34②0.99±0.21E12.14±1.320.46±0.10①2.14±0.65①14.62±2.52①14.91±3.631.01±0.09
注:①与空白组比较:P<0.05 ;②与白酒组比较:P<0.05。A:空白对照组;B:白酒组;C:单草乌组;D:低草乌酒组;E:高草乌酒组。Cmax:药峰浓度;Tmax:药峰时间;T1/2:半衰期;AUC:药-时曲线下面积;AUMC:一阶距药—时曲线下面积;MRTPO:平均驻留时间。
3 讨论
人体肝脏CYP450酶参与大部分药物代谢,同时由于CYP450的诱导或抑制可引起药物间的相互作用增强或减弱。CYP1A2、CYP3A4(大鼠为CYP3A1)和CYP2E1是人体内最重要的3种CYP450酶亚型,为大多数药物毒物的代谢酶,并且对药物的消除影响较大,与药物相互作用的关联性较强[8]。黄草乌作为云南常用的药食两用植物,常被泡制成药酒治疗风湿性关节炎及其他疑难杂症,但黄草乌中的成分复杂,这些成分是否会与酒精发生相互作用,增强黄草乌的毒性,导致人体中毒或死亡,有待研究证实。
乙醇的代谢途径主要有乙醇脱氢酶(alcohol dehydrogenase,ADH)的乙醇氧化途径和微粒体乙醇氧化体系。低浓度乙醇的代谢主要和ADH乙醇氧化途径有关,长期饮酒导致高浓度乙醇的代谢则与微粒体乙醇氧化体系中的CYP2El相关,乙醇可诱导CYP2El的活性[9-10]。康晓琳等[11]的研究表明,酒精可增强大鼠肝脏CYP2El和CYP3A的活性,引起脂质过氧化,导致肝损伤。本研究中白酒和黄草乌酒均能诱导CYP2E1的活性,对CYP3A1也呈现诱导趋势[12-13],且黄草乌酒的诱导趋势强于白酒,更容易引起大鼠肝损伤。
本研究中白酒对大鼠肝脏CYP1A2的活性无明显诱导,而黄草乌酒有抑制CYP1A2的趋势。因此,黄草乌与白酒合用后,可能抑制CYP1A2的活性,引起黄草乌中毒性成分的代谢减慢而造成毒性成分蓄积,或者经CYP1A2代谢产生的活性物质毒性较强,从而引起黄草乌中毒[14]。对于黄草乌中的主要成分滇乌碱、粗茎乌头碱甲、丽乌碱等的体内代谢过程、相代谢产物的毒性以及白酒和黄草乌合用后发生相互作用的机制还有待于进一步研究。
此外,本研究采用腹腔注射混合探针药液,由于肝脏和小肠均存在CYP3A1,因此,腹腔注射探针药物可能是引起咪达唑仑药峰浓度降低,药峰时间延长,药—时曲线下面积降低,导致黄草乌酒对CYP3A1诱导作用不显著的原因。同时,动物模型的给药量也可能是造成黄草乌酒对CYP3A1诱导和对CYP1A2抑制不明显的另一个原因。虽然大鼠与人体存在种属差异、个体差异和动物实验模型的差异,但本研究结果提示,黄草乌与白酒合用后对CYP2E1和CYP3A1的诱导,以及对CYP1A2的抑制趋势均强于白酒,黄草乌与白酒合用后会发生药物间的相互作用,造成大鼠肝损伤,本研究结果对黄草乌中毒的研究和法医学鉴定具有实践意义。
[1] 中国科学院昆明植物研究所.云南植物志(第十一卷)[M].昆明:云南出版社,2006:51.
[2] 袁梅,马晓霞,杨树德,等.滇西乌头化学成分研究[J].中药材,2013,36(6):938-940.
[3] 于占江,赵国君,贾鹏钰.草乌的应用研究及前景展望[J].包头医学院学报,2012,28(3):122-123.
[4] Mora F,Molina JD,Zubillaga E,et al.CYP450 and its implications in the clinical use of antipsychotic drugs[J].Clin Exp Pharmacol,2015,5(3):176-186.
[5] Kato M,Chiba K,Ito T,et al.Prediction of interindividual variability in pharmacokinetics for CYP3A4 substrates in humans[J].Drug Metab Pharmacokinet,2010,25(4):367-378.
[6] Ryu SD,Chung WG.Induction of the procarcinogen-activating CYP1A2 by a herbal dietary supplement in rats and humans[J].Food Chem Toxicol,2003,41(6):861-866.
[7] Hisaka A,Ohno Y,Yamamoto T,et al.Prediction of pharmacokinetic drug-drug interaction caused by changes in cytochrome P450 activity using in vivo information[J].Pharmacol Ther,2010,125(2):230-248.
[8] Zanger UM,Schwab M.Cytochrome P450 enzymes in drug metabolism:regulation of gene expression,enzyme activities, and impact of genetic variation[J].Pharmacol Ther,2013,138:103-141.
[9] Cederbaum AI,Wu D,Mari M,et a1.CYP2EI-dependent toxicity and oxidative stress in HepG2 cells[J].Free Radic Biol Med,2001,31(1):1539-1543.
[10]李俊杰.乙醇对肝细胞色素P-450氧化酶2E1的诱导[J].中国病理生理杂志,2003,19(2):193,202.
[11]康晓琳,薛永志,武润生,等.酒精性肝损伤大鼠细胞色素P450 CYP2E1和细胞色素P450 CYP3A的代谢活性[J].中国药理与毒理学杂志,2010,24(4):286-290.
[12]Su T,Mao CQ,Yin FZ,et al.Effects of unprocessed versus vinegar-processed Schisandra chinensis on the activity and mRNA expression of CYP1A2,CYP2E1 and CYP3A4 enzymes in rats[J].J Ethnopharmacol,2013,146(3):734-743.
[13]Wang BL,Yang S,Hu JP,et al.Multifaceted interaction of the traditional Chinese medicinal herb Schisandra chinensis with cytochrome P450-mediated drug metabolism in rats[J].J Ethnopharmacol,2014,155(3):1473-1482.
[14]夏伟.细胞色素P450的研究进展[J].国外医学:卫生学分册,2000,27(1):41-45.
Effect of Aconitum Vilmorimianum Kom Liquor on Rat Liver CYP1A2,CYP3A1 and CYP2E1 by Cocktail Probe Drugs Method
Ren Guo-yin1, Wang Jing-jing2, Zhang Rui-lin1, Nie Sheng-jie1, Li Ji-yin1, Li Shu-hua1
(1. School of Forensic Medicine,Kunming Medical University, Kunmig 650500,China;2. First Affiliated Hospital, Kunming Medical University, Kuning 650031, China)
ObjectiveThe impact of aconitum vilmorimianum kom liquor on rat liver CYP450 isoforms (CYP1A2,CYP3A1 and CYP2E1) were investigted by cocktail probe drugs method.MethodsThe activity of CYP450 isoforms in rats were detected by cocktail probe drugs (caffeine,midazolam and chlorzoxazone) method with UPLC-MS/MS. The rats were randomly divided into five groups: control group, white spirit group, separate aconitum vilmorimianum kom group, low-dose aconitum vilmorimianum kom liquor group and high-dose aconitum vilmorimianum kom liquor group, which were intragastrically administrated corresponding liqiud once a day for 14 days respectively. At 15th day, all rats were injected intraperitoneally with a cocktail solution, then blood samples were taken at different time points by cutting rat′s tail. The blood concentrations of probe drugs were detected by UPLC-MS/MS to evaluate the activity of CYP450 isoforms.ResultsCompared with the control group, the half-life (T1/2) of chlorzoxazone significantly decreased in other groups(P<0.05), therefore the results indicated that alcohol, aconitum vilmorimianum kom and aconitum vilmorimianum kom liquor could induce the activity of CYP2E1 obviously. However, the inductions of alcohol were not obvous on CYP1A2 and CYP3A1. Compared with the white spirit group, the inductions of aconitum vilmorimianum kom liquor on CYP3A1 and CYP2E1 were no significant, as well as the inhibition on CYP2E1.ConclusionAconitum vilmorimianum kom liquor could induce the activity of CYP2E1 ,which could cause drugs-drugs interaction and increase the hepatotoxicity of rat.
aconitum vilmorimianum kom;alcohol;cocktail probe drugs;CYP450;UPLC-MS/MS
1672-688X(2016)04-0289-05
10.15926/j.cnki.issn1672-688x.2016.04.016
云南省应用基础研究基金资助项目(2013FB118)云南省教育厅科学研究基金(2014Y161)
2016-09-24
1.昆明医科大学法医学院,云南昆明 650500 2.昆明医科大学第一附属医院,云南昆明 650031
任国印(1986-),男,河南鹿邑人,从事法医学研究工作。
李树华,女,高级实验师,Email:2530428326@qq.com
R285.5
A
