Smo和Gli1蛋白在子宫内膜癌中的表达及其临床意义
2016-08-23蔡阳阳袁红瑛
蔡阳阳,何 涛,张 新,袁红瑛
Smo和Gli1蛋白在子宫内膜癌中的表达及其临床意义
蔡阳阳1,何 涛1,张 新1,袁红瑛2
目的 探讨Smo和Gli1蛋白在子宫内膜癌组织中的表达及其临床意义。方法 收集河南科技大学第一附属医院 2007年至2009年刮宫或手术切除经病理科确诊的组织标本,分为正常增殖期子宫内膜组20例、不典型增生组21例与子宫内膜腺癌组58例。采用免疫组化法检测Smo和Gli1蛋白的表达,分析其与子宫内膜腺癌临床病理特征的关系,以及两因子在子宫内膜腺癌表达中的相关性。并对子宫内膜腺癌患者的进行随访和Kaplan-meier生存分析。结果 Smo蛋白在正常子宫内膜、不典型增生及子宫内膜癌中的阳性率分别为5.00%、33.33%和58.62%,3组比较差异有统计学意义(P<0.05);同时,Gli1蛋白的阳性率分别是0.00%、28.57%、60.34%,3组比较差异有统计学意义(P<0.05);Smo和Gli1的表达均与子宫内膜腺癌的组织学分级、临床分期、肌层侵润、淋巴结转移有关(P<0.05),而与年龄无关(P>0.05);两因子在子宫内膜腺癌表达中有正相关性(rs=0.679,P<0.05)。Smo和Gli1表达阳性病例总体生存率均低于阴性病例(均P<0.05)。结论 Smo及Gli1蛋白可能在子宫内膜腺癌的发生、发展中起重要作用,联合检测Smo和Gli1蛋白可为诊治子宫内膜腺癌及预后提供依据。
Smo;Gli1;子宫内膜癌;免疫组织化学;生存分析
子宫内膜癌(endometrial carcinoma, EAC)是女性生殖道恶性肿瘤之一,其在发达国家已经排在女性生殖道恶性肿瘤的首位[1]。其发病高峰年龄在50~70岁,多发生在绝经后女性,但近年来年轻女性子宫内膜腺癌的发病比例逐年增高[1]。子宫内膜癌的筛查方法有限,对绝经后出现异常子宫出血的女性,需要在进一步诊断性刮宫后送病理检验,若有可疑肿瘤浸润和转移的,还需行CT和MRI确定肿瘤浸润的深度和范围,以确定手术方式和手术范围,术后可以根据情况联合放疗和化疗。
参与肿瘤发生发展的信号通路主要包括G蛋白耦联受体通路、酪氨酸激酶受体通路、Wnt通路、TGF通路、Hh通路、TNF通路等[2]。近年来对Hh信号通路的研究成了热点。Hh通路参与肿瘤的发生、发展[3-4],如胰腺癌[5]、基底细胞癌、前列腺癌[6]、食管癌[7]、结肠癌[8]、胃癌[9]、乳腺癌[10]等。本实验探讨Hh信号通路中Smo蛋白和Gli1蛋白在子宫内膜癌发生、发展及预后中的作用,现报道如下。
1 材料与方法
1.1 收集材料 收集我院 2007年至2009年刮宫或手术切除经病理科确诊子宫组织标本,入组者均无术前放化疗病史。按标本组织类型分成3组:正常子宫内膜组21例、子宫内膜的不典型增生组21例和子宫内膜腺癌组58例。应用免疫组化SP法(streptavidin peroxidase conjugated method, SP)对3组不同类型的子宫内膜进行Smo和Gli1蛋白检测。子宫内膜腺癌组高分化21例,中分化13例,低分化24例,按 FIGO 2009年临床分期:Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期26例;其中发生淋巴结转移9例。上述标本经过10%福尔马林液固定,常规脱水,石蜡包埋,连续切片4 μm厚为标准。
1.2 主要试剂 兔抗人多克隆抗体Smo(bs-2801R)、兔抗人多克隆抗体Gli1(bs-11564R)及SP法免疫组化试剂盒均购自北京博奥森生物技术有限公司,DAB显色试剂盒购自福建迈新公司。Smo工作浓度1∶150,Gli1工作浓度1∶150。
1.3 实验步骤 采用免疫组化SP法,实验步骤按照试剂盒说明书进行操作,用柠檬酸缓冲液进行抗原修复,DAB显色,苏木素复染。
1.4 结果判定 Smo蛋白和Gli1蛋白阳性染色部位均位于胞质。细胞质内出现棕黄色颗粒、黄色的颗粒或者棕褐色颗粒为阳性。高倍镜下(400倍)分析,按半定量进行,以阳性细胞染色的强度及数量来综合评判。评分标准如下:A染色的强度:未染色的记0分,淡黄色1分,棕黄色2分,棕褐色3分;B计数的标准:随机的选取至少10个高倍视野(400倍),每个高倍视野中计数完整的肿瘤细胞100个,判断标准:依据着色细胞的百分数进行计分,分别为0~4分,其中<5%为 0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。以AB两项的乘积作为综合评分结果,结果评判:阳性表达≥4分,阴性表达<4分。
1.5 统计学方法 统计学分析采用SPSS 16.0软件进行数据分析,免疫组化半定量结果转为计数资料,比较采用χ2检验,两组变量之间的关系采用Spearman相关分析,随访资料采用Kaplan-Meier生存分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Smo在子宫内膜组织的表达 Smo蛋白阳性染色部位均位于胞质,细胞质内出现棕黄色颗粒、黄色的颗粒或者棕褐色颗粒为阳性,见图1。 Smo在子宫内膜癌阳性表达率58.62%(34/58),子宫内膜不典型增生为33.33%(7/21),正常子宫内膜为5.00%, 3组比较,差异有统计学意义(χ2=18.407,P<0.05),见表1。

表1 3组Smo阳性表达比较

A.增殖期 B.不典型增生 C.高分化癌 D.中分化癌 E.低分化癌图1 Smo在各组织的表达(SP,×200)
2.2 Gli1在子宫内膜组织的表达 Gli1蛋白阳性染色部位均位于胞质,细胞质内出现棕黄色颗粒、黄色的颗粒或者棕褐色颗粒为阳性,见图2。 Gli1在子宫内膜癌中阳性表达率为60.34%(35/58),在不典型增生组织中为28.57%(6/21)。3组比较差异有统计学意义(χ2=24.132,P<0.05),见表2。两两比较:子宫内膜癌组与不典型增生组比较,差异有统计学意义(χ2=6.235,P=0.013);子宫内膜癌组与正常内膜组比较,差异有统计学意义(χ2=21.893,P<0.05);不典型增生组与正常内膜组比较,经Fisher’s Exact Test 得P=0.021,差异具有统计学意义。
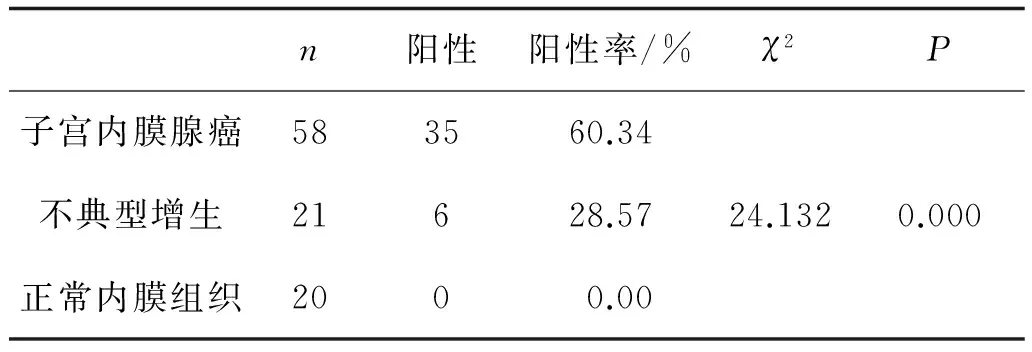
表2 3组Gli1阳性表达比较

A.增殖期 B.不典型增生 C.高分化癌 D.中分化癌 E.低分化癌图2 Gli1在各组织的表达(SP,×200)
2.3 Smo和Gli1与EAC临床生物学特征 Smo蛋白在高、中、低分化癌中的阳性表达率依次为38.09%、53.84%、79.16%,三者比较差异有统计学意义(χ2=7.946,P=0.019),见表3。根据FIGO(2009)临床分期,Ⅰ~Ⅱ期子宫内膜癌与Ⅲ~Ⅳ期比较,差异有统计学意义(χ2=6.108,P=0.013);子宫内膜癌肌层浸润≥1/2与肌层浸润<1/2比较,差异有统计学意义(χ2=5.525,P=0.019);入选的58例子宫内膜癌手术标本中有30例在手术中行淋巴结清扫,有淋巴结转移组与无淋巴结转移组比较,差异有统计学意义(P=0.02);而两个年龄组比较,差异无统计学意义(χ2=0.079,P=0.778)。Gli1蛋白在高、中、低分化癌中的阳性表达率依次为38.1%、53.8%、83.3%,3组比较。差异有统计学意义(χ2=9.874,P=0.007),见表3。Ⅰ~Ⅱ期子宫内膜癌与Ⅲ~Ⅳ期比较,差异有统计学意义(χ2=6.508,P=0.011);子宫内膜癌肌层浸润≥1/2与肌层浸润<1/2比较,差异有统计学意义(χ2=7.385,P=0.001);有淋巴结转移组与无淋巴结转移组比较,差异有统计学意义(P=0.002);两组年龄之间比较,差异无统计学意义(χ2=0.191,P=0.662)。

表3 Smo和Gli1蛋白的表达与子宫内膜腺癌的临床生物学特性的关系
(续表)

生物学特征nSmoGli1阳性阳性率/%χ2P阳性阳性率/%χ2P临床分期 Ⅰ~Ⅱ321340.63 Ⅲ~Ⅳ261973.086.1080.0131443.752076.926.5080.011肌层浸润 <1/219736.84 ≥1/2392769.235.5250.019631.582769.237.3850.007淋巴结转移 无21628.57 有9777.800.02523.81888.890.002年龄 <5015960.00 ≥50432455.810.0790.778640.002046.510.1910.662
2.4 Smo蛋白和Gli1蛋白子宫内膜腺癌中表达的相关性 在58例子宫内膜癌组织标本中,Smo蛋白和Gli1蛋白在子宫内膜癌组织中共同阳性表达30例,共同阴性表达19例,经SPSS 16.0统计软件采用Spearman等级相关分析,差异具有统计学意义(χ2=26.710,P<0.01),相关系数rs=0.679,两者呈正相关,见表4。

表4 Smo和Gli1在子宫内膜腺癌表达中的相关性 例
注:相关系数rs=0.679。
2.5 统计生存分析 对58例子宫内膜腺癌患者从手术日期开始至2015年9月随访结果,失访13例,随访率是77.6%,经Log-rank检验,Smo表达阳性病例总体生存率低于阴性病例,差异具有统计学意义(χ2=6.960,P=0.008),见图3;Gli1表达阳性病例总体生存率低于阴性病例,差异具有统计学意义(χ2=20.961,P<0.05),见图4。
3 讨论
Hh信号通路的主要成分有:细胞间的游离Hh配体,细胞膜上的蛋白Patched(ptch1、ptch2),细胞膜上7次跨膜蛋白smoothened(Smo),细胞内其下游的很多分子:如Fused(Fu)、suppressor:offused[Su(Fu)]、Casein Kinase Iα(CKIα)、蛋白激酶A(protein kinase,PKA)、Costal2(属于微管相关蛋白)、glycogen synthase kinase3β(GSK3β)和Glis蛋白中的Gli1、Gli2、Gli3蛋白(属于锌指核转录因子)等[11]。

图3 Smo蛋白表达与子宫内膜腺癌临床预后的Kaplan-meier分析(P=0.008)
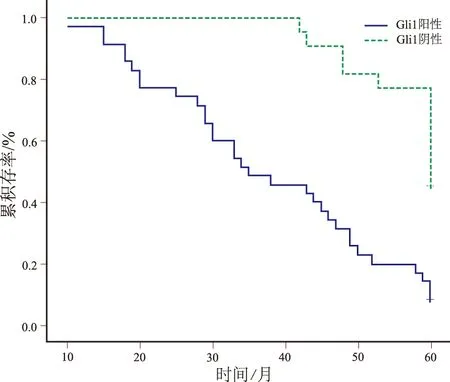
图4 Gli1蛋白表达与子宫内膜腺癌临床预后的Kaplan-meier分析(P<0.05)
正常生理情况下此信号通路是处于抑制状态,即细胞间质Hh信号蛋白是缺失的,不能与膜蛋白Patched结合。此时膜蛋白Patched与细胞膜上的Smo蛋白则形成复合物,阻止了Smo分子转位,即抑制Smo蛋白的活性,阻碍它在细胞表面上的定位,阻止其往下游的细胞内部传递信号。当细胞间质内Hh信号蛋白存在时,Hh蛋白与受体Patched发生结合,导致蛋白Patched不能与Smo蛋白形成复合物,即解除了Patched蛋白对Smo蛋白的抑制作用。Smo蛋白在细胞膜上的定位发生改变,即蛋白Smo分子羧基末端发生多个丝/苏氨酸残基的磷酸化,信号不再被Patched蛋白抑制, Smo蛋白激活。信号向细胞内部传递,细胞内微管上的复合物(由COS2驱动蛋白样分子和丝/苏氨酸激酶Fus、Sufu聚集结合而成)发生解离,下游通路被启动,之后信号传达给细胞内部的核转录因子Gli1蛋白,激活的Gli1蛋白进入细胞核中,激活靶基因,进而促使目的基因的表达,最后调节细胞的生长、增殖以及分化[12]。肿瘤发病机制中,Hh信号通路异常激活有两种方式:一是配体依赖性,即由于配体Hh蛋白发生的突变引起内源性Hh信号表达,与Patched蛋白受体相结合,解除对Smo蛋白的抑制,进而导致下游分子信号传递调节失去控制,激活靶基因,最终导致肿瘤的发生、发展;二是配体非依赖性,即Patched、Smo及Glis等基因突变发生,引起Hh通路异常激活,促进肿瘤的发生、发展[10]。
本研究结果提示,Smo和Gli1蛋白在子宫内膜腺癌中的表达都高于正常子宫内膜及子宫内膜不典型增生,并且二者在子宫内膜腺癌中的表达与分化程度(高、中、低)、临床分期、肌层浸润、淋巴结转移情况有关。Smo和Gli1蛋白在低分化子宫内膜腺癌中的表达高于高分化和中分化,临床分期越晚其表达越高,浸润越深表达也越高,有淋巴结转移的高于无淋巴结转移的,而二者均与患者年龄无关。并且,Smo和Gli1在子宫内膜腺癌中的表达呈正相关,可能存在协同作用。随访生存分析显示Smo和Gli1蛋白表达阳性的子宫内膜癌总体存活率低于阴性表达。
综上所述,Smo和Gli1蛋白的异常表达可能参与并共同促进了子宫内膜腺癌的发生、发展,并且与子宫内膜腺癌预后有关。因此,联合检测Smo和Gli1蛋白可能成为临床诊治子宫内膜腺癌及预后的重要参考依据。
[1] 陈乐真.妇产科诊断病理学[M].北京:人民军医出版社,2010:204-212.
[2]Tetsuroh S,Tetsuya M,Masaru K.Frequent up-regulation of WNT5A mRNA in primary gastric cancer[J].Int J Mol Med,2002,9(5):515-519.
[3]Michalis A,Morgane L,Harris WA,et al.A general role of hedgehog in the regulation of proliferation[J].Cell Cycle,2007,6(2):156-159.
[4]Vestergaard J,Bak M,Larsen LA.The Hedgehog signaling pa-thway in cancer[J].Prog Mol Subcell Biol,2005,40(3):1-28.
[5]Liu MS,Yang PY,Yeh TS.Sonic hedgehog signaling pathway in pancreatic cystic neoplasms and ductal adenocarcinoma[J].Pancreas,2007,34(3):340-346.
[6]Walsh PC.Hedgehog signalling in prostate regeneration,neoplasia and metastasis[J].J Urol,2004,431(7009):707-712.
[7]Mori Y,Okumura T,Tsunoda S,et al.Gli-1 expression is associated with lymph node metastasis and tumor progression in esophageal squamous cell carcinoma[J].Oncology,2006, 70(5):378-389.
[8]Richard D, Stéphane M,Pascal P,et al.Sonic Hedgehog-dependent proliferation in a series of patients with colorectal cancer[J].Surgery,2006,139(5):665-670.
[9]Lee SY,Han HS,Lee KY,et al.Sonic Hedgehog expression in gastric cancer and gastric adenoma[J].Oncol Rep,2007,17(5):1051-1055.
[10]黄海林,胡志前,王为民,等. Hedgehog信号传导通路在乳腺癌中表达增强[J].基础医学与临床,2009,29(5):522-526.
[11]Rubin LL,Sauvage FJD.Targeting the Hedgehog pathway in cancer[J].Nat Rev Drug Discov,2010, 2(4):1026-1033.
[12]Beachy PA,Karhadkar SS,Berman DM.Tissue repair and stem cell renewal in carcinogenesis[J].Nature,2004,432(7015):324-331.
Expression of Smo and Gli1 in Endometrial Adenocarcinoma and Its Correlation with the Clinicopathological Characteristics
CAI Yang-yang1, HE Tao1, ZHANG Xin1, YUAN Hong-ying2
(1.Department of Obstetrics and Gynecology, First Affiliated Hospital of Henan University of Science and Technology,Luoyang 471003,China;2.Medical College, Henan University of Science and Technology,Luoyang 471003,China)
ObjectiveTo discuss the expression of Smo and Gli1 protein in endometrial adenocarcinoma(EAC) tissue and its correlation with EAC clinicopathological characeristics.MethodsParaffin-embedded specimens were collected from the First Affiliated Hospital of Henan University of Science and Technology, and divided into three groups: normal proliferative stage of endometrium group(20 cases), atypical hyperplasia of endometrium (AEH) group(21 cases) and EAC group(58 cases). The expressions of Smo and Gli1 protein in the tissues of the three groups were detected by immunohistochemical method, and their relationship with biological characteristics of EAC and the correlation of the two factors in EAC were analyzed. Follow-up visits and Kaplan-meier survival analysis were performed in the EAC patients.ResultsThe positive expression rates of Smo protein in normal endometrial tissue, AEH and EAC were 5%, 33.34% and 58.64%, respectively,and the difference in the three groups had statistical significance (P<0.05). Meanwhile, the expression of Gli1 protein in normal endometrial tissue, AEH and EAC tissue were 0%, 28.57% and 60.34%, respectively, and that had statistically significant difference (P<0.05). The positive expressions of Smo and Gli1 were related to histological grade, clinical stage, muscular layer infiltration and lymphatic metastasis of EAC tissue (P<0.05), but they were not related to age (P>0.05). The expressions of two factors showed a positive correlation in EAC (rs=0.679,
P<0.05).ConclusionSmo and Gli1 might play an important role in carcinogenesis and development of EAC.Smo combined with Gli1 detection might provide a basis for the diagnosis,treatment and prognosis of EAC.
Smo;Gli1;endometrial adenocarcinoma;immunohistochemical method;survival analysis
1672-688X(2016)04-0247-05
10.15926/j.cnki.issn1672-688x.2016.04.003
2016-03-14
1.河南科技大学第一附属医院妇科,河南洛阳 471000 2.河南科技大学医学院,河南洛阳 471000
蔡阳阳(1989-),女,河南新乡人,医师,从事妇科肿瘤的基础与临床研究工作。
袁红瑛,女,教授,E-mail:374663945@qq.com
R737.33
A
