无定形介孔磷酸锆固定葡萄糖氧化酶的直接电化学
2016-08-22于志辉黄鹏飞汪夏燕
于志辉,黄鹏飞,汪夏燕
(北京工业大学环境与能源工程学院,北京 100124)
无定形介孔磷酸锆固定葡萄糖氧化酶的直接电化学
于志辉,黄鹏飞,汪夏燕
(北京工业大学环境与能源工程学院,北京 100124)
利用无定形介孔磷酸锆(ZrP)为载体,通过吸附法固定葡萄糖氧化酶(GOD),修饰玻碳(GC)电极得到GOD/ZrP/GC电极。在0.1 mol·L-1磷酸盐缓冲溶液中,利用循环伏安法研究了GOD/ZrP/GC电极的直接电化学行为和对葡萄糖的催化性能。结果表明,无定形磷酸锆ZrP为载体修饰的电极GOD/ZrP/GC其电化学反应电子转移速率快、表观覆盖量大;对葡萄糖的检测表现出较快的电流响应和较高的灵敏度,说明无定形磷酸锆更有利于GOD的固定和酶电极的直接电化学。
葡萄糖氧化酶;电催化性能;催化剂载体;电化学;稳定性
DOI:10.11949/j.issn.0438-1157.20151475
磷酸锆类作为一类多功能材料近年被广泛关注,其主要原因在于该材料既有离子交换树脂一样的离子交换性能,又具有很好的择形吸附性能和催化性能,同时磷酸锆类材料的热稳定性、耐酸碱性以及生物亲和性也优于其他很多载体材料,所以合成及应用磷酸锆类材料的研究受到了广泛的关注[8-10]。目前报道的合成磷酸锆类材料大多数为α-ZrP,主要是由于α型磷酸锆具有较好的催化及插层等性能[11-13];与其层状同系物相比,介孔磷酸盐的研究报道较少。介孔磷酸锆类材料的一个优越性在于其具有较大的表面积、可调变的介孔孔道结构以及丰富的骨架活性位,介孔磷酸盐材料被期望于在催化、吸附等领域得到更广阔的应用[14-18],所以介孔磷酸盐材料的合成及催化行为研究在该领域具有重要的意义。
本研究合成了无定形介孔磷酸锆载体材料,通过扫描电镜、透射电镜、BET等方法分析载体的形貌结构;以无定形介孔磷酸锆为载体固定葡萄糖氧化酶,在无任何电子媒介体存在条件下,对葡萄糖氧化酶的直接电化学性能以及其催化性能进行了研究。
1 实验部分
1.1试剂和仪器
葡萄糖氧化酶(GOD,20 U·mg-1,Type Ⅱ,Aspergillus niger,Sigma),β-D(+)葡萄糖(β-D(+)-glucose,Sigma),Nafion 溶液(质量分数为 5%,Aldrich),0.1 mol·L-1磷酸盐缓冲液(PBS),无机试剂均为分析纯。葡萄糖溶液需放置24 h后使用以保证其不同异构体之间达到平衡。
电化学性能测试均采用三电极体系、在PARSTAT2273电化学分析工作站(美国PAR公司)上进行,分别以无定形磷酸锆修饰玻碳(GC)电极为工作电极,饱和甘汞电极(SCE)为参比电极,铂黑电极为对电极,电化学测试温度为室温。
1.2无定形介孔磷酸锆的制备
将一定量的十六烷基三甲基溴化铵(CTAB)溶于15ml乙醇溶液中,待其溶解后加入磷酸(摩尔比:P/CTAB=1),静置半小时后,在搅拌过程中逐滴加入一定量的正丙醇锆作为锆源(摩尔比:P/Zr=2),室温搅拌48 h后将得到的白色沉淀用去离子水和乙醇洗涤过滤以除去CTAB,在烘箱中80℃真空干燥,即得到无定形介孔磷酸锆[12]。
1.3工作电极的制备
分别用砂纸、0.3 μm和 0.05 μm Al2O3将直径为4 mm的GC电极进行抛光至镜面,先后在无水乙醇和二次蒸馏水中超声清洗1 min,晾干备用。将4 mg ZrP超声分散于1ml 0.1%的十六烷基三甲基溴化铵(CTAB)水溶液中,形成白色的悬浊液,加入4 mg GOD,室温下搅拌30 min;用微量进样器取5 μl混合物均匀覆盖在GC电极表面,室温下待溶剂挥发后,再将1 μl Nafion溶液滴在电极表面,溶剂挥发后得到的电极为GOD/ZrP/GC电极,该电极置于0.1 mol·L-1PBS(pH=7.0)中保存于4℃冰箱中。用同样的方法制得ZrP/GC电极。
1.4介孔磷酸锆的结构表征及GOD/ZrP/GC电极的电化学性能测试
采用HITACHI S-4300扫描电子显微镜对ZrP载体材料进行表面形貌表征;BET测试在MicromeriticsASAP 2010(美国麦克仪器公司)上进行;傅里叶红外(FT-IR)光谱测量在Nicolet 360 FT-IR红外光谱仪上进行。电化学测试在室温下进行,采用三电极系统:以铂电极为对电极、饱和甘汞电极(SCE)为参比电极,分别以ZrP/GC、GOD/ZrP/GC电极(直径4 mm)为工作电极。在不同pH的PBS溶液中测定GOD/ZrP/GC的循环伏安曲线。循环伏安扫描的电压范围为-0.68~-0.28 V(vs SCE)。在pH=7.0的缓冲体系中,利用循环伏安法测定不同葡萄糖浓度中GOD/ZrP/GC电极对葡萄糖的催化性能。
2 结果与讨论
2.1磷酸锆的结构表征
图1是磷酸锆样品的大角XRD图。图中在2θ为10°~40°和40°~70°范围内分别出现了一个宽峰,并且没有明显的晶体磷酸锆的峰出现,显示了磷酸锆样品无定形的特点[19]。
图2为磷酸锆的扫描电镜图和透射电镜图。从SEM图可以看出,磷酸锆样品颗粒比较小,形状类似小球且表面光滑,很多小颗粒聚集在一起。由TEM测试结果可以看出磷酸锆为蠕虫状孔道结构,由许多球状的介孔笼通过窗口相互连接排列而成,图的边缘可以直接观察到磷酸锆的介孔笼,孔径为2~3 nm。
2.2GOD在无定形磷酸锆表面吸附的表征
图3为GOD、ZrP和 GOD-ZrP的 FT-IR光谱。GOD的 FT-IR 光谱中,在1651和1541 cm-1处出现的吸收峰分别为GOD中酰胺Ⅰ和酰胺Ⅱ的吸收峰。酰胺Ⅰ是由葡萄糖氧化酶肽链骨架中的肽段连接处的伸缩振动引起的,酰胺Ⅱ来源于弯曲和伸缩振动,蛋白质的酰胺Ⅰ和酰胺Ⅱ处的红外吸收带提供了多肽链二级结构的信息[20-21]。图3曲线c为GOD吸附在ZrP表面后的FT-IR 光谱图,可以看出GOD仍保持了酰胺Ⅰ和酰胺Ⅱ的吸收峰,但峰位有所移动,分别为1657和1544 cm-1处,其原因在于GOD的肽链上的基团与ZrP上的含氧基团之间形成的氢键可能会引起位移,另外由于ZrP上含氧基团的吸收峰与GOD的吸收峰有一定重叠也会引起位移,该结果表明GOD已吸附在ZrP上。
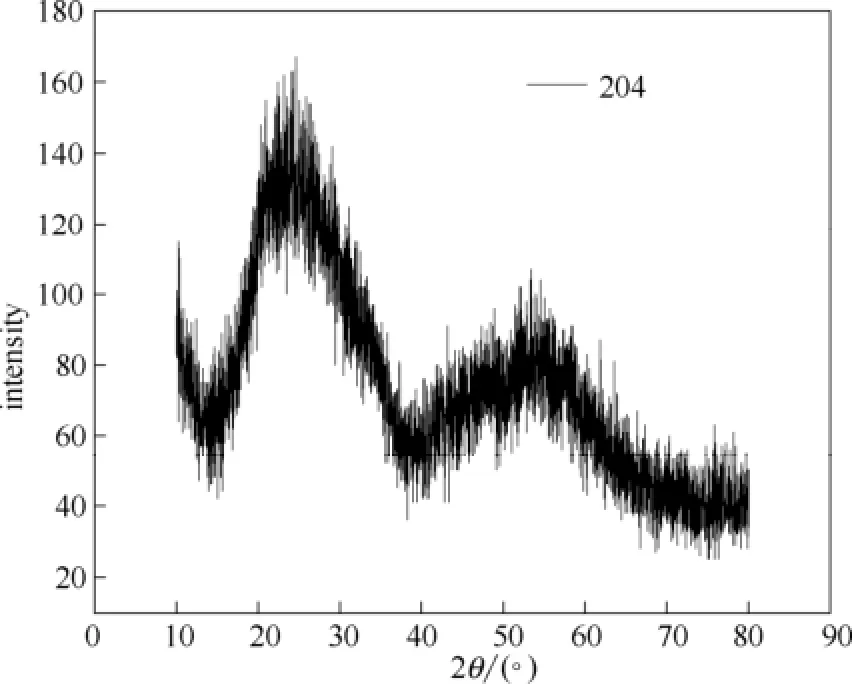
图1 合成的无定形磷酸锆样品的XRD图Fig.1 XRD patterns of synthesized amorphous ZrP

图2 无定形磷酸锆样品的SEM图和TEM图Fig.2 SEM (a) and TEM (b, c) micrographs of synthesized amorphous ZrP
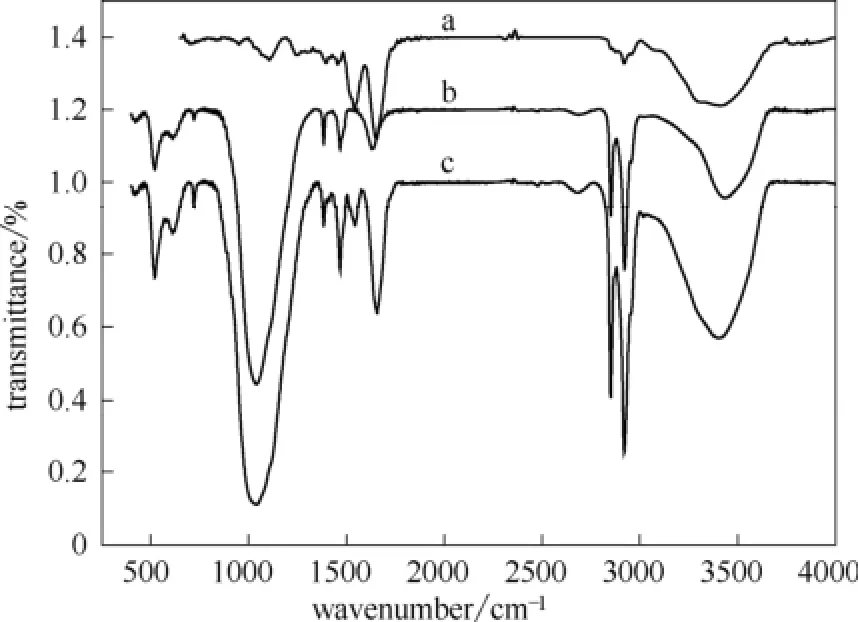
图3 GOD、ZrP和 GOD-ZrP的 FT-IR 光谱Fig.3 FT-IR spectra of GOD (a), ZrP (b), and GOD-ZrP (c)
2.3葡萄糖氧化酶的直接电化学

图4 ZrP/GC电极和GOD/ZrP/GC电极的循环伏安曲线Fig.4 CV curves of ZrP/GC (a) and GOD/ZrP/GC (b) electrodes
图4是ZrP/GC电极和GOD/ZrP/GC电极在0.1 mol·L-1PBS溶液(pH=7.0)中扫速为100 mV·s-1时的循环伏安曲线。图4曲线a表明,ZrP/GC电极的循环伏安曲线中没有任何氧化还原峰,说明该电极在此电势范围内无电活性;而在GOD/ZrP/GC电极的循环伏安曲线(图4曲线b)中,分别在Epa=-0.385 V,Epc=-0.453 V处出现了一对明显且可逆的氧化还原峰,说明电极上的酶发生了氧化还原反应,其表观式电位为E0′=-0.419 V,这与一些文献[22-24]报道的表观式电位很接近,峰位差ΔEp=68 mV,并且氧化还原峰电流基本相等,说明葡萄糖氧化酶在电极表面进行的氧化还原反应是一个可逆过程,表明葡萄糖氧化酶固定在电极表面并保持生物活性进行可逆的电子转移。
图5(a)为GOD/ZrP/GC电极在Ar气饱和的0.1 mol·L-1PBS(pH=7.0)中,不同扫描速率下的循环伏安曲线。当扫描速率从75 mV·s-1增加到200 mV·s-1氧化还原峰电流与扫描速率呈线性关系[图5(b)],证明GOD的电化学反应为表面控制过程[28]。随着扫描速率的增加,氧化峰和还原峰峰电位分别向正、负方向产生较小的偏移,pEΔ增加,但几乎不变。根据Laviron[29]电极表面异相反应动力学常数的计算方法,利用扫描速率与峰位差的关系,可得到GOD的电化学反应的电子转移速率常数ks为1.82 s-1,这一数值与Jiang等[25]修饰在自组装单分子层上的GOD直接电子转移反应速率常数ks(0.026 s-1)相比大了两个数量级,说明无定形磷酸锆更有效地促进了GOD与电极表面之间的电子传递过程。
图6为GOD/ZrP/GC电极在Ar饱和和空气饱和的0.1 mol·L-1PBS中、扫速为50 mV·s-1下的循环伏安图。由图可见,在这两种气氛下的PBS溶液中测得的CV曲线中均有一对明显、可逆的氧化还原峰出现。在氧气存在的条件下,酶的还原态(GOD-FADH2)会在电极表面被溶解氧快速地进一步氧化,反应如下[30]


图5 GOD/ZrP/GC电极在不同扫速下的循环伏安曲线及氧化还原峰峰电流与扫描速率的关系曲线Fig.5 Cyclic voltammograms of GOD/ZrP/GC electrodes at different scanrates (75, 100, 125, 150, 175, 200 mV·s-1)(a) and plots of redox peak currents vs scan rates (b)
酶的氧化态形式的催化再生导致了反应可逆性的降低以及还原峰的增加,因此如图6所示在有O2存在的PBS中测得的CV曲线与相同条件下Ar饱和的PBS中的CV曲线相比,还原峰要大,氧化峰要小,说明GOD(FADH2)可以催化溶解氧的还原[31-32]。
图 7(a)为GOD/ZrP/GC电极在 0.1 mol·L-1不同 pH 的 PBS 中的循环伏安图。由图可见,在pH 6.0~8.0范围内,均能观察到一对可逆的氧化还原峰。GOD 的氧化还原峰峰电位随 pH的增加明显负向移动,表观式量电位与 pH 呈线性关系[图7(b)],其斜率为-39.31 mV·pH-1,这一结果与先前文献报道的吸附在溶胶金纳米颗粒上的 GOD电极过程的结果(斜率为-43.7 mV·pH-1)[26]以及利用分子组装技术在 SWCNT 修饰并电沉积羟基磷灰石的电极上固定的GOD的电极过程的结果(斜率-39 mV·pH-1)[33]很相似,表明在GOD/ZrP/GC电极上发生了直接电化学反应:GOD-FADH2(FAD 为黄素腺嘌呤二核苷酸),该反应伴随有两电子两质子的转移,且GOD在电极表面的直接电子转移反应具有较好的可逆性,含两个FAD 中心的GOD 分子的直接电化学过程符合电子-质子转移数相等的机理。
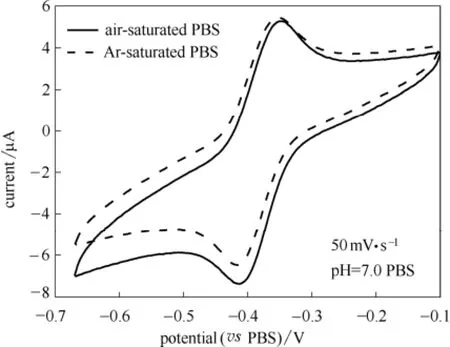
图6 GOD/ZrP/GC电极在Ar饱和和空气饱和的0.1 mol·L-1PBS中扫速为50 mV·s-1下的循环伏安曲线Fig.6 Cyclic voltammograms of GOD/ZrP/GC electrode in Ar- and air-saturated 0.1mol·L-1PBS solution with scan rate of 50 mV·s-1

图7 GOD/ZrP/GC电极在不同pH的PBS中的循环伏安曲线及E0′与溶液 pH 的关系曲线Fig.7 Cyclic voltammograms of GOD/ZrP/GC electrode at various pH values solution (0.1 mol·L-1PBS, pH 6.0, 6.5, 7.0,7.5, 8.0, scan rate: 50 mV·s-1) (a) and plot of E0′ vs pH of PBS (b)
2.4GOD/ZrP/GCE对葡萄糖的催化性能
图8是酶电极在0.1 mol·L-1pH=7.0的PBS中扫速为20 mV·s-1时催化氧化葡萄糖的循环伏安曲线。由图可见,未加入葡萄糖时,CV曲线中有一对氧化还原峰出现,当加入1 mmol·L-1的葡萄糖后,CV曲线中氧化峰电流增大而还原峰电流减小,说明葡萄糖在电极表面发生了催化氧化反应且无定形磷酸锆在酶和电极之间起到了传递电子的作用。

图8 GOD/ZrP/GC电极在无葡萄糖和有1 mmol·L-1葡萄糖的空气饱和、pH=7.0的0.1 mol·L-1PBS中的循环伏安图(扫速为:20 mV·s-1)Fig.8 Cyclic voltammograms of GOD/ZrP/GC electrode in absence and presence of 1 mmol·L-1glucose in 0.1 mol·L-1PBS, pH=7.0 (scan rate: 20 mV·s-1)
GOD/ZrP/GC修饰电极对葡萄糖的安培响应见图9(a),在0.1 mol·L-1pH7.0 PBS缓冲溶液中连续加入一定量的葡萄糖溶液,电流响应出现跳跃性增大,电极的电流响应时间小于15 s,与文献[34]中报道的响应时间相近,电极响应随着葡萄糖的浓度增大出现饱和平台,该结果是Michaelis-Menten酶反应动力学特征的充分表现。电极的响应电流在0.4~2.0 mmol·L-1的范围内与葡萄糖浓度呈线性关系,见图9(b),其线性回归方程为i=1.52Cglucose-3.304(µA,mmol·L-1,R=-0.99878,n=5)。修饰电极的灵敏度是12.1 µA·(mmol·L-1)-1·cm-2,信噪比为3时的检测限是0.3 mmol·L-1。结果表明GOD/ZrP/GC电极具有较高的灵敏度和较低检测限。

图9 葡萄糖传感器对不同浓度葡萄糖溶液的响应曲线Fig.9 Amperometric response to successive addition of 0.4 mmol·L-1glucose
图10是GOD/ZrP/GC电极在pH=7.0的0.1 mol·L-1PBS中在100 mV·s-1的扫速下循环第1圈和第90圈的CV曲线。从图中可以观察到该电极在100 mV·s-1的扫速下连续进行90圈循环伏安测试之后,氧化还原峰电流及其电位都没有明显改变,表明该修饰电极具有较好的操作稳定性。图11为将GOD/ZrP/GC电极在4℃条件下贮存7 d后和30 d后在含有1 mmol·L-1葡萄糖的0.1 mol·L-1pH=7的PBS中的循环伏安曲线。由图可得,该电极贮存7 d后其葡萄糖氧化峰峰电流维持了初始电流的95%左右,而贮存30 d后其氧化峰峰电流仍能维持初始电流的85%,表明该电极具有较好的储备稳定性,即电极使用寿命较长;用同样的方法连续制备5个电极并在上述溶液中相同条件下进行循环伏安测试,其氧化峰峰电流值的相对标准偏差仅为4.7%,表明该电极具有较好的重现性。以上结果说明,GOD/ZrP/GC电极具有良好的稳定性和重现性,同时也说明ZrP有利于葡萄糖氧化酶生物活性的保持。
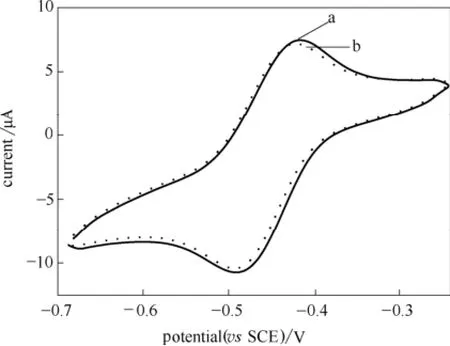
图10 GOD/ZrP/GC电极在pH=7.0的0.1 mol·L-1PBS中在100 mV·s-1的扫速下第1圈和第90圈的CV曲线Fig.10 The first (a) and 90th (b) cyclic voltammograms of GOD/ZrP/GC electrode in 0.1 mol·L-1PBS with pH=7.0,scan rate 100 mV·s-1

图11 GOD/ZrP/GC电极在4℃下贮存7 d后和30 d后在含有1 mmol·L-1葡萄糖的pH=7.0的0.1 mol·L-1PBS中50 mV·s-1扫速下的CV曲线Fig.11 Cyclic voltammograms of GOD/ZrP/GC electrode before (a) and after placement for 7 d (b) and 30 d (c) in 0.1 mol·L-1PBS with pH=7.0, scan rate 50 mV·s-1
3 结 论
研究结果表明,无定形ZrP载体材料的介孔结构有利于葡萄糖氧化酶的负载且负载量较大,以ZrP为载体可以很好地固定GOD并保持其生物活性。GOD/ZrP/GC电极的循环伏安曲线中氧化还原峰的电流与扫速呈线性关系,说明电极反应为表面控制过程;GOD的电化学反应的电子转移速率常数ks为1.82 s-1,GOD/ZrP/GC电极对葡萄糖检测的灵敏度为12.1 µA·(mmol·L-1)-1·cm-2,检测限为0.3 mmol·L-1。研究结果说明无定形磷酸锆利于GOD的固定和酶电极的直接电化学,该研究为无机载体在酶固定研究方面打下了一个很好的基础。
References
[1]GALANT L, KAUFMAN R C, WILSON J D. Glucose: detection and analysis [J]. Food Chemistry, 2015, (188): 149-160 DOI:10.1016/ j.foodchem.2015.04.071.
[2]WANG J. Electrochemical glucose biosensors [J]. Chemical Reviews,2008, 108 (2): 814-825 DOI: 10.1021/cr068123a.
[3]ALWARAPPAN S, BOYAPALLE S, KUMAR A, et al. Comparative study of single-, few-, and multilayered graphene [J]. Phys. Chem. C,2012, 116 (11): 6556. doi: 10.1021/jp211201b.
[4]GU T, ZHANG Y, DENG F, et al. Direct electrochemistry of glucose oxidase and biosensing for glucose based on DNA/chitosan film [J]. Environ. Sci., 2011, 23 (Supplement): S66. DOI: 10.1016/S1001-0742(11)61080-2.
[5]LUO Z M, YUWEN, L H, HAN Y J, et al. Reduced graphene oxide/PAMAM-silver nanoparticles nanocomposite modified electrode for direct electrochemistry of glucose oxidase and glucose sensing [J]. Biosens. Bioelectron., 2012, 36 (1): 179. DOI:10.1016/ j.bios.2012.04.009.
[6]WANG Y, YUAN R, CHAIA Y, et al. Direct electron transfer:electrochemical glucose biosensor based on hollow Pt nanosphere functionalized multiwall carbon nanotubes [J]. Mol. Catal. B: Enzym.,2011, 71 (3/4):146. DOI:10.1016/j.molcatb.2011.04.011.
[7]于志辉, 宿婷婷, 任翠华, 等. 炭气凝胶纳米颗粒固定葡萄糖氧化酶的直接电化学 [J].物理化学学报, 2012, 28 (12): 2867-2873. DOI:10.3866/PKU.WHXB201209201. YU Z H, SU T T, REN C H, et al. Direct electrochemistry and immobilization of glucose oxidase on nano-carbon aerogels [J]. Acta Phys.-Chim. Sin., 2012, 28 (12): 2867-2873. DOI: 10.3866/PKU. WHXB201209201.
[8]DONG J, WEN Y, MIAO Y, et al. A nanoporous zirconium phytate film for immobilization of redox protein and the direct electrochemical biosensor [J]. Sensors and Actuators B, 2010, 150 (1):141-147. DOI: 10.1016/j.snb.2010.07.029.
[9]LIU L M, SHEN B, SHI J J, et al. A novel mediator-free biosensor based on co-intercalation of DNA and hemoglobin in the interlayer galleries of α-zirconium phosphate [J]. Biosensors and Bioelectronics,2010, 25 (12): 2627-2632. DOI: 10.1016/j.bios.2010.04.031.
[10]LIU L M, WEN J, LIU L, et al. A mediator-free glucose biosensor based on glucose oxidase/chitosan/α-zirconium phosphate ternary biocomposite [J]. Analytical Biochemistry, 2014, 445: 24-29. DOI:10.1016/j.ab.2013.10.005.
[11]LIU L, ZHANG H T, SHEN B, et al. pH-induced fabrication of DNA/chitosan/alpha-ZrP nanocomposite and DNA release [J]. Nanotechnology, 2010, 21 (10): 105102. DOI: 10.1088/0957-4484/ 21/10/105102.
[12]BHAMBHANI A, KUMAR C V. Protein/DNA/inorganic materials:DNA binding to layered alpha-zirconium phosphate enhances bound protein structure and activity [J]. Adv. Mater., 2006, 18 (7): 939-942. DOI: 10.1002/adma.200502230.
[13]JONES D J, APTEL G, BRANDHORST M, et al. High surface area mesoporous titanium phosphate: synthesis and surface acidity determination [J]. J. Mater. Chem., 2000, 10 (8): 1957-1963. DOI:10.1039/b002474k.
[14] BHAUMIK A, INAGAKI S J. Mesoporous titanium phosphate molecular sieves with ion-exchange capacity [J]. J. Am. Chem. Soc.,2001, 123 (4): 691-696. DOI: 10.1021/ja002481s.
[15]TIEMANN M, FROBA M. Mesoporous aluminophosphates from a single-source precursor [J]. Chem. Commun., 2002, (5): 406-407. DOI: 10.1039/b110662g.
[16]TIAN B Z, LIU X Y, TU B, et al. Self-adjusted synthesis of ordered stable mesoporous minerals by acid-base pairs [J]. Nat. Mater., 2003,2 (3): 159-163. DOI: 10.1038/nmat838.
[17]MAL N K, ICHIKAWA S, FUJIWARA M. Synthesis of a novel mesoporous tin phosphate, SnPO4[J]. Chem. Commun., 2002, (2):112-113. DOI: 10.1039/B109948E.
[18]CHRISTIAN S, ALINE S, ANTONELLA G, et al. Hexagonal and cubic thermally stable mesoporous Tin(IV) phosphates with acidic and catalytic properties [J]. Angew. Chem. Int. Ed., 2002, 41 (9):1594-1597. DOI: 10.1002/1521-3773(20020503)41:9<1594:AIDANIE1594>3.0.CO;2-W.
[19]SINHAMAHAPATRA A, SUTRADHAR N, ROY B, et al. Mesoporous zirconium phosphate catalyzed reactions: synthesis of industrially important chemicals in solvent-free conditions [J]. Applied Catalysis A: General, 2010, 385 (1): 22-30. DOI: 10.1016/ j.apcata.2010.06.016.
[20]NIWA K, FURUKAWA M, NIKI K. Ir reflectance studies of electron-transfer ptomoters for cutochrome-c on a gold electrode [J]. J. Electroanal. Chem., 1988, 245 (1): 275-285. DOI: 10.1016/0022-0728(88)80074-3.
[21]IRACE G, BISMUTO E, SAVY F, et al. Unfolding pathway of myoglobin-molecular-properties of intermediate froms [J]. Arch. Biochem. Biophys., 1986, 244 (2): 459-469. DOI: 10.1016/0003-9861(86)90614-4.
[22]PERIASAMY A P. Amperometric glucose sensor based on glucose oxidase immobilized on gelatin-multiwalled carbon nanotube modified glassy carbon electrode [J]. Bioelectrochemistry, 2011, 80(2): 114-120. DOI: 10.1016/j.bioelechem.2010.06.009.
[23]SHAN C, YANG H, SONG S, et al. Direct electrochemistry of glucose oxidase and biosensing for glucose based on graphene [J]. Anal. Chem.,2009, 81 (6): 2378-2382. DOI: 10.1021/ac802193c.
[24]YAO Y, SHIU K. Direct electrochemistry of glucose oxidase at carbon nanotube-gold colloid modified electrode with poly(diallyldimethylammonium chloride) coating [J]. Electroanalysis,2008, 20 (14): 1542-1548. DOI: 10.1002/elan.200804209.
[25]JIANG L, MCNEIL C J, COOPER J M. Direct electron-transfer reactions of glucose-oxidase immobilized at a self-assembled monolayer [J]. J. Chem. Soc. Chem. Commun., 1995, (12): 1293-1295. DOI: 10.1039/C39950001293.
[26]LIU S Q, JU H X. Reagentless glucose biosensor based on direct electron transfer of glucose oxidase immobilized on colloidal gold modified carbon paste electrode [J]. Biosens. Bioelectron., 2003, 19(9): 177-183. DOI: 10.1016/S0956-5663(03)00172-6.
[27]HUANG Y X, ZHANG W J, XIAO H, et al. An electrochemical investigation of glucose oxidase at a CdS nanoparticles modified electrode [J]. Biosens. Bioelectron., 2005, 21 (5): 817-821. DOI:10.1016/j.bios.2005.01.012.
[28]BARD A J, FAULKNER L R. Electrochemical Methods, Fundamentaland Applications [M]. 2nd ed. New York: John Wiley & Sons Inc.,2001:594.
[29]LAVIRON E. General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J]. Electroanal. Chem., 1979, 101 (1): 19-28. DOI: 10.1016/ S0022-0728(79)80075-3.
[30]WU Y H, HU S S. Direct electrochemistry of glucose oxidase in a colloid Au-dihexadecylphosphate composite film and its application to develop a glucose biosensor [J]. Bioelectrochem., 2007, 70 (2):335-341. DOI: 10.1016/j.bioelechem.2006.05.001.
[31]MCKENZIE K J, MARKEN F. Accumulation and reactivity of the redox protein cytochrome c in mesoporous films of TiO2phytate [J]. Langmuir, 2003, 19 (10): 4327-4331. DOI: 10.1021/la0267903.
[32]TAO Y, KANOH H, KANEKO K. ZSM-5 monolith of uniform mesoporous channels [J]. J. Am. Chem. Soc., 2003, 125 (20):6044-6045. DOI: 10.1021/ja0299405.
[33]朱琼,魏雅,吴霞琴. 用羟基磷灰石和单壁碳纳米管制备葡萄糖传感器的研究 [J].化学研究与应用, 2011, 23 (4): 413-417. DOI:1004-1656(2011)23:4<413:YQJLHS>2.0.TX;2-9. ZHU Q, WEI Y, WU X Q. Glucose sensor based on hydroxyapatite and single-wall carbon nanotube composite [J]. Chemical Research and Application, 2011, 23 (4): 413-417. DOI: 1004-1656(2011)23:4<413:YQJLHS>2.0.TX;2-9.
[34]CHEN W, DING Y, AKHIGBE J, et al. Enhanced electrochemical oxygen reduction-based glucose sensing using glucose oxidase on nanodendritic poly[meso-tetrakis(2-thienyl)porphyrinato]cobalt(Ⅱ)-SWNTs composite electrodes [J]. Biosensors and Bioelectronics,2010, 26 (2): 504-510. DOI: 10.1016/j.bios.2010.07.062.
Direct electrochemistry of immobilized glucose oxidase on amorphous mesoporous zirconium phosphate
YU Zhihui, HUANG Pengfei, WANG Xiayan
(College of Environmental and Energy Engineering, Beijing University of Technology, Beijing 100124, China)
Glucose oxidase (GOD)/zirconium phosphate(ZrP)/glassy carbon(GC) electrode was prepared by adsorbing GOD on the amorphous mesoporous zirconium phosphate. The electrocatalytic properties of GOD/ZrP/GC electrode were characterized by cyclic voltammetric method at the medium of phosphate buffer (0.1 mol·L-1). The results showed that there were quicker electron transfer rate and larger surface coverage when GOD was supported on zirconium phosphate. At the same time, the electrochemical device with this electrode showed faster current response and higher sensitivity in detection of glucose, indicating that zirconium phosphate could be more suitable support for immobilization of GOD and achieve better performance of direct electrochemistry. Key words: glucose oxidase; electro-catalytic performance; catalyst support; electrochemistry; stability
引 言
葡萄糖含量的检测被广泛应用于医疗、食品等众多领域。利用具有良好的导电性能和生物性能的酶载体固定葡萄糖氧化酶并实现酶的直接电化学是当前研究的热点之一。固定酶所使用的载体从其组成上可以分为无机载体、高分子载体、复合载体等,目前有关载体研究报道中主要是关于高分子载体、复合载体的研究[1-7]。而无机纳米载体具有稳定性好、机械强度高、对酶和微生物无毒性、不易被酶和微生物分解、耐酸碱、寿命长等优点,所以无机纳米介孔材料作为固定化酶的新型载体的研究对于实现酶的直接电化学、提高葡萄糖氧化酶的催化性能具有重要的意义。
date: 2015-09-21.
YU Zhihui, yuzhihui@bjut.edu.cn
supported by the National High Technology Research and Development Program of China (2012AA052201).
O 646
A
0438—1157(2016)05—2161—08
2015-09-21收到初稿,2015-12-03收到修改稿。
联系人及第一作者:于志辉(1961—),女,教授。
国家高技术研究发展计划项目(2012AA052201);北京市教育委员会科技发展计划重点项目(KZ201310005001);北京市教委科研计划面上项目(KM201210005008);新世纪优秀人才支持计划项目(NCET-12-0603)。
