离子液体分散液液微萃取/高效液相色谱法测定环境水样中7种萘二酚
2016-08-19何东
何 东
(嘉应学院 梅州师范分院,广东 梅州 514087)
离子液体分散液液微萃取/高效液相色谱法测定环境水样中7种萘二酚
何东*
(嘉应学院梅州师范分院,广东梅州514087)
建立了测定环境水样中7种萘二酚的离子液体分散液液微萃取/高效液相色谱(IL-DLLME-HPLC)分析方法。以1-丁基-3-甲基咪唑六氟磷酸盐([C4MIM][PF6])为萃取剂,水样体积为8.0 mL,研究了萃取剂用量、水相pH值、萃取时间及盐添加量对7种萘二酚萃取效率的影响。获得最佳萃取条件为:[C4MIM][PF6]体积为150 μL,水相pH值为5.0~7.0,涡旋萃取时间为3 min,氯化钠添加量为0.20 g/mL。在优化条件下,7种萘二酚在一定质量浓度范围内线性关系良好,相关系数均不小于0.997 7;方法富集倍数为57倍,方法检出限(S/N=3)为0.3~1.0 μg/L;阴性环境水样中3个加标水平的平均回收率为83.5%~103%,相对标准偏差(n=6)为1.1%~3.8%。该方法快速简单、准确灵敏、环保,适用于环境水样中痕量萘二酚的富集检测。
离子液体分散液液微萃取;高效液相色谱法;萘二酚;环境水样
萘二酚是染料等行业生产合成的重要中间体,应用广泛,这类物质对人体具有致癌、致畸、致突变等潜在毒性[1-3],随着各种生产废水的排放,环境水体中痕量的酚类化合物不仅会危害生态环境,还会进一步对人类健康造成威胁。由于萘二酚在废水中的浓度较低,且水样中干扰物质较多,其分析检测需结合高效的分离富集技术和快速灵敏的检测方法。目前应用的主要方法有固相萃取/液相色谱-串联质谱(SPE-LC-MS/MS)法[2]、涡旋辅助分散液液微萃取-悬浮固化/液相色谱法(VA-DLLME-SFO/HPLC-PAD)[3]和分散液相微萃取/高效液相色谱法(DLLME-SFO/HPLC-PAD)[4]等。上述分析方法中酚类物质的分离富集均需使用易挥发、毒性较大的有机溶剂,尤其是传统的DLLME技术,常使用高毒性的卤代苯作为萃取剂,对人体和环境危害较大;而DLLME-SFO技术在取出固化的萃取剂时,萃取剂易在室温下融化损失,影响检测准确性;SPE技术则存在操作步骤繁琐、成本高等缺点。
离子液体(Ionic liquid,IL)具有性质稳定、蒸气压小、不易挥发等特点,可以代替传统有机溶剂在液液微萃取中使用,从而避免了有机溶剂挥发产生的环境污染等问题,所以基于离子液体的DLLME技术已被逐渐应用于污染物的分析检测[5-15]。Zhou等[7]于2008年应用IL-DLLME结合液相色谱/紫外检测器(HPLC/UV)检测环境水样中的甲基对硫磷和辛硫磷;闵剑青等[8]、陈晓红等[9]、侯德坤等[10]分别应用离子液体分散微萃取技术富集检测了环境水样中痕量的五氯酚、溴敌隆与溴鼠灵、四环素;Ravelo-Pérez等[11]、Zhang等[12]和Zhang等[13]分别利用IL-DLLME结合HPLC/DAD技术测定了香蕉中8种农药残留、蜂蜜中4种拟除虫菊酯以及苹果和梨中6种有机磷农药。
本文采用离子液体1-丁基-3-甲基咪唑六氟磷酸盐([C4MIM][PF6])为萃取剂,水样体积为8.0 mL,通过优化萃取剂的用量、水相pH值、萃取时间及盐添加量等参数,获得高效富集提取环境水样中7种萘二酚的最佳实验条件,同时结合高效液相色谱/二极管阵列检测器,建立了环境水样中萘二酚类化合物的检测方法。
1 实验部分
1.1仪器与试剂
Waters 2695/2998液相色谱/二极管阵列检测器系统(HPLC-PDA,Waters公司),MS3 Basic旋涡混合器(德国IKA公司),台式离心机(科大中佳公司),Milli-Q去离子水发生器(美国Millipore公司)。
1,5-萘二酚(CAS 83-56-7,99.5%,Chem Service Inc公司);1,6-萘二酚(CAS 575-44-0,97.0%,Alfa Aesar公司);1,3-萘二酚(CAS 132-86-5,99.0%)、1,7-萘二酚(CAS 575-38-2,97.0%)、2,3-萘二酚(CAS 92-44-4,98.0%)、2,6-萘二酚(CAS 581-43-1,98.0%)、2,7-萘二酚(CAS 582-17-2,97.0%)均购自Sigma-Aldrich公司;1-丁基-3-甲基咪唑六氟磷酸盐([C4MIM][PF6],纯度>98%,上海安谱科学仪器有限公司);甲醇、甲酸(色谱纯,德国CNW Technologies GmbH);氯化钠(分析纯,广州化学试剂厂);实验用水为去离子水(18.0 MΩ·cm),由Milli-Q纯水系统制备。
用甲醇将7种萘二酚分别配成质量浓度为1.0 g/L的单标储备液,于4 ℃保存。分别移取7种萘二酚的单标储备液2.0 mL于100 mL棕色容量瓶中,加水定容至刻度,配成20.0 mg/L混合标准工作液(现配现用)。
1.2色谱条件
色谱柱:Dikma C18(250 mm×4.6 mm,5 μm);流动相:A为甲醇,B为0.1%甲酸水溶液;梯度洗脱程序:0.0~35.0 min,25%~55% A;35.0~35.1 min,55%~25% A;35.1~45.0 min,25% A;流速:1.0 mL/min;柱温30 ℃;检测波长230 nm;进样量20 μL。
1.3实验方法
取15 mL环境水样于50 mL聚四氟乙烯离心管中,4 000 r/min离心5 min,移取上层澄清水样8.0 mL于10 mL尖底玻璃离心管中,测试水样pH值为5.0~7.0,否则用甲酸调节,然后加入1.6 g氯化钠,振荡溶解,再加入150 μL离子液体[C4MIM][PF6],涡旋分散萃取3 min,2 500 r/min离心3 min,弃去上层水相,吸取离子液体相,转移至200 μL尖底内插管,待HPLC分析。
2 结果与讨论
2.1萃取剂用量与分散萃取时间的优化
本实验选用10 mL尖底玻璃离心管盛装水样,考虑到后续添加氯化钠及留有空间便于充分涡旋萃取,故确定以8.0 mL样品体积进行实验条件的优化。

图1 萃取剂用量对萘二酚萃取回收率的影响Fig.1 Effect of extraction volume on recoveries of 7 naphthalenediols No.1-7 were the same as those in Table 1
采用阴性水样加标的方式,分别选取50,100,150,200,250 μL离子液体[C4MIM][PF6]进行萃取比较,以萃取后获得的萃取液体积和取样量(8.0 mL)计算富集倍数,并根据浓度计算萃取回收率(图1)。结果表明随着萃取剂[C4MIM][PF6]用量的增大,试样与萃取剂的体积比不断减小,萃取剂与目标物更充分地分散接触和快速分配,7种萘二酚的萃取回收率先增大后处于平衡,但由于最终获得的萃取液体积也相应增大,富集倍数随之降低,对8.0 mL水样的富集倍数约由230倍降为34倍,方法灵敏度也随之降低;当萃取剂用量为150 μL时,整体萃取回收率达最高,且富集倍数较大,约为57倍,此时方法的萃取回收率和灵敏度均能较好地满足痕量检测的需要,获得的萃取液体积也能满足仪器自动进样的体积需要。因此选用150 μL [C4MIM][PF6]。
传统IL-DLLME常借助分散剂来形成“萃取剂/样品溶液/分散剂”三相混合乳浊体系,以快速完成目标化合物在水溶液与萃取剂之间的分配萃取,但其存在难以应对多种目标物、萃取效率低等缺点,因此,现在逐步应用涡旋辅助(Vortex-assisted,VA)[10]和超声波辅助(Ultrasound-assisted,UA)IL-DLLME[9]等模式。这些模式借助涡旋或超声等外界能量对样品溶液进行分散处理,增大了离子液体与样品溶液中待测化合物的接触面积,有利于提高萃取效率。实验选择高速涡旋的方式进行辅助萃取,并考察了萃取时间分别为1,2,3,4,5 min时萘二酚的萃取回收率。结果显示,在1~3 min内,萘二酚的萃取回收率随着萃取时间的增加而逐渐提高,萃取3 min后,回收率基本平衡,因而选择最佳萃取时间为3 min。
2.2水相pH值的影响
萘二酚类化合物属于弱酸,7种萘二酚在水中的电离常数(pKa)在8.93~12.53之间,水相pH值会影响其存在状态,当pH值呈酸性时,萘二酚多以分子状态存在,当pH值呈碱性时,则多以离子状态存在,不同存在状态的萘二酚在两相萃取中的分配会不同。本实验用甲酸调节水相pH值(5.0~9.0),研究了不同水相pH值对萃取效率的影响。实验显示,在pH 5.0~7.0范围内,离子液体对7种萘二酚的萃取效率基本不变;在pH 8.0~9.0时,离子液体对7种萘二酚的萃取效率逐渐降低。表明以分子状态存在的萘二酚更易在离子液体中分配,从而获得更高的萃取效率。原因可能为分子状态的萘二酚极性较低,根据相似相溶原理,在低极性的离子液体[C4MIM][PF6]中相溶性较好,此外,离子液体结构上的氟原子与分子状态存在的酚羟基相互作用形成氢键;而在碱性条件下,酚羟基以阴离子状态存在,与离子液体阴离子之间难以形成氢键[16]。因此,确定萃取时水相pH值为5.0~7.0,若水相pH值不在此范围,则用甲酸调节pH值。
2.3盐添加量的影响
水相中盐的浓度可对萃取率产生两方面的影响[17]:一为盐析效应,通过水合作用降低自由水分子的浓度,从而降低溶质在水溶液中的分配,促使溶质进入萃取相,提高萃取率;二是与极性溶质产生静电相互作用力,降低其传质能力,从而降低萃取率。
实验通过不同的氯化钠添加量(0.05,0.10,0.15,0.20,0.25,0.30 g/mL)探讨了盐效应对7种萘二酚萃取回收率的影响。结果表明,盐对萘二酚萃取回收率的影响主要以盐析效应为主导,即随着氯化钠添加量的增加,7种萘二酚的萃取率逐渐提高;当氯化钠添加量为0.20 g/mL时,萃取基本达到平衡,所以实验选择氯化钠的添加量为0.20 g/mL。
2.4线性关系、检出限与定量下限
在优化条件下,分别测定系列浓度的萘二酚混合标准工作溶液,以萘二酚的色谱峰面积(y)为纵坐标,以相应的质量浓度(x,mg/L)为横坐标进行回归分析;分别以3倍信噪比(S/N)和10倍信噪比(S/N)计算仪器检出限(Detection limit of instrument,ILOD)和仪器定量下限(Quantification limit of instrument,ILOQ),再结合前处理浓缩倍数(约57倍)和回收率,计算得到7种萘二酚的方法检出限(Detection limit of method,MLOD)和方法定量下限(Quantitation limit of method,MLOQ)。由表1可见,7种萘二酚在50~5 000 μg/L浓度范围内线性关系良好,相关系数均不小于0.997 7;ILOD为15~52 μg/L,MLOD为0.3~1.0 μg/L,MLOQ为1.0~3.3 μg/L,表明本方法灵敏,适用于环境水样中痕量萘二酚的定量分析。
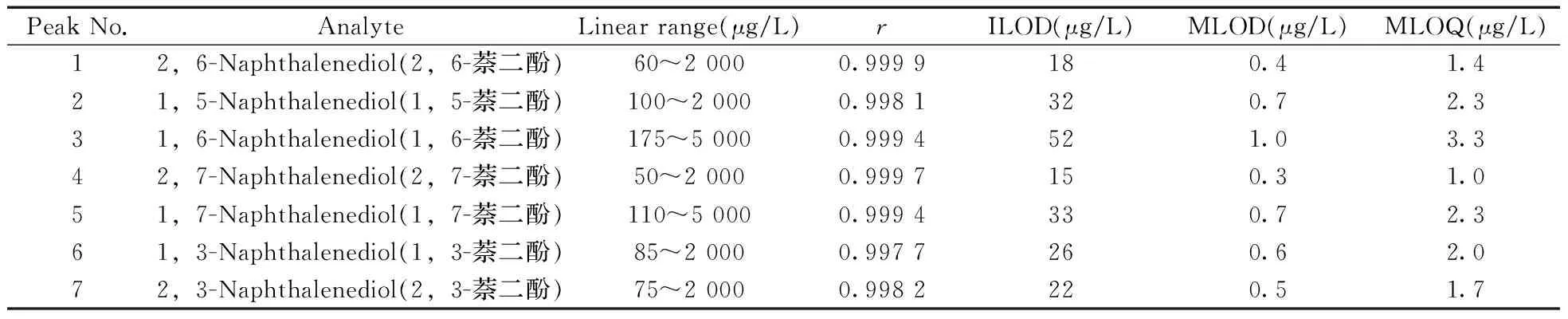
表1 7种萘二酚的线性范围、相关系数(r)、方法检出限及方法定量下限
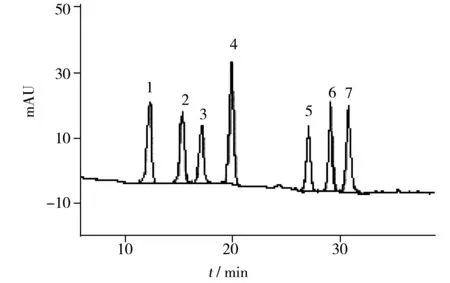
图2 阴性环境水样在2 MLOQ添加水平下的色谱图Fig.2 HPLC chromatogram of spiked(2 MLOQ)negative water sample peak 1-7 are the same as those in Table 1
2.5回收率与精密度
选取阴性环境水样,按照本实验方法进行3个加标水平(1 MLOQ,2 MLOQ,10 MLOQ)的回收率和精密度实验(n=6),图2为阴性环境水样在2 MLOQ加标水平的色谱图。数据显示,7种萘二酚在1.0~33 μg/L加标水平下,平均回收率为83.5%~103%,相对标准偏差(RSD,n=6)为1.1%~3.8%(表2),表明方法具有良好的回收率和精密度,能够满足测定要求。
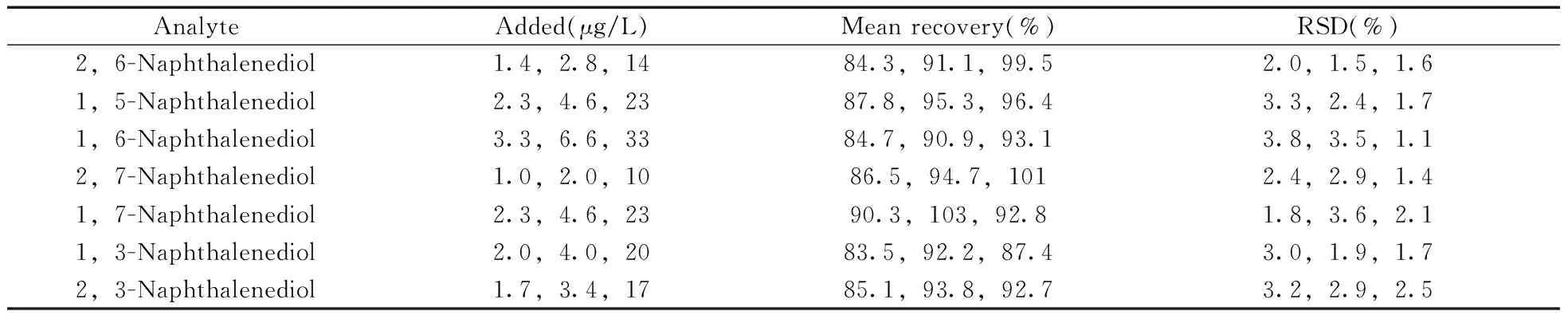
表2 回收率和精密度测定结果(n=6)
2.6方法比较与实际样品检测
将本方法与前期研究建立的测定水样中7种萘二酚的SPE-LC-MS/MS法[2]和VA-DLLME-SFO/HPLC-PAD法[3]进行对比(见表3),由表中数据可知SPE-LC-MS/MS法取样量大,富集倍数高,且灵敏度高,方法检出限可达ng/L水平,但其富集步骤较为繁琐,前处理耗时较长,检测成本较高;VA-DLLME-SFO/HPLC-PAD法和本方法取样量较少,检测仪器常规,具有简单快速、灵敏、成本低等优点。相比于VA-DLLME-SFO法,本方法的富集倍数更高,方法检出限更低,操作更简单,可以避免使用有机溶剂,从而减少了对环境和人体健康的危害。
在珠江不同河段取5个样品,并选取不同区域的3个湖水样品和5个自来水样品,按照本方法和文献[2-3]方法进行测定。结果显示13个环境水样品均未检出上述7种萘二酚。采用本方法对实际水样进行加标回收率实验,测得不同样品在2 MLOQ添加水平下的回收率为90.7%~97.8%。

表3 分析方法的比较
3 结 论
建立了环境水样中7种萘二酚的IL-DLLME/HPLC-PAD检测方法,探讨了IL-DLLME富集水样中萘二酚类化合物的条件,优选出合适的萃取剂用量、水相pH值、氯化钠添加量和涡旋分散萃取时间。方法学评价表明,该方法的回收率和精密度良好,灵敏度高,7种萘二酚的方法检出限为0.3~1.0 μg/L。方法前处理简便、富集效率高,适用于环境水样中痕量萘二酚类化合物的快速富集与检测。
[1]Chen L J,Huang J F,He M H,Lin S Y,Guo X D.Chin.J.Chromatogr.(陈立坚,黄金凤,何敏恒,林森煜,郭新东.色谱),2012,30(6):630-634.
[2]Huang J F,Lin S Y,He M H,Li X Y,Guo X D.Mod.FoodSci.Technol.(黄金凤,林森煜,何敏恒,李秀英,郭新东.现代食品科技),2012,28(5):1243-1248.
[3]Xu L Z,Li X Y,Xian Y P,He M H,Fang J,Huang J F,Guo X D.J.Instrum.Anal.(许丽珠,李秀英,冼燕萍,何敏恒,方军,黄金凤,郭新东.分析测试学报),2015,34(8):923-927.
[4]Ye C L,Liu Q L,Wang Z K.Chin.J.Anal.Lab.(叶存玲,刘清玲,王治科.分析试验室),2010,29(8):40-43.
[5]Zhang Y,Zhang Y H,Jiao B N.FoodSci.(张琰,张耀海,焦必宁.食品科学),2015,36(5):250-259.
[6]Zhang Y H,Zhang X L,Zhao Q Y,Chen W J,Wang C Q,Chen A H,Jiao B N.Chin.J.Anal.Chem.(张耀海,张雪莲,赵其阳,陈卫军,王成秋,陈爱华,焦必宁.分析化学),2014,42(10):1434-1440.
[7]Zhou Q X,Bai H H,Xie G H,Xiao J P.J.Chromatogr.A,2008,1188(2):148-153.
[8]Min J Q,Chen M L,Chen X H,Jin M C.J.Instrum.Anal.(闵剑青,陈梅兰,陈晓红,金米聪.分析测试学报),2015,34(4):438-442.
[9]Chen X H,Wei X Q,Cai M Q,Zhao Y G,Pan S D,Jin M C.J.Instrum.Anal.(陈晓红,魏晓琴,蔡美强,赵永纲,潘胜东,金米聪.分析测试学报),2014,33(6):648-652.
[10]Hou D K,Guan Y,Di X W.J.Instrum.Anal.(侯德坤,关燕,狄晓威.分析测试学报),2011,30(3):259-263.[11]Ravelo-Pérez L M,Hernandez-Borges J,Asensio-Ramos M,Rodriguez-Delgado M A.J.Chromatogr.A,2009,1216(43):7336-7345.
[12]Zhang J H,Gao H X,Peng B,Li S Q,Zhou Z Q.J.Chromatogr.A,2011,1218(38):6621-6629.
[13]Zhang L J,Chen F,Liu S W,Chen B Y,Pan C P.J.Sep.Sci.,2012,35(18):2514-2519.
[14]Guo J B,Wu H,Wang J Y,Du L M,Fu Y L.J.Instrum.Anal.(郭京波,吴昊,王婕燕,杜黎明,付云龙.分析测试学报),2012,31(12):1499-1504.
[15]Chen J,Zhou G M,Yang Y G,Qin H Y,Dou W H.J.Instrum.Anal.(陈君,周光明,杨远高,秦红英,窦文虎.分析测试学报),2013,32(3):341-345.
[16]Fan J,Fan Y C,Wang J J,Cui F L.ActaChim.Sin.(樊静,范云场,王键吉,崔凤灵.化学学报),2006,64(14):1495-1499.
[17]Zhao L M,Zhu L Y,Lee H K.J.Chromatogr.A,2002,963(1/2):239-248.
Rapid Determination of Seven Naphthalenediols in Environmental Water Samples by Ionic Liquid Dispersive Liquid-Liquid Microextraction and High Performance Liquid Chromatography
HE Dong*
(Meizhou Teachers’ Academy,Jiaying University,Meizhou514087,China)
A sensitive method based on ionic liquid dispersive liquid-liquid microextraction(IL-DLLME) and high performance liquid chromatography with diode array detector(HPLC-PDA) was developed for the preconcentration and determination of seven naphthalenediols in environmental water samples.The ionic liquid,1-butyl-3-methylimidazolium hexafluorophosphate([C4MIM][PF6]) was used as extraction agent,and 8.0 mL of aqueous phase was selected.Some important factors affecting the extraction efficiency such as amount of [C4MIM][PF6],pH value of aqueous phase,extraction time and salt concentration were optimized.The optimized conditions were as follows:150 μL[C4MIM][PF6],pH value of aqueous solution:5.0-7.0,vortex extraction time:3 min, sodium chloride:0.20 g/mL.Under the optimized conditions,the calibration curves of 7 naphthalenediols were linear in the certain concentration range with correlation coefficients not less than 0.997 7.The enrichment factor of this method was 57,and the detection limits of this method(S/N=3) were between 0.3 μg/L and 1.0 μg/L.The average recoveries of naphthalenediols at three spiked levels in negative environmental water sample ranged from 83.5% to 103% with relative standard deviations(RSD,n=6) of 1.1%-3.8%.The developed method is rapid,sensitive and environment-friendly,and is suitable for the detection of trace naphthalenediols in environmental water samples.
ionic liquid dispersive liquid-liquid microextraction(IL-DLLME);high performance liquid chromatography(HPLC);naphthalenediol;environmental water sample
2015-12-28;
2016-01-06
何东,讲师,研究方向:色谱质谱检测方法,Tel:0753-2523203,E-mail:gdone@tom.com
doi:10.3969/j.issn.1004-4957.2016.07.011
O657.72;O625.313
A
1004-4957(2016)07-0844-05
