快速响应性智能水凝胶的制备及药物缓释模拟
2016-08-19倪晓玉周颖梅徐州工程学院化学化工学院江苏徐州221018
李 梦,刘 辉,倪晓玉,王 帝,周颖梅(徐州工程学院化学化工学院,江苏 徐州 221018)
快速响应性智能水凝胶的制备及药物缓释模拟
李 梦,刘 辉,倪晓玉,王 帝,周颖梅
(徐州工程学院化学化工学院,江苏 徐州 221018)
采用紫外光照引发聚合法,以85%乙醇溶液为反应介质,不同分子量的聚乙二醇(PEG)作为致孔剂,成功合成了具有温度和pH双重敏感性的聚(N-异丙基丙烯酰胺-co-甲基丙烯酸)[P(NIPAM-co-MAA)]智能型水凝胶。利用红外光谱仪(FT-IR)、扫描电镜(SEM)测定退/溶胀率,并对凝胶进行表征,分析原料配比对凝胶性能的影响,并以乙酰水杨酸为模型药物研究了药物释放性能。结果表明,具有大孔结构的双重敏感性水凝胶能够在特定温度和pH环境下,快速平稳地释放药物,并且随着PEG分子量的增大,水凝胶的载药率和药物释放速率均得到提高。
N-异丙基丙烯酰胺;智能水凝胶;药物释放;双重敏感性
水凝胶是一类具有三维网络结构的聚合物,在水中能够吸收大量水分而溶胀,并在溶胀之后继续保持其原有结构而不被溶解。智能水凝胶对外界微小的物理化学刺激,如温度、电场、磁场、光、pH、离子强度、压力等能够感知并在响应过程中有显著的溶胀行为或响应性[1-2]。水凝胶的这种智能性使其在药物控释[3]、组织工程、活性酶的固定[4]、调光材料方面具有良好的应用前景。药物控制释放就是将药物分子与载体以物理或化学的方法结合,在体内通过扩散、渗透等控制方式,在特定部位将药物分子以适当的浓度释放出来,从而达到充分发挥药物功效的目的,控制释药可以降低传统释药模式带来的风险[5]。
自1984年有文献报道聚N-异丙酰胺具温敏性以来,聚N-异丙酰胺及其衍生物已广泛用于药物释放研究[6]。但 PNIPA 水凝胶响应速度较慢,在化学制备过程中有少量残留引发剂等杂质,使其应用受到限制[7]。另外对于一些药物如抗癌药物,要求其在胃液中的释放速度小于在肠液中的释放速度,所以 PNIPA 水凝胶的单一响应性难以达到局部准确释放药物的目的。为提高水凝胶的响应速率,可采用引入动态接枝链[8]、冷冻法、互穿聚合物网络法[9]和成孔剂法等。其中,成孔法是最为常用的改善水凝胶性能的方法之一。通过改变水凝胶孔洞的数量和尺寸,可以提高水凝胶的溶胀性能和响应速率。在水凝胶的制备方法中,紫外光照法合成凝胶是目前研究比较少并且比较新颖的合成凝胶方法,它具有条件简单,反应易于控制的优点。
本文以NIPA为单体,不同分子量的PEG作为致孔剂,并且在体系中引入了对pH敏感的甲基丙烯酸成分,赋予凝胶温度/pH双重敏感性,同时使凝胶内部形成孔洞,在提高凝胶响应速率的同时,实现靶向给药。
1 实验试剂与仪器设备
1.1 实验试剂
N-异丙基丙烯酰胺(NIPAM,AR):自制,用甲苯-正己烷(1∶7,V/V)混合溶剂重结晶;N,N'-亚甲基双丙烯酰胺(BIS-A,AR),安息香双甲醚(Doublecure BDK Lot No.86110)为光引发剂,聚乙二醇(PEG,AR),无水乙醇(AR),α-甲基丙烯酸(AR)。实验用水为自制蒸馏水。
1.2 仪器设备
SYP-Ⅲ型玻璃恒温水浴,FA1004型电子天平,DZF6020型真空干燥箱,101-1 AB 电热鼓风干燥箱,C型玻璃仪器气流烘干器, AVATAR-360型傅里叶变换红外光谱仪(FT-IR),T6紫外分光光度计,JSM-840型扫描电镜,PHSJ-3F型pH计,紫外灯(175W)。
2 凝胶制备、表征及性能
2.1 水凝胶的制备
称取180.0mg单体NIPA以及一定量的光引发剂BDK、交联剂BIS-A于5mL的玻璃具塞试管中,用微量进样器量取一定量的 MAA 注入试管并移取1.5mL 的85%无水乙醇,依次加入不同分子量的PEG,用力震荡或加热使固体全部溶解,然后编号。通入氮气5~10min以排出全部氧气(因为氧气是阻聚剂),用塞子盖紧,将试管放在距紫外灯5cm的地方进行光照聚合,反应在室温下进行。反应完全后,终止光照,得到透明状的凝胶。之后取出试管,脱模,切片,得厚度约为3mm的圆形凝胶,先用去离子水反复洗数遍,然后再将凝胶置于去离子水中浸泡,每隔12h换水1次,以除去未反应的杂质。4d后将凝胶真空烘干,依次编号为PEG 0、PEG 2000、PEG 4000和PEG 6000,置于干燥器中待用。
2.2 水凝胶的表征及性能
2.2.1 红外光谱(FT-IR)
取少量凝胶与KBr在60℃的真空干燥箱中充分干燥,取出后研磨并压片,采用傅里叶变换红外光谱仪采集样品红外光谱,振动频率范围:4000~400cm-1。
2.2.2 扫描电子显微镜(SEM)
液氮淬冷法能够较好地保持凝胶表面孔洞结构。将达到吸水平衡的水凝胶样品取出,用滤纸擦去水凝胶表面的水后放入液氮中淬冷,再转入冷冻干燥机中干燥除水。切取干燥后的小块样品表面经喷金后,用JSM-840型扫描电镜在一定加速电压下对凝胶表面进行观察。
2.2.3 差示扫描量热(DSC)
在水凝胶溶胀平衡状态下,以锋利刀片切下约30mg样品,用 DSC分析仪进行差热分析,升温速率3℃·min-1,测试其体积相转变行为和水分挥发过程。
2.2.4 水凝胶退胀动力学
将完全溶胀的凝胶称重,然后置于60℃恒温水浴锅中,每隔一定时间将水凝胶取出称重,按式(1)计算保水率(Water Retention,WR):
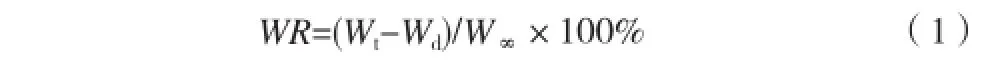
式中,Wd表示水凝胶干质量,Wt表示水凝胶于60℃水中在t时间的质量,W∞表示室温中水凝胶的质量。
2.2.5 水凝胶再溶胀动力学
将干凝胶称重后置于25℃的蒸馏水中,每隔一定时间取出水凝胶,迅速用滤纸擦拭吸取表面水分,称其质量,并按式(2)计算吸水率(Water Absorption,WA):
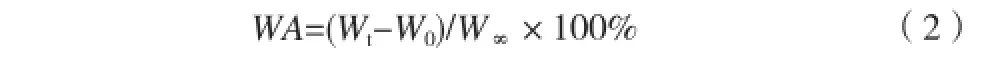
式中,W0表示水凝胶干质量,Wt表示水凝胶在25℃蒸馏水中t 时间的质量,W∞表示凝胶中水的质量。2.2.6 水凝胶pH敏感性测试
首先配置pH分别为2.0、4.0、9.0、12.0的缓冲溶液,其pH用pHS-25C数显酸度计测定并校准,用NaCl溶液将其离子强度统一调至0.10mol·kg-1,然后,取在20℃蒸馏水中溶胀平衡后的小块凝胶,分别放入上述pH缓冲溶液中,充分溶胀后,用湿的滤纸快速擦去其表面的水分并称重,直到恒重为止;最后,将其放入80℃真空烘箱中,干燥12h至恒重,并按照式(3)计算其平衡溶胀比(SR)。
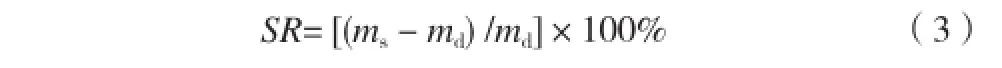
2.2.7 药物缓释实验
将干凝胶放在定量乙酰水杨酸的溶液中浸泡一昼夜,得到载药凝胶。然后将载药凝胶块分别放于不同pH值缓冲溶液中(用HCl、NaOH和NaCl等调制,以保持离子强度相等),在37℃下进行释放试验,每隔固定时间取3mL释放溶液,同时迅速补充3mL 原溶液,用紫外-可见分光光谱仪测定释放介质浓度,根据标准工作曲线计算浓度,并绘制释药率-时间曲线。
3 结果与讨论
3.1 原料组分对凝胶形成的影响
通过实验发现,光引发剂的用量应控制在0.33%以内,用量过多,容易产生气泡;反之则聚合反应缓慢甚至不聚合。交联剂应在0.67%以内,用量过多,凝胶硬度大但是很脆,易碎;用量过少,凝胶会很软,不成型。
3.2 水凝胶的红外光谱分析
加入不同分子量的PEG制得的一系列产物红外光谱见图3。
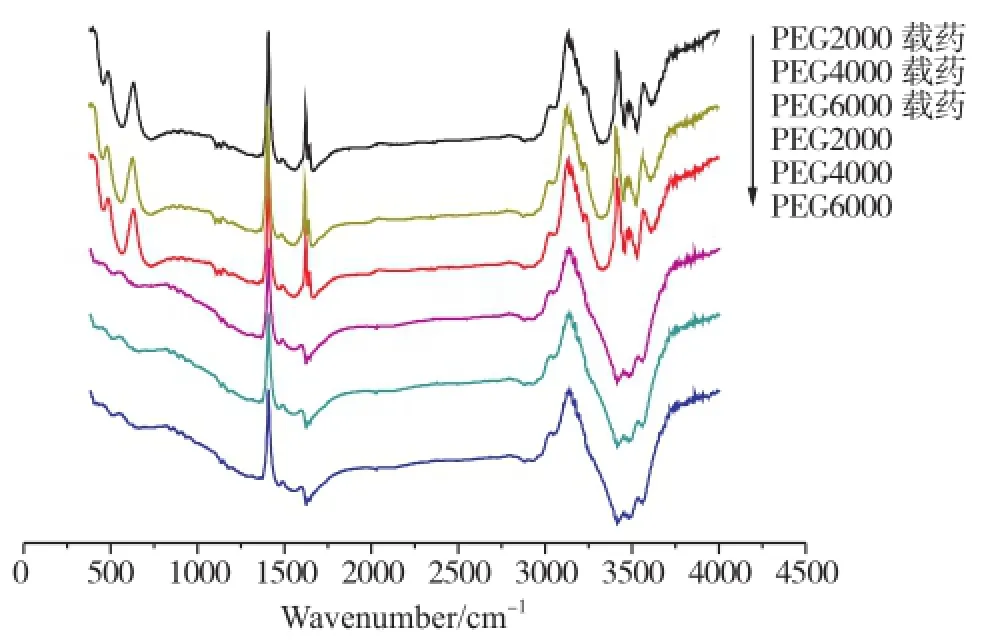
图3 水凝胶 P((NIPAM-co-MAA)及载药前后红外光谱图Fig.3 FT-IR spectra of the P(NIPAM-co-MAA) hydrogels
从图 3 可看出,凝胶中PEG分子量不同时,构成的产物红外光谱图基本相同,这说明PEG对产物的分子结构没有明显影响。1637.61 cm-1处为酰胺Ⅰ带,是C=O的吸收峰;1560.28 cm-1是酰胺Ⅱ带-NH-的面内弯曲振动峰;2973 cm-1左右的峰是甲基和次甲基的C-H振动峰;1417cm-1附近为C-H的不对称弯曲振动峰。1346cm-1附近为-CH(CH3)2中双甲基的对称振动耦合分裂峰,再加上1130.75cm-1处的C-C骨架振动吸收峰,可以证明-CH(CH3)2的存在。1271.46cm-1处为C-O的伸缩振动峰。由此说明该聚合物为N-异丙基丙烯酰胺与甲基丙烯酸的共聚物。加入吸附药物后,由图可知,3400~2500cm-1是缔合羧酸,3000cm-1左右的是苯环的C-H伸缩振动峰,2900cm-1左右是甲基中的C-H伸缩振动峰,1700cm-1左右是羧酸C=O伸缩振动峰,1740左右是苯环酯羰基振动峰,1500cm-1左右是苯环骨架振动峰,1271.46cm-1的大峰是C-O伸缩振动峰。由此说明该聚合物含有乙酰水杨酸。
3.3 多孔水凝胶的微观形貌
利用SEM观察水凝胶的内部结构如图 4 所示。随着凝胶中PEG分子量的增大,凝胶内部的孔洞逐渐增大,最后形成连续贯通的孔道。孔洞结构为水分子自由进出水凝胶提供了通道,很大程度上减小了水分子及其它水溶性物质如药物分子在水凝胶中的扩散阻力,使水凝胶具有较快响应特性。同时多孔结构也提供了巨大的容纳空间,使凝胶的负载量增加。PEG 0不含PEG,凝胶表面较为致密,只有冷冻干燥后形成的褶皱。PEG 2000从断面来看,已经有许多孔洞形成,但是孔洞较小。PEG 4000孔洞明显增大、增多,PEG 6000内部形成连续贯通的大孔。
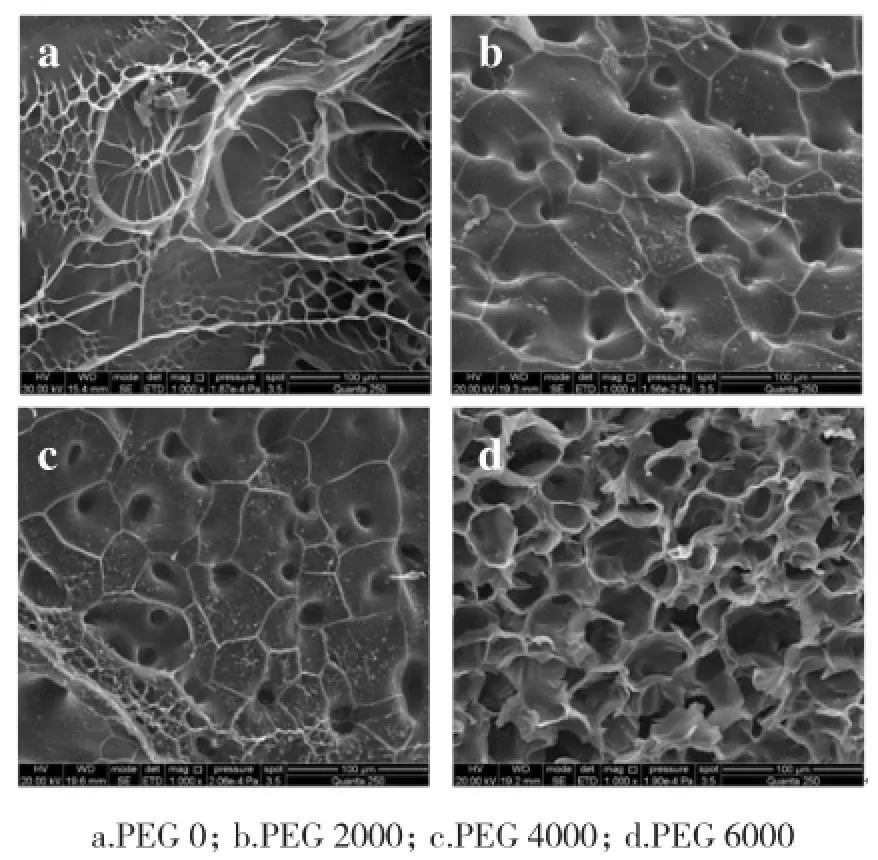
图4 P(NIPAM-co-MAA)水凝胶在干燥状态下的SEM照片Fig.4 SEM micrographs of the P(NIPAM-co-MAA) hydrogels in dry state
3.4 DSC分析
凝胶体系中存在着亲水基团和疏水基团。当温度较低时,亲水基与水分子之间存在较强的氢键作用,表现出良好的亲水性,凝胶呈现溶胀状态。当温度升高至一定值,疏水基作用开始增强,高分子链剧烈收缩并相互缠结,凝胶体积收缩,发生不连续相变同时伴随吸热现象。图5为4种水凝胶的DSC曲线,从图中可以看出,所有水凝胶的LCST都在31℃左右,并没有明显的差异。这是由于水凝胶的体积相转变是由凝胶网络中亲水基团与疏水基团的相互作用引起的,虽然添加的PEG分子量不同,但是不影响凝胶结构中2种基团的比例,即它们的化学结构相同,所以它们的LCST大致相同。由于PEG 6000、PEG 4000、PEG 2000这3种水凝胶含水量较多,所以出现的热吸收峰较宽。
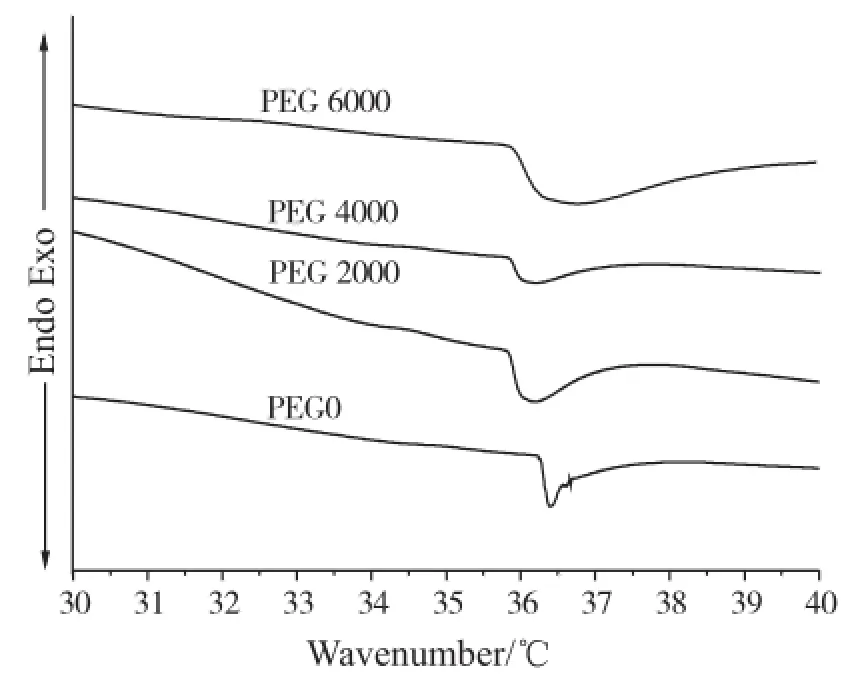
图5 P(NIPAM-co-MAA)水凝胶的DSC曲线Fig.5 DSC curves of the P(NIPAM-co-MAA) hydrogels
3.5 水凝胶去溶胀动力学
水凝胶P(NIPAM-co-MAA)的去溶胀动力学曲线如图6所示。各水凝胶在短时间内失水后达平衡状态。随着PEG分子量的增加,凝胶的退胀速率加快。根据Hoffman的水凝胶收缩模型,水凝胶的收缩从水凝胶表面开始逐渐向内部进行,水凝胶收缩后在水凝胶的表面形成疏水的致密层,阻止了水凝胶内部水的排出,因此水凝胶的收缩速率很慢。而引入孔洞结构后,水凝胶中的水可以通过孔洞透过表面致密层排出,因此水凝胶的退溶胀速率明显增加。
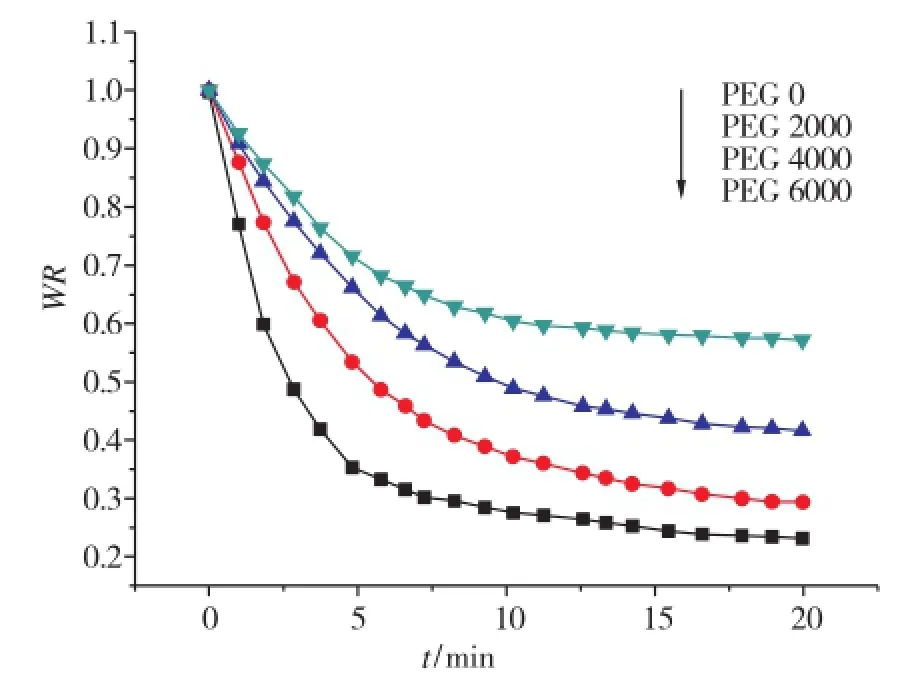
图6 P(NIPAM-co-MAA)水凝胶在60℃下的退胀率曲线Fig.6 Deswelling curves of the P(NIPAM-co-MAA) hydrogels at 60℃
3.6 水凝胶的再溶胀动力学曲线
将水凝胶P(NIPAM-co-MAA)真空干燥后放入25℃恒温水浴中,测得再溶胀动力学曲线如图7所示。由图中可以看出,具有孔洞结构的水凝胶的溶胀速率明显大于没有孔洞结构的水凝胶。随着PEG分子量的增加,水凝胶的溶胀速率逐渐增大,说明具有孔洞结构的水凝胶在相同时间内能够吸附更多的液体物质。这是因为孔道结构为水分子的快速进入提供了通道,同时内部的多孔也增大了容纳液体物质的空间,这为提高凝胶的载药量提供了依据。
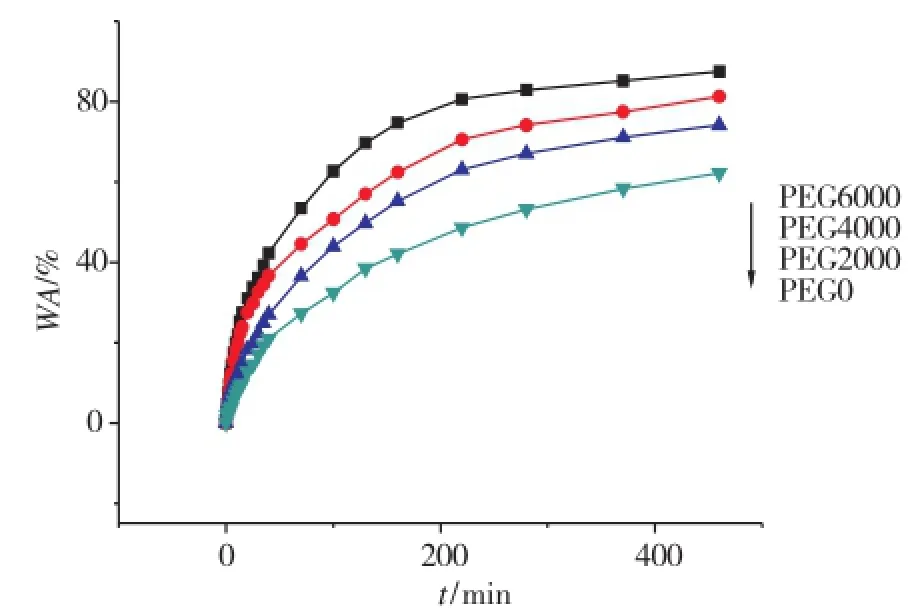
图7 P(NIPAM-co-MAA)水凝胶再溶胀率曲线Fig.7 Reswelling kinetics of the P(NIPAM-co-MAA) hydrogels
3.7 水凝胶的pH敏感性研究
图8是水凝胶在不同pH值缓冲溶液中24 h后的溶胀情况。从图中可以看出,该水凝胶为阴离子型pH敏感凝胶,并具有较高的pH敏感性。水凝胶在pH=2.0的缓冲溶液中溶胀率很小,甚至不溶胀,随着pH值的增大,水凝胶的溶胀率开始增大。当pH值增大至9.0时,溶胀率达到最高值。随着pH值继续增大,溶胀率开始降低。这是因为在酸性缓冲溶液中,由于H+浓度较高,抑制了亲水基团-COOH和酰胺基-CONH的解离,所以水凝胶的亲水性变弱。而在强碱性缓冲溶液中,可能是由于未被交联的酰胺基-CONH上的氢原子会和凝胶网络上的氧原子形成氢键,致使网络坚实而水分子不易进入,所以凝胶的溶胀率有所下降。
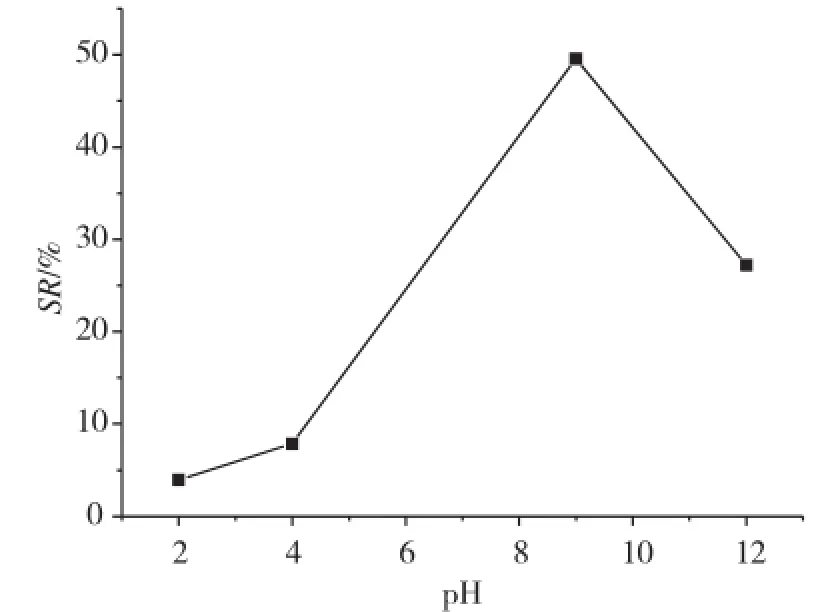
图8 P(NIPAM-co-MAA)水凝胶在20℃下的pH敏感性Fig. 8 pH sensitivity of the P(NIPAM-co-MAA)hydrogels in buffer solutions at 20℃
3.8 水凝胶药物缓释实验
考虑到药物应尽可能在人体的小肠部位释放,人体温度为36℃,因此在36℃下,分别考察凝胶在pH值为7.4和1.7时药物释放情况。
图9为乙酰水杨酸的标准工作曲线。图10为载药凝胶PEG 6000在pH值为7.4和1.7时的药物释放情况。由图可知,在两种pH值条件下,释药率均呈现先快速后缓慢,然后趋于平稳的趋势。在pH=7.4时,药物12 h的释放率约为75%,而在pH=1.4的条件下,相同时间仅释放30%。这是因为水凝胶中引入了含有羧基的甲基丙烯酸,使凝胶具有pH敏感性,当pH增大,以阴离子形式存在的羧基含量增多,电荷间的静电排斥作用使凝胶溶胀,易释放出药物小分子。说明该水凝胶有利于实现小肠部位的靶向给药。
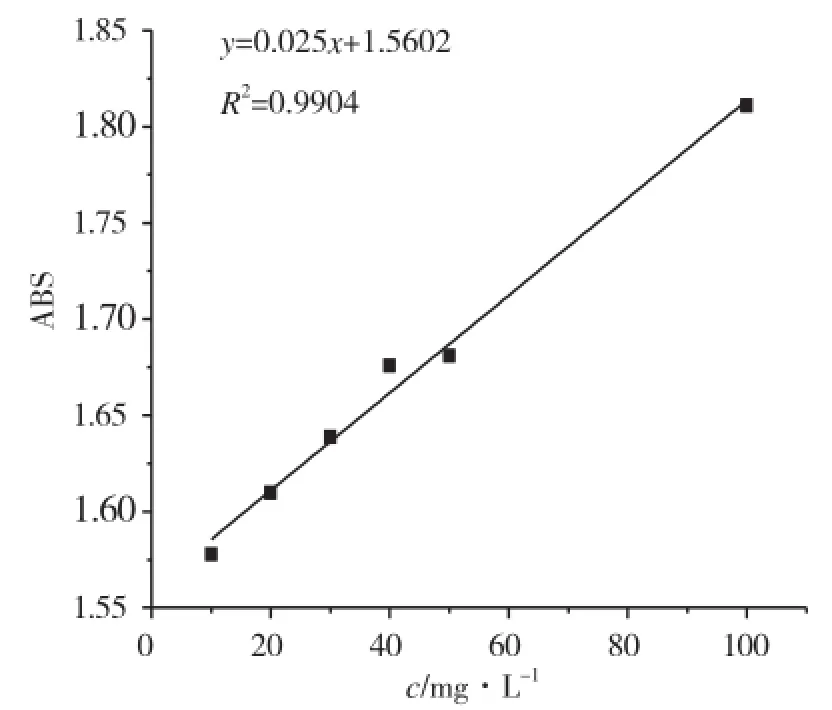
图9 乙酰水杨酸的的标准工作曲线Fig.9 Standard working curve of acetyl salicylic acid
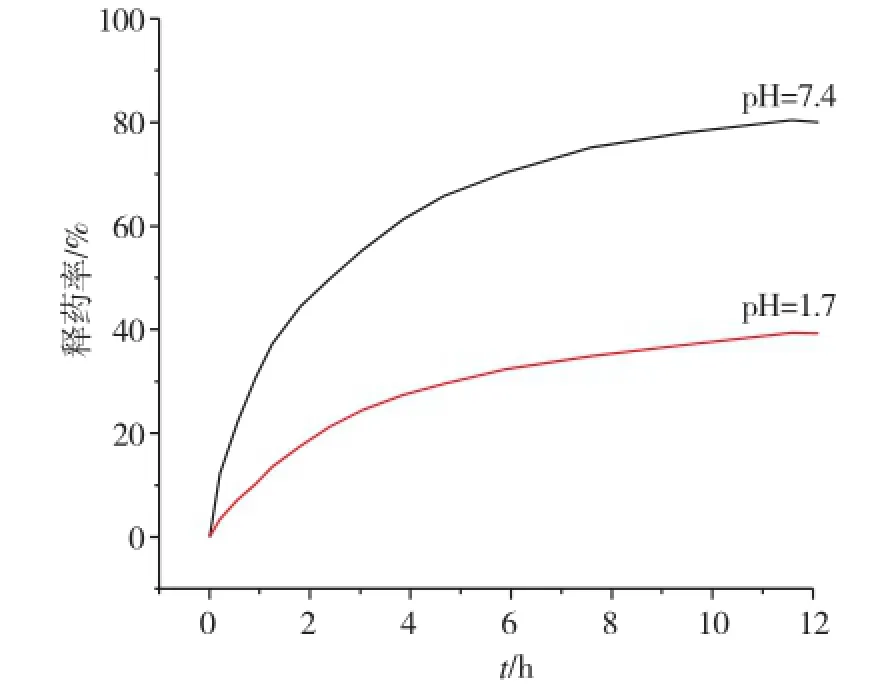
图10 不同酸度下水凝胶的药物释放曲线Fig.10 Drug release curves of the P(NIPAM-co-MAA) hydrogels at different pH environments
图11为载药水凝胶在pH=7.4的条件下释药情况。可以看出,前8h内,释药速率很快。8h之后,释药速率会逐渐变慢趋于平稳。随着PEG分子量的不断增大,凝胶释药率升高。
4 结论
采用紫外光照引发聚合法,85%乙醇溶液为反应介质,成功合成了[P(NIPAM-co-MAA)]智能型水凝胶。通过测试证明了该水凝胶具有温敏性和pH敏感性。致孔剂聚乙二醇(PEG)的引入使水凝胶内部形成多孔结构,并且随着PEG分子量的增大,孔洞逐渐增大,最后形成互为贯通的孔道,使水凝胶的载药率和释药率都得到了提高。药物释放实验发现,水凝胶的双重敏感性使其在特定温度下,能准确地在小肠部位释放药物,扩大了水凝胶在药物载体上的应用。
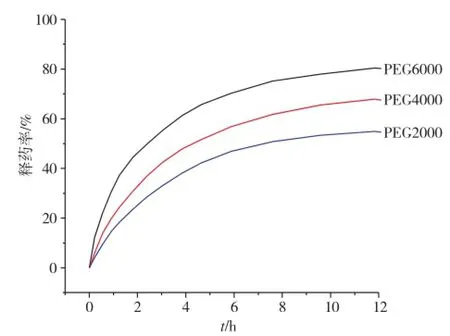
图11 水凝胶药物缓释曲线 (T=36℃, pH=7.4)Fig.11 Drug release curves of the P(NIPAM-co-MAA) hydrogels (T=36℃, pH=7.4)
[1] 毕曼,郝红,李涛,等.智能水凝胶研究最新进展[J].离子交换与吸附,2008,24(2):188-192.
[2] Dirk S. Thermo-and pH-responsive polymers in drug delivery[J]. Advanced Drug Delivery Reviews, 2006, 58(15):1655-1670.
[3] Zhuo R X, Li W. Preparation and characterization of macroporous poly(N-isopropylacrylamide) hydrogels for the controlled release of proteins[J]. Journal of Polymer Science Part A Polymer Chemistry, 2003, 41(1): 152-159.
[4] Park T G, Hoffman A S. Immobilization of Arthrobacter simplex in thermally reversible hydrogels: effect of gel hydrophobicity on steroid conversion.[J]. Biotechnology Progress, 1991(7): 383-390.
[5] 陈兆伟,陈明清,刘晓亚,等.温敏性聚(N-异丙基丙烯酰胺)水凝胶的合成与表征[J]. 功能高分子学报,2004,17(1):46-50.
[6] 刘永,崔英德,尹国强,等.药物控释用智能水凝胶研究进展[J].化工进展,2008,27(10):1593-1596.
[7] 李智慧,刘文涛,李中原,等.PNIPA/PEG多孔水凝胶的溶胀与药物释放性能[J]. 辐射研究与辐射工艺学报,2013,31(2):47-54.
[8] Chen Jun, Liu Mingzhu, Zhang Naiyan. Influence of the grafted chain length on responsive behaviors of the grafted poly (DEA-co-DMAEMA) hydrogel [J]. Sensors and Actuators B: Chemical, 2010, 149(1): 34-43.
[9] G Gallego Ferrer, M Monle ó n Pradas, J L G ó mez Ribelles. Influence of the nature of the porous confining network on the sorption, diffusion and mechanical properties of hydrogel IPNs [J]. European Polymer Journal, 2010, 46(4): 774-782.
Preparation of Rapid Responsive Intelligent Hydrogel and its Drug Release Simulation
LI Meng, LIU Hui, NI Xiao-yu, WANG Di, ZHOU Ying-mei
(School of Chemistry and Chemical Engineering, Xuzhou Institute of Technology, Xuzhou 221018, China)
In this paper, thermo and pH sensitive poly(N-isopropylacrylamide-co-methyl acrylic acid) [P(NIPAM-co-MAA)]hydrogels were successfully prepared in the 85% ethanol solution. Porous were formed in the hydrogels by adding different molecular weight of PEG. The influence of component on the characteristics of the resulting hydrogels was investigated with Fourier trans-form infrared spectroscopy (FT-IR), scanning electron microscopy(SEM) and measuring swelling ratio. Drug release properties were studied with acetyl salicylic acid as a model drug. The results showed that the intelligent hydrogels with double sensitivity and porous structure could release drug smoothly and rapidly at certain temperature or pH environment. The capacity of loading drug and drug release rate of the gels was improved with the increase of the molecular weight of PEG .
N-isopropylacrylamide; intelligent hydrogels; drug release; double sensitivity
TQ 317.3
A
1671-9905(2016)07-0013-05
徐州工程学院省级实验示范中心专项经费项目
通讯联系人:周颖梅(1975-),女,江苏徐州人,实验师,主要研究方向为功能高分子材料合成。E-mail:hgzym2012@163.com
2016-04-27
