高效液相色谱法测定氨基酸的研究进展
2016-08-19赫欣睿武中庸叶永丽高旭东陈士恩马忠仁
赫欣睿,武中庸,叶永丽,高旭东,陈士恩,马忠仁
(西北民族大学 生命科学与工程学院,甘肃 兰州 730124)
高效液相色谱法测定氨基酸的研究进展
赫欣睿,武中庸,叶永丽,高旭东,陈士恩*,马忠仁
(西北民族大学生命科学与工程学院,甘肃兰州730124)
氨基酸是构成生物体的基础物质,氨基酸分析是生命科学研究中最重要的领域之一。高效液相色谱法因分析速度快、操作简便、检测灵敏、适用范围广等优点而广泛应用于食品工业、制药工业、生命科学研究等领域。该文综述了高效液相色谱分析氨基酸的方法,包括柱后衍生法、柱前衍生法、高效阴离子交换色谱-积分脉冲安培检测法和高效液相色谱-蒸发光散射检测法。并对上述方法进行了比较,为日常的氨基酸分析提供了参考。
氨基酸;高效液相色谱法(HPLC);柱前衍生;柱后衍生;综述;研究进展
氨基酸是构成蛋白质大分子的基础物质,与生命活动息息相关。目前,自然界中发现的氨基酸约有300种,而组成生物体蛋白质的氨基酸约有20种。氨基酸分析在生物化学、食品科学、临床医学、饲料科学、化工等领域具有重要作用,因此改进和发展氨基酸的分析方法对于人类具有重要意义。高效液相色谱法(Highperformanceliquidchromatography,HPLC)是在经典液相色谱和气相色谱的基础上发展的新型分离分析技术,具有分离效能高、速度快、操作简便、检测灵敏度好、对样品适用范围广等特点,已广泛应用于各领域。高旭东等[1]建立了黄芩苷、盐酸小檗碱和大黄素的高效液相色谱检测方法。徐磊等[2]建立了高效液相色谱测定水样中 4 种痕量邻苯二甲酸酯的方法。高效液相色谱法也成为分析氨基酸的一种重要方法。目前,氨基酸的高效液相色谱分析方法主要分为间接分析和直接分析两种。间接分析可分为柱前衍生法和柱后衍生法;直接分析法包括高效液相色谱-蒸发光散射检测法和高效阴离子交换色谱-积分脉冲安培检测法。本文简要概述了氨基酸的高效液相色谱分析方法,以期为日常的氨基酸分析提供参考。
1 柱后衍生高效液相色谱法
目前氨基酸柱后衍生常用的方法主要为茚三酮和邻苯二甲醛(o-Phthaldiadehyde,OPA)法。其原理是用衍生剂将在一定色谱条件下经阳离子交换柱分离出的氨基酸衍生成具有荧光或紫外吸收的物质,再检测其光强度[3]。衍生反应发生在氨基酸与其他物质分离之后,不改变被分离组分的色谱行为,有效避免了其他物质的干扰,适合于复杂样品中氨基酸的分析检测。
1.1茚三酮柱后衍生法
1958年,Spackman等[4]首次使用茚三酮衍生离子交换色谱法分析蛋白质水解生成的氨基酸。茚三酮法是一种经典的氨基酸分析方法,可同时与一级和二级氨基酸发生衍生反应。其与一级氨基酸产生深蓝色或蓝紫色衍生物,与二级氨基酸反应产生一种黄色衍生物[5]。茚三酮法具有衍生反应迅速、产物稳定、重现性好、能检测多数氨基酸等优点,但灵敏度不高、仪器价格较高且需双波长检测等缺点也较明显。金明等[6]以茚三酮为衍生剂,采用高效液相柱后衍生法测定了鸡肉中的18种氨基酸。该方法稳定,具有较高的回收率。
1.2OPA柱后衍生法
OPA只能与伯胺发生衍生化反应,生成具有荧光的异吲哚衍生物[7]。OPA能直接与一级氨基酸反应生成荧光产物,但不能与二级氨基酸直接反应。二级氨基酸需经次氯酸钠等氧化剂氧化开环后才能与OPA衍生。OPA法具有较高的分辨率和灵敏度,检出限可达5~10pmol[8],但分析时间长、专一性强等缺点限制了其应用。师君丽等[9]采用OPA柱后衍生测定了烟草中的游离氨基酸,在样品含量范围内呈良好的线性关系,相关系数(r2)均大于0.999;在烤烟中的加标回收率为87.73%~100.02%,相对标准偏差(RSD)为2.7%~6.0%,检出限为0.13~2.00μmol/L。该方法结果准确、灵敏度较高。OPA法和茚三酮法特点比较见表1。

表1 OPA法和茚三酮法的特点比较[10-14]
2 柱前衍生反相高效液相色谱法
柱前衍生反相高效液相色谱法因操作简单、分析速度快、灵敏度高及衍生试剂种类多,近年来在许多领域得到了广泛应用。目前,柱前衍生反相高效液相色谱法分析氨基酸使用的衍生剂主要有OPA,异硫氰酸苯酯(Phenylisothiocyanate,PITC)、二硝基氟苯(2,4-Dinitrobenzene,DNFB)、9-氯甲酸芴甲酯(9-Fluorenylmethylchloroformate,FMOC-Cl)、6-氨基喹啉基-N-羟基琥珀酰亚胺基甲酸酯(6-Aminoquinolyl-N-hydroxysuccinimidylcarbamate,AQC)和丹磺酰氯(1-Dimethylaminonaphthalene-5-sulphonylchloride,Dansyl-Cl)等。
2.1OPA衍生法
OPA用于柱前衍生分析氨基酸由Cooper等[15]于1971年首次提出。图1为OPA与一级氨基酸的反应方程式。室温下,OPA在巯基乙醇环境中与一级氨基酸于1min内即可生成具有强荧光的异吲哚衍生产物[16]。OPA本身不发荧光的特性使其在色谱分离时不形成干扰峰。OPA只能与经次氯酸钠等氧化剂氧化开环后的二级氨基酸反应,也可与FMOC-Cl联用衍生二级氨基酸。该方法在分离时部分衍生物会发生裂解,造成衍生物不稳定,因此衍生后需立即进样分析[17]。OPA衍生法因样品制备简单、衍生反应迅速、灵敏度高及易于实现自动化操作等优点而成为柱前衍生反相高效液相色谱法中使用最广泛的方法之一。
杨卫等[18]采用OPA柱前衍生法测定了茶叶中的17种游离氨基酸。结果表明,17种氨基酸的保留时间和峰面积RSD分别为0.02%~0.70%和0.11%~1.15%,加标回收率为71.33%~114.75%,方法的稳定性和重现性较好。易雪静等[19]以OPA为衍生试剂,采用反相高效液相色谱法测定了东洞庭湖区野生水芹茎及叶中的氨基酸成分。结果表明:水芹的茎和叶所含15种氨基酸的总量分别为1.882g/100g和6.939g/100g,相关数据为评价野生水芹的营养价值提供了依据。该法分析速度快、结果准确,适用于水芹中氨基酸的检测。
2.2PITC衍生法
PITC能够与一级和二级氨基酸同时反应生成苯氨基硫甲酰衍生物(PTC),衍生反应速度快[20-21],灵敏度较高,以紫外检测器检测时其检出限约1pmol。该方法的衍生产物单一、稳定,冻干衍生产物在-20 ℃条件下可贮存30d,在4 ℃水溶液条件下可贮存3d,且色谱响应值无明显变化[22]。PITC具有挥发性,反应时需过量加入;但PITC具有较大毒性,衍生反应时需真空干燥装置以除去过量衍生剂[23]。即使样品中混有微量的PITC试剂也会缩短分析柱的使用时间。PITC与氨基酸的反应方程式见图2。
高向阳等[24]以PITC为衍生剂测定了贼小豆中的氨基酸种类及含量。结果表明:贼小豆中含17种氨基酸,其在1.2~250μmol/L范围内与峰面积具有良好的线性关系;加标回收率为97.03%~101.3%,RSD(n=3)为0.63%~1.9%。该方法操作简便、准确性较高、稳定性良好。张怡等[25]以PITC为柱前衍生剂,建立了反相高效液相色谱定量分析依替巴肽注射液中氨基酸组分的方法。结果表明,氨基酸在1.23~3.68mmol/L浓度范围内具有良好的线性关系,相关系数为0.999 1~0.999 6。该方法的准确性、重复性和稳定性良好,适合依替巴肽注射液中氨基酸的定量分析。
2.3DNFB衍生法
1953年,Pringle[26]采用DNFB作为衍生试剂分析了花粉蛋白中的氨基酸成分,其中DNFB能够与一、二级氨基酸同时反应生成一种稳定的衍生产物,其反应条件为避光、60 ℃[27]。该衍生产物由于含有硝基苯环而具有较强的紫外吸收,因此紫外检测时灵敏度较高,且4 ℃避光环境下可保存1个月。DNFB柱前衍生法具有分析结果较准确、重复性好、操作简便、成本低等优点。但过量衍生试剂对分析结果有一定影响,且在衍生过程中能够产生对测定结果有干扰的副产物,这限制了DNFB在氨基酸分析中的应用[28]。DNFB与氨基酸的反应方程式见图3。
赵英莲等[29]以DNFB为衍生试剂,建立了树莓中22种游离氨基酸的反相高效液相色谱检测方法。结果表明:22种氨基酸的线性系数为0.993 1~1.000 0,RSD为0.95%~4.98%,加标回收率为97.10%~103.39%,其最低检出限为0.39~2.87μg/mL,定量下限为1.29~9.47μg/mL。该方法操作简便、重复性较好。李戈等[30]以DNFB为衍生试剂,建立了柱前衍生高效液相色谱测定海巴戟中18种氨基酸的方法,平均回收率为94.2%~118.4%,RSD小于3%。该方法结果准确、重复性较好。
2.4FMOC-Cl衍生法
FMOC-Cl是一种常用的柱前衍生剂。中性溶液中,FMOC-Cl在30s内即可同时与一级和二级氨基酸反应生成具有高灵敏度的强荧光衍生物,其荧光检测灵敏度可达fmol水平[31]。以FMOC-Cl作为衍生剂衍生氨基酸时,衍生产物需迅速用戊烷萃取,萃取所得化合物稳定,室温条件下可稳定保存13d。衍生产物进行色谱分离时有良好的分辨率和分离速度,不被样品基质干扰[32]。但剩余的衍生试剂需被萃取后才能中止衍生反应[33]。试剂本身及其水解产物有荧光,检测时易产生干扰。该法现常与OPA联用。FMOC-Cl与氨基酸的反应方程式见图4。
邓樱花等[34]以FMOC-Cl为衍生剂,建立了5种常见氨基酸的反相高效液相色谱分离方法。最优化条件下完全分离了5种衍生产物,且在0.012 5~0.2mmol/L范围内,峰面积与氨基酸浓度之间的线性系数为0.992 0~0.9979。山广志等[35]以FMOC-Cl为衍生剂测定脾氨肽口服液中的17种氨基酸,其平均回收率为93.52%~112.12%,RSD(n=6)为1.0%。该方法的准确性和灵敏性较好,适用于脾氨肽口服液中游离氨基酸含量的测定。
2.5Dansyl-Cl衍生法
Dansyl-Cl于1952年由Weber首先合成,该方法是目前定量测定胱氨酸的首选方法[36]。Dansyl-Cl与氨基酸反应形成具有强荧光性的单酞化衍生物,它是测定一级、二级胺的荧光试剂,可同时检测包括亚氨基酸在内的所有氨基酸。但与组氨酸反应时能够形成多种衍生产物,与赖氨酸、酪氨酸和胱氨酸反应时能够形成双丹酰衍生产物,与其他氨基酸反应时能够形成单丹酰衍生物[37]。Dansyl-Cl与氨基酸的最适反应条件为:室温下暗反应35~50min。也有学者认为反应时间的长短主要由氨基酸的结构所决定[38]。Dansyl-Cl与组氨酸反应时会生成双峰,但次峰介于天冬氨酸和谷氨酸之间被洗脱,这种行为不干扰其余氨基酸的定量分析。Dansyl-Cl与氨基酸的衍生反应活性较差、速度较慢、重复性较差、衍生产物不稳定,需在密闭和避光的条件下反应,并且衍生完成后需立即进样分析[39]。当衍生产物的荧光被缓冲液猝灭时,需用紫外检测,但紫外检测灵敏度较低。Dansyl-Cl与氨基酸的反应方程式见图5。
闫淑莲等[40]以丹磺酰氯柱前衍生测定氨基酸,相关系数为0.998 4~0.999 4;最低检测浓度为0.206μg/L;回收率为75.1%~96.6%。该方法操作简便、灵敏度较高。
2.6AQC衍生法
1993年Cohen等[41]合成了一种全新的柱前衍生试剂AQC。AQC是近年来广泛应用的氨基酸柱前衍生试剂之一,能同时与一级和二级氨基酸发生快速、定量反应,并且过量的AQC可在1min内水解为不干扰样品测定的6-氨基喹啉(AMQ),图6为AQC与氨基酸的反应方程式。该方法具有灵敏度高、衍生物稳定、检出限低、试剂水解物干扰小、分析时间短、重现性好、适于复杂样品分析等优点[42]。当样品中含有羟基脯氨酸和羟基赖氨酸时会产生干扰定量的副产物。流动相介质中荧光量子含量差距较大时(低浓度仅为高浓度的10%),会造成洗脱时前馏分的检测灵敏度高于后馏分的灵敏度[43]。
陈蓉等[44]以AQC为衍生剂,采用柱前衍生高效液相色谱法测定了正常人血浆中17种氨基酸的含量。结果表明,其峰面积和氨基酸浓度之间具有良好的线性关系,正常人血浆中17种氨基酸的测定结果均在正常参考值范围内。该方法操作简便,具有较高的灵敏度,适用于人血浆中氨基酸浓度的检测。顾伟钢等[45]以AQC为衍生剂,建立了反相高效液相色谱测定不同方法煮制的猪肉及其汤汁中 17 种游离氨基酸的方法,结果显示,17种氨基酸衍生物在47min内得到良好分离,各氨基酸的线性范围为1~100μmol/L(胱氨酸为0.5~50μmol/L),其线性系数均大于0.99,检出限为0.29~0.96μmol/L,在汤汁中的加标回收率为86.5%~101.0%。该方法的灵敏度较高,分离效果较好,能够有效检测肉和汤汁中的氨基酸。柱前衍生法主要的衍生试剂及特点比较见表2。
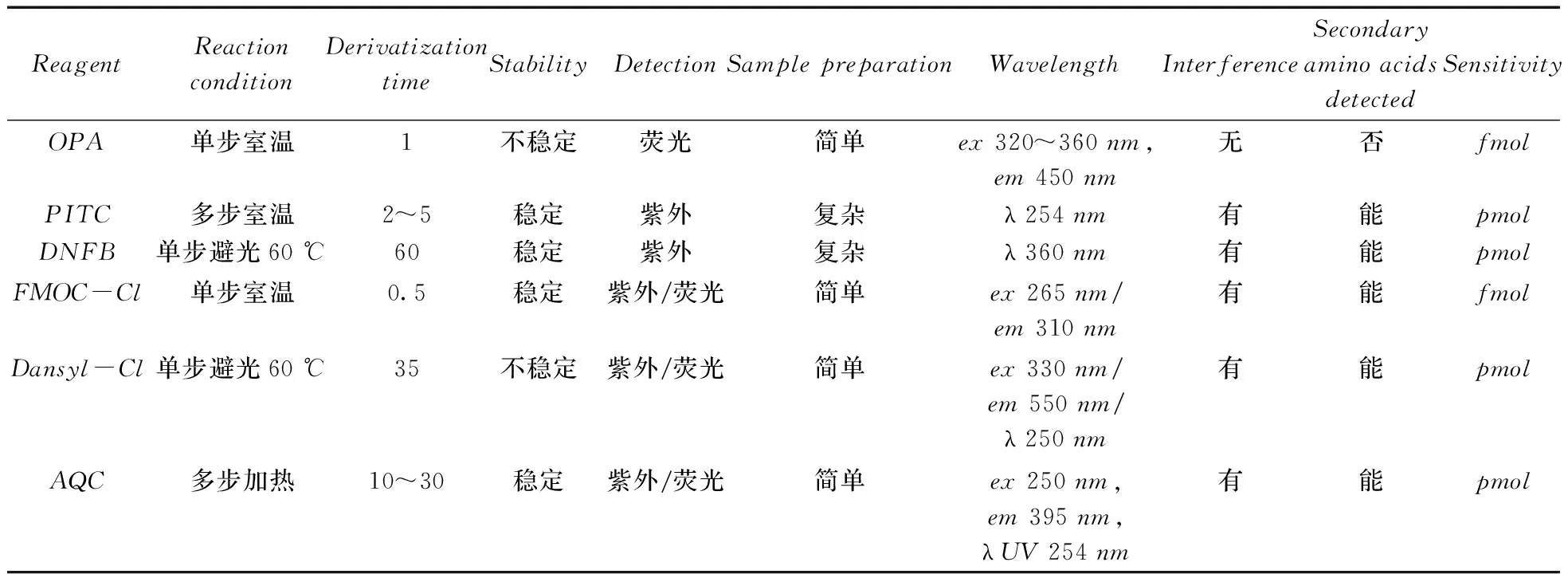
表2 柱前衍生法主要衍生试剂的特点比较
3 直接检测法
由于柱后衍生离子交换色谱法和柱前衍生高效液相色谱法均需对样品中的氨基酸进行衍生后才能检测,且衍生法操作繁杂,衍生试剂昂贵,分析成本高。因此需开发低成本、高效率的检测方法。目前使用较广泛的直接检测方法有高效阴离子交换色谱-积分脉冲安培检测法(HPAEC-IPAD)和高效液相色谱-蒸发光散射检测法(HPLC-ELSD)。
3.1HPAEC-IPAD法
1989年Welch等[46]首先提出一种新形式的脉冲安培检测法——积分脉冲安培检测法,并基于此技术采用金电极实现了对氨基酸的检测。其原理是强碱性条件下氨基酸中的羧基能够形成阴离子,而氨基酸中的氨基被施加一定电位时能在金电极表面发生氧化反应,从而实现氨基酸的分离检测。Cheng等[47]研制出“可抛弃”金电极,其对氨基酸的分析结果与普通金电极一致,且解决了普通金电极的污染问题。积分脉冲安培检测法无需衍生处理,只需将样品稀释至适当浓度即可直接进行分离检测,且灵敏度较高,检出限可达pmol~fmol级[48],操作方便,实验过程中不使用有毒物质,是一种环境友好的分析方法。
钟添华等[49]应用HPAEC-IPAD法检测珍稀药材金线莲中17种游离氨基酸,其检出限为0.23~3.37pmol,回收率为88.9%~108.0%。该方法能够有效检测金线莲中氨基酸的含量。付志红等[50]将HPAEC-IPAD法应用于寿胎丸煎煮液中18种游离氨基酸的检测,检出限为0.07~5.00μg/L,回收率为71.2%~120.9%,相对标准偏差为0.8%~10.4%。该方法操作简便、灵敏度高,能满足寿胎丸煎煮液中氨基酸的检测要求。
3.2HPLC-ELSD法
ELSD是20世纪90年代开始广泛应用的新型通用型高效液相色谱检测器,由雾化系统、退溶系统、检测系统三部分组成[51]。ELSD通用性很高,样品光学性质和物质本身结构不影响其响应,可直接检测无紫外吸收或荧光官能团的物质,故十分适合未衍生氨基酸的直接检测。但该方法的缺点是灵敏度较低,不能很好地解决痕量氨基酸的检测难题,且在检测时,响应值常与被测物浓度不呈线性关系或线性响应范围较窄,不利于定量分析。
王雅玲等[52]以HPLC-ELSD法直接测定了蛹虫草中6种未衍生游离氨基酸的含量。优化条件下,氨基酸峰面积的对数值与其质量浓度的对数值具有很好的线性关系,检出限为10.0~15.0mg/L。该法具有很好的精密度和稳定性。王玉红等[53]应用国产蒸发光散射检测器直接测定了20种未衍生基本氨基酸,其峰面积对数值和质量浓度对数值在30~300mg/L范围内呈很好的线性关系,检出限为24~100ng,样品加标回收率为90.6%~106.0%。该方法无需衍生可直接用于检测,且准确性高。
4 柱后衍生法、柱前衍生法 、HPAEC-IPAD以及HPLC-ELSD方法的比较
柱后衍生法具有反应重复性好、衍生产物稳定等优点,但检测灵敏度较低、反应时间较长、仪器价格高等不足也限制了其使用。柱前衍生法具有衍生试剂种类多、衍生时间短、操作简单、灵敏度高等优点,但衍生副产物以及衍生物水解会造成干扰。HPAEC-IPAD和HPLC-ELSD具有操作简单、能够直接检测以及无需衍生等特点,将在氨基酸分析检测中占据越来越重要的地位。表3对柱后衍生法、柱前衍生法和直接检测法的分析特性进行了对比。

表3 柱后衍生法、柱前衍生法 、HPAEC-IPAD及HPLC-ELSD方法的比较
5 结 论
氨基酸分析在众多领域具有重要作用,随着科技的发展,氨基酸分析技术的应用将愈加广泛。高效液相色谱法作为氨基酸分析技术中的重要一员,其应用也将得到人们的更加重视。本文综述了高效液相色谱法分析氨基酸的方法(柱后衍生法、柱前衍生法、高效阴离子交换色谱-积分脉冲安培检测法和高效液相色谱-蒸发光散射检测法),并对各方法进行了比较,为日常的氨基酸分析提供了参考。
[1]GaoXD,ShiYQ,ChenSE,HaoBC,LiangJP.J.Int.Pharm.Res.(高旭东,师永清,陈士恩,郝宝成,梁剑平.国际药学研究杂志),2015,42(3):409-412.
[2]XuL,XiaN.J.Instrum.Anal.(徐磊,夏宁.分析测试学报),2011,30(5):558-561.
[3]BaoHX,DaiXH.Chem.Reagents(暴海霞,戴新华.化学试剂),2013,35(7):577-584.
[4]MooreS,SpackmanDH,SteinWH.Anal.Chem.,1958,30(7):1185-1190.
[5]LiuHW.Amino Acids and Biotic Resources(刘惠文.氨基酸和生物资源),1995,17(2):50-55.
[6]JinM,NiuHL,YuanH,ZhaoY.Food Ferment.Ind.(金明,牛宏亮,袁辉,赵煜.食品与发酵工业),2014,40(1):212-215.
[7]FernstromMH,FernstromJD.J.Life Sci.,1981,29:2119-2130.
[8]DongMW,GantJR.J.Chromatogr.A,1985,327:17-25.
[9]ShiJL,LiY,PangT,SongCM,WuYP,LiuYH.Chin.J.Anal.Lab.(师君丽,李勇,逄涛,宋春满,吴玉萍,刘彦红.分析试验室),2013,32(5) :57-60.
[10]GaoEZ,YuXH,LiuT,YuKX,YuZG.Chin.J.Pharm.Anal.(高恩泽,于小涵,刘婷,于孔宪,于治国.药物分析杂志),2014,34(5) :747-759.
[11]YangCX.Food Sci.(杨春霞.食品科学),2011,32(18):239-242.
[12]ZhangT,WuHY,ZhangW,HanNY.Chin.Pharm.(张彤,武晗燕,张伟,韩南银.中国药房),2013,24(25):2377-2379.
[13]YuH,MouSF.Chin.J.Anal.Chem.(于泓,牟世芬.分析化学),2005,33(3):398-404.
[14]LiuT,JiangJD,LiuN.Sci.Technol.Food Ind.(刘婷,姜金斗,刘宁.食品工业科技),2007,28(7):207-209.[15]CooperJDH,OgdenG,MclntoshJ,TurnellDC.Anal.Biochem.,1984,142:98-102.
[16]PereiraV,PontesM,CamaraJS,MarquesJC.J.Chromatogr.A,2008,1189:435-443.
[17]Rigobello-MasiniM,PenteadoJCP,LiriaCW,MirandaMTM,MasiniJC.Anal.Chim.Acta,2008,628(2):123-132.
[18]YangW,XianS,LiDX,WanXC.J.Tea Sci.(杨卫,鲜殊,李大祥,宛晓春.茶叶科学),2011,31(3):211-217.[19]YiXJ,ZhouSR,DengLQ,XuZH.Appl.Chem.Ind.(易雪静,周石柔,邓兰青,徐中海.应用化工),2015,44(9):1751-1753.
[20]Fernandez-FigaresI,RodriguezLC,Gonzalez-CasadoA.J.Chromatogr.B,2004,799(1):73-79.
[21]MoraR,BerndtKD,TsaiH,MeredithSC.Anal.Biochem.,1988,172:368-376.
[22]ScholzeH.J.Chromatogr.A,1985,350:453-460.
[23]DaveyJF,ErsserRS.J.Chromatogr.B,1990,528:9-23.
[24]GaoXY,YouXX,HanS.Food Sci.Technol.(高向阳,游新侠,韩帅.食品科技),2013,38(9):262-266.
[25]ZhangY,SunJH,YeRH,PengL,WuDK.J.Instrum.Anal.(张怡,孙晋红,叶汝汉,彭蕾,伍迪科.分析测试学报),2013,32(8):1003-1006.
[26]PringleRB.J.Allergy,1953,24(3):251-257.
[27]LüYG,ZhangH,MengXY,ChenNF.Cereals and Oils(吕莹果,张晖,孟祥勇,陈能飞.粮食与油脂),2009,37:347-350.
[28]MortonRC,GerberGE.Anal.Biochem.,1988,170:220-227.
[29]ZhaoYL,MouDH,LiY.Food Sci.(赵英莲,牟德华,李艳.食品科学),2015,36(6):178-182.
[30]LiG,ZhaoJL.J.Tradit.Chin.Med.Chin.(李戈,赵俊凌.中华中医药杂志),2015,30(2):524-526.
[31]EinarssonS,JosefssonB,LagerkvistS.J.Chromatogr.A,1983,282:609-618.
[32]Lopez-CevantesJ,Sanchez-MachadoDI,Rosas-RodriguezJA.J.Chromatogr.A,2006,1105(1/2):106-110.[33]MillerEJ,NarkatesAJ,NiemannMA.Anal.Biochem.,1990,190:92-97.
[34]DengYH,WangZ,ChenGX,SuMW.Guangzhou Chem.Ind.(邓樱花,王舟,陈功轩,苏明伟.广州化工),2013,41(6):110-112.
[35]ShanGZ,ZuoLM,YuL,ZhangT,ZhangBW.Chin.J.New Drugs(山广志,左利民,余立,张彤,张博文.中国新药杂志),2013,22(11):1255-1258.
[36]FurstP,PollackL,GraserTA,GodelH,StehleP.J.Chromatogr.A,1990,499:557-569.
[37]McClungG,FrankenbergerJrWT.J.Liq.Chromatogr.,1988,11(3):613-646.
[38]WiedmeierVT,PorterfieldSP,HendrichCE.J.Chromatogr.B,1982,231:410-417.
[39]TapuhiY,MillerN,KargerBL.J.Chromatogr.A,1981,205:325-337.
[40]YanSL,ZhaoG,LiuYL.J.Capital Univ.Med.Sci.(闫淑莲,赵光,刘永利.首都医科大学学报),2003,24(3):338-339.
[41]CohenSA,MichauclDP.Anal.Biochem.,1993,211:279-287.
[42]SunYC,XuXZ,XuYL,TanZJ,MouZB,DuNN.Chin.J.Chromatogr.(孙言春,许宪祝,徐衍岭,谭志军,牟振波,杜宁宁.色谱),2013,(3):275-280.
[43]EngstroemA,AnderssonPE,JosefssonB.Anal.Chem.,1995,67:3018-3022.
[44]ChenR,ZhouL,DongJ,ZhangH,MiuLY.Herald Med.(陈蓉,周莉,董吉,张华,缪丽燕.医药导报),2013,32(3):310-312.
[45]GuWG,ZhangJJ,XinM,YaoYJ,JiR,LüBB,ChenJC.Chin.J.Chromatogr.(顾伟钢,张进杰,辛梅,姚燕佳,纪蓉,吕兵兵,陈健初.色谱),2011,29(10):1041-1045.
[46]WelchLE,LaCourseWR,MeadJDA,JohnsonDC,TerryH.Anal.Chem.,1989,61:555-559.
[47]ChengJ,JandikP,AvdalovicN.Anal.Chem.,2003,75:572-579.
[48]KasparK,DettmerK,GronwaldW,OefnerPJ.J.Chromatogr.B,2008,870(2):222-232.
[49]ZhongTH,HuangLY,FangJ.Anal.Test.Technol.Instrum.(钟添华,黄丽英,房静.分析测试技术与仪器),2011,17(2):74-78.
[50]FuZH,XuL,XiaJQ,MaoXJ,WanYQ.J.Anal.Sci.(付志红,徐琳,夏建秋,毛雪金,万益群.分析科学学报),2015,31(1):33-37.
[51]YuSL.The Method and Application of HPLC.Beijing:ChemicalIndustryPress(于世林.高效液相色谱方法及应用.北京:化学工业出版社),2000:39.
[52]WangYL,DaiLL,MaF,ZhaoYN,LiTT,SunLJ.J.Instrum.Anal.(王雅玲,代玲玲,马堃,赵轶男,李婷婷,孙力军.分析测试学报),2010,29(10):1091-1094.
[53]WangYH,ShenKY,LiP.Chin.J.Chromatogr.(王玉红,申克宇,李鹏.色谱),2011,29(9):908-911.
Research Progress on Detection of Amino Acids by High Performance Liquid Chromatography
HE Xin-rui,WU Zhong-yong,YE Yong-li,GAO Xu-dong,CHEN Shi-en*,MA Zhong-ren
(CollegeofLifeScienceandEngineering,NorthwestUniversityforNationalities,Lanzhou730124,China)
Aminoacidisafundamentalmaterialthatorganismsneed,anditsanalysisisoneofthemostimportanttechnologiesinlifesciences.Owningtheadvantagesofrapidness,easyoperation,highdetectionsensitivityandwideapplication,thehighperformanceliquidchromatography(HPLC)iswidelyusedinmanyfields,suchasfoodindustry,pharmaceuticalindustryandlifescienceresearch.Inthisarticle,theHPLCanalyticalmethodsofaminoacids,includingpost-columnderivatization,pre-columnderivatization,highperformanceanionexchangechromatographywithintegratedpulsedamperometricdetectionandHPLCwithevaporativelightscatteringdetection,arereviewed.Thecharacteristicsofthesemethodsarecompared,whichcouldprovideareferencefortherelatedresearchanalysis.
aminoacids;highperformanceliquidchromatography(HPLC);pre-columnderivatization;post-columnderivatization;review;researchprogress
2015-11-24;
2015-12-18
教育部动物医学生物工程创新团队(IRT13091);国家科技支撑计划项目(2015BAD29B05)
陈士恩,教授,研究方向:食品安全与品质控制,Tel:0931-4512986,E-mail:chshien@163.com
doi:10.3969/j.issn.1004-4957.2016.07.026
O657.72;O629.7
A
1004-4957(2016)07-0922-07
