分散液液微萃取技术的研究进展
2016-08-19曹江平邸宏伟周继梅梁永锋解启龙
曹江平,邸宏伟,周继梅,梁永锋,解启龙
(1.宁夏师范学院 化学化工学院,宁夏 固原 756000;2.宁夏师范学院 六盘山资源工程技术研究中心,宁夏 固原 756000;3.中国科学院 山西煤炭化学研究所 煤转化国家重点实验室,山西 太原 030001)
分散液液微萃取技术的研究进展
曹江平1,2*,邸宏伟1,2,周继梅1,2,梁永锋1,2,解启龙3
(1.宁夏师范学院化学化工学院,宁夏固原756000;2.宁夏师范学院六盘山资源工程技术研究中心,宁夏固原756000;3.中国科学院山西煤炭化学研究所煤转化国家重点实验室,山西太原030001)
分散液液微萃取是一种基于传统液液萃取的新型样品前处理技术。该文以分散液液微萃取技术中萃取剂的筛选为出发点,综述了低密度萃取剂、辅助萃取剂、反萃取剂和离子液体等低毒性萃取剂在该技术中的应用,以及应用自制装置、溶剂去乳化、悬浮萃取剂固化,辅助萃取,反萃取和离子液体-分散液液微萃取等萃取模式;并简要评述了该技术与液液萃取、固相萃取、固相微萃取、分散固相萃取、基质固相分散萃取、超临界流体萃取、超声辅助萃取等其他样品前处理技术的联用特性。
分散液液微萃取;萃取剂;综述
分散液液微萃取技术(Dispersiveliquid-liquidmicroextraction,DLLME)是由Assadi等[1]提出的一种液相微萃取技术,相当于微型化的液-液萃取(Liquid-liquidmicroextraction,LLE)[2]。与传统液液萃取相比,该方法由于加入分散剂,提高了有机萃取剂在水相中的分散,增加了水相和萃取剂之间的接触表面,使目标化合物在样品溶液和萃取剂之间实现了快速转移[3-5]。该方法集萃取及富集于一体,有机溶剂用量少,萃取时间短,具有很高的萃取效率和富集倍数[6-8]。
微量萃取剂的使用是该技术的亮点,因此萃取剂的选择成为关键。在DLLME研究初期,使用的萃取剂多为密度大于水的含氯有机化合物(如C6H5Cl,CCl4,CHCl3,C2H2Cl4,C2HCl3等)[1,9-13],使用锥底离心管即可完成萃取操作,经萃取并离心后,含有目标化合物的萃取剂相沉积于离心管底部,易于收集和后续处理,操作简捷,成本低。但这些萃取剂毒性大,挥发性强,易对操作人员和环境造成较大毒害,且主要用于水中分析物的分离分析,对于基质较为复杂的食品、生物、药物等样品的萃取效率低,选择性差。因此,探索低毒萃取剂,研究该技术与其他样品前处理技术的联用,减少有机溶剂用量,提高样品净化和富集效率成为近年来该技术的主要研究方向。本文以此为着眼点,对近年来DLLME萃取剂的筛选以及该技术与其他样品前处理技术的联用进行了评述。
1 DLLME萃取剂的筛选
按照萃取剂的性质,分别讨论了低密度萃取剂、辅助萃取剂、反萃取剂及离子液体等低毒性萃取剂在分散液液微萃取技术中的应用,以及应用自制装置、溶剂去乳化、悬浮萃取剂固化、辅助萃取、反萃取和离子液体-分散液液微萃取等相关的萃取模式及其在分离分析领域的研究和应用。
1.1低密度萃取剂(Low density solvent,LDS)
为了克服传统DLLME广泛应用密度大于水且毒性强的含氯萃取剂的缺点,近年来,低密度萃取剂甲苯[14-16]、己烷[17-18]、正辛醇[19]、十二醇[20]在DLLME中得到了研究和应用,由于低密度萃取剂多为低毒或无毒溶剂,环境友好,且对操作人员的健康危害较小,适用于食品、生物、药物等样品以及萃取过程中易产生固体沉淀的样品的分离分析,一些相关的萃取模式也得到了极大发展。
1.1.1应用自制装置低密度萃取剂虽毒性低,但难以直接应用于传统DLLME萃取装置,为解决该问题,一些自制的特殊萃取装置应运而生。Farajzadeh等[17]自制顶部细颈离心管,以环己烷(相对密度0.78)为萃取剂,DLLME萃取了水中3种有机磷农药,其操作与传统DLLME的区别是萃取完成并离心后,从自制离心管底部的橡胶隔膜向离心管中加入一定体积的水,使液面上升至萃取液达到离心管顶部细颈处,收集萃取液,结合GC-FID和GC-MS进行后续分析测定,方法的富集倍数为100~150倍,检出限(LOD)为10~100 000μg/L(GC-FID)和0.01~1μg/L(GC-MS),加标回收率为68%~105%。Zhang等[19]自制的萃取装置类似于在普通圆底烧瓶的颈部附近加开一个毛细管通道,并配有磁力搅拌装置,萃取完成后,静置使两相分离,倾斜装置使毛细管通道竖直向上,从烧瓶口加入一定量的水,抬高液面收集萃取液进行后续处理,以正辛醇(相对密度0.83)为萃取剂两步DLLME萃取并结合HPLC测定水中的5种酚类化合物,方法富集倍数为296~954倍,LOD为0.3~3.0ng/mL,加标回收率93%~103%。上述萃取装置收集萃取剂的原理相近,均在萃取完成后向装置中加水,使萃取剂进入萃取装置的毛细结构中进行收集,操作繁琐,且装置的结构复杂,难于推广应用。Maya等[21]以正辛醇为萃取剂,用注射器自动DLLME萃取装置结合紫外分光光度计测定水和软饮料中的罗丹明B,方法富集倍数为23倍,LOD为0.007mg/L,加标回收率为101%~104%。Cao等[22]用塑料滴管作萃取装置,吸入一定量的样品溶液,加入萃取剂后将其置入具塞离心管中完成萃取,离心后可方便吸取位于细颈部位的萃取相,以正辛醇作萃取剂,建立了DLLME-HPLC-UV测定PC水杯中双酚A迁移量的方法,富集倍数为31倍,LOD为0.2μg/L,加标回收率为82%~98%。这两种方法比前者操作有所简化,且萃取装置可商品化,适合于推广使用。应用低密度萃取剂特殊装置的操作过程如图1所示,表1列出了低密度萃取剂在DLLME中的成功应用。
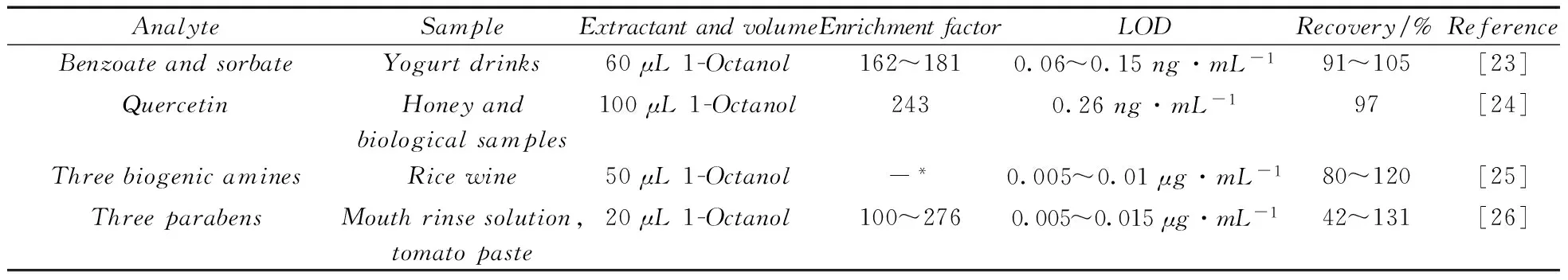
表1 低密度萃取剂分散液液微萃取的应用
(续表1)
-:nodata
1.1.2溶剂去乳化(Solventdemulsification,SD) 该方法是对LDS-DLLME的改进,区别在于完成萃取后不离心,而是向乳化体系中加入第4种溶剂(去乳化剂)以促使萃取剂液滴聚集,从而实现有机相与水相的分离。Chen等[29]将该法用于水中氨基甲酸酯农药的提取,用5mL容量瓶为萃取装置,结合GC-MS测定了湖水中4种氨基甲酸酯农药含量,LOD为0.001~0.050ng/mL,加标回收率为94%~104%。Guo等[30]建立了LDS-SD-DLLME-GC-MS方法提取和测定环境水样中的16种多环芳烃的方法,用5mL塑料滴管作萃取装置,并与传统DLLME,LDS-DLLME,USAEME(超声辅助乳化微萃取) 3种液相微萃取技术进行对比,效果良好,LOD为3.7~39.1ng/L,加标回收率为67%~95%。该方法具有操作简化,萃取完成后无需离心即可实现分离,以及无需特殊的萃取装置等优点,有望成为DLLME技术的一个很有潜力的开发方向。表2简要总结了近年来该技术在样品处理及分析检测中的应用。

表2 低密度萃取剂-溶剂去乳化分散液液微萃取的应用
1.1.3悬浮萃取剂固化(Solidificationofafloatingorganicdrop,SFO)SFO方法是为解决LDS-DLLME萃取装置问题而出现的一种DLLME方法,该法选择熔点较低(10~30 ℃)的低密度萃取剂,在传统分散液液微萃取使用的离心管中完成萃取后,将萃取装置置于冰浴中使萃取相固化,收集固化的萃取相熔化进行后续测定分析。Leong等[36]以十一醇为萃取剂,用10mL普通离心管分析测定了水中5种卤代烃,方法富集倍数为174~246倍,LOD为0.003~0.05μg/L(GC/ECD)和0.005~0.047μg/L(GC-MS),加标回收率为81%~102%。Asadollahi等[37]以十一醇为萃取剂在27mL小瓶中萃取,并结合电热原子吸收分光光度法测定了水中痕量钒,方法富集倍数为184倍,LOD为7ng/L,加标回收率为95%~105%。Suh等[38]以十一醇为萃取剂,利用15mL试管微萃取装置,建立了SFO-DLLME-HPLC-FLD测定人体血液中2种抗抑郁药的方法,富集倍数为98倍,LOD为0.75ng/mL,加标回收率为60%~66%。该方法使用低密度萃取剂,但用传统DLLME萃取装置即可完成萃取,无疑是DLLME适用性的极大拓展。表3简要总结了该技术近年来在分离分析中的应用。

表3 悬浮萃取剂固化分散液液微萃取的应用
(续表3)
-:nodata
1.2辅助萃取剂(Auxiliary solvent,AS)
AS方法是基于四元组分的萃取模式,除传统DLLME中的水溶液、萃取剂和分散剂外,还引入了第4种成分——辅助萃取剂。辅助萃取剂需满足:密度大于水;与萃取剂和分散剂的混溶性能好;水中溶解度小;不影响萃取剂对目标化合物的萃取效率且不影响分析物的色谱分离分析。这种助剂在萃取过程的主要作用是调节萃取相的密度,其与萃取剂融合后形成密度大于水的萃取相,在萃取完成并离心后能使萃取相沉积于离心管底部,解决了低毒性的轻质萃取剂在萃取过程需引入复杂萃取装置的问题,相比于传统DLLME,有机溶剂的用量大大减少,适用于各类样品的分离分析,且能有效提高萃取效率,是DLLME技术的另一个很有前景的发展方向。Farajzadeh等[51]建立了DLLME-HPLC-DAD测定水中3种抗氧化剂的方法,为减少CCl4用量,尝试使用低毒性低密度的萃取剂,在CCl4(萃取剂)中加入低毒性甲苯(辅助萃取剂),发现加入甲苯量小于70%时,对其中2种抗氧化剂的萃取效果良好。Kocúrová等[52]用145μL甲苯(萃取剂)和145μLCCl4(辅助萃取剂)混合液为萃取剂,采用类似传统DLLME的操作过程萃取了水溶液中Au3+,并结合UV-Vis和GFAAS测定了药物样品中纳米金的含量,方法线性范围分别为0.39~4.7mg/L(UV-Vis)和0.5~39.4μg/L(GFAAS),样品加标回收率在95%以上。表4总结了近年来该技术的部分应用。

表4 辅助萃取剂-分散液液微萃取的应用
-:nodata
1.3反萃取剂(Back extraction solvent,BES)
由于食品、药物以及生物样品的基质较复杂,采用普通DLLME处理后得到的样品往往含有较多杂质,使测定出现干扰或者假阳性。此外,检测仪器对上机样品的基质也有限制,如将有机溶剂注入毛细管电泳仪,易造成其断流,不能正常分离分析;发展成熟的高效液相色谱仪,也要求样品的基质易与流动相混溶。为解决上述应用问题,有研究者提出基于反萃取的DLLME萃取方法,即在DLLME萃取完成后,将极性分析物从有机溶剂中反萃取到水溶液中,进而做后续的检测分析,从而可在一定程度上解决样品的基质效应,这极大拓展了样品对检测仪器的适用性。Melwanki等[57]最早使用这种方法提取了水样品中的瘦肉精,并结合HPLC测定其含量。先用四氯乙烯为萃取剂完成DLLME,将分析物从四氯乙烯中反萃取到1%甲酸水溶液中进行后续分析测定,方法的富集倍数为175倍,LOD为4.9ng/mL,加标回收率达97%以上。孙建芝等[58]建立了分散液液微萃取-反相液液微萃取-扫集-胶束电动色谱法测定红酒中3种氯酚类物质的方法,先以正己烷为萃取剂经DLLME将3种氯酚从样品中萃取到正己烷中,然后加入0.16mol/LNaOH水溶液将分析物反萃取到水相进行后续分析测定,方法的富集倍数为991~1 812倍,LOD为0.035~0.114μg/L,加标回收率为75%~105%。经反萃取得到的水溶液样品符合毛细管电泳仪对样品基质的要求,实现了很好的实验效果。表5对近年来该技术在分析检测中的应用进行了总结。

表5 分散液液微萃取-反萃取的应用
-:nodata
1.4离子液体(Ionic liquid,IL)
离子液体是近室温下呈现液态、完全由阴阳离子所组成的盐,亦称为低温熔融盐,其本身具有许多传统溶剂所无法比拟的优点,作为绿色溶剂应用于有机及高分子物质的合成和绿色分析领域,受到越来越多化学工作者的关注[59,61,63-66]。常见的离子液体阳离子有季铵盐离子、咪唑盐离子和吡咯盐离子等,离子液体阴离子有卤素离子、四氟硼酸根离子、六氟磷酸根离子等。离子液体作萃取剂有以下优点:离子液体无味、不燃,蒸汽压极低,可减少因挥发而产生的环境污染问题;离子液体对有机和无机物均有良好的溶解性能;可操作温度范围宽(-40~300 ℃),具有良好的热稳定性和化学稳定性,易与其它物质分离,可循环利用。使用离子液体作为DLLME萃取剂的优点为:可根据分析物的理化性质设计合成具有一定结构的离子液体,以提高DLLME的选择性以及对分析物的萃取效率。将离子液体应用于DLLME技术中极大拓展了该技术的应用范围,目前发展起来的萃取模式包括:离子液体-分散液液微萃取(IL-DLLME)[64],温控辅助(Temperaturecontrolled-assisted,TCA)[67-68]、超声辅助(Ultrasoundassisted,UA)[65,69-70]、微波辅助(Microwave-assisted,MA)[71]、涡旋辅助(Vortex-assisted,VA)-分散液液微萃取[72]、离子液体-分散液液微萃取-反萃取(IL-DLLME-BE)[59,61,63]、原位离子液体-分散液液微萃取(insituIL-DLLME)[66]。
Zhou等[67]最早将离子液体用于DLLME,并建立了TCA-IL-DLLME-HPLC-UV测定环境水样中有机磷杀虫剂的方法,以[C6mim][PF6]为萃取剂,萃取装置与传统DLLME装置相同。方法取得了很好的萃取效果,其富集倍数为50倍,LOD为0.17~0.29ng/mL,加标回收率为88%~104%。张耀海等[68]建立了QuEChERS-温控离子液体分散液液微萃取结合高效液相色谱法快速检测脐橙中5种染色剂残留的分析方法,以[C8mim][PF6]为萃取剂,QuEChERS前处理的净化液为分散剂进行DLLME,方法的富集倍数为7~9倍,LOD为0.5~1.2μg/kg,样品加标回收率为70%~94%。这种方法使用“绿色溶剂”离子液体为萃取剂,降低了对环境的污染,必将成为DLLME很有前景的发展方向。表6总结了近年来该技术的部分应用。
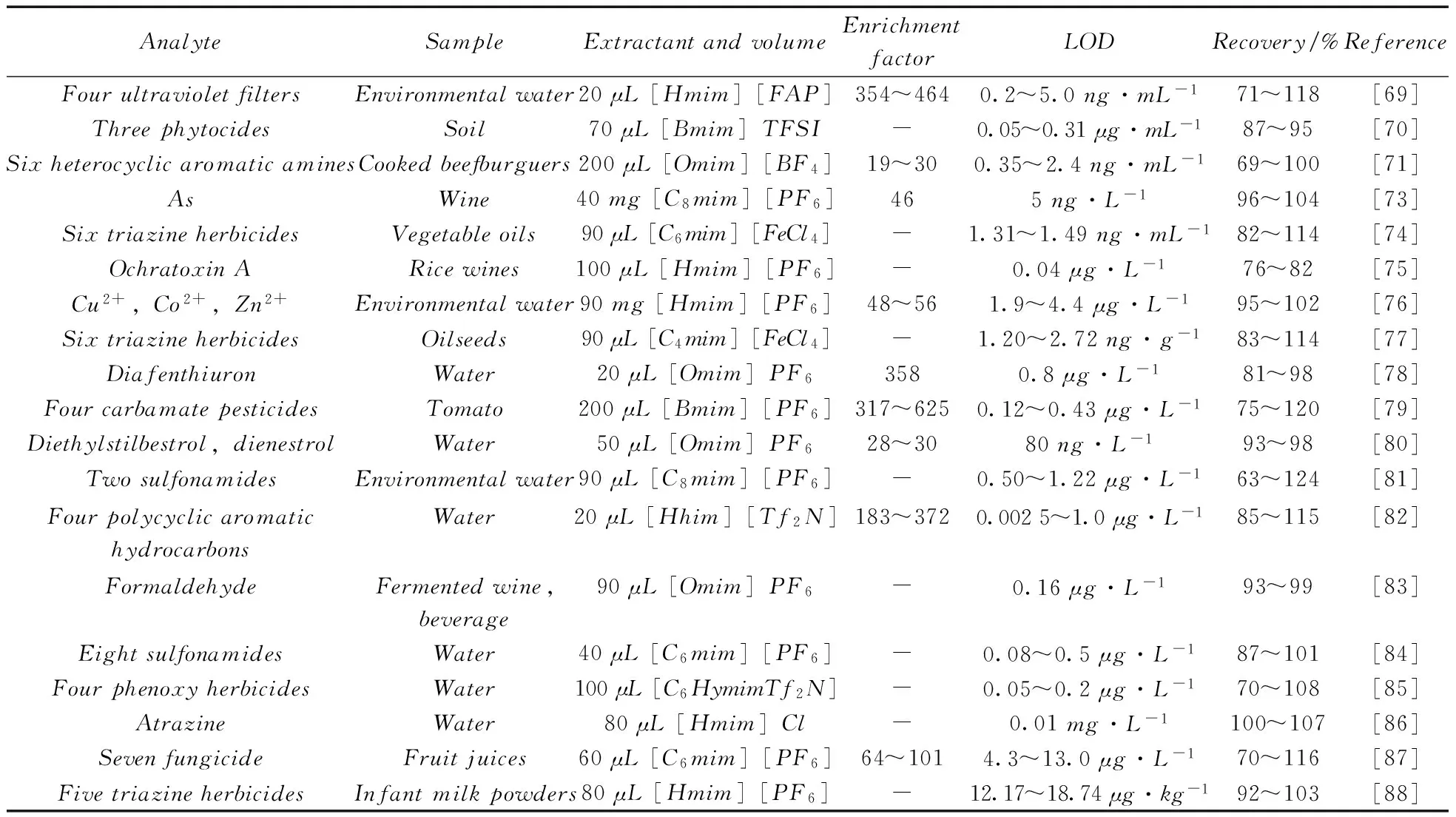
表6 离子液体-分散液液微萃取的应用
-:nodata
2 与其他样品前处理技术联用
目前对DLLME的大量研究报道集中于简单基质样品(如饮用水、环境水样品)的分离分析,对较复杂基质的固体样品及气体样品(如生物、食品、药物样品等)难于直接应用。为提高该技术的选择性及萃取效率,减少有机溶剂用量,提高样品净化和富集效率,有学者尝试将该技术与其他样品前处理技术联用,如与液液萃取(LLE)[89-90]、固相萃取(SPE)[91-92]、固相微萃取(SPME)[93]、分散固相萃取(DSPE)[94-95]、基质固相分散萃取(MSPD)[75]、超临界流体萃取(SFE)[96]、超声辅助萃取(UAE)[97]等净化技术联用。
LLE为传统样品前处理方法,利用分析物在两相分配系数的不同而实现分离,萃取效率和选择性较高,将其与DLLME联用,可简化样品基质,提高选择性;SPE根据物理性质选择性地吸附分析物,在不同极性洗脱剂作用下洗脱杂质、分析物,使样品得到净化和富集,与DLLME联用可提高选择性,增加富集倍数。SPME,DSPE,MSPD均是基于SPE发展的样品前处理技术,能实现样品中分析物的提取、分离、净化和富集,与DLLME联用可以极大提高方法选择性,降低基质效应,减少有机溶剂用量,降低方法检出限。SFE以超临界流体为萃取剂,操作压力和温度高于临界点时,气体萃取剂的密度接近液体,渗透性强,黏度较小,表现出良好的萃取能力,无需有机溶剂,环境友好,将该技术与DLLME结合,可进一步提高对样品中分析物的萃取率以及选择性。UAE利用超声波辐射产生空化效应,加强扰动,增加了分子运动的频率和速度,并增加了溶剂渗透性,从而加速目标成分进入溶剂以促进萃取,进一步与DLLME联用后可提高萃取效率,简化基质。此外,DLLME与其他样品前处理技术,如搅拌棒吸附萃取(SBSE)[98]、分子印迹技术(MIP)[99]、微波辅助萃取(MAE)[100]、亚临界水萃取(SWE)[101]等净化技术联用,可以克服DLLME的缺点,提高样品的处理效率和萃取率。可以预见,将DLLME与其他样品前处理技术相结合,应用于复杂基质样品的分离分析,将是DLLME今后重要的发展方向。
3 结 语
分散液液微萃取技术自2006年出现以来,由于使用μL级萃取剂,与传统液液萃取相比可使萃取剂用量减少上千倍,从而迅速受到分离分析领域研究者的青睐。作为近年来发展迅速的样品前处理技术,分散液液微萃取有低污染、低成本、高效率、高准确度、操作简单快捷以及方便与各种检测仪器联用等优点,已被广泛应用在化学、生物、药物、环境、食品等领域的分离分析中。但传统分散液液微萃取技术仍使用有机溶剂,且选择性较差,主要用于水溶液样品,难以应用于复杂基质的样品等问题仍待解决。预期未来DLLME的发展方向为:①筛选低毒萃取剂,更新萃取模式。筛选环境友好、成本低廉、按照分析物性质设计合成选择性更强的萃取剂,并发展自动化萃取、可在线富集萃取装置和相关萃取模式。②筛选分散剂,革新分散模式。目前普遍使用的分散剂为有机溶剂,有一定毒性,且易降低分析物在萃取剂中的分配系数。选用其他分散剂,如表面活性剂代替传统分散剂,也能实现有机物在水溶液中的良好分散;不用分散剂,改用机械力分散,如超声辅助、涡旋辅助、空气辅助分散,也能起到很好的分散效果,因此借助其他辅助分散手段实现无分散剂也是DLLME一个很好的发展方向。③与其他样品前处理技术联用。为克服DLLME技术的缺点,提高方法的选择性和萃取效率并拓宽该技术的适用范围,将该技术与其他样品前处理技术联用,将成为DLLME今后研究的重点。④与多种检测手段相结合。将DLLME离线富集与仪器在线富集相结合,拓展仪器的适用范围,提高分析仪器的灵敏度,降低检出限也将是DLLME今后的发展方向。随着DLLME技术的不断改进和发展,该技术必将在分离分析研究领域中得到更为广泛的应用。
[1]RezaeeM,AssadiY,MilaniHosseiniMR,AghaeeE,AhmadiF,BerijaniS.J.Chromatogr.A,2006,1116(1/2):1-9.
[2]WangY,ZhangYM.Prog.Chem.(王炎,张永梅.化学进展),2009,21(4):696-704.
[3]ZangXH,WuQH,ZhangMY,XiGH,WangZ.Chin.J.Anal.Chem.(臧晓欢,吴秋华,张美月,郗国宏,王志.分析化学),2009,37(2):161-168.
[4]RezaeeM,YaminiY,FarajiM.J.Chromatogr.A,2010,1217(16):2342-2357.
[6]MaJP,LuWH,ChenLX.Curr.Anal.Chem.,2012,8(1):78-90.
[7]HouDK,HeJ,ZhangFJ,KhureldavaaO.J.Instrum.Anal.(侯德坤,何江,张福金,呼日乐达瓦.分析测试学报),2014,33(5):606-614.
[8]CaoJP,XieQL,ZhouJM,YiZH.J.Instrum.Anal.(曹江平,解启龙,周继梅,易宗慧.分析测试学报),2015,34(5):616-624.
[9]RezaeeM,YaminiY,ShariatiS,EsrafiliA,ShamsipurM.J.Chromatogr.A,2009,1216(9):1511-1514.
[10]BernardoM,GonçalvesM,LapaN,MendesB.Chemosphere,2010,79(11):1026-1032 .
[11]YanHY,WangH,QinXY,LiuBM,DuJJ.J.Pharm.Biomed.,2011,54(1):53-57.
[12]CaoJP,FanYY,XieQL,BaiWW,LiuSH,ZhangXK.Food Sci.(曹江平,范盈盈,解启龙,白玮玮,刘书慧,张晓科.食品科学),2013,34(24):233-237.
[13]CaoJP,LiuSW,XieQL,YiZH,ZhouJM,ZhangYL.Food Sci.(曹江平,刘世巍,解启龙,易宗慧,周继梅,张玉龙.食品科学),2015,36(22):122-125.
[14]AlmeidaC,FernandesJO,CunhaSC.Food Control,2012,25(1):380-388.
[15]MengL,ZhuBL,ZhengKF,ZhangWW,MengPJ.Chin.J.Chromatogr.(孟梁,朱彬玲,郑可芳,张文文,孟品佳.色谱),2015,33(3):304-308.
[16]ZhuBQ,ChenH,LiSQ.Chin.J.Chromatogr.(祝本琼,陈浩,李胜清.色谱),2012,30(2):201-206.
[17]FarajzadehMA,SeyediSE,ShalamzariMS,BamorowatM.J.Sep.Sci.,2009,32(18):3191-3200.
[18]SeebunruengK,SantaladchaiyakitY,SrijaranaiS.Talanta,2015,132:769-774.
[19]ZhangPP,ShiZG,FengYQ.Talanta,2011,85(5):2581-2586.
[20]JiaS,RyuY,KwonSW,LeeJ.J.Chromatogr.A,2013,1282(5):1-10.
[21]MayaF,HorstkotteB,EstelaJM,VíctorC.Anal.Bioanal.Chem.,2012,404(3):909-917.
[22]CaoJP,LiuSH,BaiWW,ChenJ,XieQL.Anal.Lett.,2013,49(9):1342-1354.
[23]KamankeshM,MohammadiA,TehraniZM,FerdowsiR,HosseiniH.Talanta,2013,109:46-51.
[24]RanjbariE,BiparvaP,HadjmohammadiMR.Talanta,2012,89:117-123.
[25]HuangKJ,WeiCY,LiuWL,XieWZ,ZhangJF,WangW.J.Chromatogr.A,2009,1216(38):6636-6641.
[26]FarajzadehMA,DjozanD,BakhtiyariRF.Talanta,2010,81(4/5):1360-1367.
[27]López-DariasJ,Germán-HernándezM,PinoV,AfonsoAM.Talanta,2010,80(5):1611-1618.
[28]GaubeurI,AguirreMA,KovachevN,HidalgoM,CanalsA.Microchem.J.,2015,121:219-226.
[29]ChenH,ChenRW,LiSQ.J.Chromatogr.A,2010,1217(8):1244-1248.
[30]GuoL,LeeHK.J.Chromatogr.A,2011,1218(31):5040-5046.
[31]MajidiB,ShemiraniF.Talanta,2012,93(2):245-251.
[32]SeebunruengK,SantaladchaiyakitY,SrijaranaiS.Chemosphere,2014,103(5):51-58.
[33]CaldasSS,RombaldiC,AriasJLDO,MarubeLC,PrimelEG.Talanta,2016,146:676-688.
[34]WangY,ZhuCH,ZouXL,HuangLZ,YanD.Chin.J.Chromatogr.(王宇,朱成华,邹晓莉,黄黎志,严冬.色谱),2013,31(11):1076-1080.
[35]ZhouX,YangYC,YeZX.Environ.Sci.Technol.(周新,杨迎春,叶芝祥.环境科学与技术),2015,38(5):90-94.
[36]LeongMI,HuangSD.J.Chromatogr.A,2008,1211(1/2):8-12.
[37]AsadollahiT,DadfarniaS,ShabaniAMH.Talanta,2010,82(1):208-212.
[38]SuhJH,LeeYY,LeeHJ,KangM,HurY,LeeSN,YangDH,HanSB.J.Pharm.Biomed.,2013,75:214-219.
[39]ZhouYW,HanLT,ChengJ,GuoF,ZhiXR,HuHL,ChenG.Anal.Bioanal.Chem.,2011,399(5):1901-1906.
[40]LiangP,LiuGJ,WangF,WangWT.J.Chromatogr.B,2013,926(5):62-67.
[41]MatsadiqG,HuHL,RenHB,ZhouYW,LiuL,ChengJ.J.Chromatogr.B,2011,879(22):2113-2118.
[42]Rodríguez-CaboT,RodríguezI,RamilM,CelaR.J.Chromatogr.A,2011,1218(38):6603-6611.
[43]SanagiMM,AbbasHH,WanAWI,Aboul-EnienHY.Food Chem.,2012,133(2):557-562.
[44]PengG,HeQ,Al-HamadaniSM,ZhouG,LiuM,ZhuH,ChenJH.Ecotoxicol.Environ.Saf.,2015,115:229-233.
[45]BiH,ZhengX,LunXW,MaXH,HouXW.J.Instrum.Anal.(毕欢,郑鑫,伦小文,马晓薇,侯晓虹.分析测试学报),2013,32(7):823-828.
[46]DingZQ,ZhangQY.Chin.J.Anal.Chem.(丁宗庆,张琼瑶.分析化学),2010,38(10):1400-1404.
[47]JianYH,HuY,WangT,LiuJL,ZhangC,LiY.Chin.J.Anal.Chem.(翦英红,胡艳,王婷,刘建林,张琛,李鱼.分析化学),2010,38(1):62-66.
[48]WangJC,ZhangHJ,ChenJP,ZhangL.Chin.J.Chromatogr.(王金成,张海军,陈吉平,张玲.色谱),2014,32(9):913-918.
[49]XuLZ,LiXY,XianYP,HeMH,FangJ,HuangJF,GuoXD.J.Instrum.Anal.(许丽珠,李秀英,冼燕萍,何敏恒,方军,黄金凤,郭新东.分析测试学报),2015,34(8):923-927.
[50]WangY,ZouXL,ZhangWT,ZengHY,ZhangLF.Chin.J.Anal.Chem.(王宇,邹晓莉,张文滔,曾红燕,张龙飞.分析化学),2013,41(5):749-753.
[51]FarajzadehMA,BahramM,JönssonJÅ.Anal.Chim.Acta,2007,591(1):69-79.
[52]KocúrováL,BaloghIS,krlíkováJ,PostaJ,AndruchV.Talanta,2010,82(5):1958-1964.
[54]LenkaR,VasilA,BaloghIS,krlíkováJ.Talanta,2011,85(1):541-545.
[55]ZarubaS,VishnikinAB,AndruchV.Talanta,2016,149:110-116.
[56]BaloghIS,RusnákováL,krlíkováJ,KocúrováL,TörökM,AndruchV.Int.J.Environ.Anal.Chem.,2012,92(9):1059-1071.
[57]MelwankiMB,FuhMR.J.Chromatogr.A,2008,1198/1199:1-6.
[58]SunJZ,HeH,LiuSH.Chin.J.Chromatogr.(孙建芝,贺晖,刘书慧.色谱),2014,32(3):256-262.
[59]XiaoCQ,TangMQ,LiJ,YinCR,XiangGY,XuL.J.Chromatogr.B,2013,931(14):111-116.
[60]AlshanaU,ErtaN,GöG.Food Chem.,2015,181:1-8.
[61]FernándezE,VidalL,Martín-YergaD,BlancoMDC,CanalsA,Costa-GarcíaA.Talanta,2015,135:34-40.
[62]ShiH,XiaD,DengXQ,TanYM,SuXL,XieQJ,MaM.Chin.J.Anal.Chem.(石慧,夏丹,邓晓庆,谭月明,苏孝礼,谢青季,马铭.分析化学),2013,41(9):1444-1448.
[63]LiuX,FuR,LiM,GuoLP,YangL.Chin.J.Anal.Chem.(刘心,付饶,李敏,郭黎平,杨丽.分析化学),2013,41(12):1919-1922.
[64]LiuY,ZhaoEC,ZhuWT,GaoHX,ZhouZQ.J.Chromatogr.A,2009,1216(6):885-891.
[65]VázquezMMP,VázquezPP,GaleraMM,GarcíaMDG.Anal.Chim.Acta,2012,748:20-27.
[66]López-GarcíaI,Vicente-MartínezY,Hernández-CórdobaM.Talanta,2013,110:46-52.
[67]ZhouQX,BaiHH,XieGH,XiaoJP.J.Chromatogr.A,2008,1188(2):148-153.
[68]ZhangYH,ZhangXL,ZhaoQY,ChenWJ,WangCQ,ChenAH,JiaoBN.Chin.J.Anal.Chem.(张耀海,张雪莲,赵其阳,陈卫军,王成秋,陈爱华,焦必宁.分析化学),2014,42(10):1434-1440.
[69]ZhangYF,LeeHK.Anal.Chim.Acta,2012,750(11):120-126.
[70]DongSY,HuQ,YangZ,LiuR,HuangGQ,HuangTL.Microchem.J.,2013,110(9):221-226.
[71]MesaLBA,PadróJM,RetaM.Food Chem.,2013,141(3):1694-1701.
[72]GureA,LaraFJ,García-CampaaAM,MegersaN,Olmo-IruelaMD.Food Chem.,2015,170:348-353.
[73]EscuderoLB,MartinisEM,OlsinaRA,WuilloudRG.Food Chem.,2013,138(1):484-490.
[74]WangYP,SunY,XuB,LiXP,JinR,ZhangHQ,SongDQ.J.Chromatogr.A,2014,1373:9-16.
[75]LaiXW,RuanCQ,LiuRC,LiuC.Food Chem.,2014,161(6):317-322.
[76]RajabiM,AsemipourS,BarfiB,JamaliMR,BehzadM.J.Mol.Liq.,2014,194(6):166-171.
[77]WangYP,SunY,XuB,LiXP,WangXH,ZhangHQ,SongDQ.Anal.Chim.Acta,2015,888:67-74.
[78]LuWW,SunFS,DongJ,ShenY.J.Instrum.Anal.(卢委委,孙福生,董杰,沈英.分析测试学报),2010,29(11):1198-1202.
[79]HaoJY,LuoXL,TangZG,WangDJ.J.Instrum.Anal.(郝家勇,罗小玲,唐宗贵,王东健.分析测试学报),2010,29(11):1169-1172.
[80]ZhangJ,YiX,ZengYB,YeCX,PangM,LiL.J.Instrum.Anal.(张剑,易翔,曾延波,叶朝霞,庞明,李蕾.分析测试学报),2010,29(6):629-632.
[81]ChangAG,ZhouK,JiangJ,WuXY,ZhangZ.Environ.Chem.(常安刚,周凯,江静,吴向阳,张祯.环境化学),2013,32(2):295-301.
[82]ZhengXY,HeLJ,ZhangKG,JiangXM,XiangGQ,LiuJP.J.Instrum.Anal.(郑小焱,何丽君,张凯歌,江秀明,向国强,刘建平.分析测试学报),2014,33(5):566-571.
[83]WangZB,GaoY,LiuY.Phys.Test.Chem.Anal.:Chem.Anal.(王志兵,高杨,刘洋.理化检验:化学分册),2015,51(4):502-505.
[84]WuCQ,LeiJM,LiYL,WangYL,ChenDY,GongJ.Chin.J.Chromatogr.(吴翠琴,雷金妹,李韵灵,王韵靓,陈迪云,龚剑.色谱),2014,32(12):1362-1367.
[85]YangSP,GuoZF,LiuM,WangSL.Chin.J.Anal.Chem.(杨素萍,郭振福,刘敏,王素利.分析化学),2015,43(6):904-908.
[86]PanMJ,CaoQ,JingM,LiJY,ChenJW.Rock Miner.Anal.(潘闽君,曹茜,景明,李晋阳,陈家玮.岩矿测试),2015,34(3):353-358.
[87]ZhangY,ZhaoQY,ZhangYH,JiaoBN.Food Sci.(张琰,赵其阳,张耀海,焦必宁.食品科学),2015,36(4):202-207.
[88]ZhangLY,YaoD,LiN,ZhangHQ,YiAM.Chin.J.Chromatogr.(张丽媛,姚笛,李娜,张寒琦,于爱民.色谱),2015,33(7):753-758.
[89]FarajzadehMA,KhoshmaramL.CLEAN-Soil,Air,Water,2015,43(1):51-58.
[90]FarajzadehMA,FeriduniB,MogaddamMRA.Talanta,2016,146:772-779.
[91]ZhouS,ChenHX,WuB,MaC,YeY.Microchim.Acta,2012,176(3):419-427.
[92]YaminiY,FarajiM,AdeliM.Microchim.Acta,2015,182(7):1491-1499.
[93]FengJJ,SunM,BuYN,LuoCN.Anal.Bioanal.Chem.,2015,407(23):7025-7035.
[94]WuQH,LiZ,WangC,WuCX,WangWX,WangZ.Food Anal.Method,2011,4(4):559-566.
[95]ZhangY,XuH.Food Anal.Method,2014,7(1):189-196.
[96]DaneshvandB,RaofieF.J.Iran Chem.Soc.,2015,12(7):1287-1292.
[97]SereshtiH,HeidariR,SamadiS.Food Chem.,2014,143:499-505.
[98]ShamsipurM,HashemiB.RSC Adv.,2015,5:20339-20345.
[99]MudiamMKR,ChauhanA,JainR,DhuriyaYK,SaxenaPN,KhannaVK.J.Chromatogr.B,2014,945/946:23-30.
[100]KamankeshM,MohammadiA,HosseiniH,TehraniZM.Meat Sci.,2015,103:61-67.
[101]YuanK,KangHN,YueZF,YangLH,LinL,WangXW,LuanTG.Anal.Chim.Acta,2015,866:41-47.
A Review on Dispersive Liquid-Liquid Microextraction Method
CAO Jiang-ping1,2*,DI Hong-wei1,2,ZHOU Ji-mei1,2,LIANG Yong-feng1,2,XIE Qi-long3
(1.CollegeofChemistryandChemicalEngineering,NingxiaNormalUniversity,Guyuan756000,China;2.EngineeringandTechnologyResearchCenterofLiupanshanResources,NingxiaNormalUniversity,Guyuan756000,China;3.StateKeyLaboratoryofCoalConversion,InstituteofCoalChemistry,ChineseAcademyofSciences,Taiyuan030001,China)
Dispersiveliquid-liquidmicroextraction(DLLME)isanovelsamplepreparationtechnique,whichisbasedonthetraditionalliquid-liquidextraction.Inthepastfewyears,ithasalwaysgrabbedtheattentionofresearchersinthefieldofseparationandanalysisforthemeritofutilizationofμLlevelofextractionsolvent,anditalsoshowsasuperiorseparationefficiencyandastrongenrichmentability.Inthispaper,lowtoxicextractantsolventssuchlikelowdensitysolvent,auxiliarysolvent,backextractionsolventandionicliquid,andtherelevantmicroextractionmode,suchasutilizingself-madedevices,solventdemulsification,solidificationofafloatingorganicdrop,uxiliarysolventextraction,backextractionandionicliquidbasedDLLMEwerebrieflyreviewedaccordingtotheselectionofextractionsolvent.Intheend,extractioncharacteristicsofDLLMEcombinedwithotherextractiontechniqueslikeliquid-liquidextraction,solidphaseextraction,solid-phasemicroextraction,dispersivesolidphaseextraction,matrixsolidphasedispersionextraction,super-criticalextraction,ultrasonicassistedextractionwerealsobrieflyreviewed.
dispersiveliquid-liquidmicroextraction;extractionsolvent;review
2015-11-18;
2016-01-12
宁夏自然科学基金资助项目(NZ14275);宁夏高等学校科学研究项目( 2016年);宁夏师范学院科研项目(NXSFYB1646)
曹江平,助教,研究方向:分离科学与分离分析技术,Tel:0954-2079424,E-mail:jiangpingcao@126.com
doi:10.3969/j.issn.1004-4957.2016.07.025
O658.2;G353.11
A
1004-4957(2016)07-0913-09
