草莓MYB类转录因子FaMYB5基因的克隆与表达分析
2016-08-18汤浩茹四川农业大学园艺学院四川成都611130
冯 琛,王 玲,汤浩茹,肖 婕(四川农业大学园艺学院,四川成都611130)
草莓MYB类转录因子FaMYB5基因的克隆与表达分析
冯 琛,王 玲,汤浩茹*,肖 婕
(四川农业大学园艺学院,四川成都611130)
以丰香草莓(Fragaria×ananassa cv.Toyonaka)为试材,通过同源克隆技术获得FaMYB5基因全长编码序列,运用生物学软件对该序列进行相关生物信息学分析,同时采用实时荧光定量PCR方法对FaMYB5基因在果实不同发育阶段的表达模式进行研究。FaMYB5基因的cDNA全长为822 bp,编码273个氨基酸,蛋白质分子量为29.159 ku,等电点为5.709,与森林草莓的FvMYB5同源性达95.7%。实时荧光定量PCR分析显示,随着果实发育成熟,FaMYB5基因的表达逐渐上升。在果实的小绿期(SG),FaMYB5基因的表达量最低。但是在白果期(WT)出现1个降低的峰值,其表达量略高于小绿期,草莓果实开始转红时其表达量又逐渐上升,在果实全红期(FR)达到最大。结果获得了丰香草莓MYB类转录因子FaMYB5基因的cDNA全长,其表达存在差异。
草莓;FaMYB5;转录因子;基因克隆;表达模式
类黄酮化合物(flavonids)是植物重要的次生代谢产物之一,在植物界中分布广泛且具有较强的生物活性,不仅有益于人类身体健康,还影响植物花器官发育和果实着色等。草莓属蔷薇科草莓属多年生草本植物,其果实含高浓度的类黄酮化合物,具有重要的保健功能和显著的经济效益,倍受消费者和种植者的喜爱。目前,草莓类黄酮化合物代谢途径中主要结构基因已被认知,但是有关该途径转录调控信息的研究相对较少。
大量研究表明,类黄酮化合物花青素苷、原花青素等代谢途径均受MYB转录因子调控。2008年Dubos等[1]和Matsui等[2]发现,AtMYBL2是类黄酮途径的负调控因子,抑制种子中原花青素的合成和代谢。Gonzalez等[3]发现,AtMYB5 与AtTT8、AtTT2组成三元复合体,调节外种皮和毛状体的形成,在种子原花青素合成途径中起重要作用。Quattrocchio等[4]在矮牵牛中发现 At-MYB5的同源基因PbPH4与花瓣细胞和液泡的呈酸性有关;然而Deluc等[5]在葡萄中发现与 At-MYB5同源的VvMYB5a和VvMYB5b在葡萄浆果内的原花青素和花青素合成途径均起着重要作用。
另外有研究表明,矮牵牛中的 R3-MYB、PHMYBx配合R2R3-MYB抑制剂PhMYB27,负调控PhPHZ-PhAN1-PhAN11 MBW复合物的活性,达到调节营养器官中花青素合成的目的[6]。在此基础上,Aharoni等[7]推断,在草莓果实中可能也存在相似的机制,FaMYB5可能与负调控因子FaMYB1结合,共同调节与原花青素或花青素合成有关的MBW复合体活性,而FaMYB1是抑制花青素相关基因的转录从而抑制花青素的合成。另外,Burr等[8]认为,由于 FabHLH3Δ和FaMYB5有相互作用,且都是在果实发育早期表达,FabHLH3Δ可能对FaMYB5起到抑制作用。2013年Schaart等[9]发现FaMYB5的转录产物量在草莓发育过程中很稳定,可以假定它在草莓发育早期原花青素合成途径和成熟期花青素的合成途径中都起到了重要作用。FaMYB5可能抑制草莓果实原花青素或花青素合成途径(图1),需要进一步研究。
为进一步探明FaMYB5在草莓中的表达特点,拟采用草莓栽培品种丰香为材料,克隆得到FaMYB5基因cDNA全长序列,采用生物信息学方法对其序列进行分析,并通过实时荧光定量PCR技术对FaMYB5基因的表达特点进行分析,为进一步实现对FaMYB5基因的功能研究提供科学依据。

图1 草莓果实原花青素和花青素生物合成的转录调控途径[9]Fig.1 Putative transcriptional regulatory pathways controlling PA and anthocyanin biosynthesis in strawberry fruit
1 材料与方法
1.1 材料
试验材料为草莓栽培品种丰香,购于四川省双流县兴隆镇草莓种植基地,于2012年9月10日移栽至人工气候箱,培养条件为白天室温25℃,夜间15℃,相对湿度70%~90%,光照16 h,处理到11月中上旬时,草莓开始逐渐坐果。分别采集草莓不同发育时期的果实样品,样品时期的划分参照 Hou等[10-11]、Jia等[12]方法,(1)小绿期(small green,SG):坐果后7 d左右;(2)大绿期(big green,BG):坐果后14 d左右;(3)白果期(white,WT):坐果20 d左右,果实个体已经转白,部分种子已经着色;(4)始红期(initially red,IR):坐果23 d左右,果实向光面有小于1/2的面积转红;(5)片红期(partially red,PR):坐果25 d左右,果实向光面大于1/2的面积转红;(6)全红期(full red,FR):坐果28 d左右,果实全红。各时期材料用液氮速冻后,置于-80℃冰箱保存备用。
1.2 方法
1.2.1 FaMYB5基因的克隆
参照Chen等[13]的改良CTAB法,提取草莓果实总RNA,并用DNA酶Ⅰ(Thermo)处理以消除基因组DNA后参照反转录试剂盒(Thermo)进行第一链cDNA的合成,然后-20℃保存待用。对GenBank中登录的拟南芥MYB5(NP187963.1)、苹果MYB12a (AHM88213.1)、李属MYB5(XP008220661.1)、葡萄MYB5a(AAS68190)、葡萄 MYB5b(AAX51291)等MYB5基因进行保守序列分析,并以此为探针在蔷薇科基因组数据库(Genome Database for Rosaceae)中找到森林草莓的同源基因,利用Primer 5.0软件设计一对克隆cDNA全长的特异引物FaMYB5-F和FaMYB5-R(表1)。PCR扩增采用20 μL反应体系,其中上下游引物各1 μL,cDNA模板1 μL,2×Taq PCR Master Mix(天根,北京)10 μL,ddH2O补足到20 μL。扩增条件为94℃预变性4 min;94℃变性40 s;57℃退火30 s;72℃延伸1 min;35个循环;72℃再延伸10 min。PCR产物用SanPrep柱式DNA胶回收试剂盒(生工生物,上海)回收后连接到pMD19-T(宝生物,大连)载体上,转化大肠埃希菌JM109(本实验室保存),将筛选出的重组质粒送生工生物工程(上海)股份有限公司测序。结合NCBI核酸及蛋白数据库进行Blast搜索,判断是否成功克隆到相应的同源基因。
1.2.2 FaMYB5的相关生物信息学分析
利用 NCBI Blastn/p、DNAMAN、HMMER、ClustalX、MEGA 5.0、SignalP 4.1、SMART、Inter-ProScan、DNAstar等生物软件进行氨基酸同源性比对[14],蛋白质分子量、等电点、跨膜区及信号肽预测,蛋白质亚细胞定位预测,以及基于氨基酸序列的系统进化树的构建。另外,通过SWISSMODEL(http://swissmodel.expasy.org/)同源建模,以V-MYB晶体光衍射结构为模板,构建了FaMYB5的三级结构域模型。
1.2.3 实时荧光定量PCR分析
根据获得的FaMYB5的全长cDNA序列,利用Beacon Designer 7在该基因3'末端的非保守结构域设计实时荧光定量PCR引物FaMYB5-1 和FaMYB5-2(表1)。荧光染料选择SYBR(宝生物,大连),使用 CFX96实时定量PCR仪(Bio-Rad,美国)对果实6个不同的发育时期(小绿、大绿、白果、始红、片红、全红)的表达量进行测定。荧光定量PCR采用20 μL体系,其中包括SYBR Green荧光染料10 μL,上下游引物各0.6 μL,稀释10倍的cDNA 2 μL,用已灭菌的ddH2O补足至20 μL。扩增程序为95℃预变性5 s;95℃变性5 s,退火温度为55℃,最后72℃延伸30 s,共40个循环。每次循环在退火延伸结束后进行荧光采集。最后95℃保温15 s,降温到60℃维持30 s,65℃开始以0.5℃每步升温,并维持5 s采集荧光信号至95℃结束反应,绘制熔解曲线。以不加模板cDNA为阴性对照,4孔重复,以全红时期果实为对照,采用2-ΔΔCt法计算相对表达量。
以草莓FaActin-7-like(XM_004306544.1)基因作为荧光定量PCR内参照,设计引物为FaActin-F和FaActin-R(表1),PCR反应体系和程序同FaMYB5。

表1 试验所用引物Table 1 Sequence of primers
2 结果与分析
2.1 FaMYB5的全长编码区克隆
以反转录合成的cDNA为模板,利用特异引物FaMYB5-F和FaMYB5-R进行基因完整编码区的扩增,产物经1%的琼脂糖凝胶电泳,在800 bp左右有一条明亮且单一的条带,与预测片段大小相符(图2)。对该片段进行回收、连接、转化、提取质粒以及质粒PCR鉴定得到阳性克隆,送生工生物工程(上海)股份有限公司测序。测序结果显示,该cDNA全长822 bp,与森林草莓FvMYB5同源性达95.7%(图3),较FvMYB5多了一段串联重复,导致氨基酸序列差异,且该差异序列不在MYB家族保守结构区域中,所以FaMYB5蛋白结构并未发生改变,这可能是由于品种不同造成的差异。通过 NCBI Blastn在线比对,与其GenBank中登录的拟南芥MYB5(NP187963.1)、苹果 MYB12a(AHM88213.1)、李属 MYB5 (XP008220661.1)、葡萄MYB5a(AAS68190)、葡萄MYB5b(AAX51291)等其他物种MYB5基因的同源性比对,结果显示同源性均不高,约为50%。

图2 FaMYB5 PCR扩增产物凝胶电泳图Fig.2 Amplification of full open reading frame of FaMYB5 using cDNA

图3 FaMYB5与FvMYB5核酸序列比对Fig.3 The aligment of FaMYB5 gene with FvMYB5
2.2 FaMYB5的相关生物信息学
采用 SMART和 InterProScan软件分析,FaMYB5的第5~59个氨基酸为MYB结构域。FaMYB5转录因子蛋白特性分析通过在线蛋白质分析工具(http://isoelectric.ovh.org)进行,结果显示,FaMYB5转录因子编码273个氨基酸,蛋白质分子量约为 29.159 ku,正电荷氨基酸占10.99%,负电荷氨基酸占10.26%,理论等电点为5.709。用信号肽预测在线分析工具SignalP 4.1对草莓FaMYB5转录因子蛋白进行信号肽分析,结果显示,FaMYB5蛋白是水溶性蛋白,不含信号肽。运用Protfun在线软件进行蛋白功能预测,结果显示,FaMYB5转录因子具有调控功能(表2)。
草莓FaMYB5转录因子的二级结构预测用DNAStar分析软件中的Protein进行,根据Chou-Fasman的经验参数法,发现FaMYB5蛋白的α-螺旋结构有9个,β折叠区结构有6个,β-转角结构有27个(图4)。氨基酸亲水性分析显示,FaMYB5蛋白的大多数氨基酸为亲水性氨基酸(图4)。
将推导出的氨基酸序列通过ESPript 3.0进行同源建模分析其结构特征。从图5可以看出,R2R3类MYB转录因子具有2个DNA结合结构域R2和R3,而FaMYB5转录因子N端缺失70个氨基酸导致R2结构域缺少,只含1个R结构域。同时也可看到每1个R结构域都含有51~52个保守的氨基酸残基和间隔序列构成,并且每隔约18个氨基酸就会规则的出现1个色氨酸残基(w),从二级结构图上还可以看到这些氨基酸残基构成3个α螺旋。另外R3的前2个螺旋存在1个与bHLH的交互作用有关的保守区域[DE]Lx2[RK]x3Lx6Lx3R。因此,从二级结构上判断,草莓FaMYB5更类似R3类MYB转录因子,这与Schaart等[9]的研究结果一致。
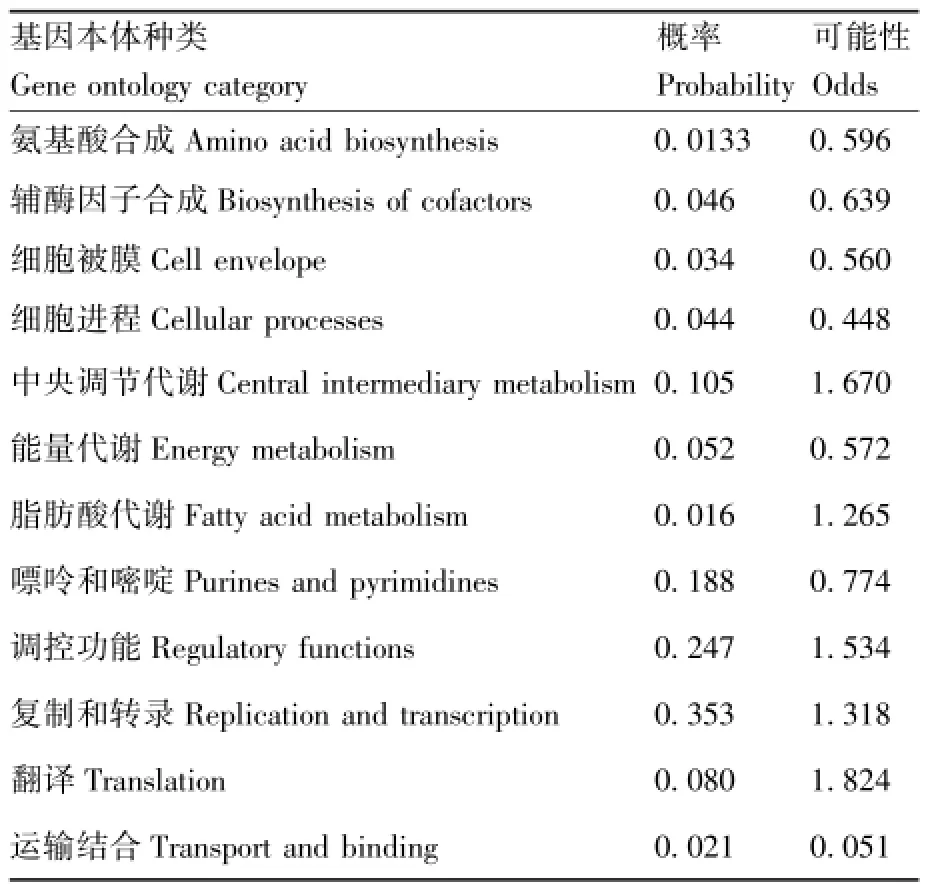
表2 FaMYB5蛋白功能预测Table 2 Function prediction of FaMYB5 protein
对已报道的MYB5转录因子及文献来源的与FaMYB5功能相近的MYB转录因子氨基酸序列,用MEGA 5.0[15]软件构建系统进化树。图6进化树表明,草莓与李属和苹果属聚为一类,说明他们的进化关系较近,推测草莓与李属和苹果在进化过程中,具有某些相似的生理特征和形态特征。
利用I-TASSER(http://zhanglab.ccmb.med. umich.edu/I-TASSER/)同源建模,以V-MYB晶体光衍射结构为模板,构建了FaMYB5的3级结构模型(图7)。由图7可以看出,FaMYB5转录因子含有3个α螺旋,构成1个R结构域,该结构域折叠成HTH结构。由FaMYB5的三级结构示意图可以进一步推断该转录因子属于R3类MYB转录因子。

图4 草莓FaMYB5转录因子二级结构预测Fig.4 Prediction of FaMYB5 transcription factor secondary structure of strawberry

图5 FaMYB5转录因子比对的R2R3结构域示意图Fig.5 Alignment of FaMYB5 transcription factors,indicating the R2R3 domain of the deduced amino acids
2.3 FaMYB5基因在草莓果实发育过程中的表达
草莓果实发育中经历几个明显的果实转色过程,幼果的绿色到白色,最后转红进入成熟。由由图8可以看出,FaMYB5基因在草莓果实发育的6个时期均有表达,其表达量的大小存在差异。从整体趋势看,随着果实发育成熟,FaMYB5基因的表达是逐渐上升的。在果实的小绿期(SG),FaMYB5基因的表达量最低。但是在白果期(WT)出现一个降低的峰值,其表达量略高于小绿期,之后草莓果实开始转红时其表达量又逐渐上升,在果实全红期(FR)达到最大。FaMYB5基因的相对表达量分别为 0.20、0.54、0.24、 0.65、0.85、1.00。
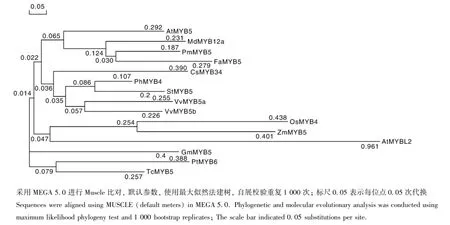
图6 MYB转录因子氨基酸序列系统进化树Fig.6 Phylogenitic relationships between flavonoid-related MYBs
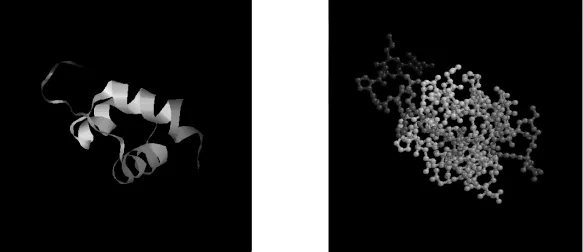
图7 FaMYB5三级结构示意图及球棍模型Fig.7 3D structures and ball and stick model of FaMYB5 protein
3 讨论
DNA结合域是MYB类转录因子结构中最为保守的区域,一般由1~3个不完全重复序列(R)组成,每1个R结构域含有51~52个保守的氨基酸残基及间隔序列,而且每隔18个氨基酸就会规则的出现1个色氨酸残基(w),这些氨基酸残基构成3个α螺旋[16]。这些保守序列对MYB类转录因子基因的克隆和鉴定具有指导意义。
在本研究中,通过生物信息学分析可知,FaMYB5转录因子只有1个R结合域,其与靶DNA的结合可能会受到影响。但由于FaMYB5属于R3类转录因子,其R3结构域的前2个螺旋包含1个保守区域[DE]Lx2[RK]x3Lx6Lx3R,具有与bHLH交互作用的结构基础,另外,酵母双杂交证实FaMYB5与bHLH3和bHLH3Δ有交互作用[9]。因此,可推断转录因子FaMYB5可能通过与R2R3类转录因子竞争bHLH转录因子的结合位点,间接调控相关酶基因。Schaart等[9]推测,草莓中FaMYB5可能与其他植物来源的R3 类MYB因子有相似功能,对类黄酮代谢途径起负调控作用,但其功能和调控机制仍不明确,需要进一步的研究。
从果实发育过程中的表达情况可以看出,该基因在草莓发育的整个过程中表达量有一定差异,后期的表达量相对前期较高,有报道指出不同品种的草莓FaMYB5基因在果实不同发育时期表达模式不同[9],本研究发现,草莓丰香的FaMYB5表达模式与Elsanta和Sonata品种草莓较相似。FaMYB5是否是类黄酮化合物代谢途径中的负调控因子,及其调控机制有待进一步研究。
本研究采用同源克隆技术,获得丰香草莓MYB类转录因子FaMYB5基因的cDNA全长,通过实时荧光定量PCR分析,在果实发育过程中,FaMYB5基因的表达存在差异,为进一步实现对这个基因的表达调控提供了基础资料。

图8 FaMYB5基因在草莓果实发育过程中的表达模式Fig.8 Expression patterns of FaMYB5 in strawberry fruit development
(References):
[1] DUBOS C,LE GOURRIEREC J,BAUDRY A,et al.MYBL2 is a new regulator of flavonoid biosynthesis in Arabidopsis thaliana[J].Plant Journal for Cell&Molecular Biology,2008,55(6):940-953.
[2] MATSUI K,UMEMURA Y,OHME-TAKAGI M.AtMYBL2,a protein with a single MYB domain,acts as a negative regulator of anthocyanin biosynthesis in Arabidopsis[J].Plant Journal,2008,55(6):954-967.
[3] GONZALEZ A,MENDENHALL J,HUO Y J,et al.TTG1 complex MYBs,MYB5 and TT2,control outer seed coat differentiation[J].Developmental Biology,2009,325(2):412 -421.
[4] QUATTROCCHIO F,VERWEIJ W,KROON A,et al.PH4 of Petunia is an R2R3 MYB protein that activates vacuolar acidification through interactions withbasic-helix-loop-helix transcription factors of the anthocyanin pathway[J].Plant Cell,2006,18(5):1274-1291.
[5] DELUC L,BOGS J,WALKER A R,et al.The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries [J].Plant Physiology,2008,147(4):2041-2053.
[6] ALBERT N W,LEWIS D H,ZHANG H,et al.Members of an R2R3-MYB transcription factor family in Petunia are developmentally and environmentally regulated to control complex floral and vegetative pigmentation patterning[J].Plant Journal for Cell&Molecular Biology,2011,65(5):771-784.
[7] AHARONI A,DEVOS C H,WEIN M,et al.The strawberry FaMYB1 transcription factor suppresses anthocyanin and flavonol accumulation in transgenic tobacco[J].Plant Journal,2001,28(3):319-332.
[8] BURR F A,BURR B,SCHEFFLER B E,et al.The maize repressor-like gene intensifier1 shares homology with the r1/b1 multigene family of transcription factors and exhibits missplicing[J].Plant Cell,1996,8(8):1249-1259.
[9] SCHAART J G,DUBOS C,ROMERO DE LA FUENTE I,et al.Identification and characterization of MYB-bHLH-WD40 regulatory complexes controlling proanthocyanidin biosynthesis in strawberry(Fragaria×ananassa)fruits[J].New Phytologist,2013,197(2):454-467.
[10] HOU Y X,TANG H R,ZHANG Y,et al.Cloning and expression analysis of ascorbate peroxidase gene during fruit development and ripening in Fragaria×ananassa cv.Toyonaka[J].World Journal of Agricultural Sciences,2009,5(6):675-679.
[11] 侯艳霞.草莓抗坏血酸代谢相关酶基因apx和dhar的克隆、序列分析及其表达模式研究[D].雅安:四川农业大学,2010:82-83. HOU Y X.Molecular cloning,sequence analysis,and expression of apx and dhar gene involed in Fragaria×Ananassa ascorbic acid metabolism[D].Ya'an:Sichuan Agricultural University,2010:82-83.(in Chinese with English abstract)
[12] JIA H F,DONG L,SUN J H,et al.Type 2C protein phosphatase ABI1 is a negative regulator of strawberry fruit ripening[J].Journal of Experimental Botany,2013,64(6):1677-1687.
[13] CHEN Q,YU H W,WANG X R,et al.An alternative cetyltrimethyl ammonium bromide-based protocol for RNA isolation from blackberry(Rubus L.)[J].Genetics and Molecular Research,2012,11(2):1773-1782.
[14] 付晓伟,焦健,刘崇怀,等.山葡萄及其杂种Myb相关基因的基因型及 VvmybA1片段的分析[J].果树学报,2014,31(3):353-361. FU X W,JIAO J,LIU C H,et al.Genotyping Myb-related genes in Vitis amurensis and its hybrids and characterizing the VvmybA1 fragment sequences[J].Journal of Fruit Science,2014,31(3):353-361.(in Chinese with English abstract)
[15] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood evolutionary distance and maximum parsimony methods [J].Molecular Biology and Evolution,2011,28(10):2731 -2739.
[16] FRAMPTON J.Myb transcription factors:Their role in growth,differentiation and disease[M].Netherlands:Springer,2004.
(责任编辑 张 韵)
Cloning and expression analysis of MYB transcription factor FaMYB5 gene from strawberry
FENG Chen,WANG Ling,TANG Hao-ru*,XIAO Jie
(College of Horticulture,Sichuan Agricultural University,Chengdu 611130,China)
The full-length cDNA sequence of FaMYB5 gene was cloned from strawberry(Fragaria×ananassa cv. Toyonaka)through homology cloning method.Then,bioinformatics and expression pattern of FaMYB5 were analyzed by some softwares and real-time fluorescent quantitative PCR technique,respectively.Sequence analysis showed that the cDNA of FaMYB5 was 822 bp,encoding 273 amino acids,while the estimated molecular weight and isoelectric point of the putative protein were 29.159 ku and 5.709,and shared high identity of 95.7%with FvMYB5 from woodland strawberry.The expression analysis showed that the expression level of FaMYB5 was gradually increasing during fruit development.The lowest expression was detected at small green(SG)stage,and a reduced peak appeared at white stage,when the expression level was merely higher than SG stage.Thereafter,the expression increased gradually from initially red(IR)stage to the full red(FR)stage when the highest level was detected.In short,full-length cDNA of FaMYB5 was cloned from strawberry,and the expression levels were different during fruit development.
strawberry;FaMYB5;transcription factor;gene cloning;expression pattern
S668.4
A
1004-1524(2016)08-1351-09
10.3969/j.issn.1004-1524.2016.08.12
2016-01-25
高等学校博士学科点专项科研基金项目(20125103110005)
冯琛(1992—),男,河北邢台人,硕士,从事分子生物学在果树上的应用研究。E-mail:fengchensicau@163.com
*
,汤浩茹,E-mail:htang@sicau.edu.cn
