荷斯坦牛TLR6基因c.640G>A多态性与体细胞评分的相关分析
2016-08-18李强子刘丽霞岳炳辉2西北民族大学生命科学与工程学院甘肃兰州730030青海畜牧兽医职业技术学院青海湟源8200
李强子,刘丽霞,岳炳辉2,张 丽,*(.西北民族大学生命科学与工程学院,甘肃兰州730030;2.青海畜牧兽医职业技术学院,青海湟源8200)
荷斯坦牛TLR6基因c.640G>A多态性与体细胞评分的相关分析
李强子1,刘丽霞1,岳炳辉2,张 丽1,*
(1.西北民族大学生命科学与工程学院,甘肃兰州730030;2.青海畜牧兽医职业技术学院,青海湟源812100)
为寻找与乳房炎相关的分子标记,以期为荷斯坦牛的抗病育种提供理论基础,利用PCR-SSCP技术和直接测序技术对宁夏农垦303头中国荷斯坦牛的TLR6基因进行了遗传多态性分析,利用一般线性模型分析TLR6基因c.640G>A突变位点与中国荷斯坦牛体细胞评分(SCS)以及各个因素之间的相关性。结果表明,中国荷斯坦牛TLR6基因c.640G>A突变位点与SCS值和胎次之间存在极显著和显著相关性,GA和AA基因型个体的SCS值极显著低于GG基因型个体(P<0.01)。因此,在中国荷斯坦牛育种中,可尝试将c.640G>A突变位点的GA基因型作为低SCC/SCS牛的优良基因型加以应用。
荷斯坦牛;TLR6基因;c.640G>A;体细胞评分
乳腺炎在泌乳牛群体中发病率极高。导致奶牛乳房炎发生的因素很多,遗传因素是主要因素之一。随着分子生物学的深入研究,利用分子标记技术进行的遗传多态性研究得到了较为广泛的应用。Toll样受体6(Toll-like receptor 6,TLR6)作为一类模式识别受体,能在抗原入侵机体早期激活免疫细胞,并与TLR2聚合形成异嗜二聚体结构而增强TLR2对某些抗原的病原相关分子模式(pathogen-associated molecular patterns,PAMPs)的识别[1],进而防止奶牛乳房炎的发生。研究发现,TLR6基因被定位于牛的第6号染色体上[2]。Axford等[3]发现鼠的TLR6基因主要表达在脾等胸腺免疫器官中。林宝山等[4]研究表明,牦牛TLR6基因在所有组织均有表达,而在脾脏中的表达量最高。但国内外关于牛TLR6基因多态性的报道相对较少。Opsal等[5]在挪威红牛TLR6基因mRNA序列中发现其c.149G>A 1个突变位点。储明星等[6]发现中国荷斯坦牛河北群体存在c.638T>A、c.640G>A、c.1578G>A、c.1644C>A、c.1720G>A、c.1765A>G 6个突变位点,并与奶牛乳房炎之间存在相关性。
基于此,本试验利用PCR-SSCP技术对中国荷斯坦牛宁夏群体的TLR6基因进行多态性分析,并研究变异位点对体细胞评分的遗传效应,以期寻找对乳房炎抗性有显著效应的遗传标记,从而为荷斯坦牛抗病育种和功能基因的分子遗传相关研究提供理论依据。
1 材料与方法
1.1 试验动物和生产性能测定
血样采自宁夏贺兰山奶业有限公司同一奶牛场的303头泌乳期荷斯坦牛,医用采血管尾静脉采血10 mL,-20℃保存。上述荷斯坦牛均是新疆天康集团6头种公牛后代,胎次为1~5胎,全混合日粮饲喂,每日采食至少3次,有完整系谱和1 a的生产性能测定(DHI)报告。生产性能测定期为产后第6天至干乳前6天,间隔为26~33 d。每头泌乳牛采样量为40 mL,按照4∶3∶3(早∶中∶晚)比例进行取样后送至宁夏DHI中心进行检测。
1.2 引物设计与PCR-SSCP
采用苯酚-氯仿抽提法从冻存血样中提取总基因组DNA,去离子水溶解稀释,-20℃保存备用。
根据GenBank上已公布的荷斯坦牛TLR6基因的mRNA序列(GenBank:NM_001001159),用Primer 5.0软件设计1对特异性引物用于扩增中国荷斯坦牛宁夏群体的TLR6基因。引物序列为:F,5′-CAACTTGACCCAACTGAAT-3′;R,5′-TTGTAAGCACGCTAAACTA-3′,由大连宝生物公司合成。PCR扩增体系25 μL:基因组DNA模板1.0 μL,上游引物F(0.25 μmol·L-1)0.5 μL,下游引物R(0.25 μmol·L-1)0.5 μL,Taq PCR Master Mix 13.5 μL,ddH2O 9.5 μL。PCR扩增程序为:95℃预变性4 min;94℃变性30 s,60.5℃退火30 s,72℃延伸30 s,共35个循环;72℃延伸10 min,4℃保存。1%琼脂糖凝胶对其扩增产物进行检测。
吸取3 μL PCR产物加入至7 μL变性上样缓冲液(0.025%溴酚蓝、98%去离子甲酰胺、10 mmol·L-1EDTA、0.025%二甲苯氰)中,加热器98℃变性10 min后迅速冰浴10 min。将变性后的PCR产物依次上样到10%的非变性聚丙烯酰胺凝胶孔中(Acr∶Scr=39∶1),160 V电压、电泳槽水循环温度18℃电泳4 h。电泳结束后利用银染法染色并判定基因型。
1.3 等位基因序列的回收测定与分析
SSCP图谱进行分析判型,将每种基因型的5个不同个体的PCR产物用凝胶纯化回收试剂盒纯化回收后送至北京华大公司进行测序。使用BioEdit和Lasergene软件分析测序峰图并判断突变位点及突变方式。
1.4 一般线性模型构建和统计分析
乳中的体细胞数(somatic cell count,SCC)呈偏离正态性和齐性分布,因而需根据公式体细胞评分(somatic cell score,SCS)=[log2(SCC/ 100)]+3将体细胞数转化为体细胞评分后进行关联分析,其中SCC单位为1 000 mL-1[7]。
应用PopGen 32软件计算各SNP基因型频率、等位基因频率、多态信息含量。使用统计软件包SPSS 19.0中的General Linear Models构建一般线性模型:

上式中,Yijk和Yik为体细胞评分值;μ为群体均值;Ai为第i种基因型固定效应(i=AA、AB、BB);Bj为第 j个产犊月份固定效应(j=1,2,3,…,n);Ck为第k个胎次的固定效应;Ai×Ck为基因型与胎次的互作效应;eijk和eik为随机残差效应。体细胞评分的分析结果用“均值±标准误”表示,方差分析结果显著时应用LSD法进行多重比较。由于用于基因型效应分析的个体均来自于同一饲养场的同一群体,因此,模型中不包含场效应和品种效应。
2 结果与分析
2.1 TLR6基因PCR扩增结果
荷斯坦牛宁夏群体TLR6基因PCR扩增产物经1%琼脂糖凝胶(150 V,15 min)电泳,电泳条带清晰无杂带,与预期目的片段长度(241 bp)相符(图1),可以用于SSCP检测。

图1 中国荷斯坦牛TLR6基因PCR扩增产物Fig.1 PCR products of TLR6 gene in Chinese Holstein
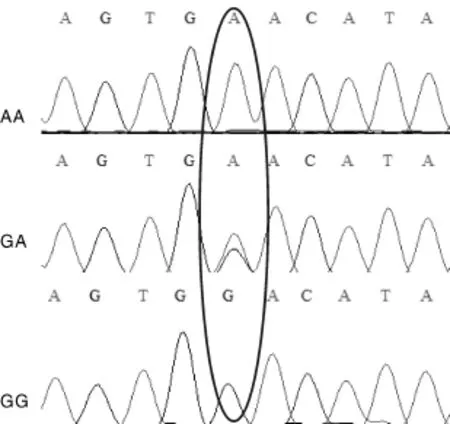
图2 中国荷斯坦牛TLR6基因c.640G>A不同基因型碱基突变情况Fig.2 TLR6 gene c.640G>A mutation of different genotypes in Chinese Holstein

图3 中国荷斯坦牛TLR6基因PCR产物SSCP检测结果Fig.3 SSCP analysis of PCR amplification of TLR6 gene in Chinese Holstein

图4 荷斯坦牛TLR6基因c.640G>A GG/AA基因型编码蛋白序列Fig.4 Holstein TLR6 gene c.640G>A GG/AA genotype encoded protein sequence
2.2 PCR-SSCP检测及序列测定分析
荷斯坦牛宁夏群体TLR6基因PCR扩增产物经SSCP分型后的测序结果与普通牛TLR6基因序列(NM_001001159)对比发现,在c.640G>A处发现1个突变位点(图2),在该位点共检测到2个等位基因G和A,且等位基因G和A均具有纯合型个体,共形成GG、GA、AA 3种基因型(图3)。导致编码蛋白质的氨基酸由酸性天冬氨酸(Asp)变为极性中性天冬酰胺(Asn)(图4)。
2.3 遗传参数分析
遗传参数分析结果表明,等位基因G和A的频率分别为0.546 2和0.453 8,基因型GG、GA和AA的频率分别为0.214 5、0.122 1和0.663 4。有效等位基因数(Ne)、遗传杂合度(He)和多态信息含量(PIC)分别是 1.983 1、0.663 4和0.372 9。PIC介于0.25和0.50之间,属中度多态。经χ2适合性检测表明,荷斯坦牛在该位点已偏离Hardy-Weinberg平衡状态(χ2=37.5215,χ20.01=6.63,P<0.01)。从表1可以看出,GA基因型个体的实际观测数极显著多于理论数,AA基因型的实际观测数极显著少于理论数(表1)。
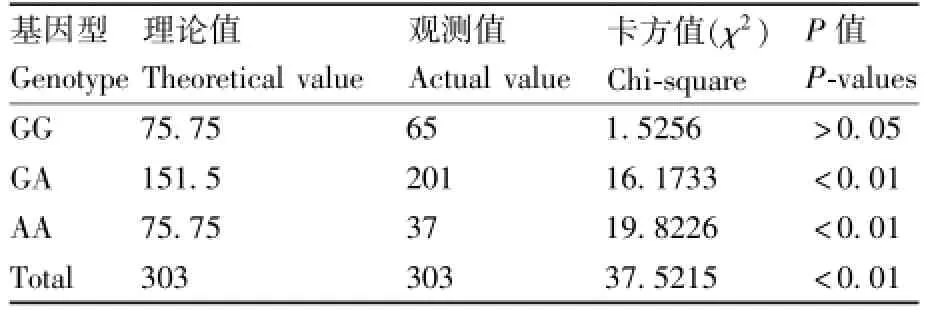
表1 中国荷斯坦牛TLR6基因c.640G>A各基因型卡方分布Table 1 Chi-square distribution of different genotype
2.4 中国荷斯坦牛TLR6基因c.640G>A突变位点与SCS及各因素之间的关联性
用一般线性模型对TLR6基因c.640G>A突变位点形成的不同基因型与SCS值进行分析,所得结果以“最小二乘均值±标准误”表示(表2),基因型和胎次的交互作用见表3。多重比较结果表明,中国荷斯坦牛TLR6基因c.640G>A突变位点形成的不同基因型对SCS均达到极显著水平(P<0.01),其中,GG基因型个体的SCS值极显著高于GA和AA基因型个体;胎次效应显著(P<0.05),而产犊月份对SCS的影响不大(P>0.05)。基因型和胎次的交互作用显示,1胎次和2胎次中AA基因型个体的SCS值显著低于GG基因型个体(P<0.05)。

表2 中国荷斯坦牛TLR6基因c.640G>A突变位点对SCS的影响Table 2 Genotype effects on SCS of TLR6 gene c.640G>A locus mutation in Chinese Holstein
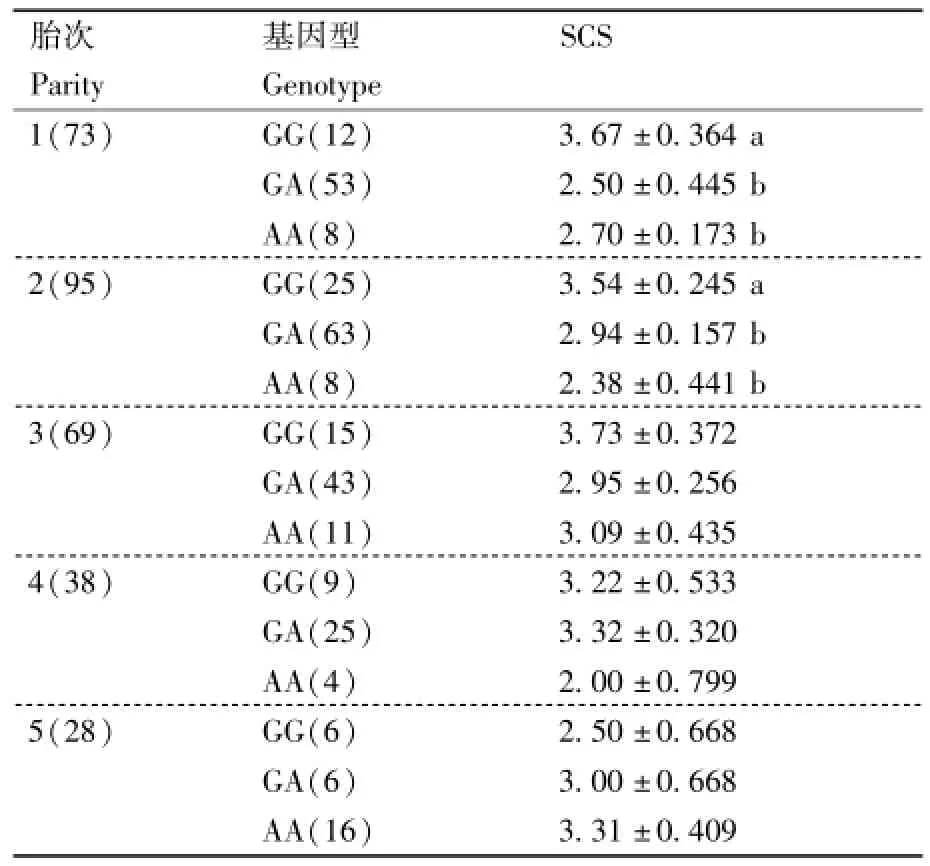
表3 胎次和TLR6基因c.640G>A基因型对中国荷斯坦牛SCS的影响Table 3 Effects of parity and genotype of TLR6 gene c. 640G>A locus mutation on SCS in Chinese Holstein
3 结论与讨论
3.1 TLR6基因多态性较丰富
Kesh等[8]在研究移植造血干细胞病人的TLR6基因mRNA序列时,发现了3个突变位点。Pierik等[9]在肠炎病人的TLR6基因mRNA序列中发现了1个突变位点。Opsal等[5]在挪威红牛TLR6基因mRNA序列中发现c.149G>A 1个突变位点。Shinkai等[10-11]克隆猪TLR6基因全长序列时发现11个突变位点。储明星等[6]研究发现,荷斯坦牛 TLR6基因存在 6个突变位点。Bergman等[12]分析了野猪与家猪TLR6基因变异差异。魏麟等[13]利用PCR-RFLPs技术检测到猪TLR6基因c.397C>T 1个突变位点。Xiao等[14]在广东人TLR6基因中发现1个突变位点。本研究在宁夏荷斯坦牛TLR6基因中发现与褚明星等[6]的研究相同的c.640G>A突变位点,并引起第70位非极性酸性天冬氨酸(Asp)变为极性中性天冬酰胺(Asn),但未发现c.638T>A突变位点。这可能是2个研究所选用的奶牛群体不同,遗传背景、选育方式和管理模式不尽相同而造成的。而该群体在c.640G>A突变位点已显著偏离Hardy-Weinberg平衡状态(P<0.05),这也极可能与人工选育过程有关。
3.2 TLR6基因突变位点对SCS极显著的影响
TLR6基因作为致病性分子受体和内生相关分子在先天性免疫系统占据重要的地位[15-16]。Opsal等[5]证明挪威红牛TLR6基因c.149G>A突变对乳房炎发病率的影响不显著(P>0.05)。Petzl等[17]对德国感染过大肠埃希菌和葡萄球菌的14头第一泌乳期荷斯坦牛的TLR6基因进行表达分析,结果显示基本不表达。储明星等[6]研究发现,TLR6基因c.638T>A、c.640G>A和c. 1720G>A 3个突变位点可以作为乳房炎抗性遗传分子标记。荷斯坦牛宁夏群体TLR6基因c. 640G>A突变产生的不同基因型对SCS极显著相关(P<0.01),GA型和AA型个体的SCS值极显著低于GG型个体(P<0.01)。基因型和胎次的交互作用显示,1胎次和2胎次中GA型和AA基因型个体的SCS值也显著低于GG基因型个体(P<0.05),随着胎次的增加,GG和GA基因型个体的SCS值有上升趋势,而AA基因型个体的SCS值呈下降趋势。熊本海等[18]和毛永江等[19]的研究也表明,随着胎次的增加,SCS值呈逐渐上升趋势。但本试验中,SCS值在1~3胎次中逐渐上升的趋势比较明显,这可能与4胎次和5胎次奶牛数量较少有关。
从表1可知,本研究的GA基因型实际观察值多于理论值,AA基因型实际观察值少于理论值,结合表2和表3的结果可知,GA基因型和AA基因型个体的SCS值并不存在显著差异。研究发现,编码蛋白质活性中心的大多数氨基酸残基为非极性的疏水氨基酸,这些小基团位置的变化,很有可能改变该蛋白质的活性中心构象,甚至空间构象,因而会进一步影响其功能的发挥。由于c.640G>A突变位点会引起第70位非极性酸性Asp变为极性中性Asn,因此c.640G>A极有可能导致其编码蛋白质的高级结构发生改变,进而使荷斯坦牛信号转导、胁迫应答和免疫应答等的生理功能发生改变。如果突变纯合型个体在除SCS值以外的性状上不存在明显优势,甚至有些性状表现劣于杂合型个体的话,在长期的人工选育过程中,突变纯合型AA基因型个体就会被逐渐淘汰,使AA基因型个体的实际观察值小于其理论值。SCC/SCS是选择降低乳腺炎发生率最合适的性状,对低SCC/SCS牛的选择可以降低乳腺炎发生率。因此,在荷斯坦牛育种中可以尝试将c.640G>A的GA基因型作为低SCC/ SCS牛的优良基因型加以应用。
(References):
[1] CAROLYN S J,NATHALIE A,JOSHUA M,et al.TLR signaling tailors innate immune responses in human microglia and astrocytes[J].The Journal of Immunology,2005,175(7):4320-4330.
[2] MCGUIRE K,JONES M,WERLING D,et al.Radiation hybrid mapping of all 10 characterized bovine Toll-like receptors [J].Animal Genetics,2006,37(1):47-50.
[3] AXFORD R F E,BISHOP S C,NICHOLAS F W,et al. Breeding for disease resistance in farm animals[M].Wallingford:CABI Publishers,2000:243-252.
[4] 林宝山,兰道亮,黄偲,等.牦牛TLR6基因的克隆、序列分析及其表达分布研究[J].东北农业大学学报,2014,45 (7):91-97. LIN B S,LAN D L,HUANG S,et al.Cloning,sequence analysis of TLR6 gene of yak and expression and distribution in tissues[J].Journal of Northeast Agricultural University,2014,45(7):91-97.(in Chinese with English abstract)
[5] OPSAL M A,VAGE D I,HAYES B,et al.Genomic organization and transcript profiling of the bovine Toll-like receptor gene cluster TLR6-TLR1-TLR10[J].Gene,2006,384(2):45-50.
[6] 储明星,李春苗,石万海,等.荷斯坦母牛TLR6基因多态性及其与体细胞评分关系的研究[J].畜牧兽医学报,2009,40(11):1621-1629. CHU M X,LI C M,SHI W H,et al.Polymorphism of TLR6 gene and its relationship with somatic cell score in Holstein cows[J].Acta Veterinaria et Zootechnica Sinica,2009,40 (11):1621-1629.(in Chinese with English abstract)
[7] SHOOK G E.Genetic improvement of mastitis through selection on somatic cell count[J].The Veterinary Clinics of North American Food Animal Practice,1993,9(3):563-581.
[8] KESH S,MENSAH N Y,PETERLONGO P,et al.TLR1 and TLR6 polymorphisms are associated with susceptibility to invasive aspergillosis after allogeneic stem cell transplantation[J]. Annals of the New York Academy of Science,2005,1026(1):95-103.
[9] PIERIK M,JOOSSENS S,VAN STEEN K,et al.Toll-like receptor-1,-2,and-6 polymorphisms influence disease extension in inflammatory bowel diseases[J].Inflammatory Bowel Diseases,2006,12(1):1-8.
[10] SHINKAI H,MUNETA Y,SUZUKI K,et al.Porcine Tolllike receptor 1,6,and 10 genes:complete sequencing of genomic region and expression analysis[J].Molecular Immunology,2006,43(9):1474-1480.
[11] SHINKAI H,TANAKA M,MOROZUMI T,et al.Biased distribution of single nucleotide polymorphisms(SNPs)in porcine Toll-like receptor 1(TLR1),TLR2,TLR4,TLR5,and TLR6 genes[J].Immunogenetics,2006,58(4):324 -330.
[12] BERGMAN I M,ROSENGREN J K,EDMAN K,et al.European wild boars and domestic pigs display different polymor-phic patterns in the Toll-like receptor(TLR1),TLR2,and TLR6 genes[J].Immunogenetics,2010,62(1):49-58.
[13] 魏麟,陈斌,黎晓英,等.猪TLR6基因MspⅠ多态性与生长性状相关性研究[J].中国农学通报,2011,27 (11):5-9. WEI L,CHEN B,LI X Y,et al.Associations between Msp Ⅰpolymorphism of TLR6 gene and growth traits of pigs[J]. Chinese Agricultural Science Bulletin,2011,27(11):5-9. (in Chinese with English abstract)
[14] XIAO W J,GONG Y X,LIU Z H,et al.Single nucleotide polymorphisms and haplotypes of TLR6 gene inChinese Cantonese population[J].International Journal of Immunogenetics,2010,37(4):245-251.
[15] KADOWAKI N,HO S,ANTONENKO S,et al.Subsets of human dendritic cell precursors express different Toll-like receptors and respond to different microbial antigens[J].The JournalofExperimentalMedicine,2001,194(6):863-869.
[16] PICCININI A M,MIDWOOD K S.Dampening inflammation by modulating TLR signaling[EB/OL].(2010-08-20)[2016-01-20].http://www.hindawi.com/journals/mi/ 2010/672395/
[17] PETZL W,ZERBE H,GüNTHER J,et al.Escherichia coli,but not Staphylococcus aureus triggers anearly increased expression of factors contributing to the innate immune defense in the udder of the cow[J].Veterinary Research,2008,39 (2):18.
[18] 熊本海,易渺,杨琴,等.中国北方荷斯坦奶牛乳成分及相关指标的季节性与胎次变化规律研究[J].畜牧兽医学报,2013,44(1):31-37 XIONG B H,YI M,YANG Q,et al.Study on seasonal and parity variation characteristics of raw milk composition and related traits of Chinese Holstein in the north of China[J].Acta Veterinaria et Zootechnica Sinica,2013,44(1):31-37. (in Chinese with English abstract)
[19] 毛永江,常玲玲,陈莹,等.影响中国荷斯坦牛SCS分布的因素分析[J].中国畜牧杂志,2011,47(7):21-31. MAO Y J,CHANG L L,CHEN Y,et al.Factors of Chinese Holstein SCS distribution[J].Chinese Journal of Animal Science,2011,47(7):21-31.(in Chinese)
(责任编辑 张 韵)
Genetic polymorphism of TLR6 gene and its associations with somatic cell score in Chinese Holstein cattle
LI Qiang-zi1,LIU Li-xia1,YUE Bing-hui2,ZHANG Li1,*
(1.College of Life Science and Engineering,Northwest University for Nationalities,Lanzhou 730030,China;2.Qinghai Vocational and Technical Institute of Animal Husbandry and Veterinary,Huangyuan 812100,China)
To search the molecular markers that are associated with mastitis and to provide theoretical basis for the Holstein cattle breeding and disease resistance,the polymoprhisms of TLR6 gene in 303 Holstein cattle in Ningxia were detected by PCR-SSCP technique,and the effect of TLR6 gene c.640G>A locus mutation on somatic cell score (SCS)of milk and various factors was analyzed using general linear model.The results showed that there was a significant relationship between TLR6 gene c.640G>A locus mutation and SCS and parity.The GA and AA genotype had significantly lower SCS than GG genotypes(P<0.01).So,GA genotype of c.640G>A locus mutation could be applied as a low SCC/SCS superior genotypes in Chinese Holstein breeding.
Holstein cattle;TLR6 gene;c.640G>A;somatic cell score
S823.2
A
1004-1524(2016)08-1332-06
10.3969/j.issn.1004-1524.2016.08.09
2016-03-10
西北民族大学国家级大学生创新创业训练计划项目(201510742084);西北民族大学引进人才科研项目(xbmuyjrc201316)
李强子(1993—),男,河北赵县人,本科生,研究方向为分子生物学。E-mail:lqz2015@sina.cn
*
,张丽,E-mail:shiningstar2013@sina.cn
