碳源对多粘类芽孢杆菌生长和多粘菌素E合成的影响
2016-08-18孙仲奇裘娟萍陆建卫赵春田浙江工业大学生物工程学院浙江杭州3004浙江钱江生物化学股份有限公司浙江海宁34400
孙仲奇,裘娟萍,陆建卫,赵春田,*(.浙江工业大学生物工程学院,浙江杭州3004;.浙江钱江生物化学股份有限公司,浙江海宁34400)
碳源对多粘类芽孢杆菌生长和多粘菌素E合成的影响
孙仲奇1,裘娟萍1,陆建卫2,赵春田1,*
(1.浙江工业大学生物工程学院,浙江杭州310014;2.浙江钱江生物化学股份有限公司,浙江海宁314400)
为探究提高多粘菌素E产量的方法,在发酵培养基中分别添加葡萄糖、蔗糖、麦芽糖、乳糖和可溶性淀粉,应用平板菌落计数和HPLC法研究了其对多粘类芽孢杆菌生长和多粘菌素E产量的影响。结果表明,5种碳源对多粘类芽孢杆菌的生长和多粘菌素E产量的影响不同,可溶性淀粉是菌体生长的最适碳源,且多粘菌素E产量依次为可溶性淀粉>乳糖>蔗糖>麦芽糖>葡萄糖。可溶性淀粉有助于延长多粘菌素E的产素期和提高其合成速率,与葡萄糖作碳源相比,多粘菌素E的产量和合成速率分别提高了111%和60%。因此,可溶性淀粉是多粘菌素E合成的最适碳源。
多粘类芽孢杆菌;多粘菌素E;碳源;可溶性淀粉
多粘菌素E(polymyxin E)是一种由多粘类芽孢杆菌(Paenibacillus polymyxa)产生的多肽类抗生素[1],主要通过破坏细胞膜的通透性[2]和诱导胞内羟基自由基的产生[3],使菌体死亡。因其抗畜禽革兰氏阴性菌作用强、毒性小、安全性高、消化道不易吸收、药物残留低,常用于饲料添加剂,是一种安全的促生长类抗生素[4-5]。
多粘菌素E由Dab、Thr、Leu和疏水酰基尾组成,通过多粘菌素合成酶PmxA、PmxB和PmxE经非核糖体途径合成,再经过转运蛋白PmxC和PmxD将其运输到细胞外[6]。多粘菌素E前体氨基酸Dab由ectB基因编码的二氨基丁酸氨基转移酶(diaminobutyrate-2-oxoglutarate transaminase,EctB)催化L-Asp合成[7-9]。其前体氨基酸由机体通过初级代谢途径合成[10],且非核糖体合成途径中氨基酸的延伸需要消耗大量的ATP[11],因此,适宜的碳源对多粘菌素E的高产至关重要。葡萄糖是多种抗生素合成过程中较好的碳源和能源,但是其分解代谢阻遏效应(carbon catabolite repression,CCR)会抑制多种抗生素的合成,例如青霉素、头孢菌素等[11],而一些非速效碳源可以促进抗生素的生物合成,如植物油可以促进头孢菌素和红霉素的产生[12-13],淀粉可以促进阿维菌素和普那霉素的合成[14-15]。因此,筛选有利于抗生素合成的碳源就显得非常重要。本研究通过分析不同碳源对多粘菌素E发酵过程中pH值、残糖和多粘菌素E产量等参数的影响,筛选出最佳的碳源,为进一步提高多粘菌素E产量提供理论依据。
1 材料与方法
1.1 菌株及培养基
1.1.1 菌株来源
多粘类芽孢杆菌由浙江工业大学微生物研究所保藏。
1.1.2 培养基
固体培养基(g·L-1):牛肉膏10.0,蛋白胨15.0,葡萄糖10.0,酵母粉2.0,氯化钠3.0,Fe-SO4·7H2O 0.1,琼脂20.0,pH 7.0,115℃灭菌30 min。
种子培养基[16],pH 7.0,115℃灭菌30 min。
发酵培养基[16],初始发酵培养基中含有45 g· L-1葡萄糖(对照组),其他试验组分别含有45 g· L-1的可溶性淀粉、乳糖、蔗糖、麦芽糖,pH 7.0,115℃灭菌30 min。
1.2 仪器与试剂
LC-20AD岛津液相色谱仪(日本岛津公司),PB-10 pH计(德国Sartorius公司),ZHWY-2112B恒温培养振荡器(上海智诚分析仪器制造有限公司),SW-CJ-1F超净工作台(苏净集团安泰公司)。葡萄糖、蔗糖(广东光华化学厂有限公司),麦芽糖、乳糖(上海伯奥生物科技有限公司),可溶性淀粉(国药集团化学试剂有限公司)。
1.3 菌株培养
斜面培养:将多粘类芽孢杆菌单菌落接种于新鲜斜面,30℃恒温培养48 h。
1级种子培养:将多粘类芽孢杆菌新鲜的斜面菌种接种于装液量50 mL/250 mL三角瓶的1级种子培养基中,摇床转速200 r·min-1,30℃培养24 h。
2级种子培养:将1级种子液以10%接种量接种于装液量100 mL/500 mL三角瓶的2级种子培养基中,摇床转速 200 r·min-1,30℃培养24 h。
摇瓶发酵培养:按10%接种量将2级种子培养液接种于装液量50 mL/250 mL三角瓶的发酵培养基中,摇床转速 200 r·min-1,30℃培养96 h。
1.4 试验设计及测定方法
试验共设蔗糖、乳糖、麦芽糖和可溶性淀粉4个处理,以葡萄糖为对照组,每个处理重复3次,发酵期间每12 h取样测定其pH、还原糖、总糖、生物量和多粘菌素E效价等参数。还原糖和总糖含量测定采用 3,5-二硝基苯酚法(DNS法)[17-18];pH测定采用 PB-10 pH计测定;生物量测定采用平板计数法[19];多粘菌素E效价的测定采用HPLC法[20]。
1.5 数据处理
利用Excel和Statview统计软件进行数据分析和差异显著度分析,数据处理后用Origin 8.0绘图。
1.5.1 多粘菌素E相对效价的计算
根据公式(1)和(2)计算多粘菌素E的效价和相对效价。
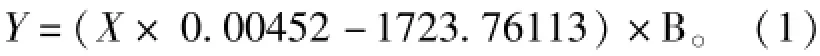
式(1)中:Y为发酵液多粘菌素E效价(U· mL-1);X为液相图谱峰面积;B为稀释倍数;0.004 52和1 723.761 13分别表示多粘菌素E标准曲线的x斜率和y轴截距;此标准曲线由实验室以多粘菌素E硫酸盐标准样品的水溶液制作。
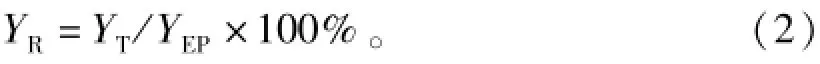
式(2)中:YT为T时刻各取样点发酵液样品多粘菌素E的效价(U·mL-1);YEP为葡萄糖对照组发酵终点时多粘菌素E的效价(U·mL-1);YR为多粘菌素E的相对效价(%)。
1.5.2 单位菌体多粘菌素E相对效价的计算
根据公式(3)和(4)计算单位菌体多粘菌素E的相对效价YPR(%),用于表征碳源对多粘菌素E合成能力的影响。

式(3)中:YP为发酵终点各组的效价(U· mL-1);Bmax为发酵过程菌体生物量的最大值(106cfu·mL-1),以106cfu为1个菌体单位;YPB为各组发酵终点的效价与最大菌体生物量的比值(U·106cfu-1)。
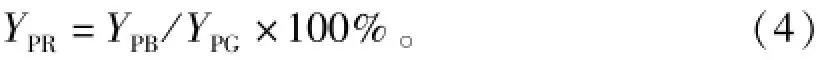
式(4)中:YPB为试验组发酵终点的效价与最大菌体生物量的比值(U·106cfu-1);YPG为对照组发酵终点的效价与最大菌体生物量的比值(U· 106cfu-1);YPR则为单位菌体多粘菌素E的相对效价(%)。
1.5.3 多粘菌素E相对合成速率的计算
由公式(5)和公式(6)分别计算试验组和对照组各个时间段多粘菌素 E的合成速率(U· mL-1·h-1)和相对合成速率(%),用于表征碳源对多粘菌素E合成速率的影响。

式(5)中:YRn-YRr为各组单位体积发酵液中每12 h合成的多粘菌素E的量(U·mL-1);YS为每h多粘菌素 E的平均合成速率(U·mL-1· h-1)。
式(6)中:YSCM为试验组多粘菌素E的最大合成速率(U·mL-1·h-1);YSGM为葡萄糖对照组多粘菌素E的最大合成速率(U·mL-1·h-1);YSR为多粘菌素E的相对合成速率(%)。
1.5.4 碳源转化为多粘菌素E相对转化率的计算
根据公式(7)和(8)计算碳源的相对转化率

式(7)中:C为碳源转化为多粘菌素E的转化率(U·g-1);MS-MF为单位体积发酵液中碳源的消耗量,即初始培养基添加量与发酵结束后培养基残留量的差值(g·L-1);YF为发酵终点多粘菌素E的效价(U·L-1)。
式(8)中:CR为碳源转化为多粘菌素E的相对转化率(%);CSM为发酵过程中试验组碳源转化为多粘菌素E的转化率(U·g-1);CGM为发酵过程中对照组葡萄糖转化为多粘菌素E的转化率(U·g-1)。
2 结果与分析
2.1 不同葡萄糖质量浓度对多粘类芽孢杆菌生长的影响
将相同含量的多粘类芽孢杆菌接入不同质量浓度葡萄糖的液体培养基中,30℃培养22 h,取样,测定D600,结果如图1所示。培养基中初始葡萄糖浓度小于20 g·L-1有利于多粘类芽孢杆菌的生长,当葡萄糖浓度达到20 g·L-1时,液体培养基中菌体含量达到最大值。葡萄糖浓度大于20 g·L-1会抑制多粘类芽孢杆菌的生长,葡萄糖质量浓度越高,菌体生长受抑制程度越严重。当葡萄糖浓度为50 g·L-1时,其最大菌体含量仅为以20 g·L-1葡萄糖最大菌体含量的64%。表明一定浓度的葡萄糖促进多粘类芽孢杆菌的生长,而高浓度的葡萄糖则会抑制多粘类芽孢杆菌的生长。
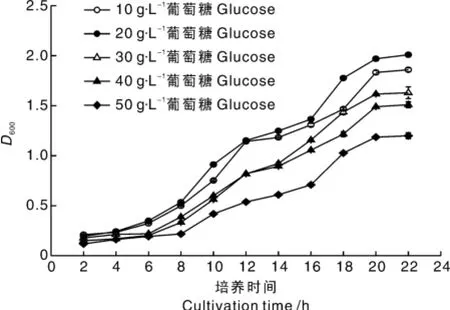
图1 不同葡萄糖质量浓度下多粘类芽孢杆菌的生长曲线Fig.1 The growth curve of Paenibacillus polymyxa in different concentrations of glucose
2.2 碳源对多粘类芽孢杆菌生长的影响
将多粘类芽孢杆菌按照1.3节的方法进行培养,由图2可知,不同碳源培养基中多粘类芽孢杆菌的生长趋势相似。在发酵0—12 h,葡萄糖对照组多粘类芽孢杆菌开始快速生长,但此时的菌体含量相对最少,之后菌体开始快速生长,在36 h生物量最先达到最高值,可能葡萄糖作为速效碳源被菌体迅速利用,从而促进菌体生长;发酵36 h后菌体开始进入衰亡期,多粘类芽孢的生长受到抑制。在蔗糖、乳糖和麦芽糖试验组中,发酵48 h内菌体处于快速生长期,之后菌体开始进入衰亡期。而在可溶性淀粉试验组中,发酵0—60 h,多粘类芽孢杆菌处于快速生长期,至60 h菌体量达到最大,可能因为可溶性淀粉的利用需要菌体合成的淀粉酶将其分解为葡萄糖才能进入同化途径供给菌体生长,有一定的生长延迟现象。5组试验组中,可溶性淀粉试验组的生物量最后达到最高。
2.3 碳源对多粘菌素发酵过程中pH值、还原糖、总糖含量的影响
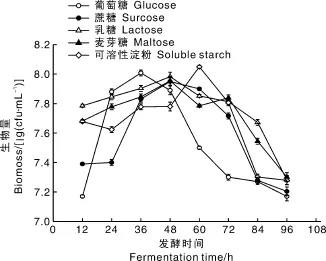
图2 多粘菌素E发酵过程中碳源对多粘类芽孢杆菌生长的影响Fig.2 Influence of carbon sources on the growth of Paenibacillus polymyxa during polymyxin E fermentation
培养基pH值是菌体生长代谢的重要表征,对抗生素的合成至关重要[21]。由图3-A可知,各试验组发酵过程中,pH变化趋势基本相同,由于碳源的快速消耗,pH值呈现下降趋势;发酵36 h后,不同碳源引起的pH值差异趋于明显,其中,葡萄糖对照组pH呈现最高值,而可溶性淀粉试验组的pH值维持在最低水平。从图3-B和3-C可知,在发酵过程中,各试验组对糖的利用趋势相似;发酵开始后,各试验组还原糖含量迅速下降,发酵48 h后葡萄糖对照组的还原糖含量不再变化,维持在最高水平,而可溶性淀粉试验组的还原糖含量维持在最低水平;各试验组的总糖含量基本维持在相同水平。

图3 碳源对多粘菌素E发酵过程中pH值、还原糖和总糖的影响Fig.3 Influence of carbon sources on pH,reducing sugar and total sugar during polymyxin E fermentation
2.4 碳源对多粘菌素E产量及其合成速率的影响
从图4-A可见,不同碳源对多粘菌素E产量的影响不同,其最终效价依次为可溶性淀粉>乳糖>蔗糖>麦芽糖>葡萄糖。其中,可溶性淀粉和乳糖试验组的多粘菌素E合成能力高于其他组,其最终相对效价分别是以葡萄糖对照组的2.11和1.58倍。可溶性淀粉试验组中,多粘类芽孢杆菌在12 h开始合成多粘菌素E,葡萄糖对照组和其他试验组在24 h才开始合成多粘菌素E。对比图3-B和图3-C,推测高浓度的葡萄糖不利于多粘菌素E的合成,而可溶性淀粉试验组中淀粉酶的缓慢释放所产生低浓度的还原糖没有葡萄糖效应,有利于多粘菌素E的生物合成。从图4-B多粘菌素E合成速率可知,不同试验组中多粘菌素E的合成速率趋势相似,均在36~48 h达到最大合成速率,之后开始下降。发酵84 h之后,葡萄糖对照组、蔗糖试验组和麦芽糖试验组的合成速率降为0,而乳糖试验组和可溶性淀粉试验组依然可以维持一定的合成速率。葡萄糖对照组合成速率最高值相对最低,乳糖试验组和可溶性淀粉试验组的相对合成速率最大,分别比葡萄糖对照组高51%和60%,说明非速效碳源——乳糖和可溶性淀粉可以提高多粘菌素E的合成速率,同时相对延长合成时间,从而提高多粘菌素E的产量。
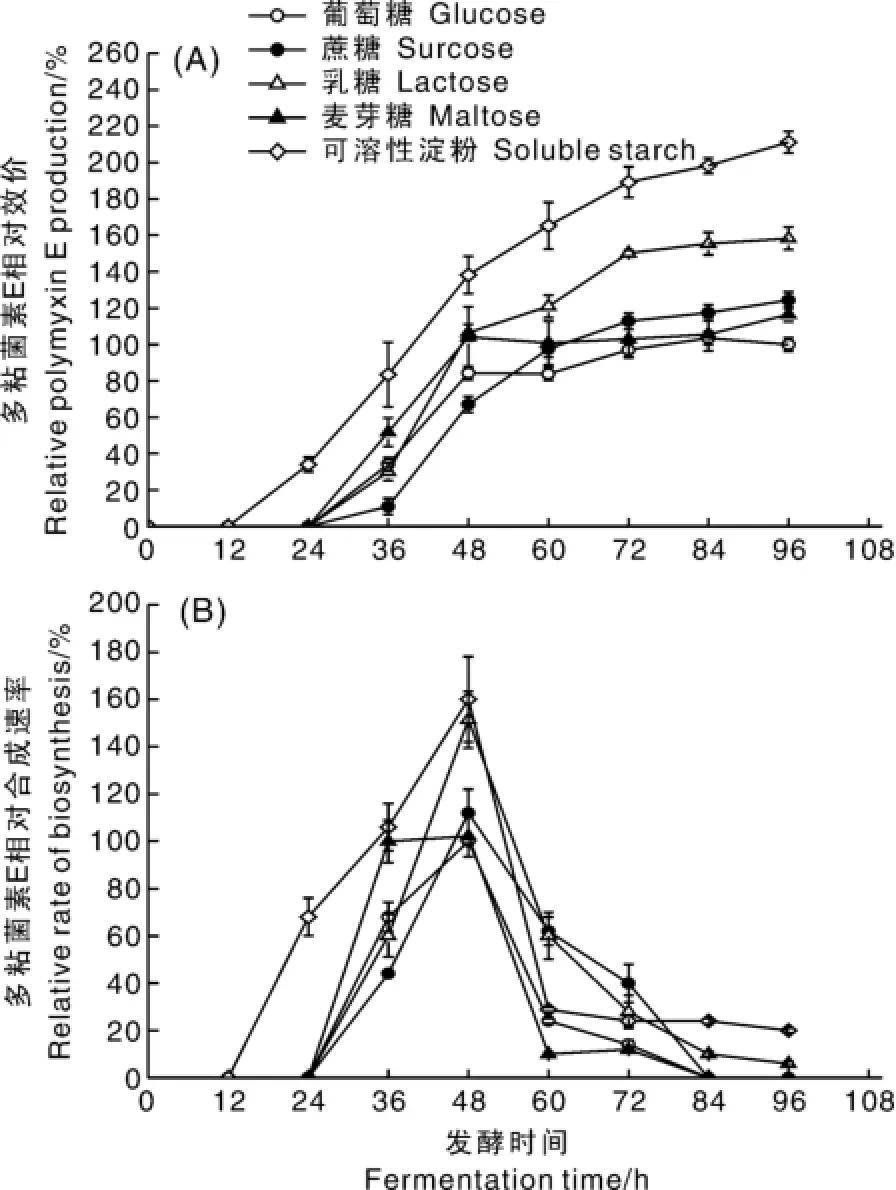
图4 碳源对多粘菌素E相对效价及相对合成速率的影响Fig.4 Influence of carbon sources on relative polymyxin E production and relative synthetic rate of polymyxin E
2.5 碳源对单位菌体多粘菌素E产量的影响
多粘菌素E是在细胞内合成的,其合成与细胞的生长有一定的相关性。根据1.5.2节公式(3)和(4)计算单位菌体的多粘菌素E产量,横坐标表示不同碳源的试验组别,结果见图5。可溶性淀粉试验组中单位菌体合成多粘菌素E的能力最强,乳糖试验组次之,葡萄糖对照组最低,推测乳糖和可溶性淀粉可以调节多粘类芽孢杆菌的次级代谢,促进多粘菌素E的生物合成。
2.6 碳源转化为多粘菌素E的差异
根据1.5.4节方法计算不同碳源的相对转化率,结果如图6所示。在发酵过程中不同碳源的多粘菌素E转化效率不同。在各试验组中,可溶性淀粉—多粘菌素E的相对转化率最高,乳糖—多粘菌素E的相对转化率次之,葡萄糖—多粘菌素E的相对转化效率最低。由此可知,可溶性淀粉更有利多粘类芽孢杆菌合成多粘菌素E。2.7 不同碳源对多粘类芽孢杆菌合成多粘菌素的影响
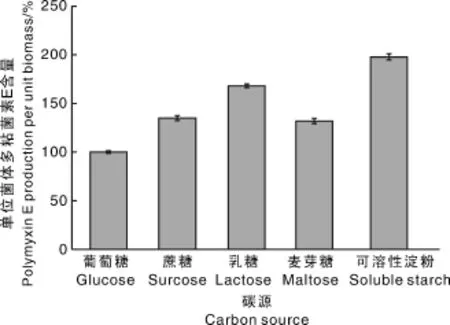
图5 碳源对单位菌体多粘菌素E产量的影响Fig.5 Influence of carbon sources on the polymyxin E production per unit biomass

图6 碳源转化为多粘菌素E的相对效率Fig.6 The relative conversion efficiency of carbon sources to the polymyxin E production
由上述试验结果可知,多粘类芽孢杆菌在不同碳源条件下进行发酵,其合成多粘菌素E的结果不同,将其主要发酵参数进行汇总,结果见表1。由表1可知,各试验组消耗的碳源无明显差别,最大生物量相近,但是多粘菌素E相对效价相差较大,其中,以可溶性淀粉为碳源的试验组相对效价最高、合成速率最快、单位菌体合成能力最强,其最大值分别为葡萄糖对照组的211%、160%和197%。上述结果表明,多粘类芽孢杆菌利用可溶性淀粉转化为多粘菌素E的效率高,合成速率快,使单位菌体合成多粘菌素E的能力增强,因此,可溶性淀粉是多粘菌素E生物合成的最适碳源。

表1 不同碳源培养基中多粘类芽孢杆菌合成多粘菌素E的比较Table 1 The comparison of the synthesis of polymyxin E by Paenibacillus polymyxa in the culture medium containing different carbon sources
3 讨论
多粘菌素E作为动物饲养促长药物,主要用于治疗革兰氏阴性菌(尤其是耐药性革兰氏阴性菌)引起的感染,抗菌作用强,饲养效果好,未来市场需求极大[4],但是发酵过程中容易出现碳代谢阻遏效应[22],导致多粘菌素E产量较低。
在抗生素发酵过程中,葡萄糖是广泛应用的能源和碳源,能被菌体快速利用,维持菌体生长和初级代谢,为次级代谢产物的合成提供前体,但是高浓度的葡萄糖会通过碳阻遏效应抑制抗生素合成相关基因转录和相关酶的活性,从而抑制抗生素的合成[11,22]。而淀粉作为非速效碳源,能够避免葡萄糖引起的碳阻遏效应,保障菌体的生长和次级代谢产物的合成。陈小煌等[23]发现可溶性淀粉对多粘类芽孢杆菌的生长优于葡萄糖,陶银英[24]的研究表明,可溶性淀粉对多粘菌素E的促进作用优于葡萄糖,本研究结论与此一致。
多粘菌素E作为一种多肽类抗生素,其前体氨基酸通过TCA循环和氨基酸合成途径合成。因此,菌体初级代谢强度与多粘菌素E产量有一定的相关性。发酵过程pH结果表明,可溶性淀粉试验组菌体初级代谢过程较强,能产生较多的副产物有机酸,使pH下降(图3),而在葡萄糖对照组中,初始葡萄糖质量浓度高,导致发酵中后期菌体自溶过早(图2),pH较高(图3),使菌体初级代谢和次级代谢异常,多粘菌素E产量较低。同时,刘铁军等[25]对多肽类抗生素杆菌肽的发酵研究表明,适宜的葡萄糖质量浓度有利于避免碳阻遏效应,维持初级代谢和次级代谢相对平衡,提高抗生素产量。由此可知,在可溶性淀粉试验组中,多粘类芽孢杆菌能够分解可溶性淀粉维持一定量的葡萄糖质量浓度,可以平衡发酵过程中初级代谢和次级代谢强度,既能为菌体生长提供必需的前提也能为多粘菌素E的合成提供前提氨基酸。
此外,研究发现,在多粘菌素E的生物合成中,多糖聚合物可溶性淀粉高于蔗糖和葡萄糖,其可溶性淀粉试验组中,较低浓度的葡萄糖能够避免碳阻遏效应,维持菌体良好的生长状态。同时,对发酵过程中多粘菌素E效价、合成速率以及相对转化效率的研究发现,可溶性淀粉能够提高多粘菌素E的合成速率,延长产素期,维持较高的转化率,从而使多粘菌素E的产量提高,是合成多粘菌素E较为理想的非速效碳源。
(References):
[1] AZZOPARDI E A,FERGUSON E L,THOMAS D W,et al. Colistin past and future:A bibliographic analysis[J].Journal of Critical Care,2013,28(2):13-19.
[2] LI C H,BUDGE L P,DRISCOLL C D,et al.Incremental conversion of outer-membrane permeabilizers into potent antibiotics for Gram-negative bacteria[J].American Chemical Society,1999,121(5):931-940.
[3] SAMPSON T R,LIU X,SCHROEDER M R,et al.Rapid killing of Acinetobacter baumannii by polymyxins is mediated by a hydroxyl radical death pathway[J].Antimicrobial Agents and Chemotherapy,2012,56(11):5642-5649.
[4] 张纯萍,肖希龙.硫酸粘杆菌素微生物检定法的改进[J].中国兽药杂志,2002,36(4):33-35. ZHANG C P,XIAO X L.Improved microbiological assay for determining colistin sulfate in serum[J].Chinese Journal of Veterinary Drug,2002,36(4):33-35.(in Chinese)
[5] EVANS M E,FEOLA D J,RAPP R P.Polymyxin B sulfate and colistin:old antibiotics for emerging multiresistant Gramnegative bacteria[J].The Annals of Pharmacotherapy,1999,33(9):960-967.
[6] CHOI S K,PARK S Y,KIM R,et al.Identification of a polymyxin synthetase gene cluster of Paenibacillus polymyxa and heterologous expression of the gene in Bacillus subtilis[J]. Journal of Bacteriology,2009,191(10):3350-3358.
[7] PARK S Y,CHOI S K,KIM J,et al.Efficient production of polymyxin in the surrogate host Bacillus subtilis by introducing a foreign ectB gene and disrupting the abrB gene[J].Applied and Environmental Microbiology,2012,78(12):4194 -4199.
[8] RESHETNIKOV A S,KHMELENINA V N,MUSTAKHIMOV I I,et al.Genes and enzymes of ectoine biosynthesis in halotolerant methanotrophs[J].Methods in Enzymology,2011,495:15-30.
[9] SCHUBERT T,MASKOW T,BENNDORF D,et al.Continuous synthesis and excretion of the compatible solute ectoine by a transgenic,nonhalophilic bacterium[J].Applied and Environmental Microbiology,2007,73(10):3343-3347.
[10] 王镜岩,朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2002.
[11] ROKEM J S,LANTZ A E,NIELSEN J.Systems biology of antibiotic production by microorganisms[J].Natural Product Reports,2007,24(6):1262-1287.
[12] HAMEDI J,MALEKZADEH F.Enhancing of erythromycin production by Saccharopolyspora erythraea with common and uncommon oils[J].Journal of Industrial Microbiology and Biotechnology,2004,31(10):447-456.
[13] KIM N R,LIM J S,et al.Optimization of feed conditions in a 2.5-l fed-batch culture using rice oil to improve cephalosporin C production by Cephalosporium acremonium M25[J]. World Journal of Microbiology and Biotechnology,2005,21 (5):322-323.
[14] JIA B,JIN Z H,MEI L H.Medium optimization based on statistical methodologies for pristinamycins production by Streptomyces pristinaespiralis[J].Applied Biochemistry and Biotechnology,2008,144(2):133-143.
[15] SIDDIQUE S,SYED Q,ADNAN A,et al.Production of avermectin B1b from Streptomyces avermitilis 41445 by batch submerged fermentation[J].Jundishapur Journal of Microbiology,2013,6(8):1-6.
[16] YU Z L,GUO C L,QIU J P.Precursor amino acids inhibit polymyxin E biosynthesis in Paenibacillus polymyxa,probably by affecting the expression of polymyxin E biosynthesis-associatedgene[J].BioMedResearchInternational,2015:690830.
[17] 张永勤,王哲平,宋雨梅,等.还原糖测定方法的比较研究[J].食品工业科技,2010,31(6):322-323. ZHANG Y Q,WANG Z P,SONG Y M,et al.Comparative study on the determination of reducing sugar[J].Science and Technology of Food Industry,2010,31(6):322-323.(in Chinese with English abstract)
[18] 武发菊,陈继红,梁仲军,等.应用不同方法测定阿维菌素发酵液中的总糖含量[J].中兽医医药杂志,2007,26 (1):36-39. WU F J,CHEN J H,LIANG Z J,et al.Determination on total sugar contents in avermectins fermented liquid by different methods[J].Journal of Traditional Chinese Veterinary Medicine,2007,26(1):36-39.(in Chinese with English abstract)
[19] 周德庆.微生物学教程 [M].北京:高等教育出版社,2002:151-152.
[20] 蔡元宁,余志良,赵春田,等.多粘类芽孢杆菌的保藏及复壮方法研究[J].浙江农业学报,2015,27(1):75 -79. CAI Y N,YU Z L,ZHAO C T,et al.Preservation method and rejuvenation method of Paenibacillus polymyxa[J].Acta Agriculturae Zhejiangensis,2015,27(1):75-79.(in Chinese with English abstract)
[21] DESAI R P,LEAF T,WOO E,et al.Enhanced production of heterologous macrolide aglycones by fed-batch cultivation of Streptomyces coelicolor[J].Journal of Industrial Microbiology and Biotechnology,2002,28(5):297-301.
[22] SERGIO S N,ADAN C V,FORERO A,et al.Carbon source regulation of antibiotic production[J].The Journal of Antibiotics,2010,63(8):442-459.
[23] 陈小煌,李自然,黄小云,等.多粘类芽孢杆菌培养条件优化研究[J].福州大学学报(自然科学版),2013,41 (5):947-954. CHEN X H,LI Z R,HUANG X Y,et al.Optimization of culture conditions of Paenibacillus polymyxa[J].Journal of Fuzhou University(Natural Science Edition),2013,41(5):947-954.(in Chinese with English abstract)
[24] 陶银英.多粘菌素E产生菌高通量诱变育种的研究[D].杭州:浙江大学,2006. TAO Y Y.Study on the high throughput strategy to screen strains with high polymyxin e productivity[D].Hangzhou:Zhejiang University,2006.(in Chinese with English abstract)
[25] 刘铁军,吴飞.葡萄糖浓度对杆菌肽发酵过程的影响[J].医学信息(中旬刊),2011,24(9):4659-4660. LIU T J,WU F.Effect of glucose concentration on bacitracin fermentation process[J].Medical Information Operations Sciences Fascicule,2011,24(9):4659-4660.(in Chinese with English abstract)
(责任编辑 侯春晓)
Effect of carbon sources on growth of Paenibacillus polymyxa and polymyxin E synthesis
SUN Zhong-qi1,QIU Juan-ping1,LU Jian-wei2,ZHAO Chun-tian1,*
(1.College of Biotechnology and Bioengineering,Zhejiang University of Technology,Hangzhou 310014,China;2.Zhejiang Qianjiang Biochemical Co.,Ltd,Haining 314400,China)
In order to explore new methods to improve the yield of polymyxin E,five different carbon sources including glucose,sucrose,maltose,lactose and soluble starch were added in the fermentation medium,respectively. The influence on Paenibacillus polymyxa growth and polymyxin E production of different carbon sources were investigated through plate counting method and HPLC method.The results indicated that the effects of different carbon sources on the growth of Paenibacillus polymyxa and the polymyxin E production varied significantly.The effect of these carbon sources on polymyxin E production was:soluble starch>lactose>sucrose>maltose>glucose.Soluble starch promoted both cell growth and polymyxin E yield by extending the polymyxin E biosynthetic period and promoting the synthetic rate.Compared with glucose as carbon source,the yield and the synthetic rate of polymyxin E were increased by 111%and 60%,respectively.Therefore,soluble starch was the optimal candidate for carbon sources among the five carbohydrates in polymyxin E synthese.
Paenibacillus polymyxa;polymyxin E;carbon source;soluble starch
S859.79;Q939.9
A
1004-1524(2016)08-1343-08
10.3969/j.issn.1004-1524.2016.08.11
2015-12-08
浙江省生物工程重中之重学科开放基金项目(20130103);浙江省自然科学基金项目(Y2111182)
孙仲奇(1990—),男,河南洛阳人,硕士研究生,研究方向为应用微生物学。E-mail:570987494@qq.com
*
,赵春田,E-mail:zct2008@yahoo.com
