铁氧化细菌及其在化工环境领域的研究进展*
2016-08-18张晓昕唐诗洋张树华
张晓昕,唐诗洋,张树华
(1.哈尔滨工业大学 城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150001;2.黑龙江省能源环境研究院,黑龙江 哈尔滨 150001)
综述
铁氧化细菌及其在化工环境领域的研究进展*
张晓昕1,唐诗洋2,张树华2
(1.哈尔滨工业大学 城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150001;2.黑龙江省能源环境研究院,黑龙江 哈尔滨 150001)
铁氧化细菌(Fe-oxidizingBacteria,FOB)具有极大的代谢可行性和潜能,在自然环境中存在数量巨大,近年来受到国内外研究者的广泛关注。本文归纳总结了近年来铁氧化细菌及其在化工环境领域的理论和应用研究进展,并指出存在问题,对今后的研究方向进行展望。
铁氧化细菌;化工环境;生物脱硫;生物浸出
铁氧化细菌(Fe-oxidizingBacteria,FOB)是一类生活在含有高浓度Fe2+的池塘、湖泊、温泉等水域中,能将二价铁盐氧化成三价铁化合物,并能利用此氧化过程中产生的能量来同化CO2进行生长的细菌的总称。此类微生物种类较多,广泛分布于自然界如地表水,土壤,海洋及地下水生态系统中[1,2[3]。由于它能氧化溶解于水中的FeO、Fe2(CO3)3并形成高铁沉积下来,起到浓缩和积累环境中铁的作用,可作为天然褐铁矿形成的参与者,是一类推动铁元素循环的微生物[4]。
铁氧化菌具有机大的代谢可行性和潜能,在环境中存在数量巨大,利用其代谢特性,可以实现Fe (II)到Fe(III)的转化,从而影响水土环境,因此,近年来,受到学者们的广泛关注,对其生理生化特性、代谢特征等开展了大量的研究,并开始利用其代谢潜能,在化工环境领域发挥重要作用,获得比较理想的处理效果。
1 铁氧化细菌种类、生境及特性研究进展
近年来,随着凝胶培养技术(Gel-stabilized)的出现,使得铁氧化细菌在自然环境中的氧化还原生境得以获得最大限度的模拟,一系列铁氧化细菌被研究人员从自然环境中分离出来。一般而言,铁氧化代谢普遍存在于细菌与古细菌门的微生物体内,常见的铁氧化菌细菌种属包括好氧菌属,例如Leptothrix,广泛存在于淡水环境中[5]。而由于环境及生境的复杂多变,海洋环境系统中的铁氧化细菌目前涉及较少,Mariprofundus ferrooxydans是其中研究最为具体充分的菌属之一[6]。除好氧铁氧化细菌之外,厌氧FOB也是十分重要的铁循环参与者。研究人员发现厌氧FOB(包括光能自养型和化能异养型)在中性pH条件下具有硝酸盐及(高)氯酸盐还原等代谢特性[7]。近年来发现的部分典型FOB的生理生态特征见表1。
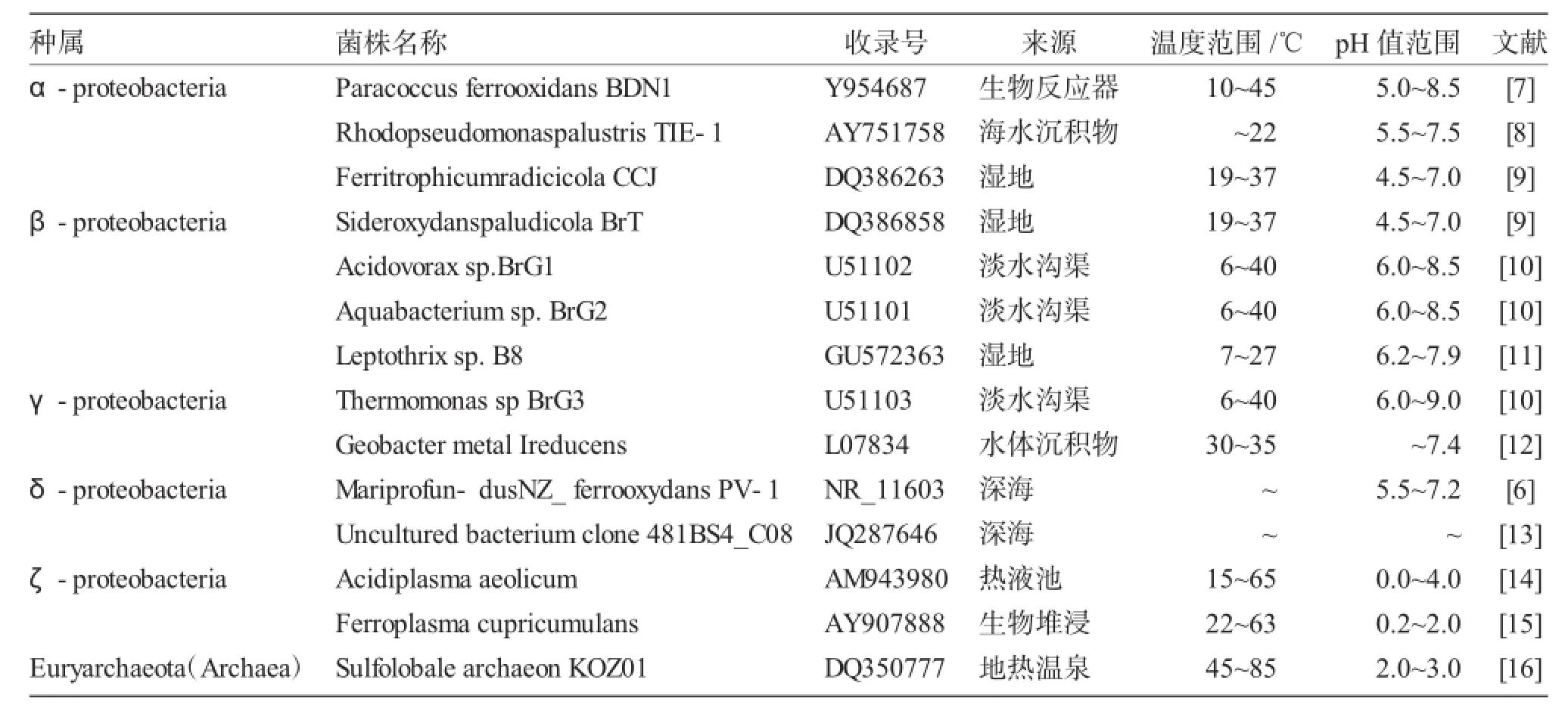
表1 部分铁氧化细菌及其特性Tab.1 Partial FOMs and their related characteristics
2 铁氧化菌在生物脱硫工艺中的应用
化工、冶金等行业中含黄铁矿硫、有机硫和硫酸盐的硫化石燃料的燃烧(煤、石油、天然气等)和排放,造成了环境问题的日益严峻,消除SO2污染,降低燃煤SOx排放的工艺与技术已成为国内外研究者关注的热点之一。微生物脱硫技术的基础是铁氧化细菌能利用Fe2+间接或者直接将烟气中SO2氧化为硫酸盐的特性。氧为这一反应的最终电子受体,反应条件较为温和,与传统的脱硫方法相比,具有高效、无二次污染且操作简单的优势[17]。
常见的脱硫微生物包括嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,At.ferrooxidans)、氧化亚铁钩端螺旋菌(Leptospirillum ferrooxidans,L.f)和氧化硫硫菌(Thiobacillusthiooxi dans)等,其中以嗜酸氧化亚铁硫杆菌的应用最为广泛。由于矿物表面含有微生物生长所需的营养物质及能源物质,微生物对矿物表面存在特性吸附。氧化亚铁硫杆菌外膜上的某些特殊官能团如-OH,-COOH,-SH等对硫化矿表面具有强烈的键合作用,使菌能强烈吸附于黄铁矿表面。通常而言,生物脱硫的反应机理如下所示[18]:
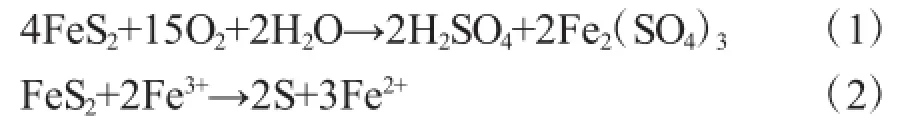
刘玉娇[19]等人研究了pH值、接种量及煤粉数量对嗜酸性氧化亚铁硫杆菌LX5的生物脱硫效能的影响。实验结果表明其生物脱硫的最佳条件为初始pH值2.5,LX5接种量10%(体积),煤粉加入量10%(质量),反应时间15d,脱硫率可达到69.2%,黄铁矿硫的脱硫率可达78%。Yang[20]等人从煤矿废水中分离出高效脱硫菌株 At.ferrooxidans菌株YY2,其总脱硫率和脱硫铁矿硫率可分别达到75% 和86%。Marinov[21]等人利用At.ferrooxidans菌株F3对含硫量极高的Bulgarian煤进行生物脱硫,总脱硫率和脱黄铁矿硫率可分别达到14%和50%。张赫[22]选取聚乙烯醇为基本包埋剂对氧化亚铁硫杆菌进行固定化,并将固定化颗粒填装生物反应器并与化学反应器联用,形成生物-化学两级反应器工艺,可以较好的应用于工业废气中SO2的处理,同其他脱硫技术相比,该工艺技术可将脱硫效率提高至85%。此外,唐家彬[17]利用电晕放电等离子体对已有氧化亚铁硫杆菌进行诱变,发现当放电间距5mm,诱变时间5min时,细菌生长周期缩短为30h左右,比原始菌株缩短12h。将诱变菌株在生物滴滤塔内挂膜固定化后处理SO2气体,挂膜时间可缩短4d。在液体喷淋量为24L·h-1,Fe2+浓度约0.9g·L-1,温度30℃,pH值为2.5,SO2浓度为3000mg·m3左右时,诱变菌株脱硫周期为5d,脱硫率均稳定在98%左右。
3 铁氧化菌在重金属污染去除工艺的应用
近年来,随着矿业、电子等行业的迅猛发展,其生产和回收等环节中会产生大量的金属离子,例如Cu,Zn,Cr,Mo,Ba,Pb等,排放后最终会导致水体呈酸性,造成土地酸化。近年来,以Acidithiobacillus,Ferroplasma,和Leptospirillum为代表的一系列铁氧化细菌已广泛应用于矿山冶金、废旧PCB板、废旧电池、电子废料处理等行业,具有环境友好、节能高效、工艺占地面积小等优势[23]。以Acidithiobacillus ferrooxidans为例,利用Fe2+作为能量来源同时产生Fe3+,反应过程如下[24]:
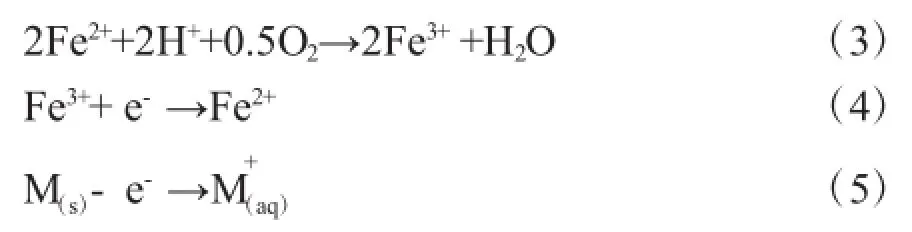
张少剑[25]利用气升式反应器,考察嗜酸氧化亚铁硫杆菌对尾矿中重金属的去除效能,结果显示铜的最佳浸出条件为反应温度在25℃左右,矿浆质量浓度为10%,初始pH值为1.6,微生物接种量为10%,浸出24 d之最大浸出率约为16.58%;镉、锌、砷的最佳浸出条件为反应温度在25℃左右,矿浆质量浓度为10%,初始pH值为1.2,微生物接种量为10%,浸出24 d之后,浸出率分别为 17.51%、81.10%和47.32%。Jadhav[26]等人综合考察了At. ferrooxidans对于含银电池的浸出效能。当反应温度为30℃,初始pH值为2.5,摇床速度150r·min-1时,菌株对银的去除率可达到98%。许治国[27]利用两段式生物浸出反应器,考察了氧化亚铁硫杆菌Z1的生物浸出废旧线路板金属富集体的处理效果。研究结果表明,相比于沸石、活性炭等载体,利用纱布固定化反应器的处理效果良好。当停留时间为6h,反应器曝气量1L·min-1和金属富集体粉末投加量12g·L-1的条件下,运行96h,铜、锌、镁、铝和镍的浸出率分别可达到91.68%、95.32%、90.32%、86.31% 和59.07%。李树美[28]考察了嗜酸性Fe(II)供能菌群对重金属的耐受性。结果表明对数期菌体对重金属存在明显的吸附作用,对Cu(II)、Zn(II)和Cd(II)的最大吸附率分别为 84.52%、98.84%和 78.74%。Rasteqar[29]等人研究了At.ferrooxidans进行生物浸出的最优条件发现当初始pH值为1,矿浆浓度9g· L-1,初始Fe3+浓度为1g·L-1时菌株对Cr和Ni的去除率可分别达到55.6%及58.2%。
4 展望
铁氧化菌具有机大的代谢可行性和潜能,在化工行业污染治理领域有着广阔的发展前景。然而,由于目前发现的铁氧化细菌生长都较为缓慢,通常需要几天甚至几周的时间,从而大大影响了处理工艺的运行周期和效果,阻碍了工艺的实际应用和发展。微生物是生物法的核心,因此具有较高生物活性及稳定处理效能的优质工程菌的驯化和分离仍将是今后的研究重点之一。同时新型工艺的开发与工艺参数的优化及相应反应动力学模型的建立还需要进一步的深入而详尽的研究。以上这些问题,也将成为今后铁氧化细菌在化工环境污染治理领域研究的热点方向。
[1] Hegler F,Lösekann-Behrens T,Hanselmann K,Behrens S,Kappler A.Influence of seasonal and geochemical changes on the geomicrobiologyof an iron carbonate mineral water spring[J].Applied Environmental Microbiology,2012,78(20):7185-7196.
[2] Melton ED,Schmidt C,Kappler A.Microbial iron(II)oxidation in littoral freshwater lake sediment:the potential for competition between phototrophic vs.nitrate-reducing iron(II)-oxidizers[J]. Front.Microbiol,2012,(3):197-209.
[3] ChakrabortyA,Roden EE,Schieber J,Picardal F.Enhanced growth of Acidovorax sp.strain 2AN during nitrate-dependentFe(II)oxidation in batch and continuous-flowsystems[J].Appl Environ Microbiol,2011,77:8548-8556.
[4] Sugio T,Taha TM,Kanao T,Takeuchi F.Increase in Fe2+-producing activityduringgrowthofAcidithiobacillusferrooxidans ATCC23270 on sulfur[J].Bioscience,Biotechnology,and Biochemistry,2007,71(11):2663-2669.
[5] Schmidt B,Sánchez LA,Fretschner T,Kreps G,Ferrero MA,Si eriz F,Szewzyk U.Isolation of sphaerotilus leptothrix strains from iron bacteria communities in tierra delfuego wetlands[J].Fems MicrobiologyEcology,2014,90(2):454-466.
[6] Esther S,David E,Webb EA,BarcoRA,Gijs K,Nelson WC.Mariprofundus ferrooxydans pv-1 the first genome ofa marine fe(ii)oxidizingzetaproteobacterium[J].Plos One,2011,6(9):77-77.
[7]Kumaraswamy R,Sjollema K,Kuenen G,van Loosdrecht M,Muyzer G.Nitrate-dependent[Fe(II)EDTA]2-oxidation by Paracoccus ferrooxidans sp.nov.,isolated froma denitrifyingbioreactor[J].Syst Appl Microbiol.2006,29:276-286.
[8] JiaoY,Kappler A,Croal LR,Newman DK.Isolation and characterization of a genetically tractable photoautotrophic fe(ii)-oxidizing bacterium,rhodopseudomonas palustris strain tie-1[J].Applied Environmental Microbiology,2005,71(8):4487-4496.
[9] Weiss JV,Rentz JA,Plaia T,Neubauer SC,Floud MM,Lilburn T. Characterization of Neutrophilic Fe(II)-Oxidizing Bacteria Isolated from the Rhizosphere of Wetland Plants and Description of Ferritrophicum radicicola gen.nov.sp.nov.,and Sideroxydans paludicola sp.Nov[J].GeomicrobiologyJournal,2007,24(7):559-570.
[10] Straub KL,Schonhuber W,Buchholz-Cleven B,Schink B.Diversity of ferrous iron-oxidizing,nitrate-reducing bacteria and their involvement in oxygen-independent iron cycling[J].Geomicrobiol.J.,2004,21:371-378.
[11] Johnson KW,Carmichael MJ,McDonald W,et al,Increasedabundance of gallionella spp.,leptothrix spp.and total bacteria in response to enhanced mn and fe concentrations in a disturbed southern appalachian high elevation wetland[J].Geomicrobiology Journal,2012,29(2),124-138.
[12] Hedrich S,Schlomann M,Johson DB.The iron-oxidizing Proteobacteria[J].Microbiology,2011,157(6):1551-1564.
[13] Fleming EJ,Davis RE,Mcallister SM,Chan CS,Moyer CL,Tebo BM.Hidden in plain sight:discoveryof sheath-forming,iron-oxidizing zetaproteobacteria at loihi seamount,hawaii,usa[J].Fems MicrobiologyEcology,2013,85(1):116-127.
[14] Golyshina OV,Yakimov MM,Lünsdorf H,Ferrer M,Nimtz M,Timmis KN.Acidiplasma aeolicum gen.nov.,sp.nov.,a euryarchaeon of the family ferroplasma-ceae isolated from a hydrothermal pool,and transfer of ferroplasma cupricumulans to acidiplasma cupricumulans comb.nov.[J].International Journal ofSystematic&EvolutionaryMicrobiology,2009,59(Pt 11).
[15] Hawkes RB,Franzmann PD,O'Hara G,Plumb JJ.Ferroplasma cupricumulans sp.nov.,a novel moderately thermophilic,acidophilic archaeon isolated from an industrial-scale chalcocite bioleach heap[J].Extremophiles,2006,10(6):525-530.
[16] Kozubal M.Isolation and distribution of a novel iron-oxidizing crenarchaeon from acidic geothermal springs in yellowstone national park[J].Appl&Environmental Microbiology,2008,74 (4):942-949.
[17] 唐家彬.高效氧化亚铁硫杆菌的筛选及脱除SO2工艺的研究[D].西安工程大学,2015.
[18] Amouric A,Brochier-Armanet C,Johnson DB,Bonnefoy V,Hallberg KB.Phylogenetic and genetic variation among fe(ii)-oxidizing acidithiobacilli supports the view that these comprise multiple species with different ferrous iron oxidation pathways[J].Microbiology,2011,157(1):111-122.
[19] 刘玉娇,杨新萍,张德伟,等.pH、接种量及固形物含量对氧化亚铁硫杆菌LX5煤炭生物脱硫的影响[J].环境工程学报,2013,7 (2):759-764.
[20] YangX,WangS,Liu Y,ZhangY.Identification and characterization of acidithiobacillus ferrooxidans yy2 and its application in the biodesulfurizationofcoal[J].CanadianJournalofMicrobiology,2015,61:1-7.
[21] MarinovSP,Stefanova M,Gonsalvesh L,Groudeva V,Gadjanov P,Carleer R.Biodesulphurized low rank coals appraisal:initial,treated,their bitumens and solid residues[J].Fuel&Energy Abstracts,2011,92(12):2328-2334.
[22] 张赫.氧化亚铁硫杆菌脱除二氧化硫的应用研究[D].兰州大学,2012.
[23] 程桂石,李金惠,刘丽丽.电子废物资源化循环转化过程与代谢规律研究[J].中国环境科学,2010,30(5):658-665.
[24] Ni YQ,He KY,Bao JT,Yang Y,Wan DS,Li HY.Genomic and phenotypic heterogeneity of Acidithiobacillus spp.strains isolated fromdiverse habitats in China[J].FEMSMicrobiol Ecol.,2008,64:248-259.
[25] 张少剑.气升式生物反应器处理铜尾矿重金属污染实验研究[D].重庆大学,2012.
[26] JadhavU,HongH.Extraction of silver from spent silver oxide zinc button cells byusingAcidithiobacillus ferrooxidans culture supernatant[J].Journal ofCleaner Production,2013,44(2):39-44.
[27] 许治国.废旧线路板金属富集体生物浸出反应器体系研究[D].华南理工大学研究生学位论文,2014.
[28] 李树美.嗜酸性Fe2+供能菌对重金属吸附效能及对钢铁盐酸洗废液的可生物氧化性研究[D].天津理工大学研究生学位论文,2013.
[29]Rastegar SO,Mousavi SM,Shojaosadati SA.Cr and ni recovery during bioleaching of dewatered metal-plating sludge using acidithiobacillus ferrooxidans[J].Bioresource Technology,2014,167(3):61-68.
Research advances and prospect in fields of chemical environmental engineering by Fe-oxidizing bacteria*
ZHANG Xiao-xin1,TANG Shi-yang2,ZHANG Shu-hua2
(1.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,Harbin 150001,China;2.Energy and Environmental Research Institute of Heilongjiang Province,Harbin 150001,China)
Fe-oxidizing bacteria(FOB)existing prevalently in natural environments,has enormous metabolic feasibility and potentiality,and has gained extensive scientific interest globally as a result.In this study,the recent research progress of FOB and its application in the field of chemical environmental engineering are summarized. The existing problems and research prospect are also explored for future study
Fe-oxidizing bacteria;chemical environment;bio-desulfuriaztion;bio-leaching
X703.1
A
10.16247/j.cnki.23-1171/tq.20160749
2016-05-13
国家自然科学基金面上项目
张晓昕(1986-),女,博士在读,研究方向:环境污染控制研究。
