食品中苏丹红检测方法的比较和优化
2016-08-17江晨舟孙洁敏张驰中邵明华上海安谱实验科技股份有限公司
江晨舟 孙洁敏 张驰中 邵明华 / 上海安谱实验科技股份有限公司
食品中苏丹红检测方法的比较和优化
江晨舟 孙洁敏 张驰中 邵明华 / 上海安谱实验科技股份有限公司
采用GB 19681-2005规定的高效液相色谱法(HPLC)对食品中的苏丹红含量进行检测,并对该方法进行前处理条件和色谱条件的优化。实验研究结果表明,经优化的方法专用SPE小柱有较好的回收率,SPE过程简单直观,易于操作,色谱分析条件简单快速,流动相易于配制,回收率稳定在95.0%~98.0%,优于高效液相色谱法的回收率80%~90%,因此更适合于食品中苏丹红含量的检测。
HPLC;苏丹红;食品;光学诱导异构
0 引言
苏丹红是一类人工合成的亲脂性、偶氮类染料,主要包括苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ 四种类型,见图1。
苏丹红染料是分子结构中含有偶氮基(一N=N一)发色团的一类人工合成的脂溶性偶氮染料,主要用于纺织品、橡胶、塑料、油漆等的着色剂[1]。苏丹红具有潜在的致癌性、遗传毒性及致敏性,这与其胺类、萘酚类代谢产物有关[2]。研究表明,苏丹红染料分子可以通过多种途径接触到人体,并透过生物膜通过血液循环分散到全身各组织细胞,与生物体内的大分子(蛋白质、DNA等)相结合,生成致敏、致癌物质。因此,一些国家和机构相继颁布了法律法规和技术标准,严令禁止苏丹红染料作为食品添加剂应用于食品生产中。世界癌症研究机构(IARC)将其列为第三类可能致癌物质[3-4]。
目前,检测这四种苏丹红染料的方法主要有分光光度法[5]、薄层色谱法[6]、电化学法[7]、酶联免疫法[8]、液相色谱法[9]、气相色谱-质谱联用法[10-14]、液相色谱-质谱联用法[15-20]和毛细管电泳法[21]等。这些方法的灵敏度、选择性和分析通量存在差异。气相色谱-质谱法仪器设备较昂贵,并且对操作人员的技术水平要求较高,难以普及。高效液相色谱仪器价格相对便宜,操作简单,一般检测机构都已普及。国家标准GB/T 19681-2005[22]规定了食品中苏丹红染料的高效液相色谱测定方法(以下简称国标法),但在实验过程中,检测到苏丹红Ⅲ和Ⅳ分别有两个色谱峰,经分析是苏丹红Ⅲ和Ⅳ的光学诱导异构体,而在国标法中并未提及。本实验在重复国标法的基础上对其进行优化,采用苏丹红专用固相萃取柱净化样品,利用物理避光法准确测定不同基质中的苏丹红。本实验方法简称安谱法。

图1 苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ结构
1 材料与方法
1.1试剂与标准品
国标法耗材:乙腈、水、正己烷、丙酮、乙醚、甲酸、无水硫酸钠、氧化铝层析柱、5%丙酮-正己烷溶液、苏丹红Ⅰ标准品、苏丹红Ⅱ标准品、苏丹红Ⅲ标准品、苏丹红Ⅳ标准品。
安谱法:乙腈、水、正己烷、丙酮、苏丹红Ⅰ标准品、苏丹红Ⅱ标准品、苏丹红Ⅲ标准品、苏丹红Ⅳ标准品、0.45 μm有机滤膜。
1.2仪器与设备
实验用仪器与设备见表1、表2。
表1 国标法仪器列表

表2 安谱法仪器列表
1.3色谱条件
1.3.1 国标法色谱条件
色谱柱:Zorbax SB-C18 4.6 mm×150 mm,3.5 μm(或相当型号色谱柱);
流动相:溶剂A 0.1%甲酸的水溶液∶乙腈=85∶15;溶剂B 0.1%甲酸的乙腈溶液∶丙酮=80∶20;

流速:1 mL/min,柱温:30 ℃,检测波长:苏丹红Ⅰ 478 nm;苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ520 nm;于苏丹红I出峰后切换。进样量10 μL。
1.3.2 安谱法色谱条件
色谱柱:CNW Athena C18-WP 4.6 mm×150 mm,5 μm;
流动相:乙腈∶水= 88∶12;
流速:1 mL/min;
紫外波长:500 nm;
柱温:35 ℃;
进样量:20 μL。
1.4标准曲线的配制
1.4.1 国标法
标准储备液:分别称取苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ及苏丹红Ⅳ各10.0 mg(按实际含量折算),用乙醚溶解后再用正己烷定容至250 mL。
标准溶液的配制:吸取标准储备液(0、0.1、0.2、0.4、0.8、1.6) mL,用正己烷定容至25 mL。此标准溶液的浓度分别为(0、0.16、0.32、0.64、1.28、2.56) μg/mL,绘制标准曲线。
1.4.2 安谱法
标准储备液:分别称取苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ及苏丹红Ⅳ各10.0 mg,用丙酮溶解后用乙腈定容至20 mL,制成500 mg/L的溶液,再稀释至50 mg/L的标准储备液。
标准溶液的配制:吸取标准储备液(0.02、0.1、0.2、1.0、4.0) mL,用乙腈定容至10 mL。此标准溶液的浓度分别为(0.1、0.5、1.0、5.0、20.0) mg/L。
1.5样品处理
1.5.1 国标法
1.5.1.1 红辣椒粉等粉状样品
称取1 g样品于三角瓶中,加入10 mL正己烷,超声5 min,过滤,用10 mL正己烷洗涤残渣数次,至洗出液无色,合并正己烷液,用旋转蒸发仪浓缩至5 mL以下,慢慢加入到氧化铝层析柱中。为保证层析效果,在柱中保持正己烷液面为2 mm左右时上样。在全程的层析过程中不应使柱干涸。用正己烷少量多次淋洗浓缩瓶,一并注入层析柱。控制氧化铝表层吸附的色素带宽小于0.5 cm。待样液完全流出后,视样品中含油类杂质的多少用10 mL正己烷洗柱,直至流出液无色。弃去全部正己烷淋洗液,用含5%丙酮的正己烷液60 mL洗脱,收集、浓缩后,用丙酮转移并定容至5 mL,经0.45 μm有机滤膜过滤后待测。
1.5.1.2 红辣椒油、火锅料、奶油等油状样品
称取0.5 g(准确至0.001 g)样品于小烧杯中,加入5 mL正己烷溶解。难溶解的样品可于正己烷中加温溶解。按1.5.1.1中“慢慢加入到氧化铝层析柱……过滤后待测”操作。
1.5.1.3 辣椒酱、番茄沙司等含水量较大的样品
称取10 g(准确至0.01 g)样品于离心管中,加10 mL水将其分散成糊状,含增稠剂的样品多加水。加入30 mL正己烷∶丙酮 = 3∶1,匀浆5 min,3 000 r/min离心10 min, 吸出正己烷层。于下层再加入20 mL×2次正己烷匀浆,离心,合并3次正己烷,加入无水硫酸钠5 g脱水。过滤后于旋转蒸发仪上蒸干并保持5 min,用5 mL正己烷溶解残渣后,按1.5.1.1中“慢慢加入到氧化铝层析柱……过滤后待测”操作。
1.5.1.4 香肠等肉制品
称取粉碎样品10 g(准确至0.01 g)于三角瓶中,加入60 mL正己烷充分匀浆5 min,滤出清液,再以20 mL×2次正己烷匀浆,过滤。合并3次滤液,加入5 g无水硫酸钠脱水。过滤后于旋转蒸发仪上蒸至5 mL以下,按1.5.1.1中“慢慢加入到氧化铝层析柱中……过滤后待测”操作。
1.5.2 安谱法
1.5.2.1 粉状样品
实验室选取市售辣椒粉为代表样品,称取1 g样品(准确至0.001 g)于50 mL离心管中。加入10 mL正己烷,旋涡混合30 s,超声5 min,4 000 r/min离心10 min,取上清液至另一个50 mL离心管中。10 mL正己烷溶解残渣同样操作一次。合并正己烷液,用氮吹仪浓缩至5 mL以下,等待SPE上样。
1.5.2.2 油状样品
实验室选取市售辣椒油、食用油、火锅调料为代表样品,称取0.5 g样品于50 mL离心管中。加入10 mL正己烷,旋涡混合30 s,超声5 min,4 000 r/min离心10 min,取5 mL上清液等待SPE上样。
1.5.2.3 含水量较多的样品
实验室选取市售辣椒酱、方便面酱包、番茄沙司、腐乳为代表样品,称取5 g(准确至0.01 g),加入5 mL水将其分散成糊状。再加入10 mL正己烷∶丙酮= 3∶1,旋涡混合5 min,超声5 min, 4 000 r/min离心10 min,吸出正己烷层。10 mL正己烷溶解残渣同样操作一次。合并正己烷液,加入5 g无水硫酸钠,用氮吹仪浓缩至干,用5 mL正己烷溶解后等待SPE上样。
1.5.2.4 固态制品
实验室选取香肠、豆豉、禽蛋作为代表样品,经粉碎机处理后称取粉碎样品1 g(准确至0.01 g)于50 mL离心管中。加入10 mL正己烷,旋涡混合30 s,超声5 min,4 000 r/min离心10 min,取上清液至另一个50 mL离心管中。10 mL正己烷溶解残渣同样操作一次。合并正己烷液,加入5 g无水硫酸钠,用氮吹仪浓缩至干,用5 mL正己烷溶解后等待SPE上样。
1.6SPE方法
1.6.1 国标法
活化平衡:10 mL正己烷;
上样:5 mL上样;
淋洗:10 mL至流出液无色;
洗脱:5%丙酮正己烷60 mL;
浓缩定容:浓缩定容至5 mL,过0.45 μm有机滤膜。
1.6.2 安谱法
活化:5 mL二氯甲烷;
平衡:5 mL正己烷;
上样:取5 mL上样,2 mL正己烷润洗;
淋洗:5 mL正己烷;
洗脱:5 mL二氯甲烷;
浓缩定容:40 ℃氮吹近干,1 mL 0.8%氨水乙腈,过0.22 μm亲水PTFE针式滤器。
2 结果与分析
2.1色谱图比较
由图2和图4比较可看出,安谱法的色谱图中没有出现国标法色谱图中苏丹红Ⅲ和Ⅳ的两个色谱峰现象。由图3与图5比较可看出,以辣椒油为基质时,安谱法测得的峰面值比国标法高,这是由于国标法中的氧化铝活性不好控制,吸附或洗脱不完全时可能会有一些残留。
2.2样品回收率
按照上述基质分类的方法进行样品处理,样品加标浓度均为1 μg/mL。根据标准曲线色谱图,1 μg/mL标准的峰面积为苏丹红Ⅰ:0.610 0 mAU ·min;苏丹红Ⅱ:0.619 9 mAU·min;苏丹红Ⅲ:0.873 9 mAU·min;苏丹红Ⅳ:0.749 3 mAU·min。具体样品处理情况见表3~表10。

图2 国标法苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ1×10-6光照色谱

图3 国标法辣椒粉苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ1×10-6色谱

图4 安谱法苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ1×10-6光照色谱

图5 安谱法辣椒油中苏丹红Ⅰ、Ⅱ、Ⅲ和Ⅳ色谱
表3~表10提供了国标法和安谱法对这四种苏丹红染料各种基质的处理情况。结果表明,采用CNW 苏丹红专用SPE小柱和基质处理的优化方案之后,安谱法的回收率稳定在95.0%~98.0%之间,而国标法的回收率稳定在80%~90%之间,因此安谱法在回收率方面优于国标法。

表3 国标法苏丹红Ⅰ
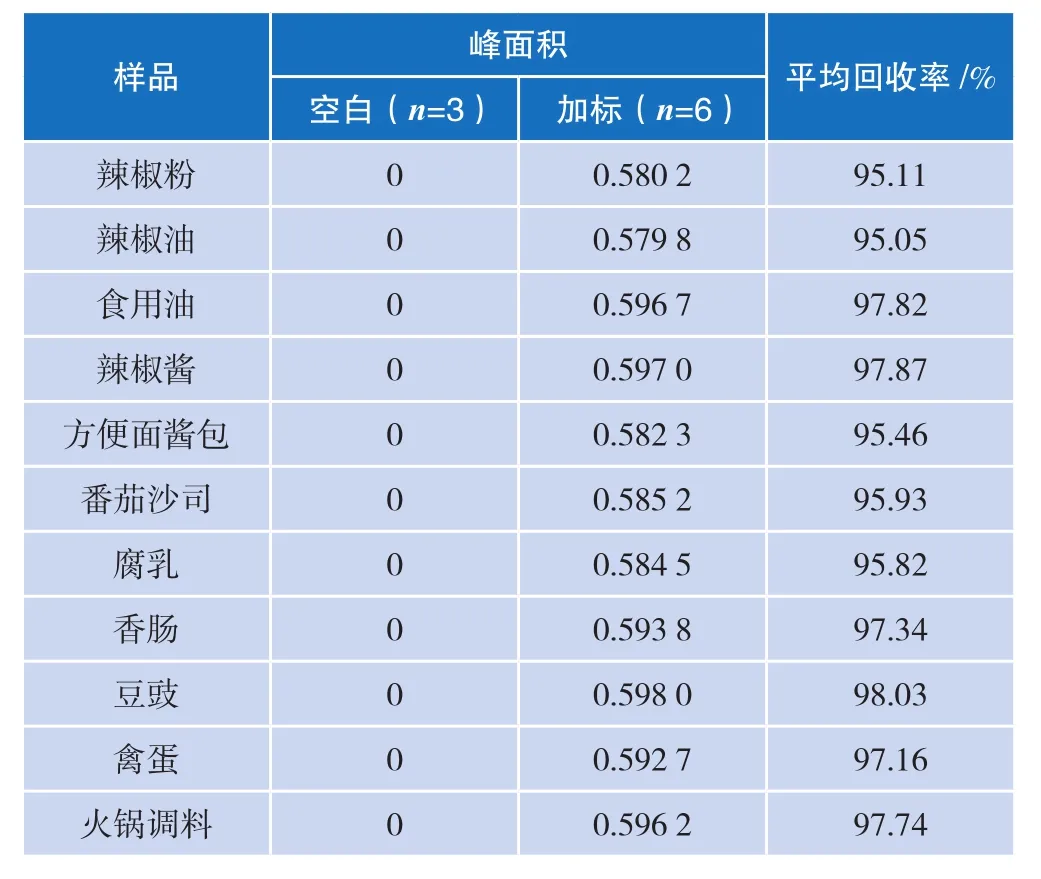
表4 安谱法苏丹红Ⅰ

表5 国标法苏丹红Ⅱ
由表7~表10可看到,辣椒酱中检测到了苏丹红Ⅲ和Ⅳ。为了判断其性质,将其与苏丹红Ⅲ和Ⅳ的标准光谱图对比,结果如图6所示。可以发现,辣椒酱中的疑似峰与苏丹红标准的色谱峰不一致,所以并非苏丹红,而是杂质峰。

表6 安谱法苏丹红Ⅱ

表7 国标法苏丹红Ⅲ

表8 安谱法苏丹红Ⅲ

表9 国标法苏丹红Ⅳ

表10 安谱法苏丹Ⅳ红
2.3标准曲线及相关系数
国标法在0.16~2.56 μg/mL内以浓度为横坐标,以峰面积为纵坐标作标准曲线,线性方程如表11所示。

表11 国标法苏丹红标准曲线

图6 辣椒酱光谱与苏丹红标准光谱对比

表12 安谱法苏丹红标准曲线
安谱法在0.10~20.00 mg/L内以浓度为横坐标,以峰面积为纵坐标作标准曲线,线性方程如表12所示。结果表明,在一定浓度范围内浓度与峰面积形成良好的线性关系,相关系数均在0.999以上,其中安谱法检测样品的最低浓度比国标法低,测定的相关系数比国标法高,线性关系更好。
3 结语
在苏丹红标准品混合物的检测中,对GB/T 19681-2005国家标准中规定的高效液相色谱检测方法进行重复试验,在优化前处理方法和色谱条件后分别进行对比分析。从实验中可以发现:
1)安谱法专用SPE小柱,SPE过程简单直观,易于操作。而国标法采用氧化铝层析柱,过程复杂,操作繁琐,活性不稳定。
2)安谱法配合反相色谱柱,选择适量丙酮+乙腈作定容溶剂,而国标法采用正己烷作定容溶剂。正己烷是正相的,根据相似相容原理,会对反相色谱柱造成一定影响。
3)安谱法色谱分析条件简单快速,流动相易于配制,并把国标法繁琐的梯度条件改为恒定条件,选择更合适的波长,检测目标物质出峰良好。
4)安谱法分析研究了光学异构现象,精确分析定量,提高了检测准确度。而国标法忽略了光学异构现象,准确度低。
5)国标法由于填料活度控制和大体积洗脱液浓缩带来不确定因素。安谱法改进了国标法,提高了分析精密度。
6)安谱法检测限和国标法保持一致。
综上所述,安谱法在国标法的基础上进行了优化和改进,更适合于食品中苏丹红含量的检测。
[1] Haiyan Xu, Thomas M. Heinze, et al. Anaerobic metabolism of 1-amino-2-naphthol-based azo dyes anaerobic metabolism of 1-amino-2-naphthol-based azo dyes(Sudan dyes) by human intestinal microflora[J]. Applied and Environmental Microbiology, 2007, 73( 23):7759-7762.
[2] Rebane R, Leito I,Yurchenko S. Analysis of Sudan I, Sudan II,Sudan III and Sudan IV using LC-UV and LC-MS [J]. Herodes K J Chromatogr A,2010,1217(17):2747-2757.
[3] 庞艳玲. 食品中苏丹红检测方法的研究进展[J]. 食品发酵与工业,2008, 34(3), 114-119.
[4] Ahistrom L H, Sparr Eskilsson C, Bjorkfund E. Determination of banned azo dyes in consumer goods[J]. Trends Anal Chem, 2005,24(1): 49-56.
[5] 庞艳玲, 王怀友.薄层色谱-紫外可见分光光度法测定食品中的苏丹红Ⅰ号[J].分析试验室, 2008, 16(1): 60-62.
[6] Peng H L, Xiong H, Li J H, et al. Vanillin cross-linked chitosan microspheres for controlled release of resveratrol[J].Food Chemistry,2010,121(1):23-28.
[7] Qi Y H, Shan W C, Liu Y Z, et al. Production of the Polyclonal Antibody against Sudan 3 and Immunoassay of Sudan Dyes in Food Samples[J].Agricultural and Food Chemistry, 2012, 60(9):2116-2122.
[8] Molder K, Kunnapas A, Herodes K, et a1. [J]. Journal of Chromatography A 2007, 1160(1/2): 227.
[9] Zacharis C K, Kika F S, Tzanavaras P D, et al. Development and validation of a rapid HPLC method for the determination of five banned fat-soluble colorants in spices using a narrow-bore monolithic column[J].Talanta,2011,84(2):480-486.
[10] Noguerol-Cal R,Lopez-Vilarino J M,Fernandez-Martinez G,et a1. High-performance liquid chromatography analysis of ten dyes for control of safety of commercial articles [J]. Journal of Chromatography A ,2008, 1179(2): 152-60.
[11] 刘珺,弓振斌.高效液相色谱-柱后在线光化学衍生荧光检测法测定辣椒油中4种苏丹红染料[J].色谱, 20l2, 30(6): 624-629.
[12] He L M, Su Y J, Fang B H, et al. Determination of Sudan dye residues in eggs by liquid chromatography and gas chromatography-mass spectrometry[J].Analytica Chimica Acta,2007, 594 (1):139-146.
[13] 何荣,廖林川,颜有仪,等.血液中苏丹红染料的高效液相色谱分析[J]. 分析测试学报, 2008, 27(7): 751-754.
[14] Erdemir U S, Izgi Band, Gucer S, et al. An alternative method for screening of Sudan dyes in red paprika paste by gas chromatographymass spectrometry[J].Analytical Methods,2013,5(7):1790-1798.
[15] 吴惠勤,黄晓兰,黄芳,等.食品中苏丹红1号的GC-MS/SIM 快速分析方法研究[J].分析测试学报, 2005, 24(3): 1-5.
[16] Schummer C, Sassel J, Bonenberger P, et al. Low-level detections of Sudan I, II, III and IV in spices and chili-containing foodstuffs using UPLC-ESI-MS/MS[J].Agricultural and Food Chemistry,2013,61(9):22 84-2289.
[17] Murty M R V S, Chary NS, Prabhakar S, et al. Simultaneous quantitative determination of Sudan dyes using liquid chromatographyatmospheric pressure photoionization-tandem mass spectrometry[J]. Food Chemistry,2009,115(4):1556-1562.
[18] Gao H, Yang M L, Wang M L, et al. Determination of 30 Synthetic Food Additives in Soft Drinks by HPLC/Electrospray Ionization-Tandem Mass Spectrometry[J].AOAC International, 2013, 96(1):110-115.
[19] Li C, W u Y L, Shen J Z. UPLC-ESI-MS/MS analysis of Sudan dyes and Para Red in food[J]. Food Additives & Contaminants: Part A,2010,27(9): 1215-1220.
[20] 王鹏,郭少飞,荆涛,等.基质固相分散液相色谱-串联质谱法检测禽蛋中的苏丹红[J].色谱,2008, 26(3): 353-357.
[21] Mejia E, Ding Y S, Mora M F, et al. Determination of banned sudan dyes in chili powder by capillary electrophoresis[J].Food Chemistry,2007,102(4):1027-1033.
[22] 国家粮食质量监督检验中心.GB/T 19681-2005 食品中苏丹红染料的检测方法高效液相色谱法[S].北京:中国标准出版社,2005.
计量动态
上海市计量测试技术研究院第四届科技节拉开帷幕
2016年5月19日,上海市计量测试技术研究院第四届科技节以“聚焦计量科技,助力科创中心”为主题,正式拉开帷幕。上海交通大学常务副校长林忠钦院士、上海市质量技术监督局总工程师陆敏等应邀出席活动。
会上,林忠钦以“提升中国制造业质量与品牌战略”为题作主题报告,重点阐述了我国实施制造强国战略的意义、制造业质量的现状和发展目标、发达国家工业质量发展经验以及我国制造业质量品牌提升三年行动计划等内容。

陆敏对上海市计量测试技术研究院第四届科技节开幕表示热烈祝贺,并指出,上海市计量测试技术研究院多年来秉持和发扬“善于思考、勇于创新、敢于担当”的科研精神,紧密围绕计量检测新技术和新领域,依托优势研究方向,积极组建科技创新团队,在“十二五”期间共获省部级以上奖项21项,其中上海市科技进步奖二等奖5项,取得了出色的成绩。他希望上海市计量测试技术研究院以增强计量科技创新能力、积极探索落实科技成果转化为己任,抓住改革创新先机,勇于探索、精准发力,推进上海科创中心建设。
会议宣读了上海市计量测试技术研究院获得2015年度上海市科技进步奖、国家质检总局科技兴检奖等多个奖项的获奖名单,并对获奖者进行了表彰。
上海市计量测试技术研究院科技节活动至今已举办至第四届,继主题报告暨颁奖仪式后还将举办科技创新论坛、服务中小企业标准化讲座、科技创新成果展、跨世纪宣传等系列活动。
(本刊通讯员)
Comparison and optimization of detection methods for sudan red in foods
Jiang Chenzhou, Sun Jiemin, Zhang Chizhong,Shao Minghua
(ANPEL Scientifc Instrument (Shanghai) Co.,Ltd.)
The high performance liquid chromatography(HPLC) stipulated in GB 19681-2005 was adopted to detect sudan red in foods. The detection method was optimized in pre-treatment conditions and chromatographic conditions. Compared with the HPLC, the experimental results showed that the dedicated SPE cartridges had good recovery, SPE process was simple and intuitive, easy to operate, chromatographic conditions were simple and rapid, the mobile phase was easy to prepare, the recoveries was 95.0%-98.0%, which was superior to the recovery of HPLC 80%-90%, so the optimized detection method is more suitable for detecting sudan red in foods.
HPLC; sudan red; food; optically induced isomerization
