妊娠对孕妇外周血IGH-CDR3免疫组库的影响
2016-08-17郭昌龙王启迪曹小芳蔡瑞琨安莉莎彭左旗王兴宇
郭昌龙 杜 蒙,2 王启迪 曹小芳 杨 英 蔡瑞琨 安莉莎 邱 月,2 刘 昕,3 彭左旗 王兴宇,3 马 旭,2*
1.国家卫生计生委科学技术研究所(北京,100081); 2.北京协和医学院研究生院;3. 北京高血压联盟研究所
·基础研究·
妊娠对孕妇外周血IGH-CDR3免疫组库的影响
郭昌龙1杜 蒙1,2王启迪1曹小芳1杨 英1蔡瑞琨1安莉莎1邱 月1,2刘 昕1,3彭左旗1王兴宇1,3马 旭1,2*
1.国家卫生计生委科学技术研究所(北京,100081); 2.北京协和医学院研究生院;3. 北京高血压联盟研究所
目的:探讨妊娠期女性外周血中IGH-CDR3序列的多样性与免疫学特性。方法:分离9例正常妊娠末期和7例非妊娠期女性外周血淋巴细胞,逆转录为cDNA ARM-PCR扩增H链CDR3区序列,高通量测序后通过与IMGT数据库对比,揭示妊娠期IGH-CDR3免疫组库的多样性及免疫学特征。结果:妊娠期女性外周血IGH-CDR3 的数目和种类均小于非妊娠女性;妊娠期女性有独特的免疫学特性,包括IGH-CDR3 长度、N末端碱基的添加数、V区域使用偏好基因及末端去除的碱基数;一些CDR3肽段在妊娠期女性中特有表达。结论:妊娠会降低孕妇外周血循环中B细胞的数量和种类并使IGH-CDR3区的免疫学特性发生变化。
妊娠; 免疫组库; IGH-CDR3
妊娠期间,母体免疫系统的适度调节对妊娠成功至关重要,随着胎儿的生长发育,其自身免疫系统逐渐成熟,分泌的细胞因子可干扰母体免疫系统[1-2]。母体的免疫系统发生一系列的调整以维持妊娠:①随着妊娠的进行,母体分泌的Th1型细胞因子不断下降,Th2型细胞因子不断增加,最终形成免疫功能由Th1 型向Th2型转变,细胞免疫功能受抑制而体液免疫功能占优势[3-4];②HLA-G、HLA-E分子表达增加,并通过抑制NK细胞和CD8+T淋巴细胞功能产生机体对妊娠的免疫耐受[5-7];③ Th17细胞比例下降、CD4+CD25+Foxp3+Treg细胞比例增高,以抑制细胞免疫功能并维持免疫耐受状态[8-9]等。妊娠过程中B细胞也会发生一些调整[10],如母体分泌一些特殊抗体以保护胎盘组织免受母体免疫系统的攻击[11],调节性B细胞可通过分泌IL-10抑制Th1型细胞功能以维持免疫耐受[12],而一些自身抗体的异常表达,如AT1-AA[13-14],可以诱导先兆子痫的发生。妊娠对B细胞免疫学特性的研究目前尚无报道,本研究利用高通量测序技术对妊娠末期和未妊娠女性外周血免疫球蛋白重链-互补决定区3(IGH-CDR3)的多样性与免疫学特性进行研究,为进一步揭示妊娠对母体免疫系统的影响提供依据。
1 对象与方法
1.1 研究对象
本研究选取的外周血标本均从北京妇产医院获得。正常妊娠末期女性入选标准:孕>39周,正常待产,无妊娠期疾病及感染史;无家族遗传病史及血液病史;B超显示胎儿发育正常,无先天畸形。非妊娠健康女性是年龄、籍贯与妊娠孕妇匹配的志愿者。本研究严格遵守赫尔辛基宣言,所有血液标本的取得均签署了知情同意书,并经北京妇产医院与本所伦理委员会通过。
1.2 实验程序
1.2.1 PBMC分离 采集每个研究对象的外周静脉血8ml,肝素钠抗凝, Ficoll法分别分离出淋巴细胞,细胞重悬于RNA保护液并冻存于-80℃备用。
1.2.2 RNA提取 采用Qiagen公司试剂盒,离心柱法。
1.2.3 ARM-PCR扩增 取1μg total RNA逆转录为cDNA, 用iRepertoire公司HBHI-M的引物试剂盒对IGH重链区域进行两步PCR扩增反应,第一步扩增反应条件:50℃ 40min;95℃ 15min;94℃ 30s,63℃ 2min,72℃ 30s,15cycle;94℃ 30s,72℃ 2min,10cycle;72℃ 10min。第一步PCR结束后取2ul反应产物作为第二步PCR的模板,反应条件:95℃ 15min;94℃ 30s,72℃ 90s,30cycle;72℃,5min。PCR产物经琼脂糖凝胶电泳检测扩增效果,切下490-570bp大小的片段做胶回收。
1.2.4 高通量测序 回收产物定量后用二代测序仪Miseq进行测序反应。
1.3 生物信息学分析
将测得的原始测序数据上传至iRepertoire公司网站,由专业生物信息人员进行统计分析。具体步骤包括:①去除掉数据中的冗余序列、短片段序列及测序质量差的序列;②将数据与公共数据库IMGT(http://www.imgt.org/)进行比对查询,根据IGH-CDR3区域V、J、D各区段的特点鉴定出各个样本的CDR3肽段序列;③统计各样本的免疫学特征。
2 结果
2.1 样本基本信息
9例正常妊娠末期孕妇和7例未妊娠健康女性的一般情况和样本基本信息见表1。

表1 研究标本基本信息
2.2 样本扩增情况
16例样本均扩增出外周血IGH-CDR3免疫组库,结果显示妊娠末期孕妇外周血IGH-CDR3 read数目和种类均低于未妊娠健康女性(CDR3数目:2.06×106/3.63×106;CDR3种类:9.34×103/5.86×104。见图1-A、1-B)。
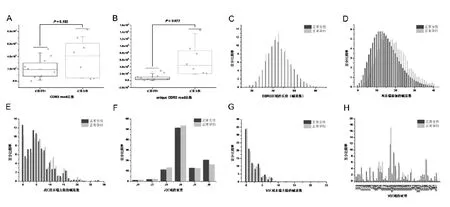
A:IGH-CDR3总数比较;B:unique IGH-CDR3总数比较;C:IGH-CDR3长度比较;D:N末端添加的碱基数比较;E:J区域末端去除碱基数比较;F:J区域基因使用频率比较;G:V区域末端去除碱基数比较;H:V区域基因使用频率比较
图1 正常妊娠末期孕妇与未妊娠健康女性外周血IGH-CDR3免疫学特性的比较
2.3 IGH-V、J基因亚家族的使用偏好性和其他免疫学特征
与未妊娠女性对比,妊娠末期女性外周血B细胞的免疫学特性发生一些变化,具体表现为:CDR3区域的长度33bp(13个氨基酸)和45bp(15个氨基酸)的利用率高于未妊娠女性(图1C);N末端添加的碱基数从0到40bp呈高斯分布, N末端添加的碱基数比未妊娠女性平均增加2~3个碱基(频率最高的碱基数由12、13个碱基增加为14、15个碱基,见图1D);二者在J基因末端去除的碱基数上也有不同,未妊娠女性去除的碱基数更多集中在0-5bp范围内,而妊娠女性去除的碱基数更偏向于6-15bp(图1E);J基因使用频率妊娠女性使用J3、J4亚基因较多,未妊娠女性J6基因使用频率较多,但二者间的差异无统计学意义(图1F);V基因末端去除的碱基数二者没有明显规律性,妊娠女性去除频率较高的碱基数分别为0bp、3bp、5bp、7bp(图1G);妊娠女性较少使用V1、V2基因家族,而偏好使用V3家族的亚基因,尤其是V3-7、V3-9、V3-11、V3-234个亚基因的使用频率远远高于未妊娠女性(图1H)。
2.4 妊娠对IGH-CDR3肽段的影响
IGH-CDR3序列是BCR分子与抗原结合的主要部分,决定了B细胞与抗原结合的特异性和强度,为了研究妊娠对外周B细胞功能的影响,分别对获取样本IGH-CDR3肽段数据进行会聚研究,建立了妊娠期与非妊娠期女性外周血IGH-CDR3数据库。结果显示在未妊娠7例样本共表达了3112种不同的肽段,其中肽段AREDY在全部7例样品中均有表达,肽段ARGLDY、AKDRSRTYLYDSSGYDY在6例样品中表达;而在9例妊娠样品中,共有186种肽段表达,其中样品间共享频率最高的肽段ARVCRGHNSCYFDS在5例样品中表达,肽段VTVPRIGTAY在4例样品中表达,其余的肽段共享频率均较低。由此可见妊娠末期的女性间共同表达的肽段显著少于未妊娠女性,但是肽段ARVCRGHNSCYFDS、VTVPRIGTAY在7例未妊娠女性中均未找到,所以这两个肽段是否是妊娠期女性独有的肽段尚需进一步的研究。
3 讨论
高通量测序技术的出现为生命科学的研究提供了巨大便利。本研究首次利用高通量测序技术对末期妊娠女性外周血IGH-CDR3免疫组库进行了筛查,并通过与未妊娠女性对比,揭示妊娠对女性IGH-CDR3免疫特性的影响。本研究显示,妊娠使女性IGH-CDR3的免疫学特性发生了一些变化,包括N末端添加的碱基数平均增加2-3bp、J基因末端去除更多的碱基、更偏好使用V3基因家族的亚基因等等,这些改变的具体机制尚未清楚,推测这可能与母体细胞免疫受到抑制、TH2型免疫占优势、Treg细胞以及调节性B细胞表达量增高有密切关系。另外肽段ARVCRGHNSCYFDS、VTVPRIGTAY在妊娠末期女性中表达的频率较高,而在未妊娠7例女性中并未发现这2个肽段表达,提示其与妊娠有密切关系,但具体作用需要更进一步的研究。本研究发现妊娠女性外周血中循环CDR3总数和种类均显著低于未妊娠女性,而且评价机体免疫能力的重要指标CDR3种类和总数也显著低于未妊娠女性,表明妊娠期女性体液免疫总体上处于抑制状态。当然由于妊娠期平均血容量增加造成的血液稀释也会对循环CDR3数量和种类有一定影响,妊娠期孕妇平均增加1400~1500ml血容量,约多出全部血容量45%[15-17]。但是由于在本研究中无论妊娠女性与未妊娠女性均选取等量的外周血淋巴细胞RNA(1ug)进行研究,所以即使考虑到血容量增加的因素,妊娠期女性的CDR3总数、种类也相对少于未妊娠女性。
综上所述,本研究利用ARM-PCR扩增与高通量测序技术成功地揭示了妊娠对女性IGH-CDR3多样性和免疫学特性的影响,为全面揭示免疫耐受在妊娠过程中的作用和机制提供了重要的基础。
[1] Borchers AT,Naguwa SM,Keen CL,et al. The implications of autoimmunity and pregnancy[J]. J Autoimmun,2010,34(3):1287-1299.
[2] Li M,Huang SJ. Innate immunity, coagulation and placenta-related adverse pregnancy outcomes[J]. Thromb Res,2009,124(6):656-662.
[3] Yamaguchi T,Takizawa F,Fischer U,et al. Along the Axis between Type 1 and Type2 Immunity; Principles Conserved in Evolution from Fish to Mammals[J]. Biology(Basel),2015,4(4):814-859.
[4] Szekeres-Bartho J. Progesterone-mediated immunomodulation in pregnancy: its relevance to leukocyte immunotherapy of recurrent miscarriage[J]. Immunotherapy,2009,1(5):873-882.
[5] Tilburgs T,Strominger JL. CD8+ effector T cells at the fetal-maternal interface, balancing fetal tolerance and antiviral immunity[J]. Am J Reprod Immunol,2013,69(4):395-407.
[6] Djurisic S,Hviid TV. HLA Class Ib Molecules and Immune Cells in Pregnancy and Preeclampsia[J]. Front Immunol,2014,5:652,1-17.
[7] Lynge Nilsson L,Djurisic S,Hviid TV. Controlling the Immunological Crosstalk during Conception and Pregnancy: HLA-G in Reproduction[J]. Front Immunol,2014,5:198,1-10.
[8] Figueiredo AS,Schumacher A. The Th17/Treg paradigm in pregnancy[J]. Immunology,2016,148(1):13-21.
[9] Lee SK,Kim JY,Lee M,et al. Th17 and regulatory T cells in women with recurrent pregnancy loss[J]. Am J Reprod Immunol,2012,67(4):311-318.
[10] Bottsford-Miller J,Haeri S,Baker AM,et al. B cell acute lymphocytic leukemia in pregnancy[J]. Arch Gynecol Obstet,2011,284(2):303-306.
[11] Muzzio DO,Soldati R,Ehrhardt J,et al. B cell development undergoes profound modifications and adaptations during pregnancy in mice[J]. Biol Reprod,2014, 91(5):115,1-11.
[12] Thaxton JE,Sharma S. Interleukin-10: a multi-faceted agent of pregnancy[J]. Am J Reprod Immunol,2010,63(6):482-491.
[13] LaMarca B,Parrish M,Ray LF,et al. Hypertension in response to autoantibodies to the angiotensin II type I receptor (AT1-AA) in pregnant rats: role of endothelin-1[J]. Hypertension,2009,54(4):905-909.
[14] LaMarca B,Wallukat G,Llinas M,et al. Autoantibodies to the angiotensin type I receptor in response to placental ischemia and tumor necrosis factor alpha in pregnant rats[J]. Hypertension,2008,52(6) :1168-1172.
[15] Sanghavi M,Rutherford JD. Cardiovascular physiology of pregnancy[J]. Circulation, 2014,130(12):1003-1008.
[16] Pritchard JA. Changes in the Blood Volume during Pregnancy and Delivery[J]. Anesthesiology,1965,26:393-399.
[17] Chesley LC. Plasma and red cell volumes during pregnancy[J]. Am J Obstet Gynecol, 1972,112(3):440-450.
[责任编辑:董 琳]
Effect of pregnancy on IGH-CDR3 immunerepertoire in peripheral blood of pregnant women
GUO Changlong, DU Meng, WANG Qidi, CAO Xiaofang,YANG Ying, CAI Ruikun,AN LiSha,QIU Yue,LIU Xing,PENG Zuoqi,WANG Xingyu,Ma Xu
1.National Research Institute for Family Planning, Beijing 100081; 2.Peking Union Medical College; 3.Beijing hypertension league institute
*Corresponding author:Ma Xu, Email: xumagroup@163.com
Objective: To investigate the diversity and immunological characteristics of IGH-CDR3 in peripheral blood of pregnant women. Methods: In order to know the diversity and immunological characteristics of IGH-CDR3 of pregnant women, circulating lymphocyte was separated from peripheral blood of 9 pregnant and 7 non-pregnant women, cDNA was reversed from RNA, IGH-CDR3 region was amplified by ARM-PCR, the corresponding PCR products were sequenced using high-throughput sequencing and then blasted with the IMGT database. Results: The number and species of IGH-CDR3 in pregnant women were much lower than that of non-pregnant women. But pregnant women have unique immunological characteristics, which including IGH-CDR3 length, number of N addition and V removal, usage bias of V gene. Some CDR3 peptides were exclusively expressed in pregnant women. Conclusion: Pregnancy can reduce the number and variety of B cells in peripheral blood of women, and the immunological characteristics of IGH - CDR3 district has changed during pregnancy.
Pregnancy; Immunerepertoire; IGH-CDR3
国家国际科技合作专项项目(2012DFB30130)、国家自然科学基金(81501418)
2016-03-22
2016-04-08
10.3969/j.issn.1004-8189.2016.05
*通讯作者:xumagroup@163.com
